2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
石油工业的发展使得石油污染土壤呈日益扩大化趋势.石油中的烷烃类、芳香烃类及苯类物质毒性大且具有致癌作用,进入土壤后难以去除,并会引起土壤理化性质变化和地下水污染等一系列重大生态问题,因此,如何修复石油污染土壤已成为世界性的环境问题(黄廷林等,2009).石油污染土壤的生物修复技术因具有投入成本低、对土壤生态环境破坏作用小、无二次污染和可操作性强等优点,正逐步成为石油污染土壤治理领域的一个具有广阔应用前景的研究方向(王华金等,2013).然而,石油污染土壤生物修复的成功运作并非易事.理论与实践证明,恢复污染土壤至其原有的生态功能是一个长期而复杂的系统生态过程(宋玉芳等,2004).在生物修复过程中,污染土壤逐渐向健康状态恢复,并伴随着一系列生化指标的变化.因此,有必要对土壤的生物修复过程及此过程中土壤的健康状况进行指示、监测及生态毒理学研究.
研究表明,土壤生态系统中的敏感指示物或指示指标能较全面地反映土壤生态毒性(刘五星等,2007).将土壤生态毒性指示与化学诊断方法有效结合起来,能够更为全面、有效地表征土壤的整体健康状况.针对石油污染土壤生态毒性指示和评价系统,国内外学者提出了包括土壤酶活性试验、高等植物毒性试验、蚯蚓毒性试验和发光菌毒性试验在内的多种生态毒性试验方法.有学者考察了柴油污染土壤生物修复过程中土壤酶活性的变化情况,结果表明,β葡萄糖苷活性与土壤中石油烃残留量呈显著正相关,而土壤脱氢酶和脂肪酶与石油烃残留量显显著负相关(Riffaldi et al., 2006).Banks等(2005)采用莴苣、粟、萝卜、红三叶草和小麦作为供试对象,以它们的种子发芽率为依据,考察了它们的适用性,结果表明,只有莴苣种子能较好地表征石油污染土壤和未受石油污染土壤的生态毒性差异.Wang等(2010)采用蚯蚓(Esisenia foelide)来评价中国胜利油田污泥的生态毒性,结果表明,去繁殖率、卵茧量和回避行为等指标能很好地指示该污泥的生态毒性.Chaineau等(2003)采用发光细菌试验来评价480 d生物堆肥后的石油污染土壤的生态毒性,得出在最初土壤毒性最大,随着时间的延长,土壤毒性逐渐减弱,但仍存在较高的毒性.同时,通过发光细菌生态毒性试验研究了两种不同堆肥条件下的石油污染土壤,发现自然条件下堆肥处理(8个月)的毒性是人工强化堆肥的2~4倍.
在这些生态毒性指示方法中,高等植物毒性试验以其相关性好、灵敏性高等优点而被国内外学者广泛用于石油污染土壤修复过程中土壤生态毒性的检测与评价(林志芬等,2001).另外,高等植物作为土壤生态系统中的基本组成部分,利用其生长发育状况来指示土壤生态毒性也是土壤污染生态毒理学诊断的重要组成部分.虽然各种植物指标在生态毒性指示方面各有优势,但涉及同种植物各指标指示效果对比,以及不同植物指示之间的一致性分析的研究还比较少.由于通过不同指示植物对土壤生态毒性进行指示和评价可以有效地集合土壤中不同食物链生物对有毒有害物质的整体毒性效应,能较为全面地反馈土壤的污染信息.因此,石油污染土壤微生物修复过程需要整合各种生态毒性指示和评价方法对土壤系统的生态安全性做出全面、科学地判断.
课题组利用前期分离筛选出的3种石油组分降解菌株构建了混合菌体系,该混合菌对石油污染土壤表现出良好的修复效果(王华金等,2013).然而,之前的研究尚未确定究竟何种高等植物及具体哪些指标能够敏感地指示微生物修复的效果;并且在石油污染土壤修复过程中,该混合菌对污染土壤的各种生化指标影响的变化规律尚不清楚.因此,本研究以莴苣、黑麦草、小青菜、小麦、萝卜为供试植物进行高等植物毒性试验,考察石油污染土壤微生物修复过程中土壤的生态毒性,通过度量石油污染土壤对不同高等植物生长发育的抑制程度来考察不同修复时期土壤中的生态毒性强弱及变化规律,并以此确定石油污染不同高等植物指示的可行性与敏感性.此外,本文从高等植物毒性试验结果出发,从生态学角度揭示石油污染土壤微生物修复过程中残留的石油污染物和中间代谢产物对土壤生态系统的影响,在证明小麦和萝卜作为指示植物可行性的同时,也探究石油污染土壤修复过程中污染土壤的各种生化指标的变化规律.
2 材料与方法(Materials and methods) 2.1 混合菌的制备课题组前期分离出3种石油烃降解菌株,包括洋葱伯克霍尔德氏菌(Burkholderiacepacia)中的烷烃降解菌GS3C,鞘氨醇单胞菌(Sphingomonas sp.)中的菲降解菌GY2B,伯克菌科P and oraea菌属的pnomenusa种中的芘降解菌GP3B(Tang et al., 2010).将上述3种菌株分别取1环进行富集培养,然后在25 mg · mL-1的原油无机盐培养基(磷酸盐缓冲液5.0 mL,FeCl3水溶液1.0 mL,CaCl2水溶液1.0 mL,MgSO4 水溶液3.0 mL,微量元素溶液1.0 mL,蒸馏水1000 mL)中分别加入1 mL富集液,接着将加入了石油降解菌的原油无机盐培养基置于的摇床中驯化(30 ℃,150 r · min-1),每5 d为一个周期,重复驯化11个周期后离心分离分别获取3种驯化产物.最后将驯化后的GS3C、GY2B、GP3B菌(4.0×108 CFU · mL-1)按等量配比的原则(1 ∶ 1 ∶ 1,体积比)复配后形成石油降解混合菌.
2.2 石油污染土壤的制备供试土壤采自广东增城的水稻田表层土壤.土壤取回经干燥处理后过4.75 mm筛,去除大颗粒物质后分为两份,一份保存于4 ℃黑暗条件下用于测定新鲜土样指标(表 1),另一份置于阴凉处风干后过2 mm筛,保存待用.供试石油为广州石化提供的原油(饱和烃45.55%,芳烃17.69%,胶质和沥青质9.68%).
| 表1 供试土壤的理化性质 Table 1 Basic physiochemical properties of the tested soils |
在Φ15 cm×20 cm塑料盆装入3 kg干土,将溶于石油醚中的石油加入土壤中,使土壤中石油烃的初始含量为5000 mg · kg-1(以干土计)(Vouillamoz et al., 2001)并搅拌均匀.接着按每100 g土加3 mL混合菌菌液的比例接种于石油污染土壤中.
最后将土壤放置在30 ℃的恒温培养箱中进行石油污染土壤的生物修复实验,每2 d进行一次翻土搅拌并维持土壤含水率的稳定.在实验过程中,分别采集干净土壤,生物修复第0、8、16、24、32、40 d的土壤(Tang et al., 2010),分别标记为S0、S1、S2、S3、S4、S5、S6作为不同修复时期石油污染土壤,并将其放置在阴凉处风干备用.
2.3 测试项目及方法 2.3.1 土壤中总石油烃的提取及含量测定准确称量5 g风干土壤,放入50 mL离心管中,加入适量无水硫酸钠,添加10 mL正己烷,在1800 r · min-1条件下振荡1 min,再将其超声30 min,然后在3000 r · min-1的条件下离心10 min,收集上层液体.重复上述过程4次,确保土壤中的石油烃全部被洗出.将上层液体过0.45 μm的有机系滤膜后移至旋转蒸发仪中进行浓缩,定容至25 mL,于225 nm处测定其吸光度值,对照石油的标准曲线,计算出石油污染土样中石油烃残留量和表观降解率η(Han et al., 2009):
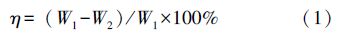
用GC-MS(DSQⅡ,美国热电)分别对原油,以及土样S0、S1、S2、S3、S4、S5和S6中的油分进行分析.具体操作条件:进样口、传输线和离子源温度分别为250、280和260 ℃;实验所采用的载气为高纯氦气;溶液的进样方式为不分流进样,进样量为1 μL;实验所采用柱子的规格为30 m×0.32 mm×0.25 μm的HP-5MS石英毛细管柱.柱子升温程序的设置:60 ℃保持5 min,以10 ℃ · min-1的速度升温至110 ℃,保持2 min,再以2 ℃ · min-1的速度升温至280℃,保持20 min.质谱的扫描范围:50~550 amu质量范围内扫描(何丽媛等,2010). 2.3.3 幼苗生长发育状况 取莴苣(Asparagus lettuce)、黑麦草(Ryegrass)、小青菜(Brassica chinensis)、大白菜(Chinese cabbage)、小麦(Triticum acstivnm L.)和萝卜(Raphanus sativus L.)种子(种子均购于广东省农业科学院,实验前均经过发芽率的预实验,确保种子发芽率均大于90%)各20粒,将种子均匀播种于事先放有100 g不同修复时期石油污染土壤的培养皿中,再在上部均匀覆盖20 g对应修复时期的供试土壤,调节土壤含水率至最大持水量的85%(Al-Mutairi et al., 2008),盖好玻璃培养皿,将培养皿置于光照培养箱(SPX-250,宁波海曙赛福实验仪器厂)中培养.培养条件为:在25 ℃条件下,黑暗培养48 h,随后进行16h/8h的光照(光照强度(4300±430)lx)/黑暗循环培养72 h(Banks et al., 2005; Al-Mutairi et al., 2008).种子发芽后继续在16h/8h(昼/夜)的光照(光照强度(4300±430)lx)条件下继续培养9 d,共计14 d后(保持恒温恒湿条件不变),测定不同土壤中小麦和萝卜的幼苗生长发育状况(株高、地上部鲜重、根鲜重、根干重).
2.3.4 超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量SOD活性测定:称取0.5 g鲜叶于预冷的研钵中,加入一定量石英砂,加入5 mL 0.05 mol · L-1 pH为7.8的磷酸缓冲液,在冰浴中研磨成浆,将浆液转入离心管中,在低温(4 ℃)超速离心机(TG16-WS,长沙湘仪离心机仪器有限公司)上以10000 r · min-1离心15 min,上清液即为酶粗提液.于4 ℃冰箱中保存,待测.取5支玻璃试管,3支用作测试样品,2支为对照管.按下列要求加入各溶液:4.05 mL 0.05 mol · L-1磷酸缓冲溶液、0.3 mL 200 mmol · L-1 DL甲硫氨基酸溶液、0.3 mL 33 µmol · L-1核黄素溶液、0.3mL 1.25 mmol · L-1 氯化硝基四氮唑溶液、0.05mL酶液,总体积为5 mL,其中2支对照管所添加的酶液用磷酸缓冲液代替(Yoshioka et al., 1979).
将上述试剂在玻璃试管中混匀后,把其中1支对照管置于暗处,其它各管均置于4000 lx日光下反应20 min(要求各管受光情况一致,温度高时时间缩短,温度低时可适当延长).最后在560 nm处分别测定其它各管的吸光度.SOD总活性以每克鲜重酶单位表示,即U · g-1(以FW计),以抑制氮蓝四唑光化还原至原来的50%为一个酶活性单位(U).SOD总活性R按公式(2)计算:
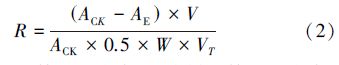
丙二醛含量测定:称取0.5 g鲜叶于研钵中,加入一定量石英砂,加入5 mL 10%三氯乙酸溶液研磨,将研磨后所得匀浆移至离心管中,在4000 r · min-1下离心10 min,收集上清液,待用.取上述上清液2.0 mL加入带塞试管中,再向试管中加入2.0 mL 0.5%硫代巴比妥酸溶液,混合均匀后,将试管放置于沸水浴中反应20 min,反应结束后迅速冷却并离心.将上清液分别于450、532和600 nm波长下测定其OD值.对照管以2 mL水代替提取液.按公式(3)计算MDA浓度C(mol · L-1),得出MDA浓度后,然后以植物组织的鲜重计算样品中MDA的含量(公式(4)).实验所用试剂除正己烷(用于气相色谱-质谱分析)为色谱纯外,其它均为分析纯,购于阿拉丁公司.
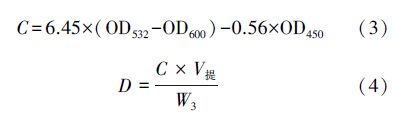
实验数据使用SPSS 17.0进行双变量相关性分析、回归分析及方差分析.
3 结果与讨论(Results and discussion) 3.1 石油污染土壤生物模拟修复实验修复效果不同修复时期土壤中总石油烃残留量及表观降解率如表 2所示.可以看出,投加菌剂的污染土壤中石油烃表观降解率远高于未投加菌剂的土壤,相应地,残留量远低于未投加菌剂的土壤.具体而言,投加菌剂的污染土壤中石油烃表观降解率随时间的推移不断上升,石油烃表观降解率在修复的第8、16、24、32、40 d分别达到54.0%、57.5%、60.2%、64.1%、64.4%,修复32 d后石油烃残留量基本保持稳定(约1.79343 mg · g-1).在生物修复前期,由于油量丰富,石油烃降解菌大量繁殖,石油烃表观降解率高;随着时间的推移,易降解的石油烃组分被大量消耗,残留物主要为芳香烃等难降解组分,这导致了降解速率的降低和残留量的相对稳定(Margesin et al., 1999).同时可以看到,不投加菌剂的污染土壤中石油烃的表观降解率随时间的延长有缓慢上升,但降解40 d后只有16.8%的石油烃被去除,其主要原因是土壤中土著微生物对石油烃的降解及石油烃中易挥发组分的挥发(Langbehn et al., 1995).与不投加菌剂的污染土壤相比,投加菌剂的污染土壤表现出更高的表观降解率和更低的残留量,这表明在该微生物修复过程中,石油烃降解菌发挥了对污染物的去除的主导作用.
| 表2 不同修复时期的土壤中石油烃残留量及表观降解率 Table 2 Changes in TPH removal efficiency and residual oil during different phases of bioremediation |
为了更深入地探讨石油污染土壤微生物修复技术的关键问题,分别对修复结束后的石油污染土壤中原油各组分(饱和烃、芳烃、沥青+胶质)的去除率进行了测定和分析,结果表明,40 d的修复期结束后,烷烃的去除率达到了66.9%±2.3%,芳烃的去除率为36.6%±3.8%,而石油烃中最难降解的沥青和胶质,它们的去除率为18.5%±3.4%,石油烃组分的去除率高低顺序为:烷烃>芳烃>沥青和胶质.这说明微生物对石油烃各组分的生物利用存在差异.石油中的沥青质和胶质进入土壤后,由于其粘稠性大和难降解性等特点,在土壤中长期积累会破坏土壤结构,影响农作物的生长和发育.石油烃组分中的芳香烃是一类具有致癌变、致突变、致畸变等“三致”作用的有毒有害物质.而恰好相反的是,这两类石油烃组分在石油污染土壤微生物修复过程中的去除率相对较低.
为进一步分析不同修复时期的土壤中残油组分组成,分别对不同修复时期的土样进行了GC-MS分析.不同修复时期土样GC-MS图谱如图 1所示.从图 1可以看出,本研究中构建的混合菌体系对土壤中的石油有明显的去除效果,并且随着修复时间的延长,去除效果更加明显.对比原油图谱(A)和未修复石油污染土壤(S1)中残油图谱可知,这两幅图谱的变化不明显,未修复石油污染土壤相对于原油只是在n-C14以下的石油烃有较明显的去除.引起这部分差别的原因可能主要是由于在配制石油污染土壤的过程中,该部分石油烃的挥发所导致.Galin等(1990)研究认为,石油烃中C15以下的这部分烃类物质较易通过化学挥发进入空气,导致空白对照组的该部分损失.然而,修复后的土壤GC-MS图谱表现出明显差异.污染土壤经过8 d微生物修复后(土样S2),C20以下的直链烷烃峰高相对于C20以上的峰高要明显低一些.这主要是因为C20以下的直链烷烃容易被微生物优先利用,导致其相对含量降低;而C20以上的烷烃不易被微生物所利用(Barin et al., 2014),所以其含量相对较高,最终在图谱表现出来.通过比较C和D图谱可知,相对分子质量较高的烃(C>20)含量相对较低,而C20以下的烷烃含量增加,并且图谱中峰的数目也明显增多.这可能是由于在修复的中期,易降解烷烃含量降低,微生物为了维持成长代谢,必须利用碳数较多的烷烃作为微生物生长代谢所需的碳源,导致C20以上的烷烃含量减少(Galin et al., 1990; Vasilieva et al., 2012).同时,由于微生物的作用,将长链分解成短链,导致短链数量和含量增加.从图谱F(S5)和G(S6)可以看出,土样S5的修复效果和土样S6的修复效果基本相同.这可能是由于在修复后期,微生物可利用的碳源减少,加上代谢中间产物的积累,破坏了土壤的原有生态体系,使得微生物的活性降低,从而影响了石油在土壤中的降解(Dorn et al., 2000; Riffaldi et al., 2006).
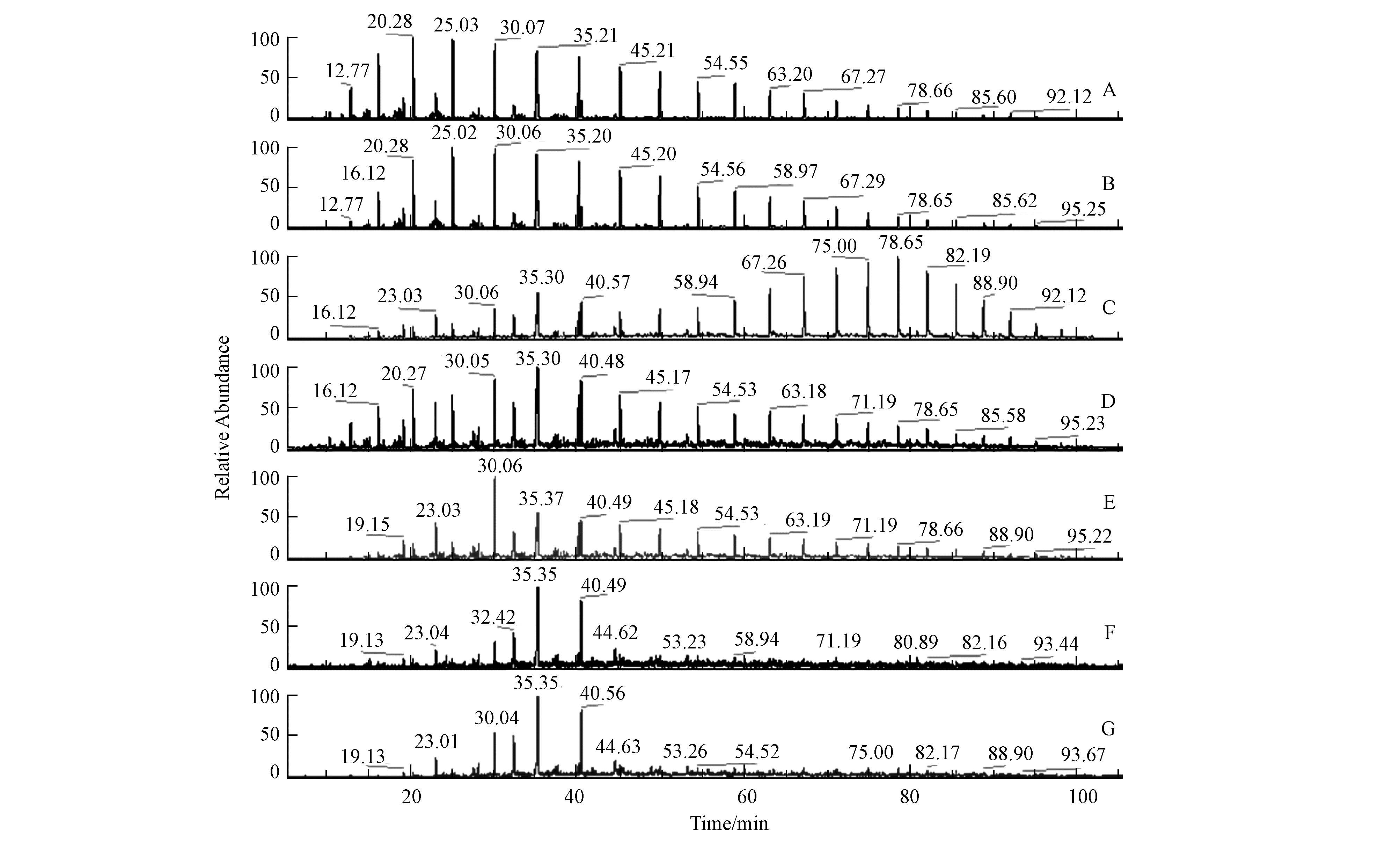 |
| 图1 不同修复阶段土样残油GC-MS图谱(A:原油GC-MS图谱; B~G:土样S1~S6中残油GC-MS图谱) Fig.1 GC/MS of residual oil in different phases of the bioremediation(A. Crude oil(S0)composition; B~G were oil compositions in soil S1,S2,S3,S4,S5 and S6,respectively) |
此外,有关学者利用“分子化石”抗生物降解的特性来评价石油污染生物修复的情况.姥鲛烷(Pr,即2,6,10,14-四甲基十五烷)和植烷(Ph,2,6,10,14-四甲基十六烷)是原油中常见的两种标志化合物,其结构比较稳定,微生物作用一般不影响它们的含量(马宝东等,1999).因此,本研究中采用Pr和Ph这两种物质来综合评价石油污染土壤的修复效果.姥鲛烷Pr/nC17、植烷Ph/nC18是衡量微生物降解原油的参数,常把Pr/nC17和Ph/nC18这两个比值作为微生物降解原油因子的重要指标,可判别原油降解的程度.Pr/nC17和Ph/nC18的比值增大,说明石油污染土壤中正构烷烃的含量减少,而异构烷烃的含量相对增多.通过原油的GC-MS分析可知,土样S1中,Pr/nC17值为0.526,而40 d的生物修复以后,其值上升至7.273;同样,土样S1中,Ph/nC18值为0.348,生物修复40 d后上升至6.357.说明本研究中石油污染土壤经40 d的微生物生物修复后,污染土壤中的正构烷烃得到了有效去除,残留下来的是一些生物利用性低的支链烷烃类物质.
3.2 莴苣、黑麦草、小青菜幼苗生长状况不同修复时期的土壤对莴苣、黑麦草、小青菜不同指标的影响如表 3所示.对莴苣而言(表 3),其株高在整个微生物修复过程中相对于S0均不存在显著性差异;地上部鲜重也仅有土样S1(111.6%)与S0之间存在显著性差异;而根鲜重和根干重则是
| 表3 不同修复时期的土壤对莴苣、黑麦草、小青菜不同指标的影响 Table 3 Effects of crude oil on the growth of Asparagus lettuce,Ryegrass and Brassica chinensis |
在修复后期表现出促进效应,土壤S5、S6与S0之间存在极显著差异,根鲜重分别为S0的114.3%和127.3%,根干重分别为S0的157.7%和179.5%.显然,莴苣的株高及地上部鲜重对石油污染土壤的生态毒性变化不敏感,不宜作为指示指标;莴苣的根鲜重和根干重在修复的前期和中期与S0的差异也不显著,并不能指示石油污染土壤的生态毒性在哪个修复时期增强,而只能说明在生物修复后期石油污染土壤的生态毒性低,另外,不同修复时期的根鲜重和根干重的质量变化范围分别在在0.33~0.42 mg和0.048~0.09 mg之间,质量较小会给实际测量操作增加难度.因此,莴苣不宜作为石油污染土壤微生物修复过程中生态毒性强弱的指示植物.
对黑麦草而言(表 3),其株高仅在土样S1中与S0存在显著性差异(为S0的108.2%);其地上部鲜重在整个修复时期都表现为抑制,土样S4、S5、S6中的地上部鲜重与S0之间存在显著性差异,分别为S0的82.0%、76.3%、78.0%;其根鲜重与根干重在不同修复时期的变化规律不明显,在S1、S4、S6中都表现出促进,但根鲜重在S5、根干重在S2又表现出抑制.由此可知,黑麦草幼苗的株高、地上鲜重、根鲜重及根干重4个指标对于石油污染土壤的生态毒性的指示规律不一致,且同样存在根鲜重和根干重质量小的问题.因此,黑麦草不宜作为石油污染土壤微生物修复过程中生态毒性强弱的指示植物.
对小青菜而言(表 3),株高和地上部鲜重在修复中期表现出显著的抑制,后期仅地上部鲜重在S6中与S0之间存在显著性差异(为S0的117.7%);根鲜重及根干重则只是在修复后期出现极显著的促进,前期和中期变化不明显.根鲜重和根干重质量小的问题依然存在,因此,小青菜也不宜作为石油污染土壤微生物修复过程中生态毒性强弱的指示植物.
综上可知,莴苣、黑麦草、小青菜作为石油污染土壤生物修复过程中的指示植物时存在对毒性变化不敏感、不同指标之间指示结果不一致及部分指标数值过小的问题,故这3种植物均不宜作为指示植物.
3.3 小麦和萝卜的毒理性试验由于莴苣、黑麦草、小青菜幼苗生长状况不能够很好地指示石油污染土壤微生物修复过程中生态毒性的变化规律,故本研究尝试用典型供试植物小麦和萝卜来进行植物毒理性试验.
3.3.1 小麦和萝卜幼苗生长状况小麦幼苗在各修复时期土壤中的生长发育总体情况如图 2所示.可以看出,在土样S1和S2中,无论是株高还是根重(干重和鲜重)均与其它处理土壤之间存在明显的差异,与无污染土壤相比表现出明显的抑制.从株高和根重这两个方面来看,土样S1、S4、S5、S6与S0相比均表现出诱导作用.小麦幼苗生长发育各指标受不同处理土壤胁迫的响应存在差异.在土样S1和S2中,小麦株高与土样S0之间存在显著差异,显著低于无污染土壤对照(p<0.05),分别为无污染土壤对照组的89.4%和87.2%;而土样S1、S4、S5、S6中小麦株高相对于无污染土壤对照均有不同程度的增加,但均不显著(p>0.05).小麦地上部鲜重在土样S1中相对于对照组有显著降低(p<0.05),为对照组的81.7%;土样S2中小麦的地上部鲜重与对照组间存在极显著差异(p<0.01),为对照组的71.8%,其它修复阶段土壤与对照组之间均不存在显著差异(p<0.05).小麦的根鲜重和干重除在土样S1中与对照组之间不存在显著差异外,其它各处理土壤中均与对照组间存在显著差异.其中,根鲜重在土样S2中表现出显著降低(p<0.05),为对照组的86.3%,在土样S3中表现出极显著降低(p<0.01),为对照组的55.1%;在土样S4、S5、S6中均表现出显著增加(p<0.05),分别为对照组的121.3%、120.9%和118.8%.根干重在土样S2和S3土壤中出现显著降低,在土样S4、S5、S6中表现出显著增加(p<0.05).
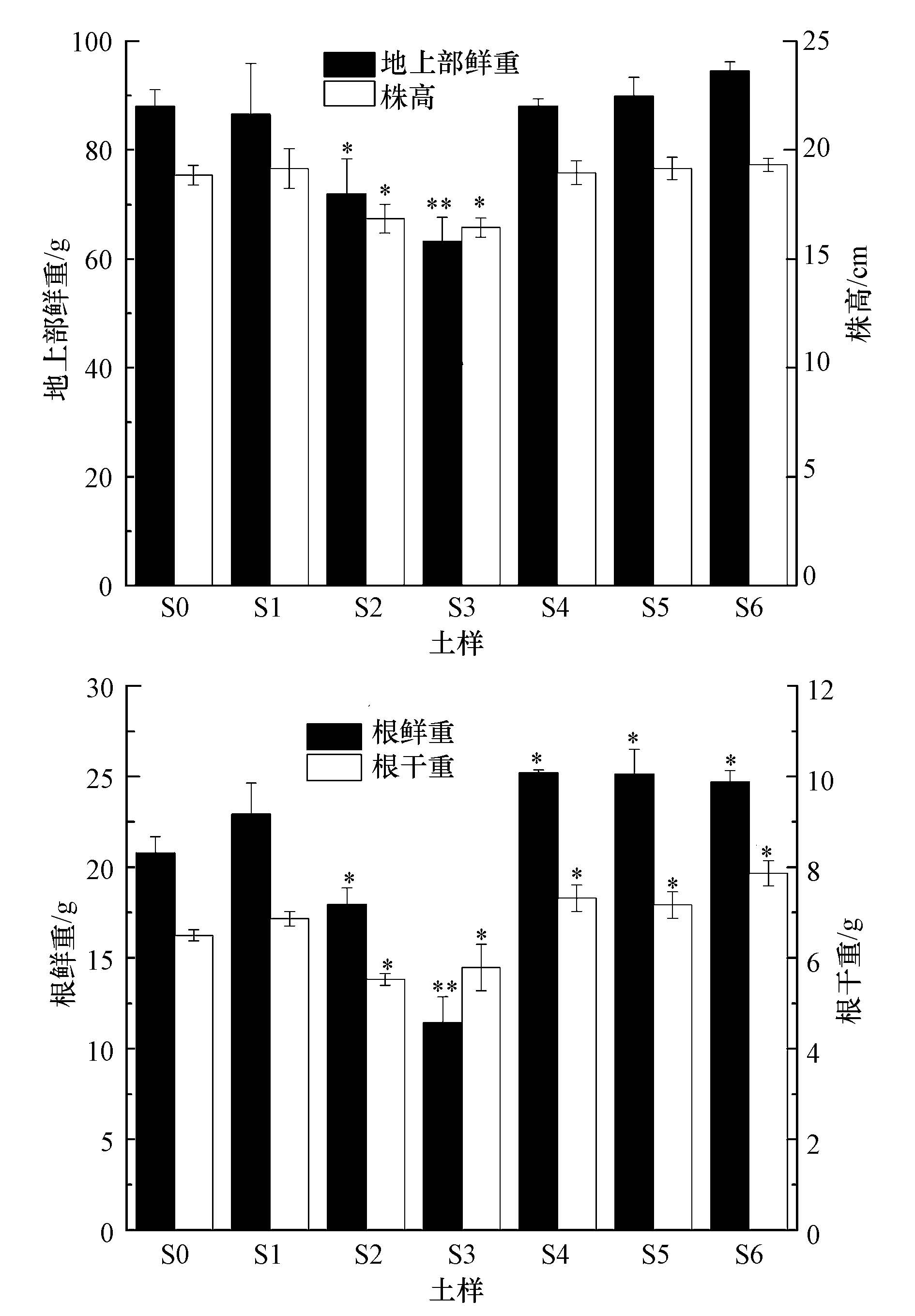 |
| 图2 原油对小麦幼苗生长的影响(*和**分别表示与S0土壤处理相比差异显著(p<0.05)和极显著(p<0.01)) Fig.2 Effects of crude oil on the plant growth(Triticum acstivnm L.) |
萝卜在各处理土壤中生长发育的总体情况见图 3.可以看出,不同修复时期土壤中萝卜幼苗的生长发育状况存在明显的差异.从株高和根重(干重和鲜重)来看,萝卜在整个修复时期的污染处理土壤中与无污染土壤对照组相比均表现出抑制作用.其中,在土样S2、S3、S4中,抑制作用相对明显.萝卜幼苗株高在土样S2、S3、S4和S5中与对照组S0相比均存在显著降低(p<0.05),分别为对照组S0的89.3%、89.8%、91.4%和92.0%.地上部鲜重在整个修复时期污染土壤中均表现出不同程度的抑制,为对照组的93.1%~98.5%,但除土样S3、S4与对照组S0间存在显著差异外(p<0.05),其它修复阶段与对照之间的差异均不明显(p>0.05).同样,萝卜幼苗根鲜重指标在各修复时期的污染土壤中均表现为抑制,为对照组的78.5%~91.6%,其中在土样S4中极显著低于无污染对照S0(p<0.01),在其它处理土壤中显著低于对照组(p<0.05).不同修复时期污染土壤中萝卜幼苗根干重与无污染土壤对照组之间差异均不显著(p>0.05).
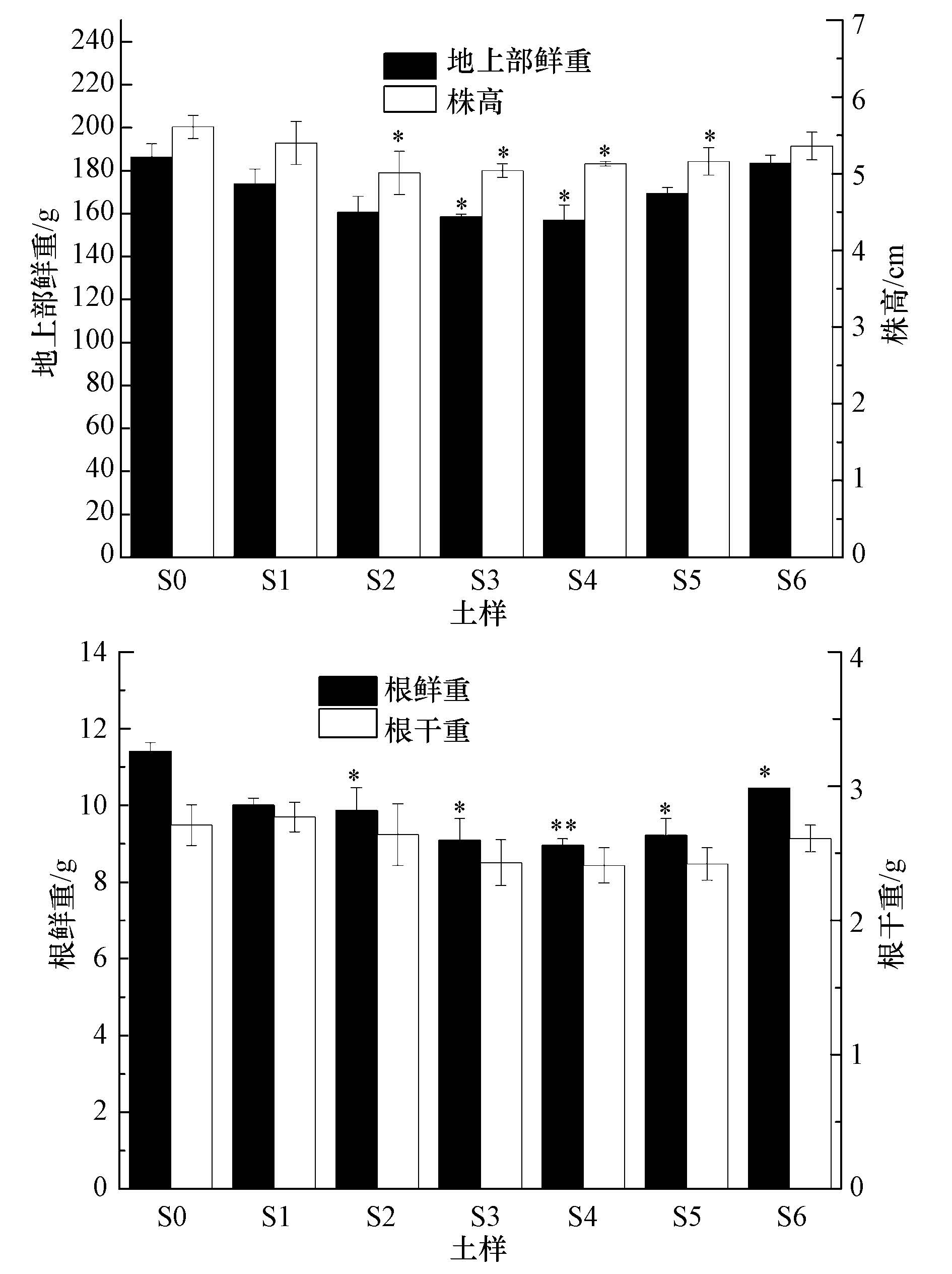 |
| 图3 原油对萝卜幼苗生长的影响(*和**分别表示与S0土壤处理相比差异显著(p<0.05)和极显著(p<0.01)) Fig.3 Effects of crude oil on the plant growth(Raphanus sativus L.) |
可以看出,不同生长指标在不同修复阶段土壤中的敏感程度各不相同,不同的植物对各处理土壤中的污染胁迫响应也存在差异.小麦的株高、地上部鲜重、根鲜重及根干重在土样S2和S3中表现为抑制作用,在其它修复时期的污染处理土壤中表现为刺激作用.这可能是由于石油污染物进入土壤导致土壤中有机质含量增加,土壤肥力有所增大,并且随着生物修复的进行,石油烃浓度降低.土壤肥力和石油烃浓度的协同作用刺激了小麦幼苗各生长发育指标的生长(宋雪英等,2006).宋玉芳等(2002)通过研究不同浓度的污染物对高等植物的影响表明,低浓度污染物对高等植物的生长产生刺激作用,高浓度污染物对植物的生长产生抑制作用.植物的根系与土壤微生物联合作用致使低浓度石油组分对植物的生长产生促进作用,并可将土壤中的石油烃转化成CO2和H2O,为土壤微生物提供能量和碳源;与此同时,植物可以将部分石油烃通过木质化作用,转化成自身的组成部分(张大庚等,2003),促进幼苗的生长发育.而萝卜的各幼苗生长发育指标在不同处理土壤中的响应与小麦存在一定的差异.萝卜的各幼苗生长发育指标在整个修复时期都表现出不同程度的抑制作用,其中,株高在土样S3中的抑制效果达到最大,地上部鲜重和根鲜重在土样S4中的抑制作用最为明显.相对于小麦而言,萝卜在本研究中表现出更高的敏感性.同时,上述结果也佐证了本研究中不同修复时期的土壤均存在一定的生态毒性,并且土壤的毒性在修复的第一阶段达到最大.
3.3.2 叶片SOD活性及MDA含量不同修复时期土壤对供试植物叶片SOD活性及MDA含量的影响如图 4所示.可以看出,小麦叶片中的SOD活性在整个修复时期土壤中均表现出刺激作用,为对照处理的105.5%~131.7%.其中,在土样S1中显著高于对照组S0(p<0.05),在土样S2、S3、S4中极显著高于对照组S0(p<0.01),并且在土样S3中刺激作用达到最大,为无污染对照处理S0的131.7%;在土样S5和S6中虽然表现出诱导作用,但与对照组S0之间的差异却并不显著.
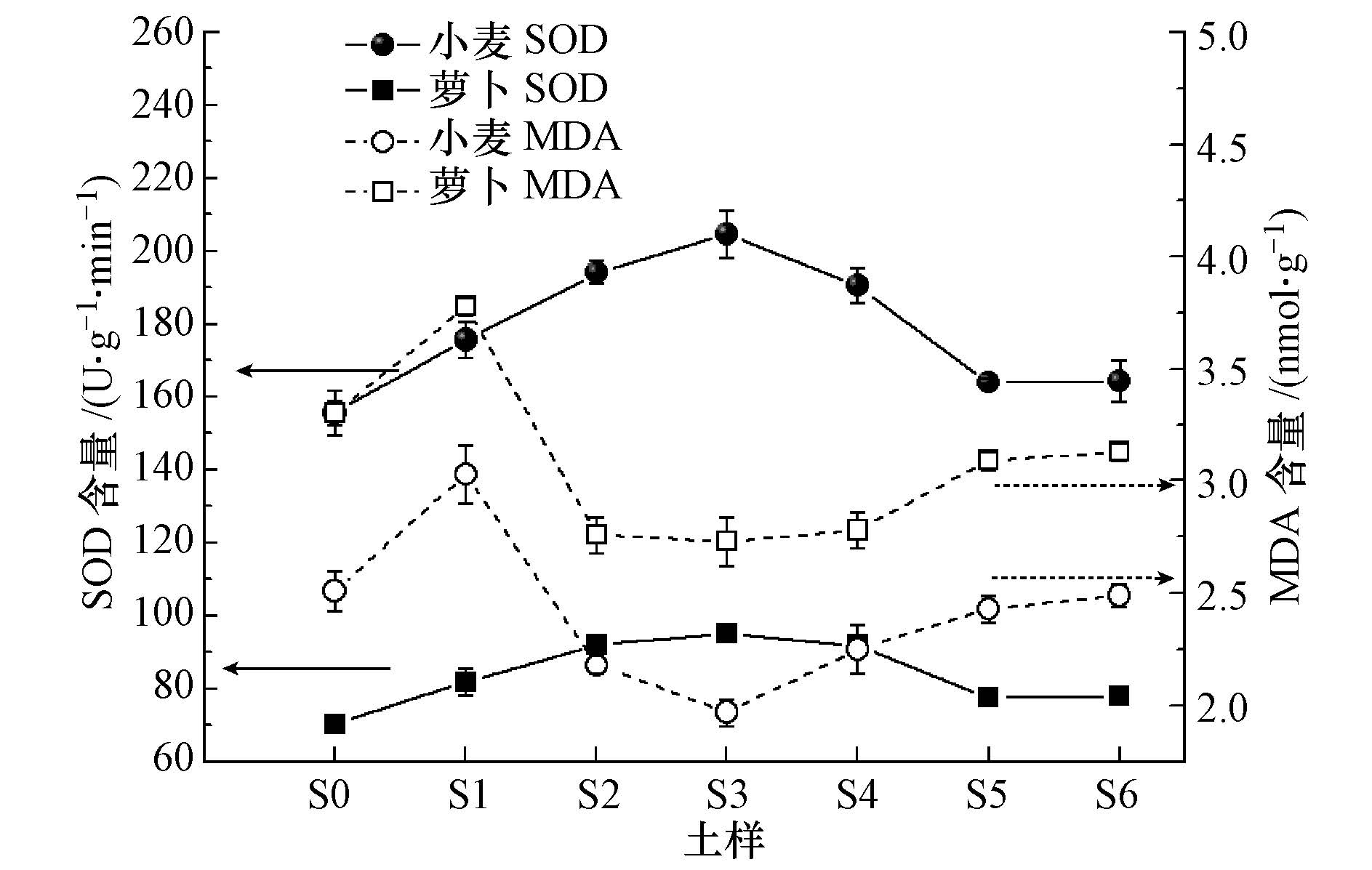 |
| 图4 原油对植物叶片的SOD活性及MDA含量的影响 Fig.4 Effects of crude oil on the SOD activity and MDA content |
同样,萝卜叶片中SOD活性与小麦的趋势大致相同,也是在土样S3中刺激作用最为明显.研究表明,植物细胞在逆境胁迫条件下产生的活性氧自由基会对植物细胞产生毒害作用.SOD活性的升高有利于自由基的清除,解除其对植物的毒害作用(Debus et al., 1997).这说明小麦和萝卜这两种植物对不同修复时期的土壤都有一定的抗性.在正常的情况下,植物组织SOD的活性与氧自由基处于动态平衡,叶片中氧自由基含量的增加必然会导致SOD活性的升高.SOD活性越高说明土壤的逆境胁迫越严重,这可以从侧面证明石油污染土壤修复的前中期生态毒性有所增强.土壤生态毒性的增强才导致了土壤中逆境胁迫增强.
不同修复阶段的土壤对供试植物叶片MDA含量的影响如图 4所示.可以看出,小麦叶片中MDA含量随修复时期的延长呈先升后降接着又缓慢回升的变化趋势.萝卜叶片中MDA含量在不同修复时期的污染土壤中呈现类似的变化趋势,只是在修复后期(土样S5和S6)小麦叶片中MDA含量与对照处理不存在显著差异,而萝卜叶片中MDA含量与对照处理相比仍然存在显著降低.生物修复初始阶段(土样S1),石油烃浓度最高,在这种逆境下,植物叶片细胞产生大量的活性氧自由基,为了解除活性氧自由基的毒害,细胞膜脂过氧化反应加剧,导致膜脂过氧化产物MDA含量增加.在随后的修复时期中,供试植物叶片细胞的MDA含量呈抑制趋势,主要原因可能是SOD活性的增加,导致其酶反应过程中产生的大量H2O2对植物细胞产生毒害作用,导致MDA含量降低(Xiong et al., 2013).后阶段MDA含量缓慢回升可能是由于植物在逆境条件下抗氧化酶系统的调节能力有限,导致植物细胞体内还是积累了过剩的活性氧自由基,这些活性氧自由基破坏了细胞膜的结构,致使MDA含量再度上升(Kilic et al., 2014).
3.4 微生物修复石油污染土壤过程中的生态毒性石油烃目标污染物是评价污染土壤修复效果的一项指标.然而由于土壤环境及石油组分的复杂性,不可能将土壤中所有的有毒有害物质都通过化学方法得到检测.土壤环境本身就是一个复杂的系统,一般的化学方法并不能科学、全面地评价土壤的修复效果和表征修复后土壤整体的质量特征,并且,在石油污染土壤中,即使石油目标污染物的含量达到环境标准,但由于难降解组分的残留和次生代谢产物或中间产物的存在,土壤的生态毒性仍然很强,而且在生物体上会最终表现出来.由于化学诊断的局限性,单一地采用化学方法来诊断和评价土壤的修复效果已经不能准确指示石油污染土壤生态毒性的强弱.
本研究以不同供试植物的生长发育状况及叶片生化指标为主要研究对象对不同修复时期石油污染土壤的生态毒性进行了分析诊断,对比了不同供试植物作为指示生物的可行性与敏感性,并以此来评价了石油污染土壤微生物的修复效果.通过对比分析可以看出,石油污染土壤生态毒性随修复时间的延长呈现先增大后减弱的变化趋势.这与采用目标污染物的化学诊断方法存在明显不同.
具体而言,植物各指标的响应并不是随着石油烃浓度的变化呈现相应的变化趋势;当石油烃浓度最高时,供试植物幼苗各生长指标的抑制效果不是最明显;相反,在石油污染土壤修复过程的前中期,石油污染土壤的抑制作用最强.这说明在石油污染土壤的修复过程中,目标污染物残留量的减少并不能笼统地说土壤的修复效果好,应结合土壤的生态学毒性试验,综合评价土壤的修复效果和健康质量.
在石油污染土壤中,即使石油目标污染物的含量达到环境标准,土壤的生态毒性仍然很强,而且在生物体上会最终表现出来.Hubálek等(2007)研究表明,尽管石油烃总量修复后降低了65%,但由指示微生物、陆生植物、水生植物、蚯蚓和甲壳类动物的生态毒性评价结果则显示为修复第一阶段的生态毒性最高,而且整个修复过程中土壤均存在一定的毒性效应.石油污染土壤随着微生物的修复其毒性变得复杂化,在修复的前中期毒性表现为增强,可能主要是由于:①修复的前期易降解组分的减少,导致难降解物质(如多环芳烃、沥青质和胶质)的含量相对增加,而多环芳烃等难降解物质的毒性要明显高于烷烃类物质.②修复过程中微生物的代谢中间产物的产生,导致其毒性要强于原来的污染物.已有研究表明,某些烃尤其是PAHs的氧化中间产物具有比母本烃更强的生态毒性(Al-Mutairi et al., 2008).因此,在石油污染土壤微生物修复过程中,应对中间代谢产物给予足够的重视.随着修复时间的延长,土壤的生态毒性慢慢降低,主要是因为微生物开始利用多环芳烃等难降解物质作为碳源,导致其含量降低;再者,土壤微生物在土壤环境中优胜劣汰,能够适应土壤新环境的微生物被保留下来,它们可以利用中间代谢产物来进行自身的生长和繁殖,这些因素的综合效益使得土壤的生态毒性随修复时间的延长慢慢地降低.可以看出,石油污染土壤修复时间越长,土壤的生态风险越小.事实表明,要想将污染土壤恢复到土壤原有的生态功能和状态是一个长期、复杂的过程.
4 结论(Conclusions)1)自制混合菌株(GS3C、GY2B、GP3B,等量配比)能够有效地降解石油污染物.
2)相对于莴苣、黑麦草和小青菜,小麦和萝卜对石油污染土壤的生态毒性变化更为敏感,更适合作为指示植物.
3)植物的毒性试验中,修复前期的土壤对植物的生长及叶片生化指标抑制最为明显,后期抑制效果减弱.
4)在石油污染土壤微生物修复过程中,土壤中目标污染物量的减少并没有导致土壤生态毒性的降低.石油污染土壤微生物修复后土壤毒性变的复杂化.石油污染土壤在整个生物修复过程中均存在一定的生态毒性,并且在修复的前中期达到最大,修复后期逐渐减弱.
| [1] | Al-Mutairi N,Bufarsan A,Al-Rukaibi F.2008.Ecorisk evaluation and treatability potential of soils contaminated with petroleum hydrocarbon-based fuels[J].Chemosphere,74(1):142-148 |
| [2] | Banks M K,Schultz K E.2005.Comparison of plants for germination toxicity tests in petroleum-contaminated soils[J].Water,Air,and Soil Pollution,167(1/4):211-219 |
| [3] | Barin R,Talebi M,Biria D,et al.2014.Fast bioremediation of petroleum-contaminated soils by a consortium of biosurfactant/bioemulsifier producing bacteria[J].International Journal of Environmental Science and Technology,11(6):1701-1710 |
| [4] | Chaîneau C H,Yepremian C,Vidalie J F,et al.2003.Bioremediation of a crude oil-polluted soil:Biodegradation,leaching and toxicity assessments[J].Water,Air,and Soil Pollution,144(1):419-440 |
| [5] | Debus R,Hund K.1997.Development of analytical methods for the assessment of ecotoxicological relevant soil contamination:Part B-ecotoxicological analysis in soil and soil extracts[J].Chemosphere,35(1/2):239-261 |
| [6] | Dorn P B,Salanitro J P.2000.Temporal ecological assessment of oil contaminated soils before and after bioremediation[J].Chemosphere,40(4):419-426 |
| [7] | Galin T S,Mcdowell C,Yaron B.1990.The effect of volatilization on the mass flow of a non-aqueous pollutant liquid mixture in an inert porous medium:experiments with kerosene[J].Journal of Soil Science,41(4):631-641 |
| [8] | Han M,Ji G D,Ni J R.2009.Washing of field weathered crude oil contaminated soil with an environmentally compatible surfactant,alkyl polyglucoside[J].Chemosphere,76(5):579-586 |
| [9] | 何丽媛,党志,唐霞,等.2010.混合菌对原油的降解及其降解性能的研究[J].环境科学学报,30(6):1220-1227 |
| [10] | 黄廷林,徐金兰,唐智新,等.2009.生物菌剂对石油污染土壤生物修复作用的研究[J].环境科学,30(6):260-265 |
| [11] | Hubálek T,Vosáhlová S,Matěj V,et al.2007.Ecotoxicity monitoring of hydrocarbon-contaminated soil during bioremediation:a case study[J].Archives of Environmental Contamination and Toxicology,52(1):1-7 |
| [12] | Kilic N,Taslipinar M Y,Guney Y,et al.2014.An investigation into the serum thioredoxin,superoxide dismutase,malondialdehyde,and advanced oxidation protein products in patients with breast cancer[J].Annals of Surgical Oncology,21(13):4139-4143 |
| [13] | Langbehn A,Steinhart H.1995.Biodegradation studies of hydrocarbons in soils by analyzing metabolites formed[J].Chemosphere,30(5):855-868 |
| [14] | 林志芬,于红霞,许士奋,等.2001.发光菌生物毒性测试方法的改进[J].环境科学,22(2):114-117 |
| [15] | 刘五星,骆永明,滕应,等.2007.石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究[J].土壤学报,44(5):848-853 |
| [16] | 马宝东,王其伟,王红艳,等.1999.潍北油田昌74井微生物采油室内性能评价研究[J].油田化学,16(1):65-68 |
| [17] | Margesin R,Zimmerbauer A,Schinner F.1999.Soil lipase activity-a useful indicator of oil biodegradation[J].Biotechnology Techniques,13(12):859-863 |
| [18] | Riffaldi R,Levi-Minzi R,Cardelli R,et al.2006.Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil[J].Water,Air,and Soil Pollution,170(1/4):3-15 |
| [19] | 宋雪英,宋玉芳,孙铁珩,等.2006.石油污染土壤植物修复后对陆生高等植物的生态毒性[J].环境科学,27(9):1866-1871 |
| [20] | 宋玉芳,周启星,许华夏,等.2002.菲、芘、1,2,4-三氯苯对土壤高等植物根伸长抑制的生态毒性效应[J].生态学报,22(11):1945-1950 |
| [21] | 宋玉芳,宋雪英,张薇,等.2004.污染土壤生物修复中存在问题的探讨[J].环境科学,25(2):129-133 |
| [22] | Tang X,He L Y,Tao X Q,et al.2010.Construction of an artificial microalgal-bacterial consortium that efficiently degrades crude oil[J].Journal of Hazardous Materials,181(1/3):1158-1162 |
| [23] | Vasilieva V,Janik L,Scherr K E,et al.2012.Data evaluation of tar oil degradation using comprehensive GC2/MS:individual compounds and principal component analysis[J].Journal of Chemical Technology and Biotechnology,87(9):1237-1245 |
| [24] | Vouillamoz J,Milke M W.2001.Effect of compost in phytoremediation of diesel-contaminated soils[J].Water Science and Technology,43(2):291-295 |
| [25] | 王华金,朱能武,杨崇,等.2013.石油污染土壤生物修复对土壤酶活性的影响[J].农业环境科学学报,32(6):1178-1184 |
| [26] | Wang S J,Yan Z G,Guo G L,et al.2010.Ecotoxicity assessment of aged petroleum sludge using a suite of effects-based end points in earthworm Eisenia fetida[J].Environmental Monitoring and Assessment,169(1/4):417-428 |
| [27] | Xiong J P,Hu S Y,Li J K,et al.2013.Influence of strong electric field on MDA and SOD of rice under atmosphere pressure[J].Journal of Physics Conference Series,418(1):12141,doi:10.1088/1742-6596/418/1/012141 |
| [28] | Yoshioka T,Kawada K,Shimada T,et al.1979.Lipid peroxidation in maternal and cord blood and protective mechanism against activated-oxygen toxicity in the blood[J].American Journal of Obstetrics and Gynecology,135(3):372-376 |
| [29] | 张大庚,依艳丽,郑西来.2003.沈抚污水灌区石油烃对土壤及水稻的影响[J].土壤通报,34(4):333-336 |
 2016, Vol. 36
2016, Vol. 36


