天然有机质(NOM)是一类具有复杂组成、结构和环境行为的有机混合物,普遍存在与湖泊水体、悬浮颗粒物和沉积物中,参与水生态系统各种生物地球化学过程,对水生态系统结构与功能具有重要影响,是环境科学与地球科学研究的热点和难点(Wu et al., 2009; Frimmel and Abbt-Braun, 2009; 吴丰昌,2010; 吴丰昌等,2008).由于NOM在水体中滞留时间长、结构组成复杂、表生行为和生态效应丰富、研究难度大,是即古老又年轻的学科;虽然对其研究已有百余年的历史,但直到近十余年来才得到快速发展,特别是在天然有机质化学组成与结构等特征表征、以及来源解析等方面.NOM中的溶解性有机质(DOM)占到97.1%(Post et al., 1990),是连接生命形态碳和无机碳的关键纽带.DOM通常是指能够通过0.1~0.7 μm滤膜的一类碳基有机化合物.广义上,溶解性有机质包含一切溶解于水中的有机化合物,以分子大小划分为小分子化合物的单糖、氨基酸等,大分子化合物的多糖、蛋白质、木质素和腐殖质等(Wu et al., 2009);以产生方式分为内生性(自然界产生的)溶解性有机质和外生性(人类化学合成产生的)溶解性有机质,如化学需氧量,后者的大量介入水生环境始于人类工业科技革命中化学合成的大发展,对水生生态系统既构成巨大的威胁,也造成了一定程度的破坏(Zhuo et al., 2010);根据存在于介质的类型可以分为地表水(河流、湖泊、海洋)、地下水、废水、大气降水、土壤或沉积物孔隙水中的溶解性有机质(Frimmel and Abbt-Braun, 2009);以提取分离的方式又可以划分为亲脂性、亲水性、酸溶性、碱溶性等溶解性有机质(Leenheer and Croué,2003)(图 1).狭义上,溶解性有机质多指生物代谢物或残体分解产生的大分子化合物或大分子降解物,如占溶解性有机质主要成分的腐殖质(胡敏酸、富里酸和非腐殖化有机物).
 |
| 图1 溶解性有机质的类型 Fig.1 The categories of the dissolved organic matter(DOM) |
溶解性有机质在地表水体中的浓度较低,无法达到元素分析、化学键(官能团)分析等表征所需要的质量,大量的无机盐离子也会影响到仪器表征.虽然有些表征手段如光谱法可以对溶解性有机质的特征进行一定程度的表征,但得到的结果并不精确,这就对分离与提纯水体中的溶解性有机质提出了迫切的要求.最早提取得到的溶解性有机质是固体介质中的碱溶性溶解性有机质胡敏酸,采用氢氧化钠浸提土壤,浸提液离心或过滤得到澄清液体,加酸后得到固体的方式获得胡敏酸固体样品(Thiessen and Engelder, 1930).20世纪60年代,凝胶色谱技术诞生和各类吸附材料的发现与合成使得水体溶解性有机质的分离、富集及提纯具备了技术条件.20世纪70年代,Weber和Wilson(1975)利用非离子型大孔吸附树脂(主要成分为聚苯乙烯二乙烯苯)层析柱对河水中的富里酸进行了富集分离,Mirkina(1977)利用凝胶色谱对水体中大于1.5 kDa的溶解性有机质进行了分离,并用冷冻干燥技术进行浓缩.20世纪80年代,Thurman和Malcolm(1981)提出了具有较高的回收率的获取水体胡敏酸与富里酸的方法,该方法适用于有机碳浓度大于0.05 mg · L-1的水体,经改进后也成为国际腐殖质协会(IHSS)推荐方法.膜分离技术起步于20世纪60年代,膜分离的雏形为滤纸、滤网等孔径较大的过滤技术,随着高分子材料的发展,基于高分子材料的滤膜使得微滤、纳滤和反渗透过滤等技术得到较快发展.20世纪90年代初,Serkiz和Perdue(1990)利用反渗透过滤技术为核心的方法获得水体中的溶解性有机质,该方法也成为了IHSS推荐方法之一.科学家在利用传统方法分离水体中有机质的同时,还在不断尝试利用其它类型的方法,如利用固相萃取技术得到性质与传统方法不同的天然有机质(Schwede-Thomas et al., 2005).为了能够高效分离、富集和纯化水体中的溶解性有机质,科技工作者采用了膜过滤(超滤、纳滤、反渗透和电渗透)(Simjouw et al., 2005; Navalon et al., 2010; Ouellet et al., 2008; Mao et al., 2012)、非离子大孔树脂(Schwede-Thomas et al., 2005; Santos et al., 2010)、离子交换树脂(Leenheer et al., 2004)、冷冻干燥(McCurry et al., 2012; Ma et al., 2001)、真空旋转蒸发(Spencer et al., 2010; Ma et al., 2001)、吸附剂富集(Schwede-Thomas et al., 2005; Bridgeman et al., 2014; Baker et al., 2008)等技术.Frimmel和Abbt-Braun(2009)对现有的技术方法的优缺点进行了总结,在此基础上,本文进行了完善得到表 1.为了纯化得到溶解性有机质,往往需要综合采用这些方法.Thurman和Malcolm(1981)的方法采用了微滤、非离子大孔树脂、离子交换树脂和冷干等技术,而Serkiz和Perdue(1990)的方法也采用了微滤、离子交换树脂、反渗透和冷干等技术.
| 表1 分离、富集与纯化溶解性有机质的方法及其优缺点 Table 1 The methods of separation,enrichment, and purification and their merits and demerits |
溶解性有机质的表征技术经历了初期依靠光谱、色谱技术表征到后来的比表面积、热分析、电镜、原子力显微镜、X射线能谱、质谱等技术(图 2).这些表征技术从溶解性有机质的表观到分子等多个层面展开,具体而言,光谱技术仍然是溶解性有机质元素、化学键、官能团及分子空间构型的主要表征手段,如电感耦合等离子体发射光谱仪(ICP-AES或ICP-OES)、原子吸收光谱仪(AAS)、原子荧光光谱仪(AFS)多用于研究溶解性有机质溶解于水中后金属或类金属元素的组成及含量的测定(Itoh and Haraguchi, 1994; Aster et al., 1996; Dong et al., 2010);X射线荧光光谱仪多用于溶解性有机质非溶解状态下颗粒表面附着的金属或类金属元素的组成及相对含量的测定(Langner et al., 2013).原子光谱应用于元素测定,而分子光谱用于研究化学键、官能团及分子空间构型,也是溶解性有机质最常用的表征手段,如紫外可见光谱仪(UV-Vis)可用于共轭体系多环芳烃含量的表征(Kalbitz et al., 2000),傅里叶变换红外光谱仪用于C—H、N—H、C O等化学键组成及相对含量的表征(Ouellet et al., 2008),荧光光谱仪(FS)常用于表征可以激发获得荧光的溶解性有机质,可反映的物质包括类胡敏酸物质、类富里酸物质、类蛋白物质等(Henderson et al., 2009);核磁共振波谱仪(NMR)可定性或定量测定溶解性有机质不同类型碳(脂肪基团碳、羧基碳、羰基碳、芳香基团碳等)及不同类型氢(脂肪基团氢、羧基氢、羟基氢、芳香基团氢等)(Nebbioso and Piccolo, 2013);元素分析仪(EA)采用梯度燃烧溶解性有机质获得C、H、N和S等氧化气体,然后通过红外检测器检测得到各元素含量(Ouellet et al., 2008);激光光散射仪(LLS)用于表征溶解性有机质的流体力学半径分布图,与色谱技术中的体积排阻色谱柱(SEC)均能用于表征物质的分子量大小(Wagoner et al., 1997).比表面积仪(BET)采用气体吸附法测定溶解性有机质固体颗粒状态下的比表面积(Wu et al., 2011).热分析(TA)技术可用于表征溶解性有机质的玻璃化转变温度以了解其成岩或热变化特征(Zhang et al., 2007).质谱(MS)技术的发展使得对溶解性有机质分子结构的研究更深入一步,稳定同位素质谱仪(SIMS)可以测13C和15N的丰度,常用于反映溶解性有机质的来源(Cozzi and Cantoni, 2011);热裂解质谱仪(Pyr-GC-MS)可直接对固体溶解性有机质进行裂解进样测定(Nguyen and Hur, 2011);高效液相色谱质谱(HPLC-MS)可直接用于溶解性有机质的表征不同吸附性质的化合物质核图谱,获得分子结构信息(Dong et al., 2013);随着高分辨率质谱仪的发明,飞行时间质谱(TOF)和傅里叶变换离子回旋共振质谱(FT-ICR-MS)可获得溶解性有机质更为详细的分子结构信息,如确定分子碎片的化学式(Haberhauer et al., 2000; Nebbioso and Piccolo, 2013; Kujawinski et al., 2002; Sleighter and Hatcher, 2007).色谱技术常与光谱、质谱等技术联合使用,以获得不同分子量(SEC色谱注)或者不同吸附性质(C18色谱注)的溶解性有机质的元素组成、分子结构等特征(Woods et al., 2010; Itoh and Haraguchi, 1994).在微观图像表征领域,电子显微镜(EM)技术、原子力显微镜(AFM)技术和X射线能谱(XPS)技术使人们对溶解性有机质的实际表面化学特性、空间外观特性和各类作用力特性有了深入的认识(Balnois et al., 1999; Wu et al., 2011).
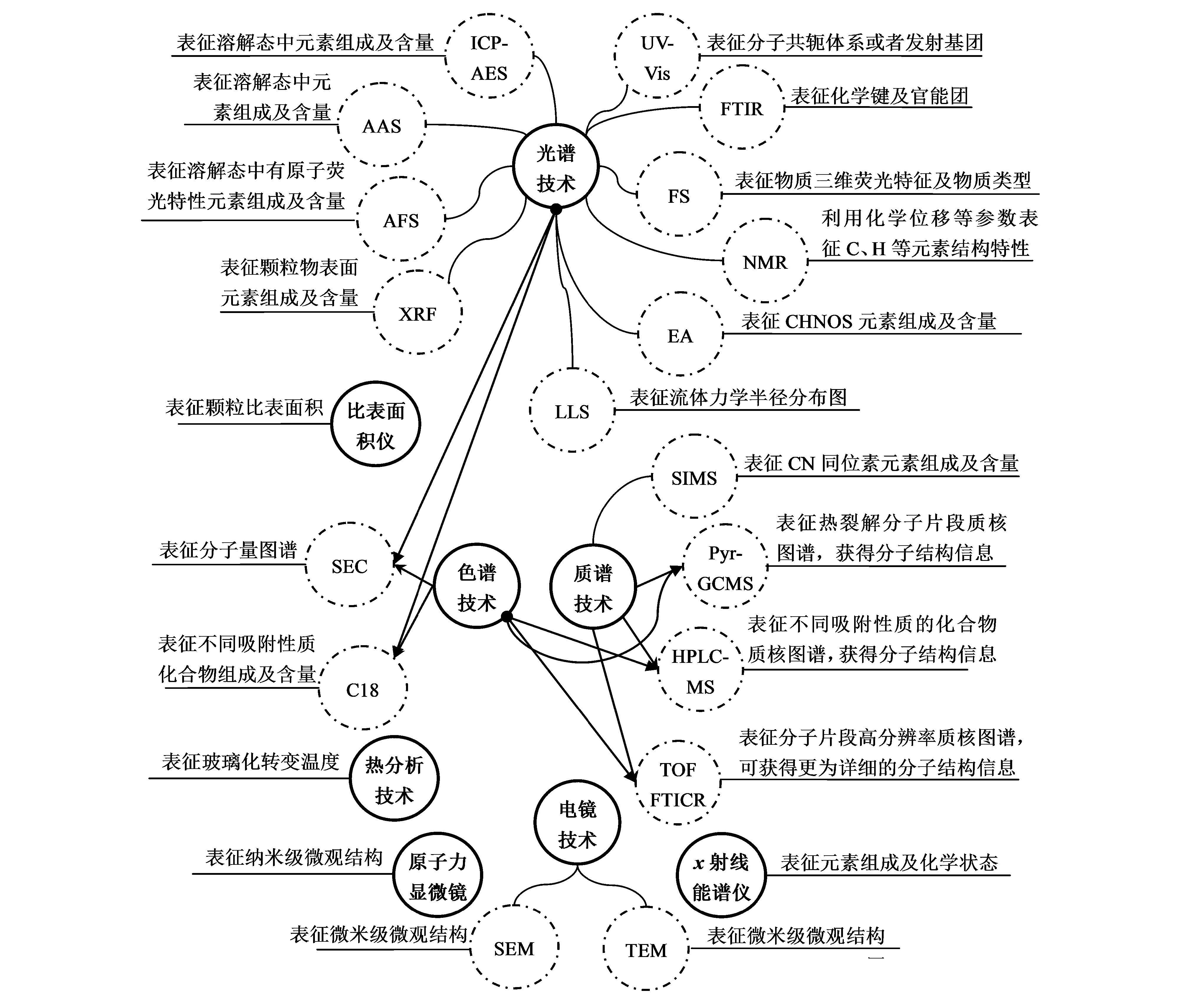 |
| 图2 溶解性有机质物化性质表征技术 Fig.2 Characterization technologies of DOM |
溶解性有机质是一类含丰富共轭体系的有机化合物,因此,其水溶液在光谱的紫外区有着较强的吸收.表征紫外光谱特征常用到的的指标包括吸光系数(a254、a260和a280)(Kalbitz et al., 2000; Spencer et al., 2007; Wang et al., 2009),单位有机碳含量吸光度(SUVA254)(Tremblay et al., 2007),光谱斜率(S275~295和S350~400)(Spencer et al., 2007; Santos et al., 2009),光谱斜率比值SR(S275~295/S350~400)(Spencer et al., 2012),吸光系数比值E2/E3(a250/a365或a254/a365)、E2/E4(a240/a420或a254/a436)、E4/E6(a465/a665)(Wang et al., 2009; Jaffé et al., 2004),光谱面积比值(波长260~280 nm、460~480 nm和600~700 nm光谱下的面积为Q2,Q4和Q6,比值为Q2/Q4、Q2/Q6和Q4/Q6)(Albrecht et al., 2011).关于以上紫外可见光谱特征指标的含义见表 2.
| 表2 紫外可见光谱特征指标含义 Table 2 The indicators calculated from ultraviolet-visible spectrum of DOM |
溶解性有机质中很多天然有机化合物如蛋白质、氨基酸、芳香烃等有荧光特征.三维荧光光谱是由激发、发射波长及荧光强度三维数据表达的矩阵光谱,近年来广泛应用于直接测定水体中蛋白质、氨基酸、芳香烃、腐殖质等有荧光特征的溶解性有机质.这类具有荧光特征的溶解性有机质根据荧光激发/发射波长特征划分为类蛋白和类腐殖质.类蛋白主要由类酪氨酸、类色氨酸或其衍生物组成,鲜见类苯胺酸.类酪氨酸随环境变化小,而类色氨酸会随环境变化发生蓝移;类腐殖质包括类胡敏酸和类富里酸,其中类富里酸又分为紫外类富里酸和可见富里酸(蒋愉林等,2008).图 3总结了国内外海水、河口、河流、湖泊、降水、地下水、孔隙水、污水、饮用水中三维荧光光谱中峰值对应的激发波长和发射波长的二维图.大部分文献将溶解性有机质划分为6类,分别是类富里酸(A)、类胡敏酸(C)、低激发色氨酸类(S)、高激发色氨酸类(T)、低激发酪氨酸类(D)、高激发酪氨酸类(B).以上几类溶解性有机质在河流中广泛存在,也是海水中这几类有机质的来源之一,而作为河流的主要输入源降水,其未含有低激发类氨基酸,但降雨径流可携带湿地中的低激发类氨基酸进入河流湖泊(席北斗等,2008; 方芳等,2010; 徐成斌等,2010; 冯龙庆等,2011; 吴静等,2011; 陈欣,2012; 王曼霖等,2012; 吴静等,2012; 杨长明等,2012; 祝鹏等,2012; 戴春燕等,2013; 吕丽莎等,2013; 闫丽红等, 2013a,2013b; 赵瑾等,2013; 赵芸等,2013; Schwede-Thomas et al., 2005; Birdwell and Valsaraj, 2010; Huguet et al., 2010).人为废水由于含有大量的生物废弃物如蔬菜、肉类等,其含有所有类别的溶解性有机质,不做处理的废水也是对河流湖泊贡献这些物质的来源之一.孔隙水和地下水中含有这些溶解性有机质,可能是由地表水向地下水的渗透造成的.
 |
| 图3 水体溶解性有机质荧光峰值激发波长和发射波长二维图 Fig.3 Two-dimension graph of excitation emission wavelength versus excitation wavelength of DOM′s fluorescent peaks |
平行因子法(Parallel factor analysis,PARAFAC)是目前解析三维荧光光谱最流行的方法,该方法最初用于心理学,期望从庞大的数据集中找到主要的影响因子.目前广泛用于水体溶解性有机质三维荧光的解析(Fellman et al., 2009; Kowalczuk et al., 2009; Kowalczuk et al., 2010; Cory and McKnight, 2005; Wang et al., 2014; Meng et al., 2013; Guo et al., 2014).Stedmon和Bro(2008))利用Matlab软件编辑的工具包使得三维荧光PARAFAC的解析更为便捷.由于不同地区的水体不同,研究者提取出来的组分也不同,Cory和McKnight(2005)提取了13个组分,Fellman 等(2009)利用该13组分模型拟合自己的研究地点时发现不能很好的拟合,故自己建立了一个10组分的模型,更能反映其数据特征,其它研究者也根据自己的研究地点提取了适用于自己研究地点的组分.Parr等(2014)构建了一个包含38个组分模型的数据库,使得比较不同组分模型中各组分之间的相似性和差异性从一般定性描述发展成定量呈现.
4.3 微观表面性质溶解性有机质在离子强度、pH等条件变化时,其颜色、粘稠度等表观性质也会发生很大变化.而这些表观性质变化来源于微观分子的性质变化.Namjesnik-Dejanovic和Maurice(1997)研究水体中富里酸微观特征时发现低浓度的富里酸分子呈现海绵状,有小环分布,而高浓度的富里酸分子会发生聚集现象;Balnois 等(1999)利用AFM观察到的美国Suwannee河胡敏酸呈现球形,由于该胡敏酸具有较强的亲水性,其在pH=3~10,离子强度为5~50 mmol · L-1时均未发生聚集现象,而泥炭提取的胡敏酸在pH<5时(离子强度为500 mmol · L-1)就发生聚集现象了;除了pH和离子强度,铝盐同样会使溶解性有机质发生聚集作用,聚集增强它与疏水性有机污染物的结合能力(Pan et al., 2008);AFM同样显示了溶解性有机质与纳米材料的络合作用,有机质会增加纳米材料的聚集而沉淀,会使其生物有效性降低(Hu et al., 2010).溶解性有机质分子基团表面的官能团决定了其微观行为,比如疏水性的官能团能够增强其对疏水性有机污染物的结合或者用于改性吸附材料增强其吸附能力(Wu et al., 2011).
4.4 分子量分布溶解性有机质是一类有着不同分子量的混合物.通常采用HPLC-SEC分离,通过紫外(UV)、示差折光检测器(RID)、有机碳测定仪(TOC)、荧光检测器(FLD)和质谱检测器(MSD)等的表征,再利用聚磺苯乙烯(PSS)、聚环氧乙烷(PEO)、高分子化合物(HMC,如硫磺胆酸、维生素B12、单宁酸、球状蛋白等)等进行校准,就可以获得不同分子量的溶解性有机质的分布图(Frimmel and Abbt-Braun, 2009; Klaus et al., 2000; Ertunç et al., 2002; Ahmed et al., 2012),其中PSS被认为是最好的校准的溶液,一方面,它在紫外检测器下有较强的信号,另一方面,该物质与溶解性有机质有相似的洗脱色谱图和相同的流体力学性质(Peuravuori and Pihlaja, 1997).通常认为溶解性有机质属于高分子混合物,因此表达其分子量均值时会用到加权平均(Mw)和数均平均(Mn),而两者的比值为分散性系数(PDI),该值用于衡量分子量分布的宽度(Everett et al., 1999).胡敏酸Mw、Mn和PDI值范围为2355~34654 Da,1928~9560 Da和1.22~5.29,富里酸Mw、Mn和PDI值范围为876~20177 Da,516~6640 Da和1.22~3.04,其它类型溶解性有机质Mw、Mn和PDI值范围为300~141573 Da,494~141573 Da和0.18~8.75.除了采用HPLC-SEC分离不同分子量的天然有机质,也可采用不同孔径的超滤滤膜分离不同分子量范围的溶解性有机质用于后续的实验(Gueguen et al., 2006; Hur and Schlautman, 2003; Xu et al., 2011).
4.5 化学键与官能团组成化学键及官能团是溶解性有机质的功能性单位.Kim 等(2006)对Suwannee河胡敏酸红外光谱的解析发现,含氧官能团相对较高,主要体现在醇基和羧基;具体而言,3400 cm-1周围的信号值说明OH官能团的存在,3000~2850 cm-1间信号峰说明脂肪族C—H,C—H2,C—H3伸缩振动的存在,2900~2700 cm-1间信号峰说明羧基中OH伸缩振动的存在,1800~1580 cm-1间信号峰说明芳香烃和脂环烃的C C,酮、醌和酰胺中的C O伸缩振动的存在,1470~1350 cm-1间信号峰说明脂肪烃和含CH3化合物C—H变形振动的存在,1280~1137 cm-1间信号峰说明酯和酚C—O伸缩振动的存在,880~750 cm-1间信号峰说明含羧酸化合物中OH伸缩振动的存在,650~510 cm-1间信号峰说明羧基中OH变形振动和氨基NH面外摇摆振动存在.可根据比对信号峰差异比较不同地区溶解性有机质的差异,如,韩国Han河的腐殖质物质中酮和醌相比Suwannee河含量较高,而酯和酚含量较低.Leenheer等(2004)在对大盐湖中溶解性有机质各组分的红外光谱分析可知,1660 cm-1周围的信号峰和700~500 cm-1间信号峰共同说明氨基官能团的存在.由于很多基团在同样的位置都可能出峰,因此有时需要结合元素组成数据排除一些可能存在的官能团,比如在羟基和氨基的取舍中就需要看N和O原子数量,如果N很少,可以排除氨基的大量存在(Ouellet et al., 2008).雨水中的溶解性有机质与地表水有着一定的差别,其中3000~2850 cm-1间信号峰明显相对较强,说明其中脂肪族C-H,C-H2,C-H3官能团的大量存在(Santos et al., 2009).溶解性有机质与其它污染物发生结合、吸附等交互作用时,监控交互作用产物的化学键和官能团峰形及峰位变化,可以解释作用机理(Chai et al., 2010; Chekli et al., 2013).
核磁共振技术已广泛应用于溶解性有机质的表征,常用1H谱和13C谱解析其化学键和官能团,在固体核磁技术发展不成熟之前常使用液体核磁共振技术.利用二维核磁共振(1H谱和13C谱)可以获得更为精细的化学键和官能团组成信息.美国Ontario 湖的溶解性有机质主要含大量羧基的脂环族分子、杂多糖和芳香族分子构成,1H谱和13C谱的高度相关性也说明支链萜类物质的存在(Kaiser et al., 2003; Lam et al., 2007),Abdulla等(2010)利用13C谱和红外各自的二维相关性也发现美国Elizabeth河和Chesapeake湾中的溶解性有机质富含大量羧基和杂多糖,Woods等(2010)利用HPLC-SEC-1HNMR提出了一个有效的分离均匀溶解性有机质后进行核磁共振的方法,并证实了溶解性有机质中杂多糖和芳香族的大量存在.1H谱和13C谱分别表征不同类型化学键和官能团上的1H和13C的化学位移信号.一般,1H谱能反映4类不同化学键和官能团上的氢,分别是脂肪烃上的氢(0~1.8 ppm,C—H),羰基、羧基、酯、氨基上á位碳氢和芳香烃支链碳上的氢(1.8~3.3 ppm,H—C—C),羟基、酯和醚连接氧的碳上的氢和连接氧或氮上的烃基上的氢(3.3~6.3 ppm,H—C—O),芳香氢如烯烃、芳香烃上的氢、醌、酚和含氧杂芳香烃上的氢(6.3~10.0 ppm,不包含可交换态氢,H-Ar)(Averett et al., 1994; Kim et al., 2006);IHSS官网上(http://www.humicsubstances.org/thornnmr.html)将13C谱反映的C基化学键和官能团划分为6个组分:脂肪烃上的碳(0~60 ppm,其中0~45 ppm,CHx,45~60 ppm,CH3-O)、杂脂肪族(含氧)上的碳(60~90 ppm,HCOH)、醛基上的碳(90~110 ppm,O—C—O)、芳香烃上的碳(110~165 ppm,其中110~140 ppm,C C/Ar—C,140~165 ppm,Ar—O)、羧基上的碳(165~190 ppm,COO/CON)、羰基上的碳(190~220 ppm,C O).以上的划分方式是建立在胡敏酸或者富里酸分析的基础上,实际在研究溶解性有机质时,范围会有一定的偏差,但核磁共振图谱中这个区域基本上反映各种类型的氢或者碳.按照1H谱可知,溶解性有机质中C—H占23%~58%,H—C—C 占22%~45%,H—C—O占10%~25%,H—Ar占4%~12%,其中脂肪烃占主导地位,而芳香烃则含量较低;按照13C谱可知,溶解性有机质中脂肪烃占15%~61%,杂脂肪族(含氧)占7%~68%,醛基占0.2%~12%,芳香烃占0~48%,羧基占0~24%,羰基占~18%.可见,13C谱体现的差异性更强,解析的官能团也比1H谱更多,当然必要时最好能同时采用两种方式分析溶解性有机质,再结合红外光谱,可以得到更为可靠的化学键和官能团分析结果.
傅里叶变换离子回旋共振质谱(FT-ICR-MS)是当前最高端的高分辨率质谱,质荷比的分辨率达到10-6级,配合分子数据库可以检索到符合荷质比的大量分子信息,Brown和Rice(2000)首次利用ESI-FT-ICR-MS对美国Suwannee河胡敏酸和富里酸的质谱图进行了测定,发现离子强度和pH值会对谱图分布造成影响,而阳离子的影响较小.Kujawinski等(2002)进一步优化了实验条件,得到了低离子密度和高扫描次数条件下分辨率极高的质谱图.Stenson等(2002)发现,电喷雾电离(ESI)可能对高分子量(5000~10000 Da)的组分无论采用正模式还是负模式都不能进行很好的离子化.Van Krevelen图(O/C原子数量比—H/C原子数量比二维图)、Kendrick质量亏损图(名义Kendrick质量—Kendrick质量亏损二维图)和双键等价值图(碳数量—双键等价值二维图)是研究FT-ICR-MS产生数据的常用的3种方法,它们直观反映溶解性有机质的化学式组成特征,可用于不同类型溶解性有机质分子差异的比较,如含氧或氢的变化(Sleighter and Hatcher, 2007; Tremblay et al., 2007; Nebbioso and Piccolo, 2013).
4.6 结构模型溶解性有机质的结构模型是在核磁共振、红外、高分辨率质谱等技术的基础上得到的平均结构模型,而非真实结构.有研究者通过HPLC-SEC分离可以得到组分相对纯的有机物,然后利用质谱技术进行表征,得到很多化合物的分子式,由于分子种类极多,需要进一步的归类(Koch et al., 2008).结构模型虽然并非真实结构,但也算是种类繁多分子的一个平均,对于研究溶解性有机质整体性质还是十分有价值的,尤其是研究溶解性有机质与其它新兴污染物交互作用时,可以首先利用分子结构进行模拟研究.不难看出,各类模型中常出现的官能团或化学键包括芳香环、脂肪环、杂环、羧基、羟基、酚基、羰基、醚基等.各类溶解性有机质的分子量均超过1000 Da.但实际情况中的溶解性有机质很可能是这些基本结构的组合,如因为容易形成酯而出现以这些基本结构为单位的高分子聚合体(Schulten,1999),因此,在利用HPLC-SEC测定分子量大小时会发现溶解性有机质的分子量均大于1000 Da.当然我们也不能忽视HPLC-SEC的测定仅是利用分子大小来估计半径,其在技术领先度上并不如质谱,但是它与质谱可能会将大分子轰击破坏相比,能有效反映原始状态下溶解性有机质的分子量状态,同时采用两种方式确定溶解性有机质分子量特征将更加可靠.
5 溶解性有机质的来源解析 (Souce identification of DOM) 5.1 光谱特征解析来源紫外可见光谱特征在反映溶解性有机质本身性质(共轭体系、腐殖化程度、腐殖物质组成变化)基础上可反映其来源(表 2).光谱斜率比值较低说明高分子量、芳香性强及维管束植物产生溶解性有机质的输入(Spencer et al., 2012).E2/E4(a254/a436)是重要的来源指标,Battin(1998)的研究表明以植被产生或土壤浸提胡敏酸为主的陆源性溶解性有机质的E2/E4值范围为4~12,而以微生物代谢或降解物为主的内源性溶解性有机质的E2/E4则会相对偏高(Jaffé et al., 2004).Zhang 等(2013)利用吸光系数a350说明浮游植物和大型水生植物产生溶解性有机质的差异,前者该值为5.5 m-1,而后者该值达28 m-1.
溶解性有机质的三维荧光解析得到不同的组分.其中,一般认为,类胡敏酸和类富里酸主要来源于陆源性植物代谢物或生物残体(即外源性),而类蛋白或类氨基酸主要来源于水生生物(藻类、大型水生植被)的代谢或生物残体(即内源性)(Lapierre and Frenette, 2009; Zhang et al., 2009).但研究也表明,不同研究区域这种划分并不完全合理.实际上,陆生植物也是类蛋白或类氨基酸的来源之一,有些情况甚至是主要来源(Murphy et al., 2008),这取决于内源性输入通量与外源性有机质输入通量的大小,因此,在判定来源时,有必要研究其潜在来源介质中的有机质荧光特征,如对湖泊溶解性有机质来源解析时,就可对入湖河流、周边湿地、降水、沉积物等介质的溶解性有机质荧光特征进行分析.
5.2 元素组成解析来源溶解性有机质最初引起人们的兴趣是由于其碳含量十分接近于水生生物的碳含量,蓝藻的碳含量为28.9%~50.1%,绿藻的碳含量为44.1%~60.3%(Ahlgren et al., 1992),浮游动物的碳含量为48%±1%(Andersen and Hessen, 1991),而淡水鱼类的碳含量为40%~50%(Hendrixson et al., 2007).H/C、O/C和C/N等元素比值法可用于判定溶解性有机质的来源,如C/H值在12左右时,该物质来源于土壤或者水体腐殖质的可能性较大,而当该值小于9时,该物质为非腐殖质的可能性比较大(Ma et al., 2001).较低的C/O值说明溶解性有机质中存在大量的糖类物质.C/N值是判定溶解性有机质来源的指标之一,一般,陆生植物的C/N比值为13~14,有的甚至大于30(Müller and Mathesius, 1999),而低等植物的C/N比值一般小于10,其浮游动物平均为6.3,浮游植物为6.0,其中硅藻为5.5~7.0,蓝绿藻为6.5,底栖生物为2.8~3.4(朱松泉和窦宏身,1993).C、N同位素也是指示溶解性有机质的指标之一,13C同位素在不同介质中的丰度不同(图 4),可以据此推断溶解性有机质的来源.Jaffé 等(2012)在研究北美河流上游水体溶解性有机质时发现,C/N比值为17.7~46.3,说明陆生植物和大型水生植物为其主要来源,而13C同位素值为-28.9‰~-24.8‰,表明大型水生植物和C3植物的代谢或残体是溶解性有机质的主要来源.当13C同位素值较高时,可以判定有陆源性C4和CAM植物的输入(Cawley et al., 2012).
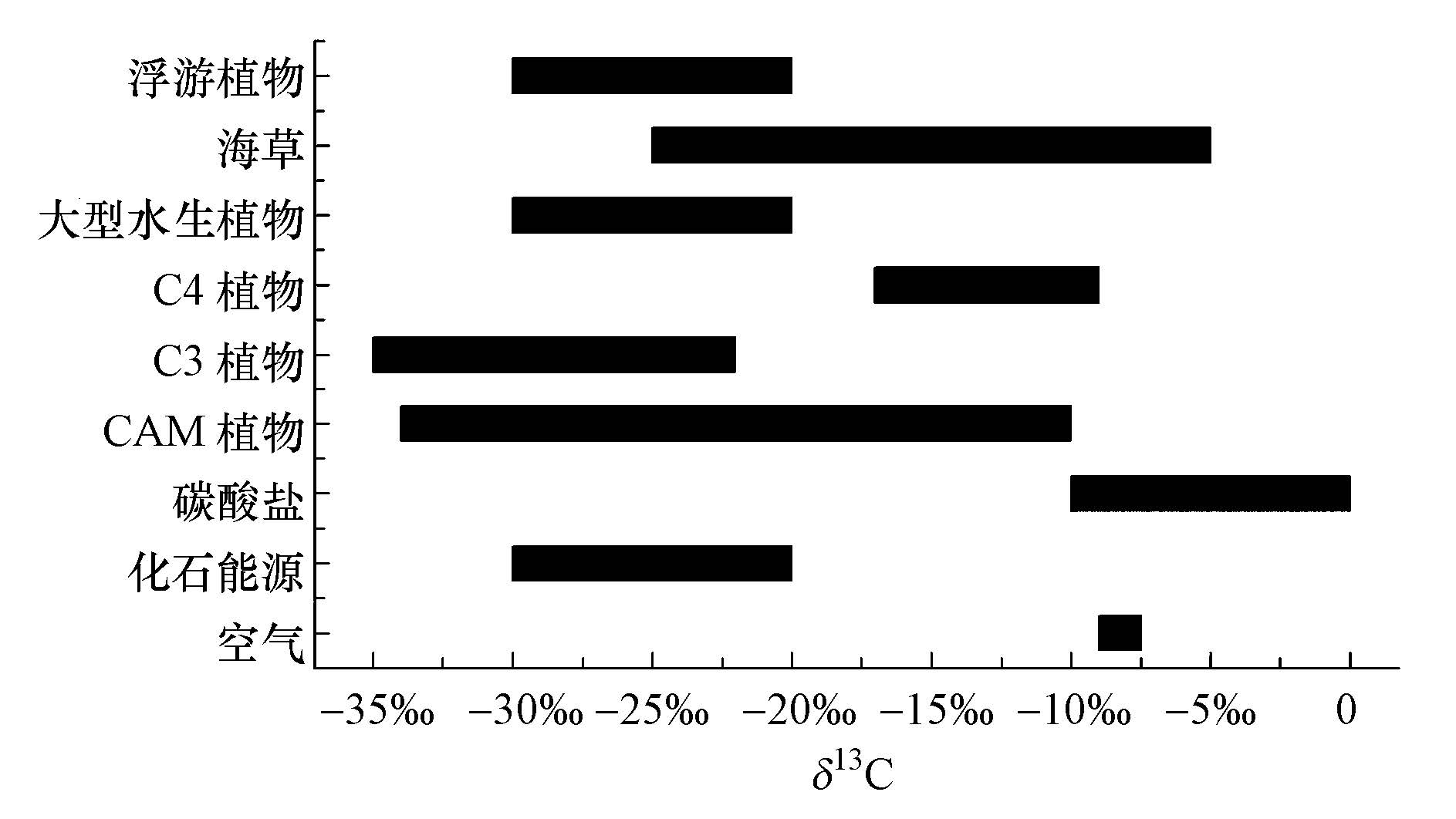 |
| 图4 不同介质中13C同位素的含量 Fig.4 The 13C isotope in various media |
分子特征解析主要依靠分子量分散性、化学键和官能团等性质进行解析.Nguyen and Hur(2011)对多种溶解性有机质来源介质产生有机质的分子量分布和核磁共振13C谱进行了测定,利用主成分分析得到土壤、稻田和污水处理厂的有机质是韩国Paldang湖溶解性有机质主要来源,其中它们的分子量PDI值十分接近,其它来源有机质PDI值与之差别加大.核磁共振1H谱和13C谱中均有反映芳香烃含量的指标,一般芳香烃含量高,说明腐殖化程度高,其来源于陆生植被的输入的可能性就大,而芳香烃含量低,且氮含量较高,则说明来源于水体中藻类等微生物的输入(Kim et al., 2006; Cawley et al., 2013).在利用高分辨率质谱表征化学式时,Van Krevelen图(图 5)常被用来反映溶解性有机质中各物质的组成(Sleighter and Hatcher, 2007),图中纤维素、木质素、超聚碳水化合物为陆生植被的输入源携带,而氨基酸、蛋白质、脂质、氨基糖等多由内源性引入.
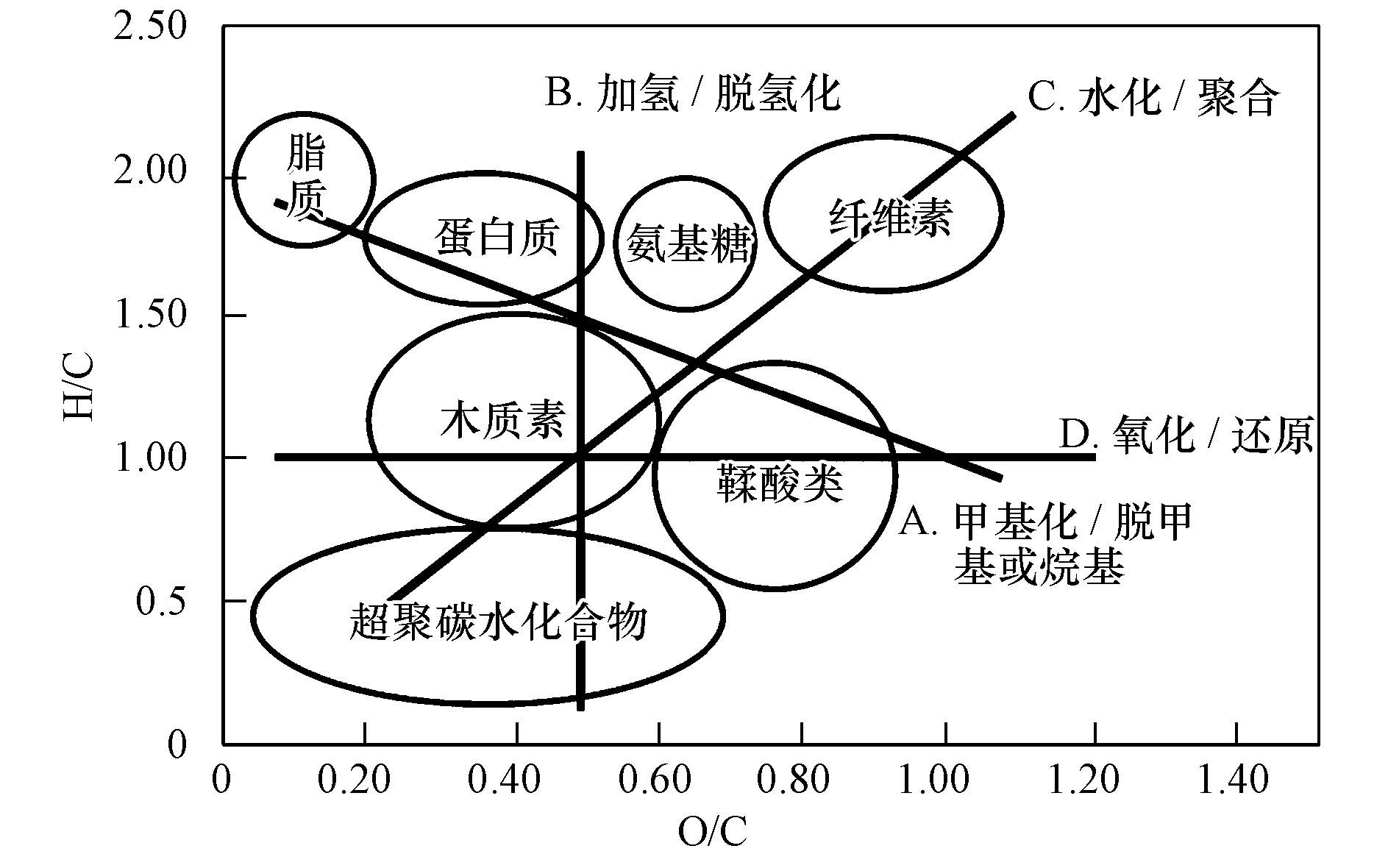 |
| 图5 表征溶解性有机质分子特征的Van Krevelen图 Fig.5 Molecular characteristics of DOM on the basis of the Van Krevelen graph |
生物标志物是一类比较稳定的DOM,能保持原有生物碳骨架等相关信息;随着近年来分子生物学和分子有机地球化学的发展,生物标志物分析技术已被广泛应用于有机质来源解析(吴丰昌,2010).类脂化含物是目前研究最多的生物标志物,主要包括正烷烃、脂肪酸、酮、醇、醛及甾、萜等(傅家谟和盛国英,1996),已广泛应用于湖泊沉积物中DOM的来源解析(Ficken et al., 2000; Meyers,2003; 盛国英等,1998; 林田等,2005);来源于浮游生物和细菌的正构烷烃碳数低,奇偶优势不明显;来源于陆生高等植物的正构烷烃则碳数较高,具有明显奇偶优势(姚书春和沈吉,2003);同系生物标志物(如正烷烃)的短碳链和长碳链组分间的相对含量比值(L/H)较高,往往指示藻类、细菌等来源有机质的优势输入(张干等,1999);类脂成分为主的水生浮游动植物死亡后,沉积物中脂肪酸以一元脂肪酸占绝对优势,而以高等植物为主输入沉积物中,有机质中含有大量结合的二元脂肪酸(向明菊等,1997).某些生物标志物只来自某些特定的生物,如甲藻甾醇、甲藻甾酮及其甾烯衍生物是甲藻输入沉积物的标志物(傅家谟和盛国英,1996).利用色谱-同位素质谱技术分析类脂生物标志物单体稳定同位素组成,使类脂标志物研究精度大大提高、误差大大降低,促进了类脂生物标志物研究的迅速发展(林田等,2005).核酸类(DNA和RNA)和蛋白质是DOM中的易变物质,但仍会有一定残留;从DOM中提取这些有机质,利用测序技术,就能鉴定湖泊沉积物中生物种类,从而解释有机质来源(梁小兵等,2001; 徐丽敏,2000).近十余年来,由于氨基酸分析技术的突破,使得氨基酸组成分析成为解析DOM来源的重要手段;该方法目前主要应用于海洋研究,在湖泊等淡水的应用较少.胞壁酸可作为细菌来源有机质的重要生物标志物(Tremblay and Benner, 2006),不同来源的DOM所含的氨基酸组成不同,因此可以利用特定氨基酸的比值来判断DOM的来源,如氨基酸与氨基糖的比值可反映DOM的动物与植物来源,葡萄糖胺与半乳糖胺的比值可反映细菌来源(该比值<2)或浮游生物来源(该比值>8)(Davis et al., 2009).
6 结语(Conclusions)溶解性有机质是水体天然有机质的主要成分,它是一类包含了复杂结构及交互作用的溶解性有机混合物,在水生生态系统中扮演着重要角色.从水中提纯溶解性有机质是其特性、表生行为与环境效应研究的前提.为了纯化得到溶解性有机质,往往需要综合膜过滤、非离子大孔树脂、离子交换树脂、冷冻干燥、真空旋转蒸发、吸附剂富集等技术.溶解性有机质表征技术经历了初期依靠光谱、色谱技术表征到近期的比表面积、热分析、电镜、原子力显微镜、X射线能谱等,而后到高分辨率质谱等技术,综合使用上述表征手段为研究溶解性有机质吸附、结合、络合、光诱导等环境行为提供了技术保障.溶解性有机质的表观特征(紫外可见吸收和荧光光谱)广泛应用于研究其在水环境中的存在状态和环境行为,也是监测水处理过程中有机质去除效果的重要手段;其微观形态、分子量分布、化学键组成等内部特征的解析是认知其分子和结构、解释其作用机理和预测其环境归趋的基础.溶解性有机质主要来源于生物体的代谢和死亡残体分解,光谱特征能判断其陆源性和内源性特征,同位素特征能判定其来源的生物体类型,而分子特征则能解释来源的物质组成,生物标志物则涉及某种来源的具体有机化合物组成.溶解性有机质来源复杂,单一指标很难判断有机质的来源,甚至会产生不同的研判结果,而综合运用多种新技术、新方法是溶解性有机质来源解析研究的发展趋势.
| [1] | Abdulla H A N, Minor E C, Hatcher P G. 2010. Using two-dimensional correlations of 13C NMR and FTIR To investigate changes in the chemical composition of dissolved organic matter along an estuarine transect[J]. Environmental Science & Technology, 44(21):8044-8049 |
| [2] | Ahlgren G, Gustafsson I B, Boberg M. 1992. Fatty acid content and chemical compostition of freshwater microalgae[J]. Journal of Phycology, 28(1):37-50 |
| [3] | Ahmed T, Ohta K, Nagafuchi O, et al. 2012. Binding interactions of 1-naphthol with dissolved organic matter of Lake Biwa and treated sewage wastewater:The role of microbial fulvic acid[J]. Environmental Toxicology and Chemistry, 31(10):2201-2209 |
| [4] | Albrecht R, Le Petit J, Terrom G, et al. 2011. Comparison between UV spectroscopy and nirs to assess humification process during sewage sludge and green wastes co-composting[J]. Bioresource Technology, 102(6):4495-4500 |
| [5] | Andersen T, Hessen D O. 1991. Carbon, nitrogen, and phosphorus-content of fresh-water zooplankton[J]. Limnology and Oceanography, 36(4):807-814 |
| [6] | Aster B, Burba P, Broekaert J A C. 1996. Analytical fractionation of aquatic humic substances and their metal species by means of multistage ultrafiltration[J]. Fresenius Journal of Analytical Chemistry, 354(5):722-728 |
| [7] | Averett R C, Leenheer J A, McKnight D M, et al. 1994. Humic Substances in the Suwannee River, Georgia; Interactions, Properties, and Proposed Structures[M]. New York:U.S. Geological Survey, Map Distribution |
| [8] | Baker A, Tipping E, Thacker S A, et al. 2008. Relating dissolved organic matter fluorescence and functional properties[J]. Chemosphere, 73(11):1765-1772 |
| [9] | Balnois E, Wilkinson K J, Lead J R, et al. 1999. Atomic force microscopy of humic substances:Effects of pH and ionic strength[J]. Environmental Science & Technology, 33(21):3911-3917 |
| [10] | Battin T J. 1998. Dissolved organic matter and its optical properties in a blackwater tributary of the upper Orinoco river, Venezuela[J]. Organic Geochemistry, 28(9/10):561-569 |
| [11] | Birdwell J E, Valsaraj K T. 2010. Characterization of dissolved organic matter in fogwater by excitation-emission matrix fluorescence spectroscopy[J]. Atmospheric Environment, 44(27):3246-3253. |
| [12] | Bridgeman J, Gulliver P, Roe J, et al. 2014. Carbon isotopic characterisation of dissolved organic matter during water treatment[J]. Water Research, 48:119-125 |
| [13] | Brown T L, Rice J A. 2000. Effect of experimental parameters on the ESI FT-ICR mass spectrum of fulvic acid[J]. Analytical Chemistry, 72(2):384-390 |
| [14] | Cawley K M, Ding Y, Fourqurean J, et al. 2012. Characterising the sources and fate of dissolved organic matter in Shark Bay, Australia:a preliminary study using optical properties and stable carbon isotopes[J]. Marine and Freshwater Research, 63(11):1098-1107 |
| [15] | Cawley K M, McKnight D M, Miller P, et al. 2013. Characterization of fulvic acid fractions of dissolved organic matter during ice-out in a hyper-eutrophic, coastal pond in Antarctica[J]. Environmental Research Letters, 8(4):045015 |
| [16] | Chai X L, Ji R, Wu J, et al. 2010. Abiotic association of PAEs with humic substances and its influence on the fate of PAEs in landfill leachate[J]. Chemosphere, 78(11):1362-1367 |
| [17] | Chekli L, Phuntsho S, Roy M, et al. 2013. Characterisation of Fe-oxide nanoparticles coated with humic acid and Suwannee River natural organic matter[J]. Science of the Total Environment, 461-462:19-27 |
| [18] | 陈欣. 2012. 长江口及其邻近海域CDOM光学特性与示踪应用的初步研究[D]. 杭州:浙江大学 |
| [19] | Cory R M, McKnight D M. 2005. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter[J]. Environmental Science & Technology, 39(21):8142-8149 |
| [20] | Cozzi S, Cantoni C. 2011. Stable isotope (δ13C and 15δN) composition of particulate organic matter, nutrients and dissolved organic matter during spring ice retreat at Terra Nova Bay[J]. Antarctic Science, 23(1):43-56 |
| [21] | 戴春燕, 吴静, 向熙, 等. 2013. 工业废水为主的城市污水的荧光指纹特征[J]. 光谱学与光谱分析, 33(2):414-417 |
| [22] | Davis J, Kaiser K, Benner R. 2009. Amino acid and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis[J]. Organic Geochemistry, 40(3):343-352 |
| [23] | Dong H P, Wang D Z, Xie Z X, et al. 2013. Metaproteomic characterization of high molecular weight dissolved organic matter in surface seawaters in the South China Sea[J]. Geochimica et Cosmochimica Acta, 109:51-61 |
| [24] | Dong W M, Liang L Y, Brooks S, et al. 2010. Roles of dissolved organic matter in the speciation of mercury and methylmercury in a contaminated ecosystem in Oak Ridge, Tennessee[J]. Environmental Chemistry, 7(1):94-102 |
| [25] | Ertunç T, Hartlieb N, Berns A, et al. 2002. Investigations on the binding mechanism of the herbicide simazine to dissolved organic matter in leachates of compost[J]. Chemosphere, 49(6):597-604 |
| [26] | Everett C R, Chin Y P, Aiken G R. 1999. High-pressure size exclusion chromatography analysis of dissolved organic matter isolated by tangential-flow ultrafiltration[J]. Limnology and Oceanography, 44(5):1316-1322 |
| [27] | 方芳, 翟端端, 郭劲松, 等. 2010. 三峡水库小江回水区溶解有机物的三维荧光光谱特征[J]. 长江流域资源与环境, 19(3):323-328 |
| [28] | Fellman J B, Miller M P, Cory R M, et al. 2009. Characterizing dissolved organic matter using PARAFAC modeling of fluorescence spectroscopy:a comparison of two models[J]. Environmental Science & Technology, 43(16):6228-6234 |
| [29] | 冯龙庆, 刘明亮, 张运林, 等. 2011. 夏季丰水期河流输入对太湖有色可溶性有机物的贡献[J]. 水科学进展, 22(1):104-111 |
| [30] | Ficken K, Li B, Swain D L, et al. 2000. An n-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes[J]. Organic Geochemistry, 31(7/8):745-749 |
| [31] | Frimmel F H, Abbt-Braun G. 2009. Dissolved organic matter (DOM) in natural environment//Senesi N, Xing B, Huang P M, eds. Biophysico-Chemical Processes Involving Natural Nonliving Organic Matter in Environmental Systems[M]. New York:John Wiley & Sons, Inc |
| [32] | 傅家谟, 盛国英. 1996. 环境有机地球化学初探[J]. 地学前缘, 3(1/2):127-132 |
| [33] | Gueguen C, Guo L D, Wang D L, et al. 2006. Chemical characteristics and origin of dissolved organic matter in the Yukon River[J]. Biogeochemistry, 77(2):139-155 |
| [34] | Guo X J, He L S, Li Q, et al. 2014. Investigating the spatial variability of dissolved organic matter quantity and composition in Lake Wuliangsuhai[J]. Ecological Engineering, 62:93-101 |
| [35] | Haberhauer G, Bednar W, Gerzabek M H, et al. 2000. Application of MALDI-TOF-MS to the characterization of fulvic acids//Ghabbour E A, Davies G, eds. Humic Substances:Versatile Components of Plants, Soil and Water[M]. Cambridge:Royal Soc Chemistry. 143-152 |
| [36] | Henderson R K, Baker A, Murphy K R, et al. 2009. Fluorescence as a potential monitoring tool for recycled water systems:A review[J]. Water Research, 43(4):863-881 |
| [37] | Hendrixson H A, Sterner R W, Kay A D. 2007. Elemental stoichiometry of freshwater fishes in relation to phylogeny, allometry and ecology[J]. Journal of Fish Biology, 70(1):121-140 |
| [38] | Hu J D, Zevi Y, Kou X M, et al. 2010. Effect of dissolved organic matter on the stability of magnetite nanoparticles under different pH and ionic strength conditions[J]. Science of the Total Environment, 408(16):3477-3489 |
| [39] | Huguet A, Vacher L, Saubusse S, et al. 2010. New insights into the size distribution of fluorescent dissolved organic matter in estuarine waters[J]. Organic Geochemistry, 41(6):595-610 |
| [40] | Hur J, Schlautman M A. 2003. Using selected operational descriptors to examine the heterogeneity within a bulk humic substance[J]. Environmental Science & Technology, 37(5):880-887 |
| [41] | Itoh A, Haraguchi H. 1994. Formation of large molecular humic acid with addition of zinc ion as elucidated by liquid chromatography/ICP-AES[J]. Chemistry Letters, (9):1627-1630 |
| [42] | Jaffé R, Boyer J N, Lu X, et al. 2004. Source characterization of dissolved organic matter in a subtropical mangrove-dominated estuary by fluorescence analysis[J]. Marine Chemistry, 84(3/4):195-210 |
| [43] | Jaffé R, Yamashita Y, Maie N, et al. 2012. Dissolved organic matter in headwater streams:compositional variability across climatic regions of North America[J]. Geochimica et Cosmochimica Acta, 94:95-108 |
| [44] | 蒋愉林, 黄清辉, 李建华. 2008. 水体有色溶解有机质的研究进展[J]. 江苏环境科技, 21(2):57-59 |
| [45] | Kaiser E, Simpson A J, Dria K J, et al. 2003. Solid-state and multidimensional solution-state NMR of solid phase extracted and ultrafiltered riverine dissolved organic matter[J]. Environmental Science & Technology, 37(13):2929-2935 |
| [46] | Kalbitz K, Geyer S, Geyer W. 2000. A comparative characterization of dissolved organic matter by means of original aqueous samples and isolated humic substances[J]. Chemosphere, 40(12):1305-1312 |
| [47] | Kim H C, Yu M J, Han I. 2006. Multi-method study of the characteristic chemical nature of aquatic humic substances isolated from the Han River, Korea[J]. Applied Geochemistry, 21(7):1226-1239 |
| [48] | Klaus U, Pfeifer T, Spiteller M. 2000. APCI-MS/MS:A powerful tool for the analysis of bound residues resulting from the interaction of pesticides with DOM and humic substances[J]. Environmental Science & Technology, 34(16):3514-3520 |
| [49] | Koch B P, Ludwichowski K U, Kattner G, et al. 2008. Advanced characterization of marine dissolved organic matter by combining reversed-phase liquid chromatography and FT-ICR-MS[J]. Marine Chemistry, 111(3/4):233-241 |
| [50] | Kowalczuk P, Durako M J, Young H, et al. 2009. Characterization of dissolved organic matter fluorescence in the South Atlantic Bight with use of PARAFAC model:Interannual variability[J]. Marine Chemistry, 113(3/4):182-196 |
| [51] | Kowalczuk P, Cooper W J, Durako M J, et al. 2010. Characterization of dissolved organic matter fluorescence in the South Atlantic Bight with use of PARAFAC model:Relationships between fluorescence and its components, absorption coefficients and organic carbon concentrations[J]. Marine Chemistry, 118(1/2):22-36 |
| [52] | Kujawinski E B, Hatcher P G, Freitas M A. 2002. High-resolution fourier transform ion cyclotron resonance mass spectrometry of humic and fulvic acids:Improvements and comparisons[J]. Analytical Chemistry, 74(2):413-419 |
| [53] | Lam B, Baer A, Alaee M, et al. 2007. Major structural components in freshwater dissolved organic matter[J]. Environmental Science & Technology, 41(24):8240-8247 |
| [54] | Langner P, Mikutta C, Suess E, et al. 2013. Spatial distribution and speciation of arsenic in peat studied with microfocused x-ray fluorescence spectrometry and x-ray absorption spectroscopy[J]. Environmental Science & Technology, 47(17):9706-9714 |
| [55] | Lapierre J F, Frenette J J. 2009. Effects of macrophytes and terrestrial inputs on fluorescent dissolved organic matter in a large river system[J]. Aquatic Sciences, 71(1):15-24 |
| [56] | Leenheer J A, Croué J P. 2003. Peer reviewed:characterizing aquatic dissolved organic matter[J]. Environmental Science & Technology, 37(1):18A-26A |
| [57] | Leenheer J A, Noyes T I, Rostad C E, et al. 2004. Characterization and origin of polar dissolved organic matter from the Great Salt Lake[J]. Biogeochemistry, 69(1):125-141 |
| [58] | 梁小兵, 万国江, 黄荣贵. 2001. PCR-RFLP 技术在环境地球化学研究中的应用及展望[J]. 地质地球化学, 29(1):94-98 |
| [59] | 林田, 郭志刚, 杨作升. 2005. 类脂化合物单体碳稳定同位素在古气候环境研究中的意义[J]. 地球科学进展, 20(8):910-915 |
| [60] | 吕丽莎, 赵卫红, 苗辉. 2013. 三维荧光结合平行因子分析在东海溶解有机物研究中的应用[J]. 光谱学与光谱分析, 33(3):653-658 |
| [61] | Müller A, Mathesius U. 1999. The palaeoenvironments of coastal lagoons in the southern Baltic Sea, I. The application of sedimentary Corg/N ratios as source indicators of organic matter[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 145(1/3):1-16 |
| [62] | Ma H Z, Allen H E, Yin Y J. 2001. Characterization of isolated fractions of dissolved organic matter from natural waters and a wastewater effluent[J]. Water Research, 35(4):985-996 |
| [63] | Mao J D, Kong X Q, Schmidt-Rohr K, et al. 2012. Advanced solid-state NMR characterization of marine dissolved organic matter isolated using the coupled reverse osmosis/electrodialysis method[J]. Environmental Science & Technology, 46(11):5806-5814 |
| [64] | McCurry D L, Speth T F, Pressman J G. 2012. Lyophilization and reconstitution of reverse-osmosis concentrated natural organic matter from a drinking water source[J]. Journal of Environmental Engineering, 138(4):402-410 |
| [65] | Meng F G, Huang G C, Yang X, et al. 2013. Identifying the sources and fate of anthropogenically impacted dissolved organic matter (DOM) in urbanized rivers[J]. Water Research, 47(14):5027-5039 |
| [66] | Meyers P A. 2003. Applications of organic geochemistry to paleolimnological reconstructions:a summary of examples from the Laurentian Great Lakes[J]. Organic Geochemistry, 34(2):261-289 |
| [67] | Mirkina S D. 1977. The isolation and biochemical characteristics of dissolved organic matter in natural waters[J]. Okeanologiya, 17(4):629-637 |
| [68] | Murphy K R, Stedmon C A, David Waite T, et al. 2008. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy[J]. Marine Chemistry, 108(1/2):40-58 |
| [69] | Namjesnik-Dejanovic K, Maurice P A. 1997. Atomic force microscopy of soil and stream fulvic acids[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 120(1/3):77-86 |
| [70] | Navalon S, Alvaro M, Alcaina I, et al. 2010. Multi-method characterization of DOM from the Turia river (Spain)[J]. Applied Geochemistry, 25(11):1632-1643 |
| [71] | Nebbioso A, Piccolo A. 2013. Molecular characterization of dissolved organic matter (DOM):a critical review[J]. Analytical and Bioanalytical Chemistry, 405(1):109-124 |
| [72] | Nguyen H V M, Hur J. 2011. Tracing the sources of refractory dissolved organic matter in a large artificial lake using multiple analytical tools[J]. Chemosphere, 85(5):782-789 |
| [73] | Ouellet A, Catana D, Plouhinec J B, et al. 2008. Elemental, isotopic, and spectroscopic assessment of chemical fractionation of dissolved organic matter sampled with a portable reverse osmosis system[J]. Environmental Science & Technology, 42(7):2490-2495 |
| [74] | Pan B, Ghosh S, Xing B S. 2008. Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration[J]. Environmental Science & Technology, 42(5):1594-1599 |
| [75] | Parr T B, Ohno T, Cronan C S, et al. 2014. comPARAFAC:a library and tools for rapid and quantitative comparison of dissolved organic matter components resolved by Parallel Factor Analysis[J]. Limnology and Oceanography:Methods, 12(3):114-125 |
| [76] | Peuravuori J, Pihlaja K. 1997. Molecular size distribution and spectroscopic properties of aquatic humic substances[J]. Analytica Chimica Acta, 337(2):133-149 |
| [77] | Post W M, Peng T-H, Emanuel W R, et al. 1990. The global carbon cycle[J]. American Scientist, 78(4):310-326 |
| [78] | Santos P S M, Otero M, Duarte R M B O, et al. 2009. Spectroscopic characterization of dissolved organic matter isolated from rainwater[J]. Chemosphere, 74(8):1053-1061 |
| [79] | Santos P S M, Otero M, Filipe O M S, et al. 2010. Comparison between DAX-8 and C-18 solid phase extraction of rainwater dissolved organic matter[J]. Talanta, 83(2):505-512 |
| [80] | Schulten H R. 1999. Interactions of dissolved organic matter with xenobiotic compounds:Molecular modeling in water[J]. Environmental Toxicology and Chemistry, 18(8):1643-1655 |
| [81] | Schwede-Thomas S B, Chin Y P, Dria K J, et al. 2005. Characterizing the properties of dissolved organic matter isolated by XAD and C-18 solid phase extraction and ultrafiltration[J]. Aquatic Sciences, 67(1):61-71 |
| [82] | Serkiz S M, Michael Perdue E. 1990. Isolation of dissolved organic-matter from the suwannee river using reverse-osmosis[J]. Water Research, 24(7):911-916 |
| [83] | 盛国英, 蔡克勤, 阳学贤, 等. 1998. 合同察汗淖 (碱) 湖沉积物中的长链不饱和酮及其古气候意义[J]. 科学通报, 43(11):1090-1093 |
| [84] | Simjouw J P, Minor E C, Mopper K. 2005. Isolation and characterization of estuarine dissolved organic matter:Comparison of ultrafiltration and C18 solid-phase extraction techniques[J]. Marine Chemistry, 96(3/4):219-235 |
| [85] | Sleighter R L, Hatcher P G. 2007. The application of electrospray ionization coupled to ultrahigh resolution mass spectrometry for the molecular characterization of natural organic matter[J]. Journal of Mass Spectrometry, 42(5):559-574 |
| [86] | Spencer R G M, Pellerin B A, Bergamaschi B A, et al. 2007. Diurnal variability in riverine dissolved organic matter composition determined by in situ optical measurement in the San Joaquin River (California, USA)[J]. Hydrological Processes, 21(23):3181-3189 |
| [87] | Spencer R G M, Aiken G R, Dyda R Y, et al. 2010. Comparison of XAD with other dissolved lignin isolation techniques and a compilation of analytical improvements for the analysis of lignin in aquatic settings[J]. Organic Geochemistry, 41(5):445-453 |
| [88] | Spencer R G M, Butler K D, Aiken G R. 2012. Dissolved organic carbon and chromophoric dissolved organic matter properties of rivers in the USA[J]. Journal of Geophysical Research-Biogeosciences, 117(3), doi:10.1029/2011JG001928 |
| [89] | Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods, 6(11):572-579 |
| [90] | Stenson A C, Landing W M, Marshall A G, et al. 2002. Ionization and fragmentation of humic substances in electrospray ionization Fourier transform-ion cyclotron resonance mass spectrometry[J]. Analytical Chemistry, 74(17):4397-4409 |
| [91] | Thiessen G, Engelder C J. 1930. Isolation of the humic acids[J]. Industrial and Engineering Chemistry, 22(10):1131-1133 |
| [92] | Thurman E M, Malcolm R L. 1981. Preparative isolation of aquatic humic substances[J]. Environmental Science & Technology, 15(4):463-466 |
| [93] | Tremblay L, Benner R. 2006. Microbial contributions to N-immobilization and organic matter preservation in decaying plant detritus[J]. Geochimica et Cosmochimica Acta, 70(1):133-146 |
| [94] | Tremblay L B, Dittmar T, Marshall A G, et al. 2007. Molecular characterization of dissolved organic matter in a North Brazilian mangrove porewater and mangrove-fringed estuaries by ultrahigh resolution Fourier Transform-Ion Cyclotron Resonance mass spectrometry and excitation/emission spectroscopy[J]. Marine Chemistry, 105(1/2):15-29 |
| [95] | Wagoner D B, Christman R F, Cauchon G, et al. 1997. Molar mass and size of Suwannee River natural organic matter using multi-angle laser light scattering[J]. Environmental Science & Technology, 31(3):937-941 |
| [96] | Wang L Y, Wu F C, Zhang R Y, et al. 2009. Characterization of dissolved organic matter fractions from Lake Hongfeng, Southwestern China Plateau[J]. Journal of Environmental Sciences, 21(5):581-588 |
| [97] | 王曼霖, 席北斗, 许其功, 等. 2012. 镜泊湖水体水溶性有机物荧光特性研究[J]. 光谱学与光谱分析, 32(9):2477-2481 |
| [98] | Wang Y, Zhang D, Shen Z Y, et al. 2014. Characterization and spacial distribution variability of chromophoric dissolved organic matter (CDOM) in the Yangtze Estuary[J]. Chemosphere, 95:353-362 |
| [99] | Weber J H, Wilson S A. 1975. The isolation and characterization of fulvic acid and humic acid from river water[J]. Water Research, 9(12):1079-1084 |
| [100] | Woods G C, Simpson M I, Kelleher B P, et al. 2010. Online high-performance size exclusion chromatography-nuclear magnetic resonance for the characterization of dissolved organic matter[J]. Environmental Science & Technology, 44(2):624-630 |
| [101] | 吴丰昌, 王立英, 黎文, 等. 2008. 天然有机质及其在地表环境中的重要性[J]. 湖泊科学, 20(1):1-12 |
| [102] | Wu F C, Takahito Y, Hiroshi S, et al. 2009. Dissolved organic matter in the aquatic environment//Wu F C, Xing B S, eds. Natural Organic Matter And Its Significance in The Environment[M]. Beijing:Science Press |
| [103] | 吴丰昌. 2010. 天然有机质及其与污染物的相互作用[M]. 北京:科学出版社 |
| [104] | 吴静, 崔硕, 苏伟, 等. 2011. 北京城市水体的三维荧光特征[J]. 光谱学与光谱分析, 31(6):1562-1566 |
| [105] | 吴静, 谢超波, 曹知平, 等. 2012. 炼油废水的荧光指纹特征[J]. 光谱学与光谱分析, 32(2):415-419 |
| [106] | Wu P X, Tang Y N, Wang W M, et al. 2011. Effect of dissolved organic matter from Guangzhou landfill leachate on sorption of phenanthrene by Montmorillonite[J]. Journal of Colloid and Interface Science, 361(2):618-627 |
| [107] | 向明菊, 史继扬, 周友平, 等. 1997. 不同类型沉积物中脂肪酸的分布、演化和生烃意义. 沉积学报, 15(2):84-88 |
| [108] | 席北斗, 魏自民, 赵越, 等. 2008. 垃圾渗滤液水溶性有机物荧光谱特性研究[J]. 光谱学与光谱分析, 28(11):2605-2608 |
| [109] | Xu B, Ye T, Li D P, et al. 2011. Measurement of dissolved organic nitrogen in a drinking water treatment plant:Size fraction, fate, and relation to water quality parameters[J]. Science of the Total Environment, 409(6):1116-1122 |
| [110] | 徐成斌, 孟雪莲, 马溪平, 等. 2010. 人工湿地处理水体中溶解有机物的三维荧光光谱表征[A]//2010年环境污染与大众健康学术会议[C]. 武汉:武汉大学 |
| [111] | 徐丽敏. 2000. 21世纪的生命科学一邹承鲁教授访谈录[J]. 生物化学与生物物理进展, 27(1):3-5 |
| [112] | 杨长明, 汪盟盟, 马锐, 等. 2012. 城镇污水厂尾水人工湿地深度处理过程中 DOM 三维荧光光谱特征[J]. 光谱学与光谱分析, 32(3):708-713 |
| [113] | 姚书春, 沈吉. 2003. 巢湖沉积物柱样中正构烷烃初探[J]. 湖泊科学, 15(3):200-204 |
| [114] | 张干, 王苏民, 傅家谟, 等. 1999. 固城湖 GS-1 孔 11.87-12.28 m 古环境变更线的分子有机地球化学证据[J]. 科学通报, 44(7):775-779 |
| [115] | Zhang L, Leboeuf E J, Xing B S. 2007. Thermal analytical investigation of biopolymers and humic- and carbonaceous-based soil and sediment organic matter[J]. Environmental Science & Technology, 41(14):4888-4894 |
| [116] | Zhang Y L, van Dijk M A, Liu M L, et al. 2009. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes:Field and experimental evidence[J]. Water Research, 43(18):4685-4697 |
| [117] | Zhang Y L, Liu X H, Wang M Z, et al. 2013. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes[J]. Organic Geochemistry, 55:26-37 |
| [118] | 赵瑾, 席北斗, 许其功, 等. 2013. 兴凯湖沉积物富里酸荧光特性研究[J]. 光谱学与光谱分析, 33(7):1824-1828 |
| [119] | 赵芸, 林进, 陈浩, 等. 2013. 辽河水体中溶解有机质的光谱初步研究[J]. 环境科学与技术, 36(4):103-108 |
| [120] | 祝鹏, 廖海清, 华祖林, 等. 2012. 平行因子分析法在太湖水体三维荧光峰比值分析中的应用[J]. 光谱学与光谱分析, 32(1):152-156 |
| [121] | 朱松泉, 窦宏身. 1993. 洪泽湖[M]. 合肥:中国科学技术大学出版社. 94-95 |
| [122] | Zhuo J F, Guo W D, Deng X, et al. 2010. Fluorescence excitation-emission matrix spectroscopy of CDOM from Yundang Lagoon and its indication for organic pollution[J]. Spectroscopy and Spectral Analysis, 30(6):1539-1544 |
| [123] | 闫丽红, 陈学君, 苏荣国, 等. 2013a. 2010年秋季长江口口外海域CDOM的三维荧光光谱-平行因子分析[J]. 环境科学, 34(1):51-60 |
| [124] | 闫丽红, 苏荣国, 段亚丽, 等. 2013b. 渤海有色溶解有机物的三维荧光光谱特征[J]. 海洋与湖沼, 44(5):1162-1169 |
 2016, Vol. 36
2016, Vol. 36


