苯并〖a〗芘(BaP)是一种典型的PAHs,主要来源于化石燃料的不完全燃烧和吸烟暴露(Caiment et al.,2015).流行病学调查表明长期香烟暴露可以增加人类心血管疾病的发病率和死亡率(Jacobs et al.,1999;Gentner and Weber,2011).实验室研究表明在人类心血管疾病的发生与发展过程中,BaP起着直接或间接的作用(Gentner and Weber,2011;Jules et al.,2012).一般来说,进入体内的BaP结合并激活芳香烃受体(AhR),诱导细胞色素P450(CYP1A和CYP1B)的表达,同时BaP被其催化形成二氢二醇环氧化物(BPDE),其中以反式BPDE(anti-BPDE)致癌性最强(Miller and Ramos,2001;Bansal et al.,2014).另一方面,CYP1A的表达导致活性氧(ROS)的浓度升高(Kim et al.,2000).线粒体不仅是ROS产生的主要场所,也是ROS作用的重要靶部位.ROS浓度的上升反过来会引起线粒体损伤,例如氧化应激、线粒体呼吸障碍和mtDNA损伤(Bansal et al.,2014).
SO2是环境中普遍存在的污染物,主要来源于含硫矿石燃料的燃烧和加工.流行病学资料显示,SO2吸入人体后,不仅对呼吸系统有毒作用,而且可以增加心血管疾病,如心梗、心律失常、缺血性心脏病、心力衰竭等的发生率和死亡率(阚海东和陈秉衡,2002).吸入生物体内的SO2,极容易在体液中转化为它的代谢衍生物——亚硫酸盐和亚硫酸氢盐(Shapiro,1977).实验室前期研究表明,SO2是一种全身性毒物,这些衍生物会随着血液在体内循环,到达小鼠各个组织脏器(包括心脏)造成氧化损伤及DNA损伤(Meng,2003;Meng et al.,2004).进一步研究显示,SO2可以引起小鼠心脏超微结构的改变,其中以线粒体最明显,受损伤最严重(Meng and Liu,2007).线粒体是氧化磷酸化的主要场所,线粒体代谢产生的能量是机体内能量的主要来源,而心脏是高度依赖ATP的器官.Hadler揭示亚硫酸盐的毒性与线粒体氧化磷酸化功能受损有关(Hadler and Cook,1979). 本课题组前期实验已经就SO2诱导心脏线粒体损伤的分子机制进行了探讨,实验结果表明,大鼠吸入SO2后,可能通过降低心肌中PGC1-α的表达,影响其与NRF1的结合及对mtTFA的调控,进一步抑制线粒体基因组的转录,最终可能使大鼠心肌线粒体的氧化磷酸化功能受损(秦国华等,2014).
SO2与PAHs都是典型煤烟型大气污染物中重要的组成成分.研究者们发现SO2对BaP诱发的大鼠和仓鼠肺部肿瘤有增强作用;亚硫酸盐可增加BPDE的致突变性,使BPDE与核DNA的结合增加(Pauluhn et al.,1985;Reed and Jones,1996;Green et al.,1994).课题组前期实验也表明,在SO2和BaP急性暴露下,SO2通过调控原癌基因的表达起到对BaP的辅致癌作用(Qin and Meng,2006,2010).之前对SO2和BaP复合暴露的研究都集中在探讨致癌机制,关于二者诱导线粒体损伤的分子机制尚未见报道.因此,本实验对小鼠进行SO2动式吸入染毒与BaP腹腔注射,在mRNA和蛋白水平检测线粒体氧化磷酸化复合体的两种亚基(CO4和ATP6)及调控线粒体呼吸链组分的核转录因子PGC1-α、NRF1和mtTFA的表达.
2 材料与方法(Materials and methods) 2.1 实验动物处理C57BL6 品系雄性小鼠(体重18~20 g)24只,购自北京维通利华实验动物技术有限公司,随机分成4组,每组6只,分别为对照组、SO2组、BaP组、SO2+BaP组.其中SO2组和SO2+BaP组在1 m3的玻璃熏气箱中进行SO2(7 mg · m-3)动式吸入染毒,每天6 h,共28 d(Meng et al.,2005).对照组和BaP组接受过滤的新鲜空气.箱顶的电动搅拌扇可以保证箱内气体浓度均匀一致,箱内SO2浓度采用盐酸副玫瑰苯胺分光光度法分析测定,每30 min测定1次.动物染毒期间禁食禁水,其余时间自由进食和饮水(自来水).SO2吸入染毒开始后的第1~5 d,每天在SO2吸入染毒后,BaP组和SO2+BaP组进行腹腔注射溶于橄榄油的BaP(40 mg · kg-1(b.w.)),每天注射1次;而对照组和SO2组只注射橄榄油(Grova et al.,2008).熏气结束禁食18 h后将动物脱颈处死,取心脏放入液氮中速冻后转入-80 ℃冰箱中保存.
2.2 mRNA的提取与荧光定量PCR取60 mg的心脏组织,用Trizol提取总RNA,琼脂糖凝胶电泳检测RNA纯度,分光光度计测定OD260/OD280,确保比值在1.9~2.1的范围内.取1 μg总RNA,采用PrimeScriptTM反转试剂盒合成cDNA,合成后的cDNA产物于-80 ℃备用.使用Analytik Jena荧光定量PCR仪进行扩增,扩增所需引物均采用Primer Premier 5.0软件设计,引物序列见表 1. PCR体系为20 μL,其中含有1 μL cDNA,10 μL SYBR Premix Ex Taq,上下游引物各1 μL和7 μL H2O.反应条件为:95 ℃预变性3 min; 95 ℃变性20 s,55 ℃退火20 s,72℃延伸20 s,45个循环,每个循环在72 ℃采集荧光信号;最后在60~72 ℃获得溶解曲线.由标准曲线获得样品目的基因的浓度,结果以目的基因与GAPDH基因表达的比值来表示.
| 表 1 荧光定量PCR所用引物序列 Table 1 Primers used in real-time RT-PCR |
取60 mg心脏组织,加1 mL蛋白工作液,匀浆至无组织块.蛋白工作液成分为:1% Nonidet P40,1 mmol · L-1 EDTA,125 mmol · L-1 sodium fluoride,0.5 mmol · L-1 sodium vanadate,2.5 μg · mL-1 aprotinin,5 μg · mL-1 pepstatin,50 μg · mL-1 leupeptin,25 μmol · L-1 PMSF,25 μg · mL-1 trypsin inhibitor.匀浆后转移至EP管中,4 ℃放置20 min,1300 r · min-1,离心15 min,取上清,以BSA为标准蛋白用考马斯亮蓝法测蛋白浓度.采用Western blot方法检测目的基因的蛋白表达情况.以50 μg的蛋白上样,使用聚丙烯酰氨凝胶电泳(SDS-PAGE)法分离蛋白,将目的蛋白电转PVDF膜上,封闭,一抗过夜孵育,荧光二抗孵育之后使用Odyssey红外扫描仪进行扫描,结果以目的基因与GAPDH基因灰度的比值来表示.
2.4 数据处理用SPSS统计软件分析数据,用origin 7.0作图.结果以均值±标准误(mean±SE)来表示,用One-way ANOVA法检验染毒组与对照组的显著性差异.
3 结果(Results) 3.1 SO2和BaP复合暴露对小鼠心脏线粒体氧化磷酸化复合体Ⅳ、Ⅴ两种亚基mRNA表达水平的影响如图 1所示,检测SO2和BaP复合暴露后,心脏线粒体呼吸途径中复合体Ⅳ的亚基CO4以及复合体Ⅴ的亚基ATP6 mRNA表达水平.结果表明:如图 1a所示,对于由nDNA编码的CO4,与对照组相比,SO2单独作用并没有产生损伤,BaP组CO4表达下降但不显著,SO2+BaP组有显著性差异,分别为对照组的1.11、0.89、0.80倍;且SO2+BaP组与SO2组相比,有统计学意义上的显著性差异.图 1b表明,与对照组相比,由mtDNA编码的ATP6在SO2慢性暴露28 d后表达没有下降,BaP处理后表达下降,复合暴露组mRNA的表达显著性下降,分别是对照组的1.44、0.44、0.33倍,且复合暴露组与SO2组相比显著性下降.
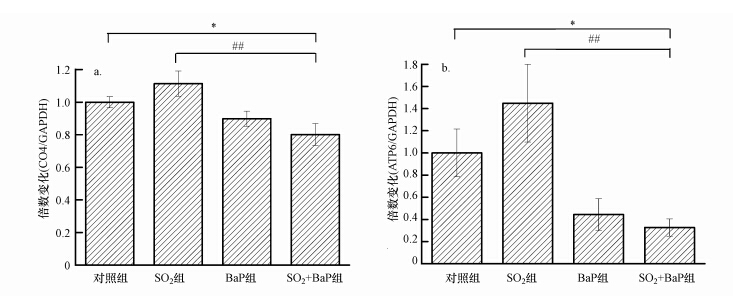 |
| 图 1 SO2和BaP复合暴露对线粒体氧化磷酸化复合体Ⅳ亚基CO4(a)复合体Ⅳ亚基ATP6,(b)mRNA表达水平的影响(SO2组、BaP组、SO2+BaP组与对照组比较,*p<0.05; SO2+BaP组与SO2组比较,##p<0.01;n=6) Fig. 1 Effect of SO2 and BaP co-exposure on mRNA levels of CO4 and ATP6 in mouse myocardial cell |
如图 2a所示,与对照组比较,处理组的线粒体调控基因PGC1-α的mRNA表达水平降低,其中BaP组和SO2+BaP组与对照组相比有显著性差异,分别为对照组的0.75和0.74倍.NRF1和mtTFA变化趋势一致:SO2慢性暴露28 d后,与对照组比较,NRF1和mtTFA的mRNA表达上升但不显著;BaP单独作用和污染物复合暴露组NRF1和mtTFA 在mRNA表达水平上降低,NRF1和mtTFA在SO2+BaP组与对照组差异显著,分别为对照组的0.51、0.53倍;复合暴露组与SO2单独作用比较有显著性差异(图 2 b和图 2 c).
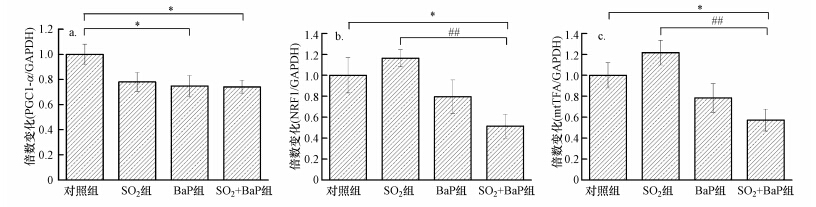 |
| 图 2 SO2和BaP复合暴露对PGC1-α(a)、NRF1(b)和mtTFA(c)的mRNA表达水平的影响(SO2组、BaP组、SO2+BaP组与对照组比较,*p<0.05; SO2+BaP组与SO2组比较,##p<0.01; n=6) Fig. 2 Effect of SO2 and BaP co-exposure on mRNA levels of PGC1-α、NRF1 and mtTFA in mouse myocardial cell |
图 3表示SO2和BaP复合暴露对小鼠心脏线粒体调控基因PGC1-α、NRF1、mtTFA蛋白水平的影响,其中图中柱形图上方所示为蛋白条带图.由图可知,与对照组相比,SO2单独暴露后对小鼠心脏PGC1-α、NRF1的蛋白水平呈降低趋势,mtTFA蛋白表达表现为上升趋势,但都不显著;BaP单独作用后,PGC1-α 的蛋白表达水平与对照组相比降低但不显著,NRF1和mtTFA的蛋白表达无显著下调.SO2+BaP组与对照组相比,3种调控基因表达下降,分别为对照组的0.82、0.61、0.70倍,其中NRF1和mtTFA蛋白表达与对照组相比有显著性差异.
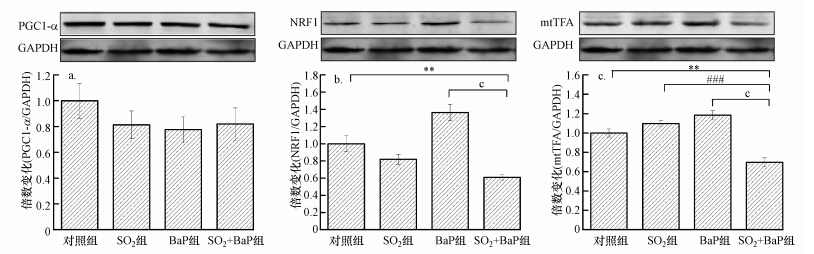 |
| 图 3 SO2和BaP复合暴露对PGC1-α(a)、NRF1(b)和mtTFA(c)的蛋白表达水平的影响(SO2组、BaP组、SO2+BaP组与对照组比较,**p<0.01; SO2+BaP组与SO2组比较,###p<0.001;SO2+BaP组与BaP比较,cp<0.001;n=6) Fig. 3 Effect of SO2 and BaP co-exposure on protein levels of PGC1-α、NRF1 and mtTFA in mouse myocardial cell |
线粒体是氧化磷酸化的主要场所,呼吸链上的蛋白受核DNA(nDNA)和线粒体DNA(mtDNA)的双重控制,其中细胞色素C氧化酶是线粒体呼吸链电子传递的终末复合酶,CO4是细胞色素C氧化酶的一个亚基,由nDNA编码;ATP合酶是生物体内广泛存在的一种重要的膜酶,ATP6是其中一个由mtDNA编码的亚基.实验室前期实验表明,SO2急性暴露7 d,可引起大鼠心肌线粒体mtDNA编码的亚基(包括CO4)表达下降,而慢性暴露30 d后,表现出大鼠脑线粒体相关亚基表达的上升(秦国华等,2014;Qin et al.,2012).我们检测了SO2慢性暴露30 d和BaP腹腔注射5 d后.小鼠心肌线粒体中分别由nDNA和mtDNA编码的两个亚基CO4和ATP6的mRNA表达水平.发现SO2吸入对小鼠心脏中上述基因的表达无显著影响(图 1).香烟中含有PAHs,Pieters已经报道,香烟烟雾暴露可以诱导肺mtDNA成分mRNA表达下降,这与我们在图 1得到的:BaP单独作用下亚基CO4和ATP6转录水平表达下降这一结论一致(Pieters et al.,2013).然而,对低剂量BaP暴露人群的研究显示,血液中相对mtDNA拷贝数是上升的(Carugno et al.,2012).
当SO2和BaP复合暴露后,CO4和ATP6的mRNA表达与对照组相比显著下降,与SO2组相比,也有统计学上的显著性差异(图 1).众所周知,SO2和BaP都可以引起机体的氧化应激,而氧化应激对线粒体有双重效应:轻微刺激可以促进mtDNA的合成并增加线粒体的数量;剧烈的氧化应激造成线粒体损伤的积累,最终引起mtDNA合成的障碍(Hou et al.,2010).mtDNA编码的ATP6在SO2慢性暴露下mRNA表达不受影响,而在BaP组和复合暴露组下降,提示活性氧产生量在BaP及SO2与BaP复合暴露组可能要比SO2单独暴露组更多,从而对线粒体DNA的影响也更为严重.同时,我们也观察到由nDNA编码的CO4的趋势与ATP6一致,说明SO2和BaP不仅仅影响mtDNA的表达,在长期作用下,对nDNA编码的线粒体亚基也造成了损伤.
过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC1-α)是心肌线粒体生物合成的重要的辅激活因子,在心肌肥大和心力衰竭发病机制中起关键作用,对环境化学污染物相当敏感(Jiang et al.,2015).PGC1-α与核呼吸因子(NRF1)结合调节nDNA编码的氧化磷酸化复合物,而NRF1通过调控线粒体转录因子(mtTFA)的表达来调控mtDNA编码的氧化磷酸化复合物(阎德民等,2008).因此,我们通过RT-PCR检测了3种调控基因的mRNA表达,采用Western blot技术检测蛋白表达.实验室前期研究揭示,SO2急性暴露7 d,可引起大鼠心肌线粒体调控基因表达的下降,而慢性暴露30 d后,这3种调控基因在大鼠脑线粒体中表现为:PGC1-α没变化,NRF1和mtTFA表达上调(秦国华等,2014).在对人支气管上皮细胞的研究发现,NRF1是BaP诱导的线粒体损伤的关键原因,并与mtTFA的蛋白表达相关(Zhang et al.,2011).而SO2和BaP复合暴露,在mRNA水平下调了3种调控基因PGC1-α、NRF1和mtTFA的表达;在蛋白水平,SO2和BaP复合暴露显著下调NRF1和mtTFA的表达,但对PGC1-α的蛋白影响较小(图 2和图 3).这提示PGC1-α在SO2和BaP复合暴露过程中可能参与,但并不发挥最关键的作用.NRF1在蛋白水平的下降,必然导致mtTFA表达下调,二者进而分别调控线粒体亚基CO4和ATP6的表达.
引起这些核转录因子下调的机制涉及到细胞因子的释放,如TNF-α和TGF-β.有报道指出,TNF-α可以通过降低体外培养的脂肪细胞及肌细胞的PGC1-α、NRF1和TFAM的mRNA水平而减少线粒体的生物合成(Valerio et al.,2006).在A549细胞里,观察到TGF-β的诱导能够降低PGC1-α及下游靶基因的mRNA表达水平(Sohn et al.,2012).因此,我们推测SO2及衍生物可能通过诱导心肌细胞中细胞因子的释放干扰线粒体调控基因的表达,再通过PGC1-α调控途径来抑制线粒体的生物合成.其具体的上游调控机制还有待进一步的研究.
| [1] | Bansal S, Leu A N, Gonzalez F J, et al. 2014. Mitochondrial targeting of cytochrome P450 (CYP) 1B1 and its role in polycyclic aromatic hydrocarbon-induced mitochondrial dysfunction[J]. The Journal of Biological Chemistry, 289(14): 9936-9951 |
| [2] | Caiment F, Gaj S, Claessen S, et al. 2015. High-throughput data integration of RNA-miRNA-circRNA reveals novel insights into mechanisms of benzo pyrene-induced carcinogenicity[J]. Nucleic Acids Research, 43(5): 2525-2534 |
| [3] | Carugno M, Pesatori A C, Dioni L, et al. 2012. Increased mitochondrial DNA copy number in occupations associated with low-dose benzene exposure[J]. Environmental Health Perspectives, 120(2): 210-215 |
| [4] | Gentner N J, Weber L P. 2011. Intranasal benzo pyrene alters circadian blood pressure patterns and causes lung inflammation in rats[J]. Archives of Toxicology, 85(4): 337-346 |
| [5] | Green J L, Jones B C, Reed G A. 1994. Effects of sulfite on the uptake and binding of benzo pyrene diol epoxide in cultured murine respiratory epithelial cells[J]. Environmental Health Perspectives, 102(2): 216-220 |
| [6] | Grova N, Schroeder H, Farinelle S, et al. 2008. Sub-acute administration of benzo pyrene (B P) reduces anxiety-related behaviour in adult mice and modulates regional expression of N-methyl-D-aspartate (NMDA) receptors genes in relevant brain regions[J]. Chemosphere, 73(Suppl. 1): S295-S302 |
| [7] | Hadler H I, Cook G L. 1979. The mitochondrial activation of sulfate and arsenate and their role in carcinogenesis[J]. Journal of Environmental Pathology and Toxicology, 2(3): 601-612 |
| [8] | Hou L F, Zhu Z Z, Zhang X, et al. 2010. Airborne particulate matter and mitochondrial damage: a cross-sectional study[J]. Environmental Health: A Global Access Science Source, 9: 48 |
| [9] | Jacobs D R, Adachi H, Mulder I, et al. 1999. Cigarette smoking and mortality risk: twenty-five-year follow-up of the seven countries study[J]. Archives of Internal Medicine, 159(7): 733-740 |
| [10] | Jiang Y, Xia W, Yang J, et al. 2015. BPA-induced DNA hypermethylation of the master mitochondrial gene PGC-1α contributes to cardiomyopathy in male rats[J]. Toxicology, 329: 21-31 |
| [11] | Jules G E, Pratap S, Ramesh A, et al. 2012. In utero exposure to benzo(a)pyrene predisposes offspring to cardiovascular dysfunction in later-life[J]. Toxicology, 295(1/3): 56-67 |
| [12] | 阚海东, 陈秉衡. 2002. 我国部分城市大气污染对健康影响的研究10年回顾[J]. 中华预防医学杂志, 36(1): 59-61 |
| [13] | Kim H S, Kwack S J, Lee B M. 2000. Lipid peroxidation, antioxidant enzymes, and benzo pyrene-quinones in the blood of rats treated with benzo pyrene[J]. Chemico-Biological Interactions, 127(2): 139-150 |
| [14] | Meng Z Q. 2003. Oxidative damage of sulfur dioxide on various organs of mice: sulfur dioxide is a systemic oxidative damage agent[J]. Inhalation Toxicology, 15(2): 181-195 |
| [15] | Meng Z Q, Qin G H, Zhang B, et al. 2004. DNA damaging effects of sulfur dioxide derivatives in cells from various organs of mice[J]. Mutagenesis, 19(6): 465-468 |
| [16] | Meng Z Q, Qin G H, Zhang B. 2005. DNA damage in mice treated with sulfur dioxide by inhalation[J]. Environmental and Molecular Mutagenesis, 46(3): 150-155 |
| [17] | Meng Z Q, Liu Y X. 2007. Cell morphological ultrastructural changes in various organs from mice exposed by inhalation to sulfur dioxide[J]. Inhalation Toxicology, 19(6/7): 543-551 |
| [18] | Miller K P, Ramos K S. 2001. Impact of cellular metabolism on the biological effects of benzo pyrene and related hydrocarbons[J]. Drug Metabolism Reviews, 33(1): 1-35 |
| [19] | Pauluhn J, Thyssen J, Althoff J, et al. 1985. Long-term inhalation study with benzo pyrene and SO2 in Syrian golden hamsters[J]. Experimental Pathology, 28(1): 31 |
| [20] | Pieters N, Koppen G, Smeets K, et al. 2013. Decreased mitochondrial DNA content in association with exposure to polycyclic aromatic hydrocarbons in house dust during wintertime: from a population enquiry to cell culture[J]. PLoS One, 8(5): e63208 |
| [21] | 秦国华, 霍雅俊, 桑楠. 2014. 二氧化硫对心肌细胞线粒体损伤的分子机制探讨[J]. 环境科学学报, 34(4): 1074-1078 |
| [22] | Qin G H, Meng Z Q. 2006. The expressions of protooncogenes and CYP1A in lungs of rats exposed to sulfur dioxide and benzo(a)pyrene[J]. Regulatory Toxicology and Pharmacology: RTP, 45(1): 36-43 |
| [23] | Qin G H, Meng Z Q. 2010. Sulfur dioxide and benzo(a)pyrene modulates CYP1A and tumor-related gene expression in rat liver[J]. Environmental Toxicology, 25(2): 169-179 |
| [24] | Qin G H, Wang J X, Huo Y J, et al. 2012. Sulfur dioxide inhalation stimulated mitochondrial biogenesis in rat brains[J]. Toxicology, 300(1/2): 67-74 |
| [25] | Reed G A, Jones B C. 1996. Enhancement of benzo pyrene diol epoxide mutagenicity by sulfite in a mammalian test system[J]. Carcinogenesis, 17(5): 1063-1068 |
| [26] | Shapiro R. 1977. Genetic effects of bisulfite (sulfur dioxide)[J]. Mutation Research/Reviews in Genetic Toxicology, 39(2): 149-175 |
| [27] | Sohn E J, Kim J, Hwang Y, et al. 2012. TGF-β suppresses the expression of genes related to mitochondrial function in lung A549 cells[J]. Cellular and Molecular Biology (Noisy-le-Grand, France), 58(Suppl.): OL1763-OL1767 |
| [28] | Valerio A, Cardile A, Cozzi V, et al. 2006. TNF-α downregulates eNOS expression and mitochondrial biogenesis in fat and muscle of obese rodents[J]. The Journal of Clinical Investigation, 116(10): 2791-2798 |
| [29] | 阎德民, 王伟, 王波, 等. 2008. 温度对PGC-1在心肌细胞中表达的影响[J]. 中国医科大学学报, 37(1): 38-40 |
| [30] | Zhang L J, Bao Y, Li J. 2011. Nuclear respiratory factor-1 is involved in mitochondrial dysfunction induced by benzo(a)pyrene in human bronchial epithelial cells[J]. Basic & Clinical Pharmacology & Toxicology, 109(2): 115-122 |
 2015, Vol. 35
2015, Vol. 35


