2. 长庆油田公司油气工艺研究院, 西安 710018
2. Institute of oil-gas techniques, Companies of Changqing Oil Field, Xian 710018
随着石油产品需求量的不断增加,石油及其制品通过多种途径进入环境,对土壤和水体造成了严重污染,并且威胁着人类的健康,石油污染土壤技术的研究及应用正日益受到广泛重视与关注(Farhad et al., 2000; 张子间等,2009).由于物理修复(如热处理)在破坏土壤中污染物的同时也破坏了土壤的组分和结构,而且价格昂贵;化学修复效果较好,但所使用的化学试剂会产生二次污染,限制了其应用范围(Kishore et al., 2007).
生物修复技术被认为是一种绿色环保、无二次污染、高效、可彻底降解污染物的具有发展前景的石油污染修复方法(徐金兰等,2009; Lu et al., 2014).该技术关键在于利用功能微生物可降解多种石油烃组分,研究内因——如何最大程度强化菌群自身降解石油污染底物的能力(Zhang et al., 2008),并对影响混合菌群降解性能的营养条件和环境因素(外因)进行试验研究.如利用细菌和真菌在生长以及对石油类物质降解途径方面的互补性,构建了以真菌和细菌组成的混合菌剂,大大地提高了石油类物质的生物降解(刘铮等,2008);利用GC-MS数据分析降解菌对原油中的烷烃、芳香烃的降解能力(何丽媛等,2010; 郭娜等,2011);GC-MS联用法用于含油污泥中碳氢化合物降解性能的测定(Lazar et al., 1999),另外,Ma等(2011)对降解菌的生长特性,降解菌对不同烃类的利用能力及添加淀粉和葡萄糖碳源对降解率的影响行进了研究.国内外研究表明,石油降解菌酶的活性(Yan et al., 2013)、环境、无机营养、肥料、微生物的类型等对油污染场地的修复起到重要作用(Vasudevan et al., 2010).利用石油地质中石油族全组分进行微生物降解分析是一种独特的角度,需要对全族物质做全面解析,前面所述研究中对有对正构烷烃和姥鲛烷,植烷的降解研究,但藿烷,甾烷族成分的图谱解析不易识别,且含量低,研究很少.
笔者前期从甘肃长庆油田油污土壤中富集、筛选出5株降解石油的菌株,对其进行了鉴定及油污土壤的修复研究(陈丽华等,2012; 雒晓芳等,2012; 张海玲等,2012).本文运用石油地质学和分析化学对石油降解菌降解石油烃的族组分的GC-MS“指纹分析”和标志物的演化参数分析,揭示微生物降解石油族主要成分正构烷烃、藿烷和芳烃的降解程度及地球演变特征,从而对菌群底物——石油族不同化学结构进行优化提供重要实验依据,同时对降解过程中的生物演化从地球化学的角度进行了机理分析.使所构建的石油降解菌群对底物利用达到优化效果,能对石油烃进行最彻底的降解,以提高菌群的生物修复功能.
2 实验部分(Experiments) 2.1 实验材料 2.1.1 油样来源所用原油取自甘肃陇东地区西峰市郊油井,将原油用正己烷(色谱纯)溶解,然后水浴蒸发正己烷,并在真空干燥箱中除尽残留正己烷,得到标准油样品,放入干燥器中备用.
2.1.2 菌株来源所用菌种为本实验室分离保存(雒晓芳等,2012),分别为:A6菌株属于铜绿假单胞菌(Pseudomonas aeruginosa)菌属,A5菌株属于蒙氏假单胞菌(Pseudomonas monteilii)菌属,D4菌株属于鲁菲不动杆菌(Acinetobacter lwoffii)菌属,F1菌株属于黄色类诺卡氏菌(Nocardioides luteus)菌属,F2菌株属暗黑微绿链霉菌(Streptomyces atrovirens)菌属.
2.1.3 无机盐培养基NH4NO3 2.0 g · L-1,K2HPO4 1.5 g · L-1,KH2PO4 3.0 g · L-1,MgSO4·7H2O 0.1 g · L-1,无水CaCl2 0.01 g · L-1,NaEDTA·2H2O 0.01g · L-1,pH值为7.5.
2.2 实验方法 2.2.1 试样处理将5种菌剂F1、F2、A5、A6、D4接入20 mL无机盐培养基的三角烧瓶,培养基含标准油10 mg,28 ℃下培养7 d,15 d后取出加入10 mL氯仿,超声破乳15 min,萃取出氯仿相,水浴蒸发氯仿,再将残油准确称量后定容10 mL,即为GS-MC 测试降解油样.将不添加菌剂的标准油作为对照组.
2.2.2 GS-MC测定各菌株降解石油各组分含量降解油样各组分分析条件为:气化温度 260 ℃,载气He,柱温200 ℃,柱SE-30(50 m).质谱条件为:电子能量70 eV,质量范围40~450.GS-MC图谱图解析时从总离子流图中提取正构烷烃、藿烷、芳烃系列物质,用质量归一法计算出样品中各系列化合物的含量.在石油混合物组分中分子量相同物质的比较多,但每个物质的结构不同,在GC-MS离子源中,每个分子被电子流轰击打成碎片时,由于结构不同而出现各自的特征碎片离子.如正构烷烃的碎片离子为57、71、85…,藿烷会出现最大的积分碎片峰191,甾烷的最大特征碎片为217(α,α型结构),218(M+1峰)(β,β型结构).利用物质的特征碎片值可以从总离子流图中将同系列物质提取出来.
石油烃中正构烷烃、藿烷系列物质的降解率R计算方法如下:R=(M1-Mi)/M1,式中:M1为对照组中标准油各物质质量百分含量;Mi为第7、15 d残油中各物质质量百分含量.
3 结果与讨论(Results and discussion) 3.1 石油降解菌对正构烷烃的降解不同石油降解菌对石油中不同烃类的降解能力不同.多数石油降解菌一般只能降解一种或几种烃类(徐金兰等,2009),而中、长链正构烷烃能被大多数石油降解菌所降解.研究在不同时间里各菌株降解正构烷烃的降解率,及微生物对正构烷烃降解演化动态变化规律,即用OEP、w(∑C21-)/w(∑C22+)、姥植比(w(Pr)/w(Ph))等生物降解标志物演化参数反映各菌株对原油中正构烷烃演化降解的规律.
3.1.1 正构烷烃的降解差异分析原始油样与经混合菌作用7、15 d的正构烷烃碳数分布均为C14~C39.从GC-MS图谱分析计算得到经菌剂作用7 d和15 d后原油的降解率.从降解率折线图可以看出,7 d菌剂作用于原油降解不明显,而15 d的降解幅度比7 d大,菌株在7 d主要利用中低碳数的正构烷烃,而15 d菌株主要降解高碳数段,在C31~C39碳数段15 d的降解均为正值;F2、A5对高碳数正构烷烃降解高达60%以上,A5菌15 d降解高达67.58%.说明7 d以前降解菌仍处于适应阶段,降解优势在15 d更明显;7,15 d的降解呈明显的互补规律,正构烷烃各部分含量呈先增后减或先减后增的规律;奇偶优势在15 d体现更明显.
各菌株对正构烷烃的降解效果如图 1所示.由 图 1可看出: A5和A6的降解图形相似,这可能与其所属菌属相似有关,从而摄取的碳源结构也相似(崔志松等,2010).除去D4菌株,其它菌株在7 d主要降解中低碳数正构烷烃,15 d以降解高碳数烷烃为主,而D4菌株降解情况与其它菌株正好相反.降解结果使中间碳数烷烃含量大幅增加,在C20~C24间出现降解低谷.而对于混合菌剂H(图 1f),前7 d不管对于低碳数还是高碳数正构烷烃都具有较好的降解效果,但15 d的降解以高碳数正构烷烃为主,整个石油烃的含量呈下降趋势.由此可见,相对于分子量较大的芳香烃污染物来说,微生物降解正构烷烃相对容易,周期较短(Douglas et al., 2012).同时,正构烷烃降解后的产物也为微生物提供充分可利用的碳源,更有利于微生物的生长,这也是微生物对正构烷烃降解率较高的一个原因(Dubinsky et al., 2013).
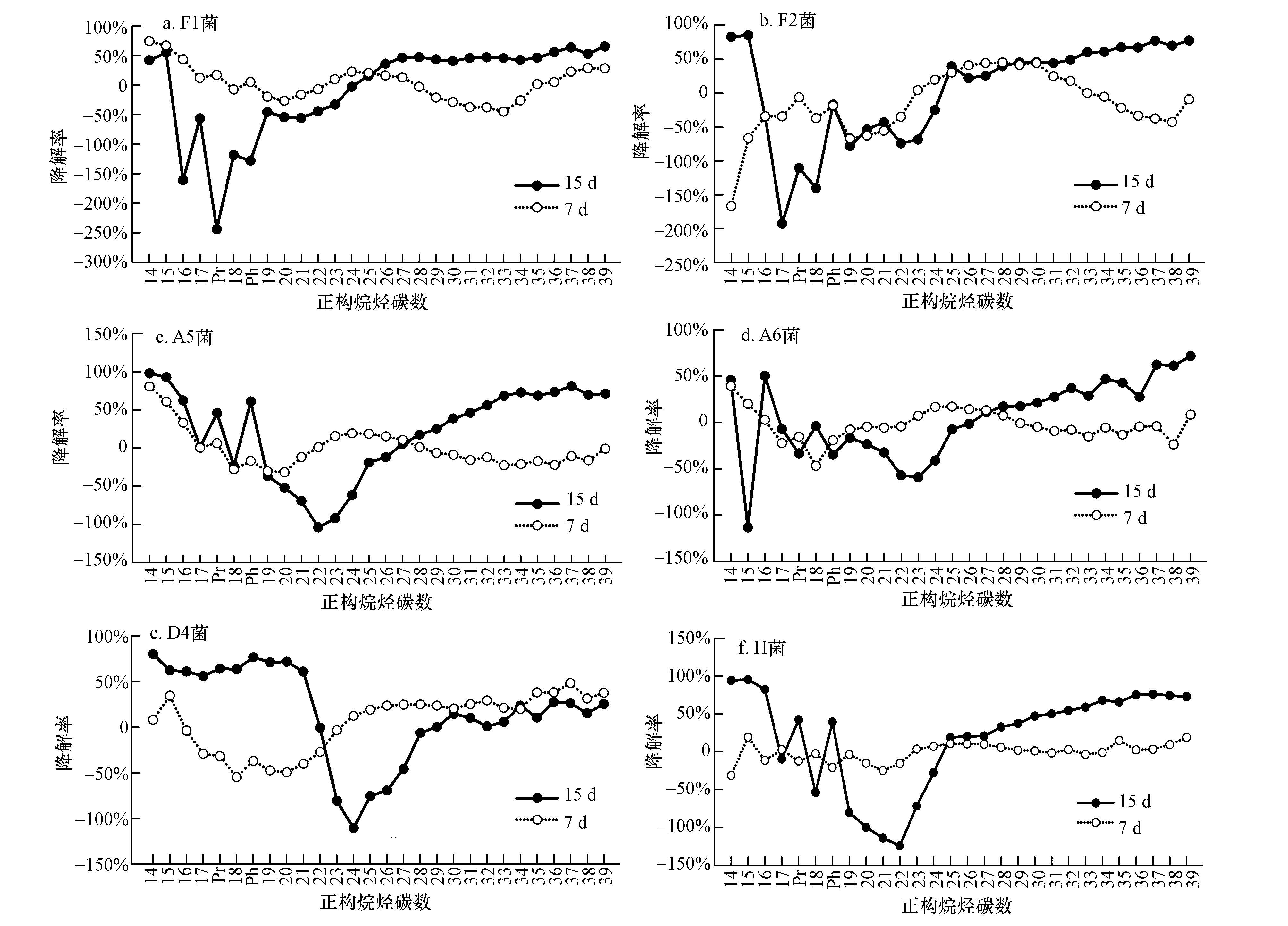 |
| 图1 不同菌剂对正构烷烃的降解率 Fig.1 Degradation rate of N-Alkanes by different bacteria |
从表 1可以看出,原始油样和经菌株降解 7 d和15 d的正构烷烃的碳数分布相同均为C14~C39,经各种菌剂作用后正构烷烃的主峰碳明显前移,表明菌剂对高碳数正构烷烃具有选择性,有较强烈的去甲基作用的结果(陈丽华等,2012).15 d,F2、A5、混合菌H对于高碳数段的正构烷烃降解率高达60%以上,最高为A5菌剂高碳数降解率为67.58%,D4菌剂降解低碳数达到67.50%;7 d中,A5菌剂降解中低碳数正构烷烃最高为13.77%,D4降解高碳数正构烷烃最高(32.22%);表明A5和D4菌剂对于正构烷烃降解表现较优.混合菌对于正构烷烃的降解率要高于各个单菌分别作用,菌种之间表现为协同作用,菌种间可以稳定共存.说明菌种合理混合有利于石油降解.
| 表1 菌株对不同碳数正构烷烃平均降解率 Table 1 Different carbon number n-Alkanes degradation rate by Strains |
从表 2可以看出,原始油的成熟度高,经菌株作用后OEP变化不太明显,但原始油样的OEP值多数大于经菌剂作用7 d的原油样品,可见各菌株在7 d降解正构烷烃时,奇数碳烷烃的降解速率大于偶数碳烷烃;而从15 d的OEP值可看出,F1和A6样品的OEP值与原始油量相比分别为1.026和1.067,略大于原始油样OEP值.除F1、A6菌株外,其它菌株的OEP值都小于1,且长期的OEP值均比短期的小,说明15 d这些菌剂降解奇数碳的优势更为明显.
| 表2 正构烷烃生物演化参数值 Table 2 N-Alkanes biological evolution parameter |
F2的w(∑C21-)/w(∑C22+)值在7 d和15 d都是最大,说明F2菌剂对高碳数降解优势最为明显,这与表 1的结果相一致.D4菌剂在15 d的w(∑C21-)/w(∑C22+)值大幅降低(15 d的值为0.265),同样表明D4菌剂没有强烈降解高碳数烷烃的特征,反而有选择性降解低碳数烷烃的能力.
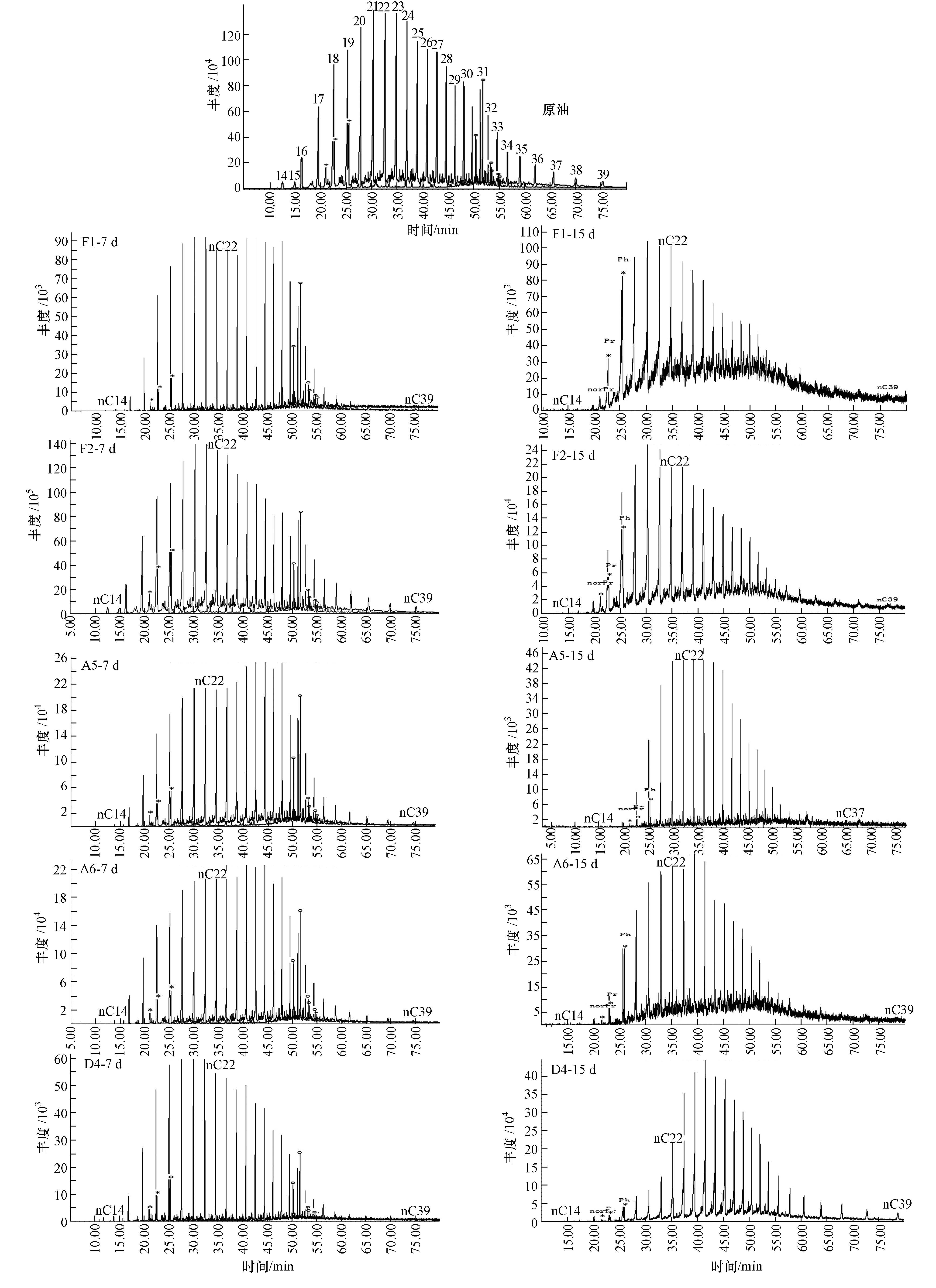 |
| 图2 原油样和各菌剂GC/MS总离子流图 Fig.2 Total ion GC/MS chromatogram of crude oil sample and each bacteria |
由表 2可以看出,除A6降解15 d油样姥植比(0.99)与原油基本相近外,其它菌株对石油降解后,其w(Pr)/w(Ph)比值均大于原油,说明原油中类异戊二烯烷烃在不同菌剂的作用过程中,均发生了明显的降解,使部分植烷脱去一个甲基转化为姥鲛烷.
3.2 藿烷的降解规律藿烷的主要成分为萜类化合物,包括三环二萜烷和五环三萜烷化合物,藿烷不是由生物体直接合成,而是由死亡生物体经地球化学过程演化而来.其微生物转化涉及羟基化、环氧化、脱氢等多种反应类型.在菌剂的作用下,环氧化分为两种,一种氧化酶先将其氧化为环醇,接着脱氢形成环酮;另一种氧化酶再氧化环酮,环断开,之后深入降解(杨丽芹等,2011).羟基化,在化合物的非羟基化位点上引入一个羟基能增强其生物学活性(张翔等,2010).
藿烷相对稳定,常用藿烷作为一个可靠的指标来评估大多数野外条件下的生物降解(Venosa et al., 1997).目前研究表明,C30藿烷及其相关同系物(如C31~C35藿烷)在一定的实验条件下可被微生物降解菌降解(Bost et al., 2001; Frontera-Suau et al., 2002; Huesemann et al., 2003).本节用各菌株降解藿烷各物质相对原油的降解率,分析各菌株降解藿烷的不同,用生物标志物Ts/Tm、C31和C31的αβ-22S/22(S+R) 、∑hop/∑烷烃比值作为生物演化石油过程中藿烷降解和构型转化的依据.
其中:Ts/Tm是石油地质领域常用的有机质演化程度参数,Ts为18α(H)-22.29.30-三降藿烷,Tm为17α(H)-22.29.30-三降藿烷.在生物体原生质中只有Tm构型是没有Ts构型的,当这类生物进入地质体后在热作用、微生物作用、压力及矿物催化作用下三降藿烷将由Tm立体构型逐渐向更稳定的Ts立体构型转化,因而Ts/Tm比值越大既反映了有机质受外作用力的程度越强,研究样品主要改变的外作用力是混合菌作用,所以Ts/Tm比值越大则混合菌对有机质的降解越强烈.
大于31个碳的17α(H)、21β(H)构型的藿烷其第22位碳原子成为手性碳,因而会出现一对镜像异构体(22S+22R).由于在生物体中22R异常高而22S很低,通常将22R构型称作生物构型将22S构型称作生地质构型.当这类生物进入地质体后在热作用、微生物作用、压力及矿物催化等外力作用下22R将逐渐向22S转化,其转化终点值为22S ∶ 22R=6 ∶ 4.地球化学研究中常用C31αβ-22S/22(S+R)和C32αβ-22S/22(S+R)作为判识有机质手性构型演化程度的参数.∑藿烷/∑正构烷烃比值是样品中藿烷系列的相对丰度与正构烷烃系列相对丰度的比值,用来研究原油遭受不同细菌作用15 d后,藿烷系列与正构烷烃系列的降解速率特征.
3.2.1 藿烷的降解差异分析各菌对藿烷的降解率如图 3所示,降解趋势平缓,没有明显被降解的个物.但芒柄花根烷、降莫烷、γ-蜡烷、二升藿烷、三升藿烷、四升藿烷、五升藿烷的降解均达到20%以上.A6菌种除了17α(H)21β(H)-22S-31、32、33、34-四 升藿烷与17α(H)21β(H)-22R-31、32、33、34-四升藿烷外,对于其他藿烷降解率都较高,降解平均.A5菌种在前期对于中间碳数的藿烷降解要比低碳数和高碳数的藿烷要彻底.各菌剂7 d和15 d藿烷降解趋势基本一致,说明藿烷的降解主要表现为手性碳向稳定构型转化,但藿烷的降解幅度在15 d时比7 d高些.藿烷的降解波动明显,是由于系列物质S和R构型的交替出现,细菌作用促使五环三萜类化合物的手性碳R构型向更稳定的S构型转化(陈丽华等,2012),S构型化合物更稳定,所以降解率低,R构型物质不稳定,降解率高,呈现出波浪状的降解趋势.
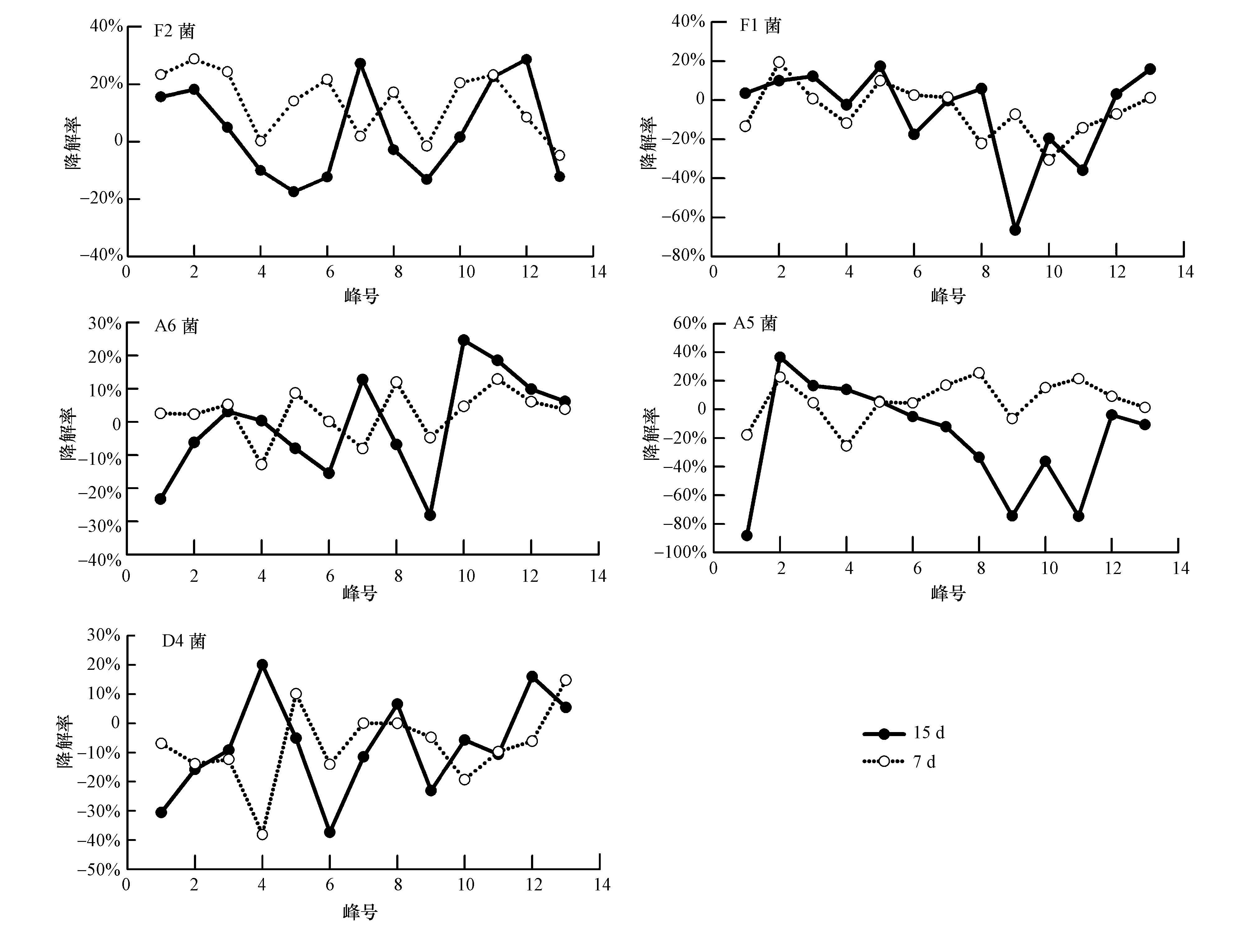 |
| 图3 不同菌株作用下藿烷的降解率 (备注 峰号代表的物质: 1: 18α(H)-22,29,30-三降藿烷(Ts), 2: 芒柄花根烷, 3: 17α(H)-22,29,30-三降藿烷(Tm), 4: 降羽扇烷, 5: 17α(H)21β(H)-30-降藿烷, 6: 重排-30-降藿烷, 7: 羽扇烷, 8: 17β(H)21α(H)-30-降莫烷, 9: 17α(H)21β(H)-藿烷, 10: 五环三萜烷, 11: 五环三萜烷, 12: 17β(H)21α(H)-莫烷, 13: 17α(H)21β(H)-22S-31-升藿烷, 14: 17α(H)21β(H)-22R-31-升藿烷, 15: γ-蜡烷, 16: 17α(H)21β(H)-22S-31,32-二升藿烷, 17: 17α(H)21β(H)-22R-31,32-二升藿烷, 18: 17α(H)21β(H)-22S-31,32,33-三升藿烷, 19: 17α(H)21β(H)-22R-31,32,33-三升藿烷, 20: 17α(H)21β(H)-22S-31,32,33,34-四升藿烷, 21: 17α(H)21β(H)-22R-31,32,33,34-四升藿烷, 22: 17α(H)21β(H)-22S-31,32,33,34,35-五升藿烷, 23: 17α(H)21β(H)-22R-31,32,33,34,35-五升藿烷) Fig.3 Degradation rate of hopane by different bacteria |
图 4为A6降解后的藿烷(m/z191)质量色谱图,本节仅以A6菌株为例,其他菌株霍烷图因篇幅有限,在此不一一列举.从A6的质量色谱图可以更好的佐证图 4的结果.
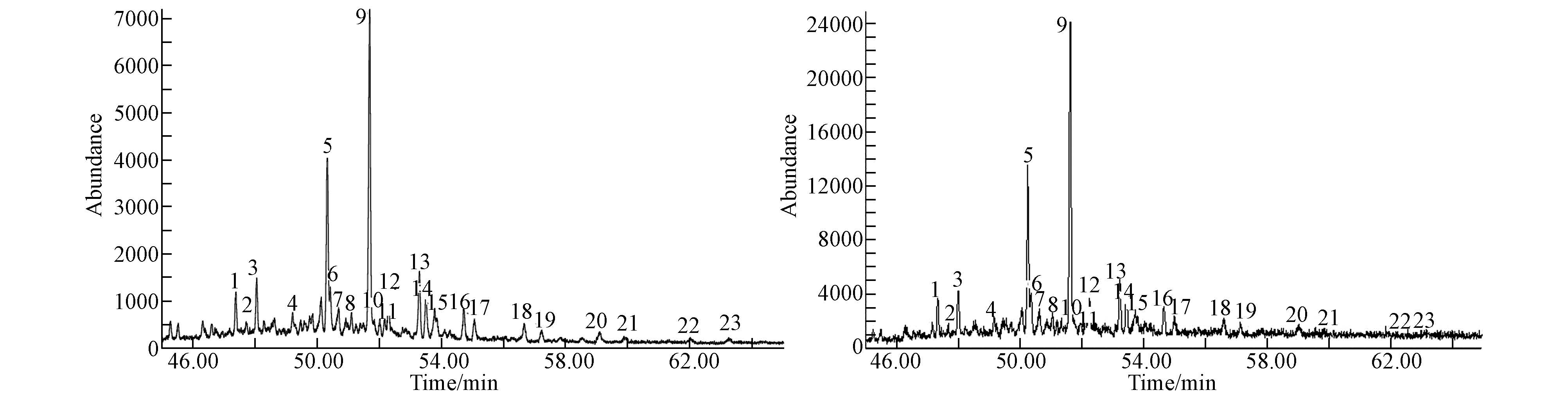 |
| 图4 原油和A6降解后的藿烷(m/z191)质量色谱图 Fig.4 TIC(m/z191)of hopane degraded by A6 and petroleum |
原油被5种菌剂作用7 d原油的藿烷系列碳数分布相同,均为C27~C35(C28缺失),主峰均为C30-αβ藿烷.大于31个碳的17α(H)、21β(H)构型的藿烷,其第22位碳原子成为手性碳,因而会出现一对镜像异构体(22S+22R).如表 3所示,原始油样C31-αβ-22S/C31αβ-22(S+R)和C32-αβ-22S/C31αβ-22(S+R)比值分别为0.591和0.577,接近转化终点值0.600,所以原石油样为成熟质,受外力作用变化不会很大.经各菌株降解后样品的C31-αβ-22S/C31αβ-22(S+R)和C32-αβ-22S/C31αβ-22(S+R)比值均大于原始油样值,且油样经5种菌剂7 d降解后C31-αβ-22S/C31αβ-22(S+R)和C32-αβ-22S/C31αβ-22(S+R)比值均有一项达到转化终点.由此可见,该5种菌剂能促使五环三萜类化合物的手性碳R构型向更稳定的S构型转化,短期内就可以达到转化终点.
| 表3 藿烷生物演化参数(质量分数) Table 3 Hopane biological evolution parameter |
在实验中通过添加菌剂提供外作用力,可见w(Ts)/w(Tm)比值越大则说明菌剂对有机质的降解越强烈.从表 4可以看出,5种菌剂降解石油的w(Ts)/w(Tm)比值均大于原始油样的值,且菌剂在短期内对藿烷的降解较明显.A5菌剂对藿烷降解的w(Ts)/w(Tm)比值最大(0.966),对藿烷的降解程度最强,转化最彻底.
| 表4 藿烷转化参数(单位:质量分数) Table 4 Hopane degradation parameter |
从表 4中w(∑藿烷)/w(∑正构烷烃)比值可看出,A6、F1菌剂的该比值明显大于原始油样的0.394,这两种菌剂作用原油时正构烷烃的降解优势明显大于藿烷系列,而A5、D4和F2的w(∑藿烷)/w(∑正构烷烃)比值分别为0.111、0.158和0.215,明显小于原始油样的0.394,这3种菌剂作用原油时,藿烷的降解速率明显大于正构烷烃系列.各菌剂降解藿烷优势表现为A5>D4>F2>F1>A6.
3.3 芳香烃的降解规律陇东原油芳烃主要含萘、菲、联苯、和三芳甾烷等5个系列,分别含2~4个芳核的稠环芳烃,以及含五个芳核的α-苯并芘.芳香烃是重要的原油组分,相对于烷烃来说稍难降解,芳香烃的有氧代谢必须有分子氧参加,同时需要加氧酶的催化.细菌通过过氧化物酶将分子氧的两个氧原子结合进芳香烃中,形成顺式构型的二氢二醇,顺式二氢二醇在另外一种过氧化物酶的催化下将芳香环破裂成邻苯二酚.与细菌相反,真菌通过催化单氧化酶和环氧化物水解酶使芳烃转化为反式构型二氢二醇(张翔等,2010).
在生物质转化中,TMCH/CH参数反映了(CH)系列的去甲基效应的程度,该值越小则表明 分子芳香环上的甲基取代基的去甲基效应越强烈.TeMN/N参数反映了萘(N)系列去甲基效应的程度,该值越小则表明萘环上甲基取代基的去甲基效应越强烈.
∑芳烃/∑正构烷烃是用来研究原油在不同细菌时间作用下,稠环芳烃与烷烃的降解速率或降解程度特征.
石油样品中检测出(CH)、甲基(MCH)、二甲基(DMCH)和三甲基(TMCH),以 的相对丰度最高为特征.表 5显示原油的TMCH/CH为0.500,在7 d各菌剂的降解当中,F2、A5、D4的TMCH/CH不变仍为0.500,对芳烃的降解效果不明显,而菌剂F1、A6的TMCH/CH分别为0.417、0.426,表明对芳烃具有降解效应.
| 表5 芳香烃的降解参数(质量分数) Table 5 Aromatic hydrocarbon degradation parameter |
萘是含有两个芳香环的稠环芳烃,研究的样品中检测出:甲基萘(MN)、二甲基萘(DMN)、三甲基萘(TMN)和四甲基萘(TeMN),以四甲基萘的相对丰度最高为特征.表 5显示原油的TeMN/MN值为5.200,各菌剂的TeMN/MN值均比原油的小,表明几种菌株对萘环上的甲基均有去甲基化效应,其中F2的去甲基化效应最弱,而A5对原油的去甲基化效应最强,这也与文献报道假单胞菌物种具有降解各种石油化合物能力,包括脂族和芳族化合物相一致(Deppe et al., 2005; Lo Giudice et al., 2010; Whyte et al., 1997).
| 表6 芳香烃的演化参数(质量分数) Table 6 Aromatic hydrocarbon biological evolution parameter |
从表 6中看出,15 d菌剂降解油样中未检测出萘,证明萘在15 d前已经被菌剂的强烈去甲基反应降解完全.而F1、F2、A6的菲/正构烷烃比值明显大于原油样的0.167值,表明这3种细菌作用原油时正构烷烃的降解速率明显大于菲系列,但D4、A5的菲/正构烷烃比值明显小于原油样的值,表明这2种菌作用原油时菲系列的降解速率较正构烷烃快.同理,/正构烷烃比值中D4、A5、F2均小于原油样的值,表明这3种菌降解原油时正构烷烃的降解速率明显小于 系列.从各参数的综合比较可以看出,A5、D4菌剂对芳香烃有较好的降解优势.
4 结论(Conclusions)通过微生物降解石油族主要成分正构烷烃、藿烷和芳烃的降解程度及地球演变特征分析,可以看出各菌对石油族重要组分——正构烷烃、藿烷、芳香烃具有不同的降解程度和演化特征.
1)各菌对石油族成分中正构烷烃的降解最主要,表现为7 d与15 d的降解呈明显的互补规律,即7 d到15 d正构烷烃各物质含量呈先增后减或先减后增的规律,F2、A5对高碳数正构烷烃降解率高达60%以上,在降解菌中占据优势;F2、A5和D4菌株15 d时OEP值说明他们后期降解奇数碳优势更为明显;w(∑C21-)/w(∑C22+)值表明F2菌株具有选择性降解高碳数正构烷烃的特点,而D4菌株相对具有选择低碳数正构烷烃降解的特点.
2)藿烷的演化分析可以看出,所筛选的5种菌剂均能促使五环三萜类化合物的手性碳R构型向更稳定的S构型转化,7 d对石油的降解就可以达到转化终点,各菌剂降解藿烷优势表现为A5>D4>F2>F1>A6.
3)菌剂在对芳香烃的降解中表现出强烈的去甲基化作用,在对菲和的降解中,A5和D4菌降解优势最明显.
综上所述,这5株菌在对石油主要成分正构烷烃、藿烷、芳香烃的降解中,F2、A5和D4菌株表现优于其他菌株,同时标志物演化参数进一步揭示了物质结构的降解演化特征,其演化参数值与降解率结果保持一致性,也进一步佐证和解释了不同菌株的降解差异.所以,在石油污染的微生物修复应用中,利用各种标志物反映菌株对原油中正构烷烃、藿烷、芳香烃的降解差异和演化特征具有更清晰地辨识度,同时可以帮助我们对降解中各成分结构的演化有更深入的认识,在石油修复过程中,对合理利用菌株或者混合菌株的选择上更具有科学性.
| [1] | Bost F D, Frontera-Suau R, McDonald T J, et al. 2001. Aerobic biodegradation of hopanes and norhopanes in Venezuelan crude oil[J]. Org. Geochem., 32:105-114 |
| [2] | 陈丽华,马金珠,雒晓芳,等. 2012.添加混合菌剂对石油污染土壤的降解[J].中南大学学报, 43:4581-4589 |
| [3] | Deppe U, Richnow H H, Michaelis W, et al. 2005. Degradation of crude oil by an arctic microbial consortium[J]. Extremophiles, 9(6):461-470 |
| [4] | Douglas G S, Hardenstine J H, Liu B, et al. 2012. Laboratory and field verification of a method to estimate the extent of petroleum biodegradation in soil[J]. Environ Sci Techno, 46:8279-8287 |
| [5] | Dubinsky E A, Conrad M E, Chakraborty R, et al. 2013. Succession of hydrocarbon-degrading bacteria in the aftermath of the deepwater horizon oil spill in the gulf of mexico[J]. Environ Sci Technol, 47:10860-10867 |
| [6] | Frontera-Suau R, Bost F D, McDonald T J, et al. 2002. Aerobic biodegradation of hopanes and other biomarkers by crue oil-degrading enrichment cultures[J]. Environ Sci Technol, 36:4585-4592 |
| [7] | 郭娜,李志敏,叶勤. 2011.烷烃降解菌的筛选、鉴定及优势菌株的降解特性[J].应用与环境生物学报, 17(4):572-576 |
| [8] | 韩慧龙,陈镇,刘铮,等. 2008.真菌-细菌协同修复石油污染土壤的场地试验[J].环境科学, 29(2):454-461 |
| [9] | 何丽媛,党志,唐霞,等. 2010.混合菌对原油的降解及其降解性能的研究[J].环境科学学报, 30(6):1220-1227 |
| [10] | Huesemann M H, Hausmann T S, Fortman T J. 2003. Biodegradation of hopane prevents use as conservative biomarker during bioremediation of PAHs in petroleum contaminated soils[J]. Biorem. 7:111-117 |
| [11] | Kishore E D, Ashis K M. 2007. Crude petroleum-oil biodeg-radation efficiency of Bacillus subtilis and pseudomonas aeruginosa strains isolated from a petroleum-oil contami-nated soil from North-East India[J]. Bioresource Tech-nology, 98(7):1339-1345 |
| [12] | Lazar I, Dobrota S, Voicu A, et al. 1999. Microbial degradation of waste hydrocarbons in oily sludge from some romanian oil fields[J]. Pet Sci Eng, 1-3:296-305 |
| [13] | Lo G A, Bruni V, De Domenico M, et al. 2010. Psychrophiles-cold-Adapted hydrocarbon-degrading microorganisms[M]. In Handbook of Hydrocarbon and Lipid Microbiology, Timmi K N, Ed, Springer-Verlag:Heidelberg, 1897-1921 |
| [14] | Lu L, Huggins T, Jin S, et al. 2014. Microbial metabolism and community structure in response to bioelectrochemically enhanced remediation of petroleum hydrocarbon-contaminated soil[J]. Environ Sci Technol, 48:4021-4029 |
| [15] | 雒晓芳,陈丽华,王冬梅,等. 2012.石油降解菌株的分离鉴定及降油特性[J].微生物学杂志, 32(5):11-17 |
| [16] | Ma X, Hou X, Chen J, et al. 2011. The screening and degradation of oil-degrading bacteria from the crude oil contaminated sites[C]. Environment and Transportation Engineering, RSETE 2011-Proceedings, 4658-4659,DOI:10.1109/RSETE.2011.5965353 |
| [17] | Nadim F, Hoag G E, Liu S, et al. 2000. Detection and remediation of soil and aquifer systems contaminated with petroleum products:an overview[J]. Journal of Petroleum Science and Engineering, (26):169-178 |
| [18] | Vasudevan N, Rajaram P. 2010. Bioremediation of oil sludge-contaminated soil[J]. Environment International, 26(5):1012-1024 |
| [19] | Venosa A D, Suidan M T, King D, et al. 1997. Use of hopane as a conservative biomarker for monitoring the bioremediation effectiveness of crude oil contaminating a sandy beach[J]. J Ind Microbiol Biotechnol, 18:131-139 |
| [20] | Whyte L G, Bourbonniere L, Greer C W. 1997. Biodegradation of petroleum hydrocarbons by psychrotrophic Pseudomonas strains possessing both alkane (alk) and naphthalene (nah) catabolic pathways[J]. Appl Environ Microbiol, 63(9):3719-3723 |
| [21] | 徐金兰,黄廷林,唐智新,等. 2009.石油污染土壤生物修复高效菌的降解特性[J].石油学报, 25:570-576 |
| [22] | Yan S, Wang Q, Qu L, et al. 2013. Characterization of oil-degrading bacteria from oil contaminated soil and activity of their enzymes[J]. Biotechnology and Biotechnological Equipment, 27(4):3932-3938 |
| [23] | 杨丽芹,蒋继辉. 2011.微生物对石油烃类的降解机理[J].油气田环境保护, 23(2):34-42 |
| [24] | 张海玲,周立辉,陈丽华,等. 2012.修复黄土塬区石油污染土壤的微生物混合菌剂及修复方法[P].中国, 201210272041.7 |
| [25] | 张翔,胡昌华. 2010.二萜类化合物微生物转化研究[J].化学工程与装备, 38(4):46-53 |
| [26] | 张子间,刘勇弟,孟庆梅,等. 2009.微生物降解石油烃污染物的研究进展[J].化工环保, 29(3):193-198 |
 2016, Vol. 36
2016, Vol. 36


