2. 西南林业大学, 昆明 650224
2. Southwest Forestry University, Kunming 650224
银纳米颗粒因其具有良好的光电、催化、超导性能和杀菌消毒活性,已经成为目前市场上应用最广泛的金属纳米材料(吴源,2010).每年全球由银纳米颗粒制成的产品达 320 t之多(Nowack et al., 2011).银纳米颗粒产品的大量生产和广泛应用增加了其向环境释放的机会,而其进入环境的最大可能性是通过污水排放或地表径流(Bradford et al., 2009),所以处于地表低洼地带的湿地水环境将成为其最终的归宿.检测数据显示,部分污染区域的每千克干重污泥中银纳米颗粒残留量达到1.94~856 mg(Chen et al., 2012).银纳米颗粒的排入和积累会对水生生物产生毒性作用(Griffitt et al., 2009).目前,银纳米颗粒对水生生物的毒理研究主要集中在藻类(小球藻(Chlorella vulgaris)(苑志华等,2013)、莱因哈德衣藻(Chlamydomonas reinhardtii)(Navarro et al., 2008)、羊角月芽藻(Pseudokirchneriella subcapitata)(Griffitt et al., 2008)、黒藻(Hydrilla sp)(Jha et al., 2009)、海链藻(Thalassiosira weissflogii)(Miao et al., 2009))、鱼类(斑马鱼(Zebrafish)(Griffitt et al., 2009;Bar-Ilan et al., 2009;Lee et al., 2007)、鲈鱼(Eurasian perch)(Bilberg et al., 2010))、大型溞(Daphnia magna)(Blinova et al., 2013),浮萍(Lemna minor L)(Gubbins et al., 2011)等,且大多研究都是采用水培实验进行.然而,以大型水生挺水植物作为受试植物,采用更接近于自然环境的土壤培养开展生物毒理实验研究还很少见.
本研究选取大型挺水植物水葱作为研究对象,采用室内土壤培养方式,研究银纳米颗粒对其①生长,地上及地下生物量的影响,②叶绿素含量及叶绿素荧光的影响,③丙二醛、脯氨酸含量的影响.掌握银纳米颗粒对大型湿地植物水葱早期生长、光合等生理特性的影响,为后期开展银纳米颗粒对湿地植物的毒理性研究提供理论基础.
2 材料与方法(Materials and methods) 2.1 N-AgNPs的制备与表征通过柠檬酸钠还原硝酸银的方法制备N-AgNPs,具体方法参照Fang等(2005).取1000 mL 0.001 mol · L-1 AgNO3溶液置于1000 mL烧杯中,用恒温磁力加热搅拌器加热到沸腾,在保持溶液沸腾且连续搅拌的情况下,逐滴加入100 mL 1%的柠檬酸钠溶液,直到溶液变为黄绿色后停止加热,冷却到室温,即已配好N-AgNPs原溶液.此时N-AgNPs的浓度为98.2 mg · L-1,然后按比例对N-AgNPs原溶液进行稀释,至实验所需的浓度5、10、15、20 mg · L-1.采用透射电子显微镜(TEM,Hitachi H-7650,Japan)观察银纳米颗粒的形态.
2.2 研究方法实验选取的水葱种子采自昆明市五甲塘湿地公园,采集回来剔除杂质,晾干后放置黑暗处,4 ℃下储藏备用.实验所用的土壤为沼泽土,采自大理市剑川县剑湖.土壤带回实验室风干,除去杂草、根系及较大石块等,研磨,过0.5 mm筛后备用.选取15个培养盘(内径15 cm左右,高度2.2 cm左右),每个培养盘内均匀撒入沼泽土,厚度1 cm左右,喷洒200 mL的蒸馏水使之润湿,随机选取颗粒饱满的水葱种子10颗,均匀撒在培养盘中,种子表面再覆盖一层薄土,使得水葱种子完全被覆盖.培养盘中分别喷洒40 mL浓度分别为0(蒸馏水)、5、10、15、20 mg · L-1 N-AgNPs悬浮液,使土壤水分充分饱和,再用保鲜膜覆盖每个培养盘以保持土壤水分,放在室内培养.实验设置5个浓度梯度,每个浓度梯度设置3个重复,共15个样品.待水葱幼苗长出3 d后,测定其叶片长度,定为初始叶片长度.随后培养35 d.在培养期间,每天添加40 mL相应浓度的N-AgNPs悬浮液,保证土壤表面有积水,对照加相应体积的蒸馏水.每隔7 d测定1次水葱的生长高度.培养结束后,测定水葱叶片长度、地上生物量、地下生物量、叶绿素含量、叶绿素荧光参数、叶片中丙二醛含量及脯氨酸含量.
2.3 测量指标及方法水葱叶片长度用卷尺测定,地上生物量及地下生物量用称重法测定,叶绿素含量用便携式CCM-200 Plus测定.
LGR=(LL-PL)×t-1 式中,LGR为叶片生长速率(mmol · L-1),LL、PL分别为培养后叶片长度和初始叶片长度(mm),t为培养时间(d).
叶绿素荧光相关参数用LI-6400 便携式光合系统测定仪测定.11 月6 日 22:30(叶片已进行充分的暗适应),针对事先标记好的叶片,测定其最小初始荧光 Fo和最大荧光 Fm.11 月7 日上午11:00(光适应状态),打开活化光,将标记过的叶片依次置于荧光叶室内,测定光下最小荧光 Fo′、光下最大荧光Fm′、稳态荧光 Ft.按以下公式计算:
光化学最大量子效率:
Fv/Fm =(Fm-Fo)/Fm
有效荧光产量:
Yield(ΔFv/Fm)=(Fm′-Ft)/Fm′
电子传递速率:
ETR = Yield × PAR ×0.84 ×0.5
光化学淬灭系数:
qP =(Fm′-Ft)/(Fm′-Fo′)
非光化学淬灭系数:
NPQ =(Fm-Fm′)/Fm′ = Fm/Fm′-1
叶片中丙二醛含量的测定用硫代巴比妥酸(TBA)法(李合生,2000),脯氨酸含量的测定用酸性茚三酮法(李合生,2000).
2.4 数据处理采用 Excel2010及 SPSS11.5 进行数据分析和制图.
3 结果与分析(Results and analysis) 3.1 N-AgNPs的表征制备好的N-AgNPs悬浮液,采用透射电子显微镜(TEM,Hitachi H-7650,Japan)观察银纳米颗粒的形态(图 1).银纳米颗粒呈圆球状,分散效果良好,没有出现团聚现象,经过统计得出,颗粒的平均粒径为6.82 nm.
 |
| 图1 N-AgNPs的表征 Fig.1 Characterization of the N-AgNPs |
N-AgNPs对水葱叶片的生长起到了促进作用(图 2),与对照组相比,N-5 mg · L-1、N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组的水葱叶片生长速率分别增加20.7%、37.6%、42.9%、47.7%,即N-AgNPs浓度越高,对水葱生长的促进作用越大.N-AgNPs对水葱叶片生长的促进作用随着培养时间的延长而增强.培养期内,对照组水葱的生长速率在逐渐降低,N-5 mg · L-1处理组水葱的生长速率表现平稳,而N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组中水葱的生长速率都表现出波动上升的趋势.
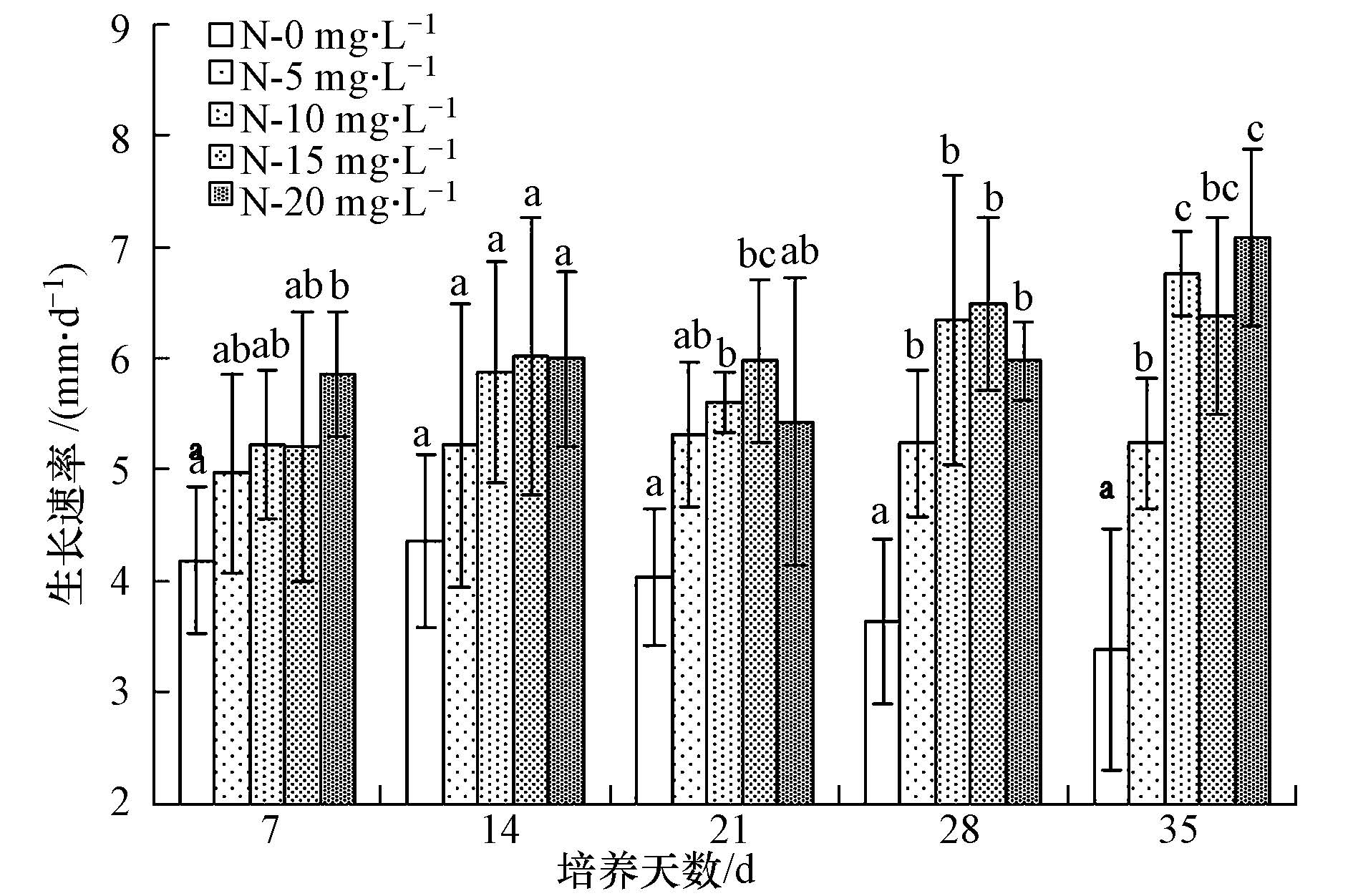 |
| 图2 N-AgNPs对水葱叶片生长速率的影响(不同字母表示其统计差异达到显著水平(p<0.05)) Fig.2 Effect of N-AgNPs on the leaf growth rate of Scirpus tabernaemontani |
水葱的地上生物量大于地下生物量(表 1).N-AgNPs对水葱地上生物量和地下生物量的影响表现一致,即随着N-AgNPs浓度的增加,表现出先增大后减小再增大的趋势.与对照组相比,N-5 mg · L-1、N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组水葱的生物量分别增加77.3%、158.2%、95.5%、127%,说明N-AgNPs促进了水葱生物量的累积.N-AgNPs浓度与水葱地上、地下生物量均呈正相关关系.
3.3 N-AgNPs对水葱叶片叶绿素含量及叶绿素荧光参数的影响N-AgNPs显著促进了水葱叶片中叶绿素的含量的积累,与对照组相比,N-5 mg · L-1、N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组水葱叶片中叶绿素的含量分别增加23.3%、67.7%、85.2%、80.5%,呈现先增大后减小的趋势(表 1),对照组叶绿素含量最小,CCI(Chlorophyll Content Index)为12.17,N-15 mg · L-1处理组叶绿素含量最大,CCI为22.53.水葱叶片中叶绿素含量与N-AgNPs的浓度呈显著正相关关系,且各浓度间差异性不显著(p=0.349).
| 表1 不同浓度N-AgNPs对水葱生理特征的影响 Table 1 Effect of different concentrations of N-AgNPs on the physiological characteristics of Scirpus tabernaemontani |
从表 1中可知,N-AgNPs浓度增加导致Fv/Fm小幅度增加,N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组与对照组差异显著(p<0.05).N-AgNPs浓度与Fv/Fm呈显著正相关关系.N-5 mg · L-1处理组的ΔFv/Fm最大,随N-AgNPs浓度的增加,ΔFv/Fm逐渐减小.各处理组均与对照组差异不显著(p>0.05).相关分析得,ΔFv/Fm与N-AgNPs的浓度相关性不显著.N-5 mg · L-1处理组水葱叶片的ETR最大,随着浓度的增大,ETR逐渐减小,且各处理组与对照组差异性不显著(p>0.05).N-5 mg · L-1处理组qP最大,随着浓度的增加,qP逐渐减小.N-5 mg · L-1处理组qP与对照组差异显著(p<0.05),其他处理组与对照组差异不显著(p>0.05).N-20 mg · L-1处理组与对照组差异性不显著(p>0.05),与其他处理组差异性显著(p<0.05).相关分析得,qP与ΔFv/Fm、ETR显著正相关.随着N-AgNPs浓度增大,水葱叶片中NPQ先增大后减小再增大,且各处理组间差异性不显著.
3.4 N-AgNPs对水葱叶片中丙二醛和脯氨酸含量的影响N-15 mg · L-1处理组丙二醛的含量略高于对照组,为对照组的107.4%,且与对照组差异性不显著;N-5 mg · L-1、N-10 mg · L-1、N-20 mg · L -1处理组分别为对照组的83.5%、76.0%、66.2%,并与对照组差异性显著(p<0.05).N-15 mg · L-1处理组与对照组差异性不显著,而与其他处理组差异性显著(p<0.05)(图 3).
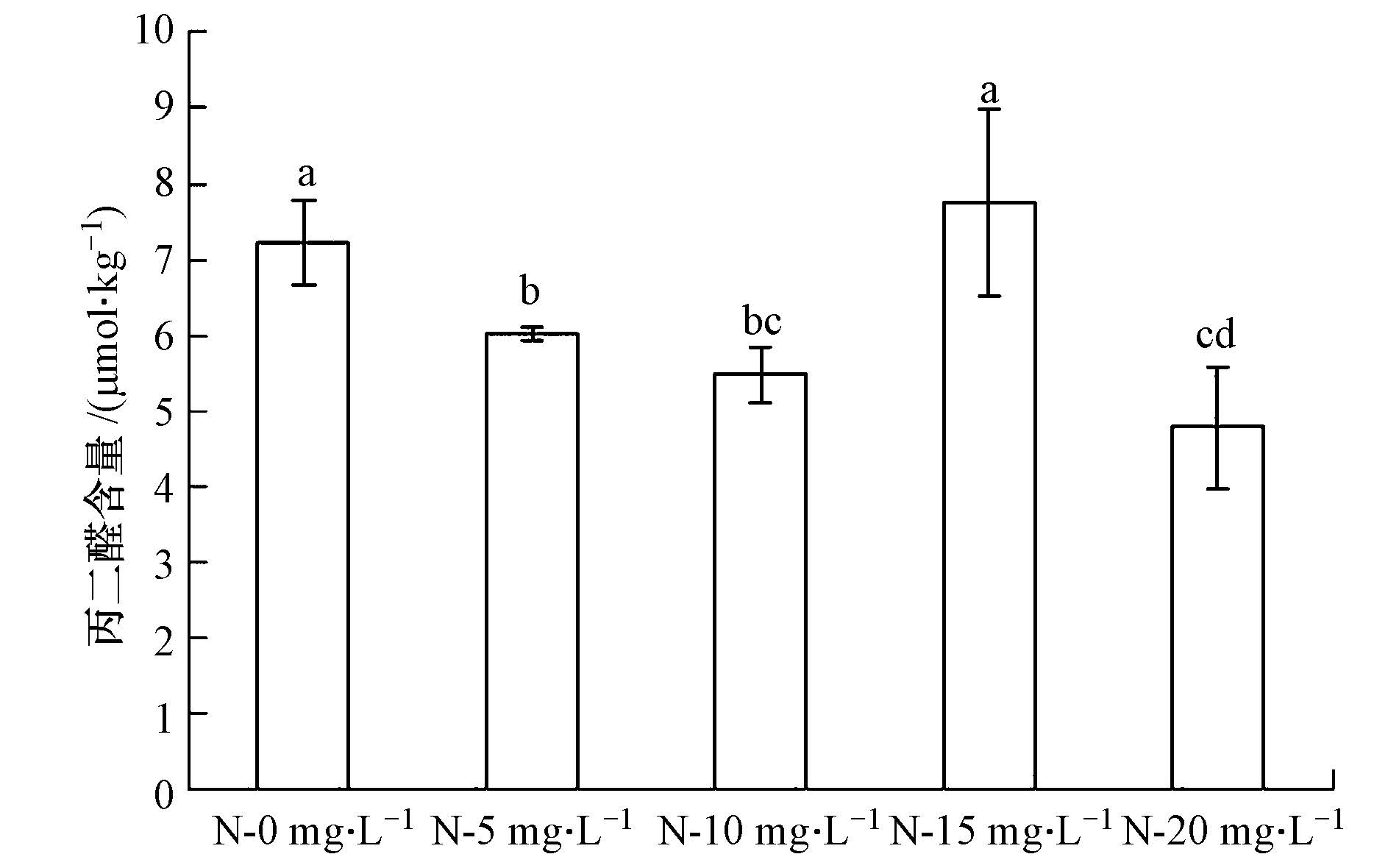 |
| 图3 N-AgNPs对水葱叶片中丙二醛含量的影响(不同字母表示其统计差异达到显著水平(p<0.05)) Fig.3 Effect of N-AgNPs on the malondialdehyde content in leaf of Scirpus tabernaemontani |
水葱叶片中脯氨酸含量随N-AgNPs浓度的变化如图 4所示,N-AgNPs降低了水葱叶片中脯氨酸的含量.随着N-AgNPs浓度的增大,呈现先增大后逐渐减小的趋势,分别为对照组的24.0%、46.5%、30.6%、22.8%.N-10 mg · L-1处理组脯氨酸含量较高,之后逐渐降低.而且各处理组与对照组差异性极显著(p<0.01).
 |
| 图4 N-AgNPs对水葱叶片中脯氨酸含量的影响(不同字母表示其统计差异达到显著水平(p<0.05)) Fig.4 Effect of N-AgNPs on the proline content in leaf of Scirpus tabernaemontani |
N-AgNPs暴露对植物生长产生重要影响.Krishnar等(2012)研究得出银纳米颗粒可促进假马齿苋(Bacopa monnieri)蛋白质和碳水化合物的合成,表现出较好的植物生长趋势.Sharma等(2012)研究也表明银纳米颗粒对芥菜(Brassica juncea)鲜重、根及叶片的长度、幼苗的活力指数有显著的影响,银纳米颗粒的暴露使得幼苗根长及活力指数增大,显著促进芥菜的生长.本研究表明,N-AgNPs明显促进了水葱叶片的生长和生物量的累积,与上述研究结果一致.然而,Yin 等(2011)研究对黑麦草(Lolium multiflorum)生长的影响时发现银纳米颗粒抑制了根和芽的生长,当银纳米颗粒的浓度达到40 mg · L-1时,黑麦草幼苗根毛不发育,并且可导致细胞的损伤.Jiang等(2012)的研究证明银纳米颗粒显著的降低了紫背浮萍(Spirodela Polyrhiza)生物量的含量.银纳米颗粒暴露对植物生长表现出促进和抑制两种截然相反的影响,一方面与受试物种及所处环境有关,另一方面与银纳米颗粒的包裹材料、尺寸及浓度有关(Hund et al., 2006).可见,银纳米颗粒对大型植物的毒性机理尚未明确,还有待于深入研究.
4.2 N-AgNPs对水葱叶片中叶绿素含量及叶绿素荧光参数特征的影响分析叶绿素是植物进行光合作用的主要色素,它在光合作用的光吸收中起核心作用.本研究表明,N-AgNPs显著增加了水葱叶片中叶绿素的含量.15 mg · L-1处理下水葱叶片中叶绿素含量增量最大,与对照组相比增加85.2%.Sharma等(2012)的研究得出银纳米颗粒处理过的芥菜(Brassica juncea)幼苗叶片中叶绿素含量显著提高,与我们的研究结果一致.
叶绿素荧光特征能够反映植株叶片的光合效率和潜在能力(刘建锋等,2011).PSⅡ原初光能转换效率(Fv / Fm)反映了PSⅡ反应中心的光能转换效率(吴甘霖等,2010).在不受光抑制的情况下,Fv/Fm 一般介于 0.75~0.85(何炎红等,2005),且不受生长条件的影响.本研究中的Fv/Fm 均处于正常范围,与表观量子效率的推论具有一致性.N-AgNPs导致Fv/Fm小幅度增加,说明更多的PSⅡ反应中心处于“开放状态”来进行光反应.PSⅡ中较多开放的反应中心和氧化电子受体降低了反应自由基的产生(Guo et al., 2005).因此,本研究表明,N-AgNPs暴露使得水葱叶片光氧化损伤的发生率降低.Fv/Fm与N-AgNPs浓度,地上生物量,地下生物量,叶绿素含量呈显著正相关关系,这表明随着N-AgNPs浓度增大,PSⅡ的潜在光化学反应活力上升,叶绿素含量增大,导致水葱更多生物量的累积.PSⅡ有效光量子产量(ΔFv/Fm)反映了 PSⅡ反应中心部分关闭情况下的实际 PSⅡ光能捕获的效率(吕芳德等,2003).ETR反映电子传递速率,光化学猝灭系数(qP)反映 PSⅡ天线色素吸收的光能用于光化学电子传递的份额(张守仁,1999).本研究中,N-5 mg · L-1处理组ΔFv/Fm、ETR和qP同时达到最大,随着浓度的增加,ΔFv/Fm、ETR和qP都逐渐减小.说明N-5 mg · L-1处理组水葱叶片中PSⅡ中ΔFv/Fm、ETR和qP达到阈值,此时水葱叶片PSⅡ功能反应中心开放度最大,光合电子传递速率最快,光合电子传递活性最大,随着处理浓度增大,水葱叶片PSⅡ功能反应中心开放度减小,光合电子传递速率逐渐变慢,光合电子传递活性逐渐降低.非光化学淬灭系数(NPQ)反映的是天线色素吸收的光能不能用于电子传递而以热的形式耗散掉的部分光能,热耗散是植物保护PSⅡ的重要机制(王文林等,2013).本研究中,N-5 mg · L-1处理水葱叶片中NPQ最大,之后逐渐减小,N-20 mg · L-1处理组又略微增大,说明在N-5 mg · L-1处理下,虽然 PSⅡ捕获的光能增加(Fv/Fm和ΔFv/Fm最大),但用于光化学反应的比例降低,而转化为热耗散的比例升高,即碳同化积累的能量减少.随着浓度的增加,PSⅡ捕获的光能减小,转化为热耗散的比例减小,在N-20 mg · L-1处理下,PSⅡ捕获的光能最小,而转化为热耗散的比例又略微增大,说明此时碳同化积累的能量最小.
4.3 N-AgNPs对水葱叶片中丙二醛和脯氨酸含量特征的影响分析丙二醛是植物体内细胞衰老的重要特征之一,其含量的高低可作为植物在逆境胁迫条件下膜系统受损程度的指标,植物细胞受损程度越高,丙二醛的含量就越高(陈金发,2014).本研究发现,N-15 mg · L-1处理组丙二醛的含量高于对照组,与对照组差异性不显著,而与其他处理组差异性显著.这可能的原因为N-15 mg · L-1处理下水葱叶片的细胞膜受损比较严重,抗氧化酶不能及时清除多余的自由基引起的,导致细胞膜发生严重的过氧化现象.总体上看,N-AgNPs浓度增加使得水葱叶片中丙二醛积累量减少,膜系统受损程度降低,膜脂过氧化作用减弱.脯氨酸作为植物抗逆性的一个重要指标,其含量的高低直接反映了植物本身的自我调节能力(黄益宗等,2013).本研究表明,N-AgNPs显著降低了水葱叶片中脯氨酸的含量,说明N-AgNPs暴露环境下,水葱的自我调节能力减弱.Sharma等(2012)对芥菜(Brassica juncea)的研究与我们的研究结果一致.
5 结论(Conclusions)1)N-AgNPs显著促进了水葱叶片的生长.与对照组相比,N-5 mg · L-1、N-10 mg · L-1、N-15 mg · L-1、N-20 mg · L -1处理组水葱叶片的生长速率分别增加20.7%、37.6%、42.9%、47.7%,生物量分别增加77.3%、158.2%、95.5%、127%.N-AgNPs浓度与水葱生长速率,地上生物量,地下生物量呈正相关关系.
2)N-AgNPs浓度的增大促进了水葱叶片叶绿素含量的增加,且N-AgNPs浓度与叶片中叶绿素含量显著正相关,N-AgNPs促进了PSⅡ反应中心的光能转换效率(Fv/Fm).且N-AgNPs浓度与Fv/Fm显著正相关.N-5 mg · L-1处理组水葱叶片PSⅡ功能反应中心开放度最大,光合电子传递速率最快,光合电子传递活性最大;随着N-AgNPs浓度增大,水葱叶片PSⅡ功能反应中心开放度减小,光合电子传递速率逐渐变慢,光合电子传递活性逐渐降低.N-5 mg · L-1处理下,水葱叶片用于光化学反应的比例降低,而转化为热耗散的比例升高,即碳同化积累的能量减少;N-20 mg · L-1处理下,水葱叶片碳同化积累的能量达到最小.
3)N-AgNPs降低了水葱叶片中的丙二醛含量,膜脂过氧化作用减弱;同时,N-AgNPs降低了水葱叶片中脯氨酸的含量,水葱的自我调节能力减弱.
| [1] | Bar-Ilan O, Albrecht R M, Fako V E, et al. 2009. Toxicity assessments of multisized gold and silver nanoparticles in zebrafish embryos[J]. Small, 5(16):1897-1910 |
| [2] | Bilberg K, Malte H, Wang T, et al. 2010. Silver nanoparticles and silver nitrate cause respiratory stress in Eurasian Perch (Perca fluviatilis)[J]. Aquatic Toxicology, 96(2):159-165 |
| [3] | Blinova I, Niskanen J, Kajankari P, et al. 2013. Toxicity of two types of silver nanoparticles to aquatic crustaceans Daphnia magna and Thamnocephalus platyurus[J]. Environmental Science and Pollution Research, 20(5):3456-3463 |
| [4] | Bradford A, Handy R D, Readman J W, et al. 2009. Impact of silver nanoparticle contamination on the genetic diversity of natural bacterial assemblages in estuarine sediments[J]. Environmental Science & Technology, 43(12):4530-4536 |
| [5] | 陈金发. 2014.铬胁迫对旱伞草生理生化特性的影响[J].湿地科学, 12(3):356-361 |
| [6] | Chen Y G, Chen H, Zheng X, et al. 2012. The impacts of silver nanoparticles and silver ions on wastewater biological phosphorous removal and the mechanisms[J]. Journal of Hazardous Materials, 239-240:88-94 |
| [7] | Fang J H, Zhong C G, Mu R W. 2005. The study of deposited silver particulate films by simple method for efficient SERS[J]. Chemical Physics Letters, 401(1/3):271-275 |
| [8] | Griffitt R J, Luo J, Gao J, et al. 2008. Effects of particle composition and species on toxicity of metallic nanomaterials in aquatic organisms[J]. Environmental Toxicology and Chemistry, 27(9):1972-1978 |
| [9] | Griffitt R J, Hyndman K, Denslow N D, et al. 2009. Comparison of molecular and histological changes in zebrafish gills exposed to metallic nanoparticles[J]. Toxicological Sciences, 107(2):404-415 |
| [10] | Gubbins E J, Batty L C, Lead J R. 2011. Phytotoxicity of silver nanoparticles to Lemna minor L[J]. Environmental Pollution, 159(6):1551-1559 |
| [11] | Guo D P, Guo Y P, Zhao J P, et al. 2005. Photosynthetic rate and chlorophyll fluorescence in leaves of stem mustard (Brassica juncea var. tsatsai) after turnip mosaic virus infection[J]. Plant Science, 168(1):57-63 |
| [12] | 何炎红,郭连生,田有亮. 2005.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报, 25(11):2226-2233 |
| [13] | 黄益宗,隋立华,王玮,等. 2013. O3对水稻叶片氮代谢、脯氨酸和谷胱甘肽含量的影响[J].生态毒理学报, 8(1):69-76 |
| [14] | Hund-Rinke K, Simon M. 2006. Ecotoxic effect of photocatalytic active nanoparticles (TiO2) on algae and daphnids[J]. Environmental Science and Pollution Research, 13(4):225-232 |
| [15] | Jha A K, Prasad K, Prasad K, et al. 2009. Plant system:Nature's nanofactory[J]. Colloids and Surfaces B:Biointerfaces, 73(2):219-223 |
| [16] | Jiang H S, Li M, Chang F Y, et al. 2012. Physiological analysis of silver nanoparticles and AgNO3 toxicity to Spirodela polyrhiza[J]. Environmental Toxicology and Chemistry, 31(8):1880-1886 |
| [17] | Krishnaraj C, Jagan E G, Ramachandran R, et al. 2012. Effect of biologically synthesized silver nanoparticles on Bacopa monnieri (Linn.) Wettst. plant growth metabolism[J]. Process Biochemistry, 47(4):651-658 |
| [18] | Lee K J, Nallathamby P D, Browning L M, et al. 2007. In vivo imaging of transport and biocompatibility of single silver nanoparticles in early development of zebrafish embryos[J]. ACS Nano, 1(2):133-143 |
| [19] | 李合生. 2000.植物生理生化实验原理和技术[M].北京:高等教育出版社. 134-261 |
| [20] | 刘建锋,杨文娟,江泽平,等. 2011.遮荫对濒危植物崖柏光合作用和叶绿素荧光参数的影响[J].生态学报, 31(20):5999-6004 |
| [21] | 吕芳德,徐德聪,侯红波,等. 2003. 5种红山茶叶绿素荧光特性的比较研究[J].经济林研究, 21(4):4-7 |
| [22] | Miao A J, Schwehr K A, Xu C, et al. 2009. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances[J]. Environmental Pollution, 157(11):3034-3041 |
| [23] | Navarro E, Piccapietra F, Wagner B, et al. 2008. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii[J]. Environmental Science & Technology, 42(23):8959-8964 |
| [24] | Nowack B, Krug H F, Height M. 2011. 120 years of nanosilver history:Implications for policy makers[J]. Environmental Science & Technology, 45(4):1177-1183 |
| [25] | 彭小凤,朱敏,任洁,等. 2014.纳米银的植物毒性研究进展[J].生态毒理学报, 9(2):199-204 |
| [26] | Sharma P, Bhatt D, Zaidi M G H, et al. 2012. Silver Nanoparticle-mediated enhancement in growth and antioxidant status of Brassica juncea[J]. Applied Biochemistry and Biotechnology, 167(8):2225-2233 |
| [27] | Sharma V K, Yngard R A, Lin Y. 2009. Silver nanoparticles:Green synthesis and their antimicrobial activities[J]. Advances in Colloid and Interface Science, 145(1/2):83-96 |
| [28] | 王文林,万寅婧,刘波,等. 2013.土壤逐渐干旱对菖蒲生长及光合荧光特性的影响[J].生态学报, 33(13):3933-3940 |
| [29] | 吴甘霖,段仁燕,王志高,等. 2010.干旱和复水对草莓叶片叶绿素荧光特性的影响[J].生态学报, 30(14):3941-3946 |
| [30] | 吴源. 2010.纳米银的生物效应及毒性作用机制[D].合肥:中国科学技术大学. 1-119 |
| [31] | Yin L Y, Cheng Y W, Espinasse B, et al. 2011. More than the Ions:The effects of silver nanoparticles on Lolium multiflorum[J]. Environmental Science & Technology, 45(6):2360-2367 |
| [32] | 苑志华,汤晓琳,白炎青,等. 2013.纳米银对小球藻光合作用和呼吸作用的影响[J].中国环境科学, 33(8):1468-1473 |
| [33] | 张守仁. 1999.叶绿素荧光动力学参数的意义及讨论[J].植物学通报, 16(4):444-448 |
 2016, Vol. 36
2016, Vol. 36


