2. 旱区地下水文与生态效应教育部重点实验室, 西安 710054
2. Key Laboratory of Subsurface Hydrology and Ecological Effect in Arid Region of Ministry of Education, Xi'an 710054
近年来,随着我国经济的高速发展,城市化进程的加速,大气气溶胶污染日趋严重,由此造成的能见度下降与人群健康危害事件也越来越多.而这其中,灰霾已经成为影响城市空气质量的重要因素.西安市位于陕西省中部,是西北地区最大的城市,南依秦岭,北邻黄土高原,位于渭河流域中部的关中盆地,特殊的盆地结构及静风少雨等不利的气象条件造成西安市灰霾天气频发.研究发现,西安在近47年霾天气平均年总日数达到99.2 d,已经成为我国诸多“浊岛”之一(刘小宁等,2005).
霾是一种天气现象,又称灰霾、阴霾.中华人民共和国气象行业标准(QX/T 113-2010)中定义,霾是大量极细微的干尘粒子等均匀地浮游在空气中,使水平能见度小于10 km的大气浑浊现象.灰霾不仅会污染环境,危害人体健康,而且对云的形成,甚至全球气候变化都会产生影响(Okada et al., 2001; Yadav et al., 2003; Yu et al., 2011).因此,灰霾天气备受中国学术界、政府部门和社会公众的关注.研究还发现,灰霾天气的本质是细模态气溶胶污染(Watson,2002;吴兑,2005;吴兑等,2006; 陆晓波等,2009).但目前关于灰霾天气气溶胶的研究主要集中在对气溶胶的理化性质、二次颗粒物形成与转化机理等方面(Tan et al., 2009; Yang et al., 2012; Cheng et al., 2013;Sun et al., 2013; Quan et al,2014),对其生物学特性的研究还较少.
众所周知,大气气溶胶粒子的组成既有有机和无机的化学物质,也有生物物质.微粒中含有微生物或生物大分子等生命活性物质的,称为生物气溶胶,其中含有细菌、真菌、病毒和放线菌等多种微生物的称为微生物气溶胶(Ariya et al., 2004).土壤、植物与岩石表面附着的微生物均是生物气溶胶的重要来源.研究表明,生物气溶胶在大气气溶胶中所占比例可达25%(Jaenicke,2005),而且会给人体健康带来不可忽视的危害(Garrett et al., 1998; Vermani et al., 2010; Haas et al., 2013),特别是生物气溶胶的粒径会对其在呼吸道中的沉降位置产生影响(Boreson et al., 2004),以及某些种属的微生物具有的过敏与传染性,会使其危害性变得更加复杂.但是,目前国内外学术界对城市空气中微生物气溶胶的研究相对较少,已有的研究主要集中在正常天气(非霾天)下城市环境以及特殊环境下(如污水处理厂、污泥处置场和动物养殖场等)微生物气溶胶的浓度与粒径分布方面(Fang et al., 2005,2008; Liao et al., 2005; Vermani et al., 2010;方治国等,2004;Yamamoto et al., 2012; Haas et al., 2013;邱雄辉等,2012; Li et al., 2013;2015),对灰霾天气条件下微生物气溶胶特性的研究却鲜有报道.针对这一现状,本研究考察西安市秋季灰霾天气条件下,可培养微生物气溶胶的浓度、粒径与种属分布状况,以及其同气象参数的相关关系,以期为评估灰霾暴发时微生物气溶胶引起的环境效应与健康风险提供基础数据.
2 采样与分析(Sampling and analysis) 2.1 采样地点与时间采样地点位于西安市长安大学雁塔校区环境科学与工程学院楼顶,距离地面27 m,采样高度为楼顶上1.5 m处.该采样点位于西安市南二环与南三环之间,周围主要为住宅区和教学区,没有明显的工业污染排放源,采样点周围50 m范围内也没有树木与绿地.
采样时间为2014年10月7—23日.对于微生物气溶胶,使用Andersen六级撞击式空气采样器(Westech,UK)在每天的7 ∶ 30—8 ∶ 30和11 ∶ 00—12 ∶ 00两个时段分别进行重复两次的采样,每次采样时间大约为10 min.为了与微生物气溶胶浓度进行相关性分析,同时段还采用激光可吸入粉尘连续测量仪(PC-3A,中国)对PM2.5进行实时监测.另外,为得到采样期间PM2.5的日均浓度值以方便界定灰霾天,本研究还采用frmOmni环境大气采样器(BGI,USA)在每天的0 ∶ 00—22 ∶ 00对大气PM2.5连续采样22 h.
2.2 采样方法与培养方法Andersen六级撞击式空气采样器是国际上通用的生物气溶胶标准采集仪器.该采样器共分为6级,每一级共有400个小孔,从上往下孔径逐级减小.采样时空气中的微生物粒子分等级地按大小被收集在采样介质表面,供微生物学分析(Andersen,1958).采样器各级特性如表 1所示.采样时,气体流量为28.3 L · min-1,每次采样前均用流量计对采样泵进行校准,并使用75%酒精对采样器各级进行消毒.
| 表1 Andersen采样器各级特征 Table 1 Characteristics of Andersen sampler |
PM2.5样品采集所使用的frmOmni环境大气采样器流量为5 L · min-1,采样介质为47 mm的石英纤维滤膜(Whatman QM/A,Engl and ).采样前后的滤膜均经恒温、恒湿24 h(温度为20~25 ℃,湿度为40%~45%)后再进行称重(METTLER TOLEDO MS105),从而计算得到日均PM2.5质量浓度.采样期间,还采用便携式自动气象站(JLC-QGL,中国)监测了风速(m · s-1)、温度(℃)、湿度等气象参数.另外,采样期间的能见度(km)等数据主要参考网络资料(http://www.wunderground.cn).
采用平皿培养和平板菌落计数法来检测微生物浓度.每次采样前将90 mm玻璃培养皿进行灭菌处理(121 ℃和30 min)后,加入30 mL培养基.采样完成后,迅速将培养皿取出、加盖,然后倒置于培养箱内培养.细菌使用营养琼脂培养基(牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15 g,蒸馏水1000 mL,pH=7.4,放线菌酮500 mg),37 ℃恒温培养箱内培养48 h;真菌使用沙氏培养基(葡萄糖40 g,蛋白胨10 g,琼脂20 g,蒸馏水1000 mL,pH=6.2,氯霉素100 mg),28 ℃恒温培养箱内培养72 h.通过在适宜微生物生长的条件下对样品进行培养,使样品中优势菌群出现.
2.3 计算方法 2.3.1 生物气溶胶浓度采集的样品进行菌落计数时,为避免培养皿上微生物粒子的重叠现象,可采用Positive-hole法(Andersen,1958)对菌落数进行校正处理:
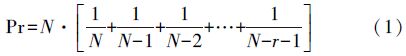
然后,根据采样流量Q和采样时间t,由公式(2)即可计算出生物气溶胶的浓度:

通过计算采样器各级生物气溶胶粒子数占总数的百分比,按VI~I的顺序进行累加,计算出各级的累计百分比.再由给定采样器各级有效截面粒子径(ECD)与各级累计百分比,求得对数回归方程,累计百分比为50%时所对应的ECD即为中值直径.
2.4 微生物种属鉴别方法 2.4.1 细菌鉴别方法用接种针挑取少许培养基中待测菌的菌苔,均匀划线,32 ℃培养24~48 h,选择单菌落重复以上操作数次,直至待测菌完全纯化.同时观察待测菌的菌落特征,主要观察菌落的颜色、光润、形状、大小等.通过革兰氏反应、葡萄糖的氧化发酵测定、接触酶(过氧化氢酶),确定细菌种属(Murray et al., 2003).
2.4.2 真菌鉴别方法用无菌解剖刀把琼脂切成1 cm2见方,把这些小方块放到载玻片正中间,琼脂块的四周接种上待测真菌悬液,用无菌盖玻片覆盖在琼脂上.另取2~3 mL 20%甘油水溶液注入滤纸上,盖好培养皿,25~27 ℃培养.取40~50 ℃ PDA(Potato Dextrose Agar)培养基15~20 mL,注入90 mm无菌培养皿中,待冷却凝固.把待测菌制成孢子悬液,然后稀释至100 CFU · mL-1,用接种针蘸取少许稀释液,在PDA平板均匀划线.盖好培养皿,25~27 ℃培养.载玻片培养用于菌体形态观察,48 h后观察,主要观察菌丝形态,有无横隔,以及孢子梗形态、孢子囊形态、孢子形态等(Kirk et al., 2001).
2.5 统计分析利用SPSS 19.0计算描述性统计参数,如单因素方差分析、t检验与Spearman′s相关性分析.当p<0.05与p<0.01时,分别表明95%与99%的置信区间内具有统计学意义上的显著差异.
3 结果与讨论(Results and discussion) 3.1 灰霾天的界定与特征表 2为采样期间每日的PM2.5浓度、空气质量指数(Air Quality Index,AQI)与气象参数.需要说明的是,AQI是我国普遍使用的定量描述空气清洁或者污染程度的无量纲指数,其中,AQI(PM2.5)是由日均PM2.5浓度值计算得出,与PM2.5浓度正相关,当该值高于100时(中国空气质量II级标准),通常认为出现灰霾污染.此外,广东省霾日统计方法认为当日均相对湿度<90%且日均能见度<10 km时,记为霾日(薛莲等,2011).因此,综合以上两种方法,可以认定在本次采样周期内西安市经历有两次灰霾过程,分别为10月8—10日与10月18—22日,共6 d(见表 2最后一列).
| 表2 风速、温度、湿度、能见度、日均PM2.5浓度及相应空气质量指数AQI(PM2.5) Table 2 Wind speed,temperature,RH,visibility,PM2.5 daily concentration and AQI(PM2.5)during 7—23 October |
由表 2可见,在灰霾天时,日均PM2.5浓度处于123~279 μg · m-3范围内,显著高于我国空气质量日均标准值(75 μg · m-3).此外,6个灰霾天日均PM2.5浓度的平均值(179.8 μg · m-3)大约是其余7个非灰霾天(53.0 μg · m-3)的3倍多.另外,在表 2中还可以看到,灰霾天的风速亦低于非灰霾期间(p<0.05).这表明在灰霾期间,风对气溶胶的输送与稀释作用明显较弱,容易造成空气污染物的积聚.
3.2 采样期间微生物气溶胶的浓度水平图 1为采样期间微生物气溶胶与实时PM2.5浓度值,这里的各项数据均由算术平均值与标准偏差组成,其中,微生物气溶胶的浓度为采样每天两个时段的平均值.从图 1中可以看到,可培养的细菌气溶胶在灰霾天的浓度值(1102~1736 CFU · m-3)显著高于非灰霾天(427~609 CFU · m-3)(p<0.05);可培养真菌气溶胶的浓度也有相同的特征,其在灰霾天的浓度(1466~1703 CFU · m-3)亦显著高于非灰霾时(248~398 CFU · m-3)(p<0.01).另外,同前述的PM2.5日均值规律一样,灰霾天气条件下的实时PM2.5浓度均值(161.3 μg · m-3)也远高于非灰霾天(51.3 μg · m-3),大约是3倍多.通过对微生物气溶胶浓度与实时PM2.5浓度进行相关性分析发现,采样的13 d内,实时PM2.5浓度与细菌气溶胶浓度显著正相关(p<0.01),与真菌气溶胶浓度亦显著正相关(p<0.05).这表明随着细颗粒物浓度的增加,微生物气溶胶浓度也会随之增大.Degobbi等(2011)和Haas等(2013)也给出了类似的报道,并认为这主要是因为随着空气中颗粒物浓度的增大,微生物更易附着于颗粒物上,而使其浓度增大.
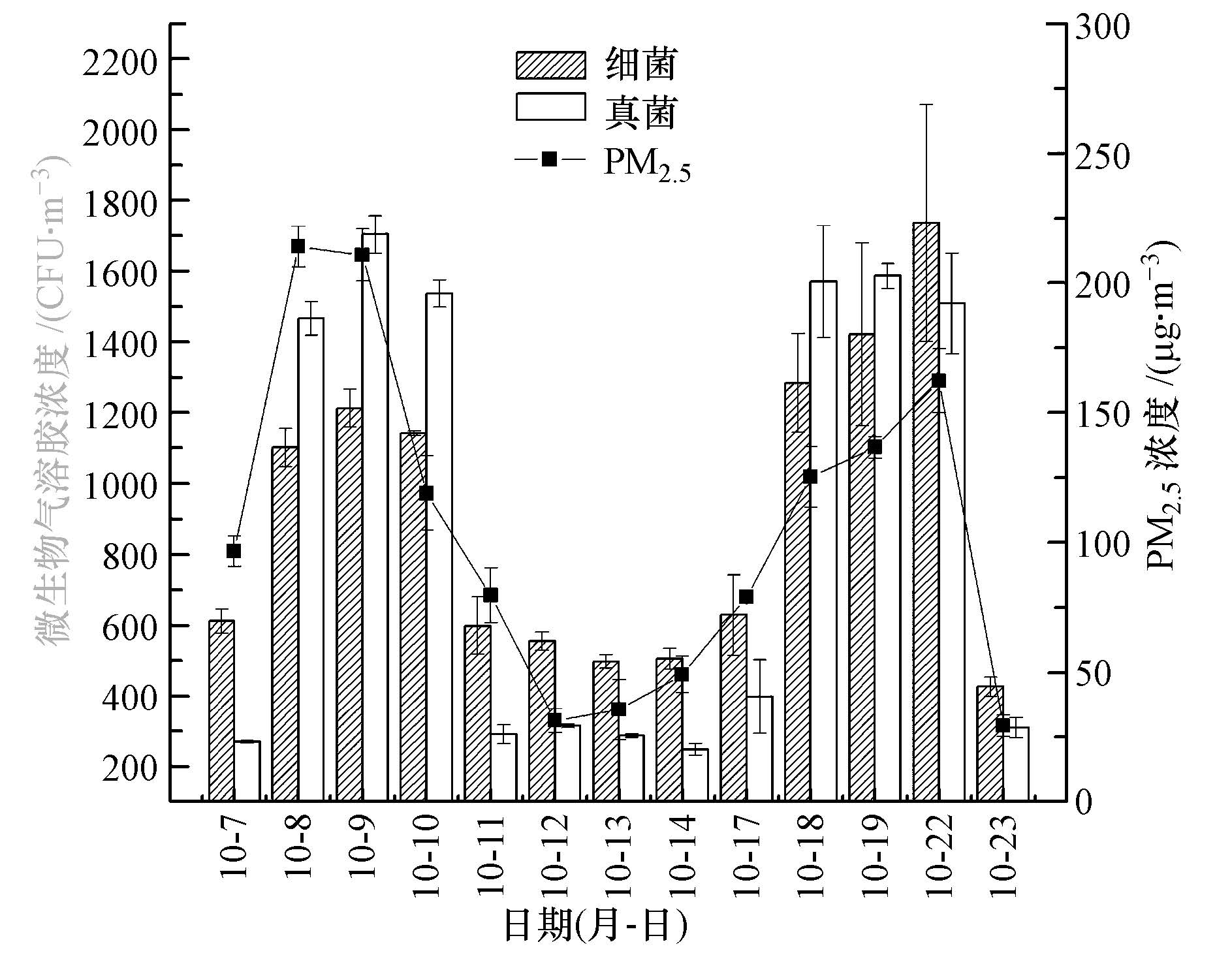 |
| 图1 采样期间微生物气溶胶与PM2.5浓度的变化 Fig.1 Concentration of bioaerosols and PM2.5 on haze and non-haze days |
由于我国目前还没有出台室外环境微生物气溶胶浓度的官方标准,因此,较难评价本次监测到的西安市微生物气溶胶的污染状况.然而,通过比较中国科学院生态环境研究中心推荐的室外标准值(细菌气溶胶<1000 CFU · m-3,真菌气溶胶<500 CFU · m-3)发现,在本次采样期间,可培养细菌与真菌气溶胶在非灰霾天时并未超标,但在灰霾天时均超过这一标准.很明显,灰霾暴发时超标的微生物气溶胶严重地威胁着人民群众的身体健康.因此,除了需要关注灰霾天气空气气溶胶的化学组成的危害外,还需要重视微生物气溶胶给人体健康带来的潜在危害.
尽管关于灰霾天气条件下空气中可培养微生物气溶胶的研究鲜有报道,但与已有的沙尘暴天气条件下的微生物气溶胶的报道进行比较也是大有裨益的.Li等(2011)报道指出,青岛市滨海区在2010年5月份沙尘暴期间空气中可培养生物气溶胶浓度达到830 CFU · m-3,而在非沙尘天气时则为373 CFU · m-3. Griffin等(2003)在加勒比海北部地区的非灰霾天气条件下,从所收集的3652 L空气样品中共检出19种细菌,28种真菌;而在非洲灰霾暴发时,在同一采样点2369 L空气样品中则共检出171种细菌,76种真菌.正如上述研究者所认为,尘粒或者细颗粒可以作为空气中微生物的载体,并为其提供营养物质,从而导致空气中微生物含量的升高.因此,可以预计,在灰霾天气条件下微生物气溶胶的浓度可能高于沙尘暴天气条件下.这主要归因于相比于沙尘暴天气,灰霾天气下空气中细颗粒物的比例及空气湿度均会升高,从而为微生物的繁殖与生长提供适宜的环境.
3.3 采样期间微生物气溶胶的粒径分布根据Yu等(2011)与Quan等(2014)的定义,本文将空气动力学当量直径小于2.1 μm的颗粒定义为细颗粒,对应Andersen采样器的Ⅴ~Ⅵ级.
图 2为采样期间空气中可培养细菌气溶胶的粒径分布.显然,可培养细菌气溶胶在非灰霾天与灰霾天时粒径分布存在差异.在非灰霾天,可培养细菌气溶胶的粒径主要集中在stage Ⅳ(2.1~3.3 μm)、stage Ⅲ(3.3~4.7 μm)和stageⅡ(4.7~7.0 μm)上,分别占总数的25.6%±6.7%、23.8%±8.3%和20.4%±3.9%,而相对较低的百分比分布在stage Ⅴ(1.1~2.1 μm)与stage Ⅵ(0.65~1.1 μm)两级上(p<0.05),均低于10%.在灰霾天期间,可培养细菌气溶胶在stage V上出现峰值(p<0.05),占总数的25.0%±6.8%,谷值则出现在stage Ⅵ上(12.1%±4.7%).此外,相较于非灰霾天,在灰霾天时各级细菌气溶胶浓度均有所增长,其中,涨幅最大的是stage Ⅴ,其它各级浓度涨幅依次为:stage Ⅰ、stage Ⅱ、stage Ⅵ、stage Ⅲ、stage Ⅳ.
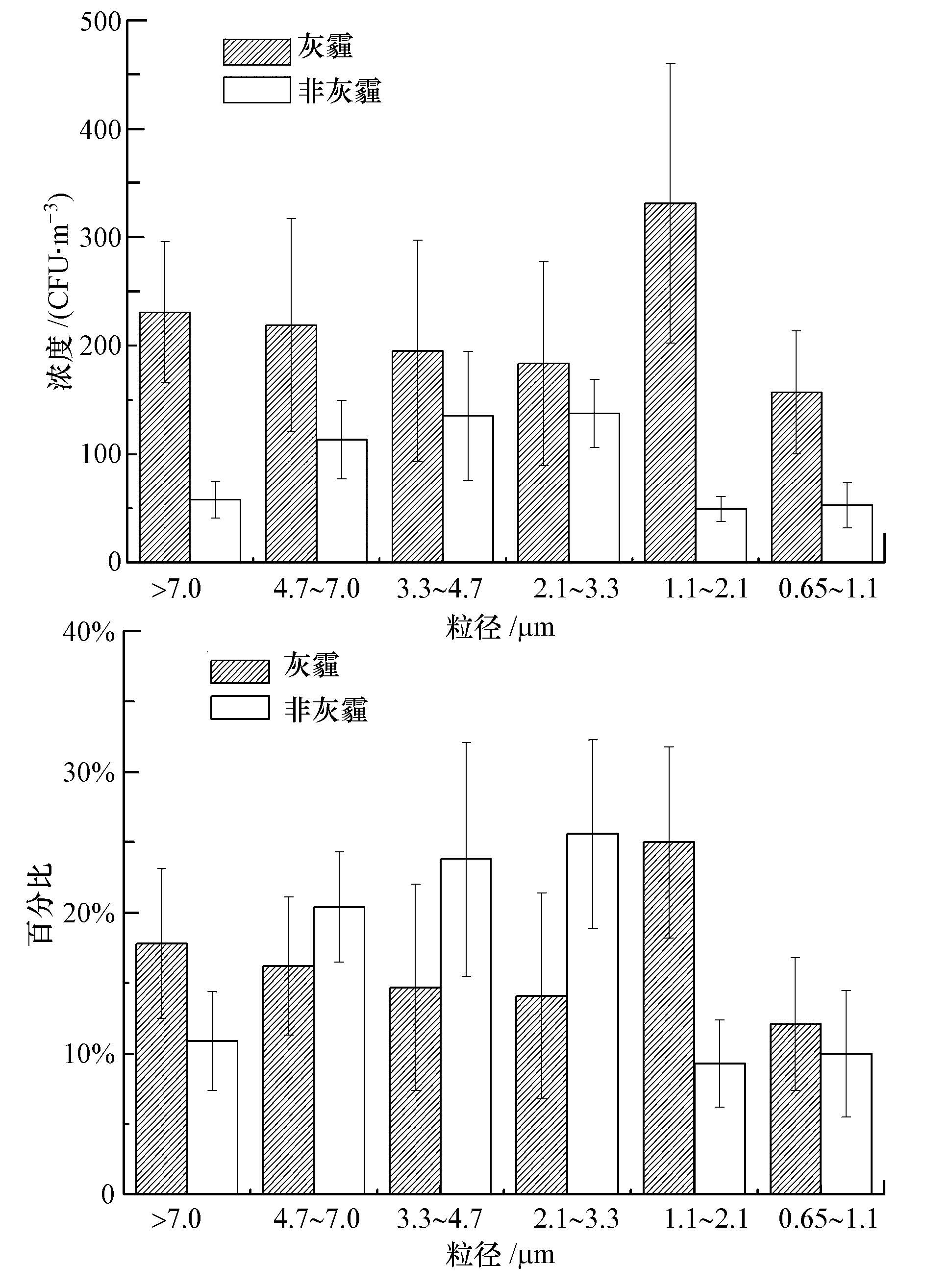 |
| 图2 可培养细菌气溶胶的粒径分布 Fig.2 Size distribution of airborne viable bacteria on haze and non-haze days |
图 3为采样期间空气中可培养真菌气溶胶的粒径分布.可以发现,可培养真菌气溶胶在非灰霾天与灰霾天时的粒径分布呈现出相似的规律.在非灰霾天时,可培养真菌气溶胶的粒径主要集中在stage Ⅱ和stage Ⅲ上,而分布在stage Ⅴ和stage Ⅵ两级上的要显著低于其它各级(p<0.05),且分布在stage Ⅱ和stage Ⅲ(p>0.05),以及stage Ⅴ和stage Ⅵ(p>0.05)两级上的可培养真菌气溶胶浓度在统计学上并无显著差异.而当灰霾暴发时,可培养真菌气溶胶在stage Ⅲ上出现峰值(p<0.05),占总数的29.4%±4.1%,谷值则出现在stage Ⅴ上(8.2%±3.2%)(p<0.05).此外,在灰霾天,可培养真菌气溶胶各级浓度亦均有所增长,其中,涨幅最大的是stage Ⅲ(p<0.05),其他各级浓度涨幅依次为stage Ⅳ、stage Ⅰ、stage Ⅵ、stage Ⅱ、stageⅤ.
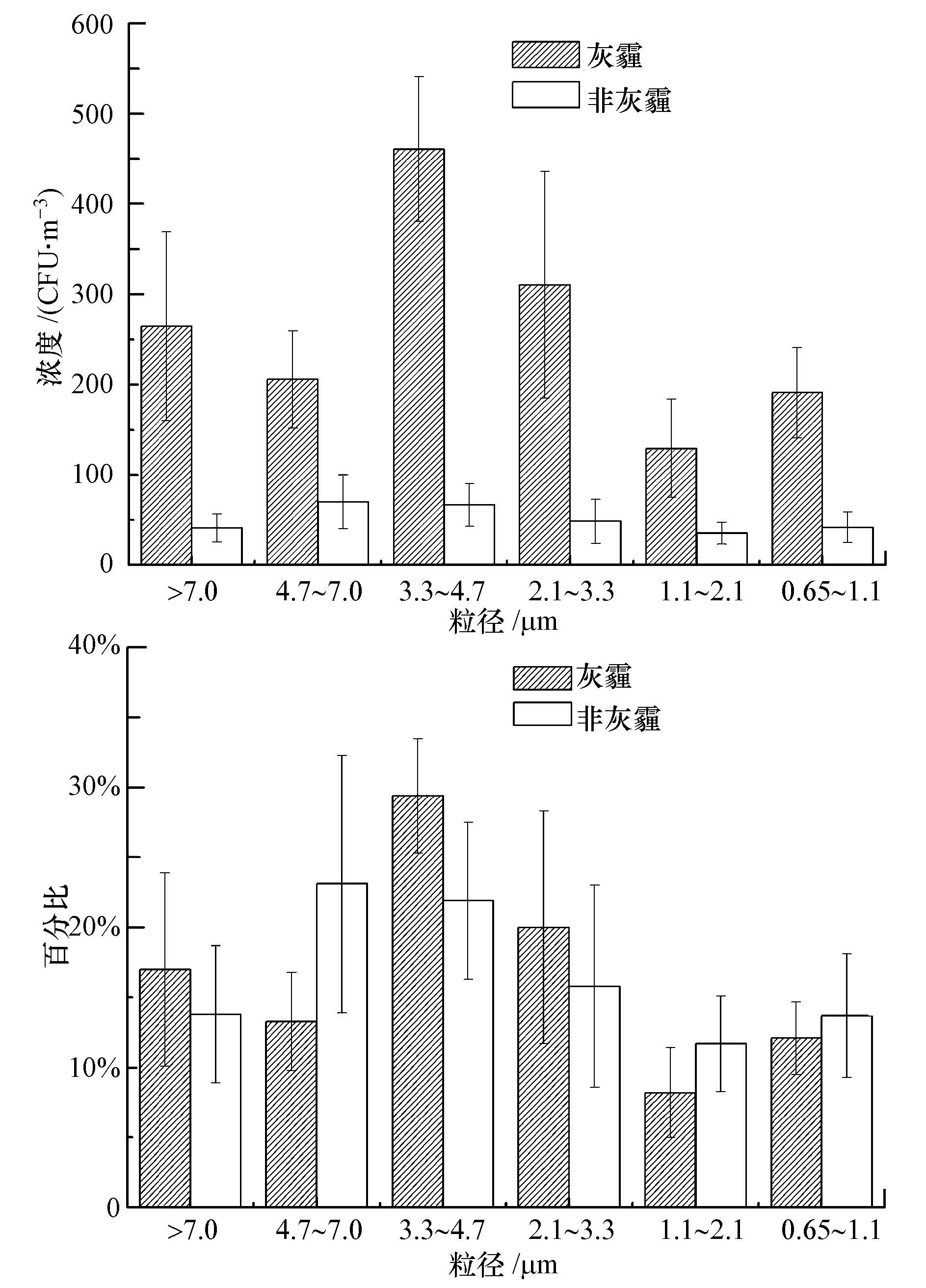 |
| 图3 可培养真菌气溶胶的粒径分布 Fig.3 Size distribution of airborne viable fungi on haze and non-haze days |
上述微生物气溶胶在非灰霾天时的粒径分布特征,与其他研究者在室外正常天气条件下的研究结果类似.比如,Fang等(2008)和Li 等(2015)分别报道了北京市和西安市室外空气环境中可培养细菌气溶胶均主要分布在粗粒径范围(>2.1 μm).Zuraimi等(2009)研究发现,新加坡室外空气中真菌气溶胶在2.1~3.3 μm上出现峰值.Fang等(2005)观察发现,北京市室外空气中可培养真菌气溶胶峰值出现在2.0~3.5 μm粒径范围,在<1.0 μm颗粒上的分布比例最低.青岛市空气中真菌气溶胶峰值出现在2.1~3.3 μm粒径范围,在0.65~1.1 μm范围内的分布比例最低(Li et al., 2011).
为了进一步考察微生物气溶胶的粒径分布,对Andersen采样器各级有效截面粒子直径(ECD)与各级累计百分比进行对数回归,并计算对应的中值直径(图 4).结果显示,在非灰霾天气时,可培养细菌与真菌气溶胶中值直径分别为(2.32±0.12)μm和(2.48±0.24)μm,而在灰霾天时,可培养细菌与真菌气溶胶中值直径则分别为(1.96±0.29)μm和(2.44±0.23)μm.对比发现,相较于非灰霾天,两种微生物气溶胶在灰霾天气时中值直径均有所降低,其浓度峰值会向细颗粒方向偏移.这可能是由于灰霾天空气中会出现更多的细颗粒物而致.如前所述,灰霾天PM2.5浓度值是非灰霾天时的3倍多.研究显示,细颗粒物主要来源于一次污染源与大气二次反应过程;煤炭、秸秆燃烧、工业、交通排放等二次反应过程都是西安市细颗粒污染物的主要来源(Cao et al., 2014; Cheng et al., 2013),尤其是在10月份关中平原农作物收割季节,西安市周边农村地区常常出现露天焚烧秸秆等农作物残渣的现象.因此,在本次研究所进行采样的10月份,西安市频发灰霾天是不足为奇的.
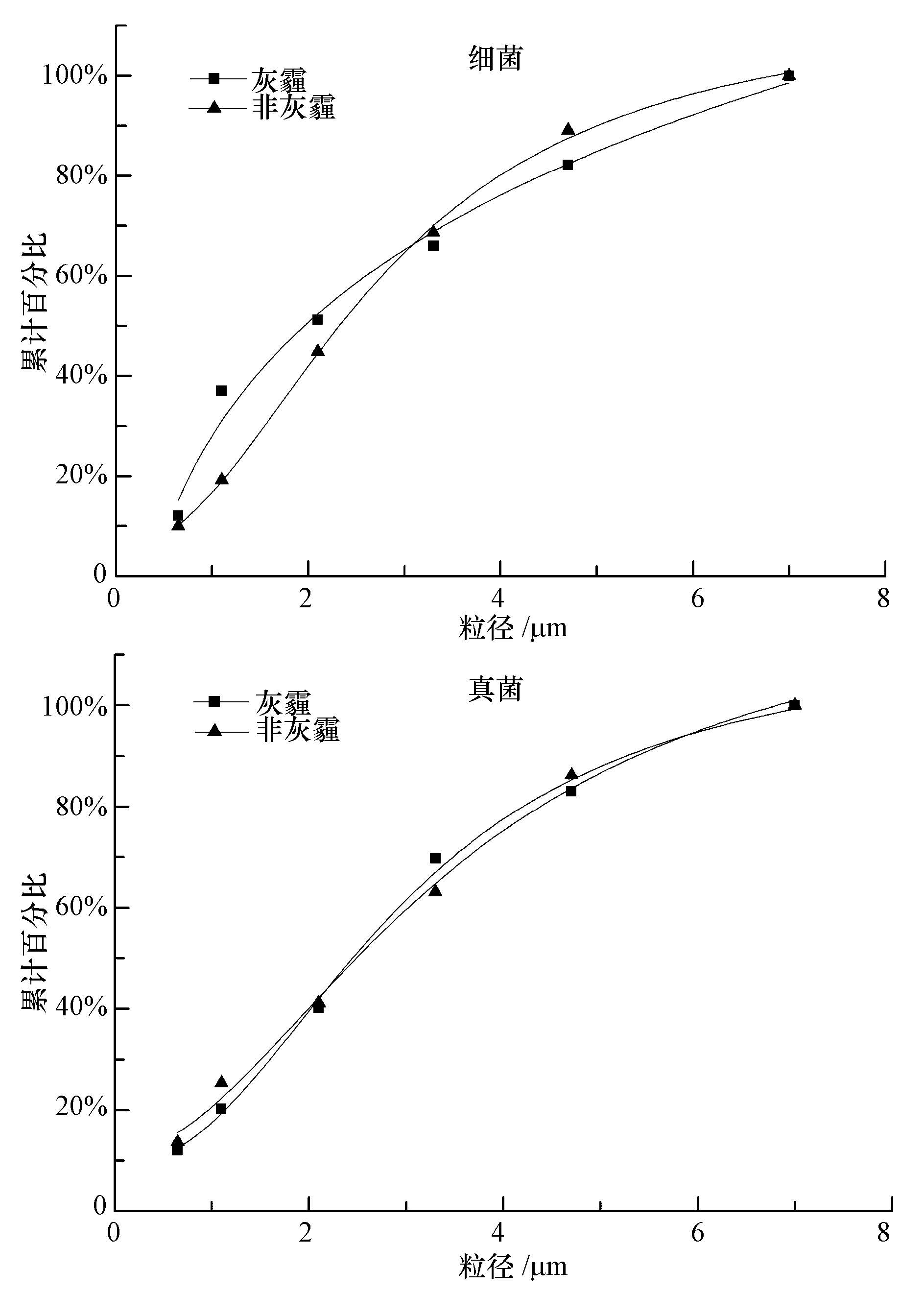 |
| 图4 生物气溶胶的累计百分比 Fig.4 Cumulative frequency of airborne bacteria and fungi on haze and non-haze days |
为了探究气象因素对微生物气溶胶浓度及粒径分布的影响,对采样期间温度、湿度、能见度、AQI(PM2.5)指数与微生物气溶胶浓度进行Spearman相关性分析,主要包括不同粒径范围微生物气溶胶浓度(BI到BVI,FI到FVI)与微生物气溶胶总浓度(BT与FT)的相关性分析,分析结果如表 3所示.
| 表3 温度、湿度、能见度和AQI(PM2.5)与BI~BVI、FI~FVI、BT和FT的Spearman相关性分析 Table 3 Spearman′s correlation analysis between temperature,relative humidity,visibility,AQI(PM2.5) and concentration of BI to BVI,FI to FVI,BT and FT |
表 3中显示,温度与各粒径微生物气溶胶的浓度均呈正相关,其中与FIV(p<0.01)、FV(p<0.05)、FVI(p<0.05)显著正相关,这也与以往报道的非灰霾天时的研究结果相一致(Li et al., 2011).湿度与细菌和真菌气溶胶浓度均呈正相关,其中与FII相关性尤为显著(p<0.05).湿度对可培养真菌气溶胶的影响与其他研究者在非灰霾天气时的研究结果相似(Li et al., 2011; Wang et al., 2001);而环境湿度对可培养细菌气溶胶的影响则与其他研究者研究结果存在差异(de Goffau et al., 2009).这可能是因为在不同地理位置、气候条件及植被类型等条件的影响下,细菌种属存在差异,适宜其生长的湿度也不尽相同.Fang等(2008)考察了北京市室外3个采样点的微生物气溶胶浓度的变化情况,发现早上、下午的浓度一般会高于中午,他们认为这与气象因素及环境条件密切相关.但他们的结果是建立在一年的观测数据之上的,四季气象条件变化很大.而从表 1可以看到,本次测量由于只集中在2014年10月中旬前后,因此,风速、温度与湿度等气象条件变化并不剧烈,所以一天当中两个时段所测量的微生物气溶胶浓度的差别并不十分明显.另外,近年的研究还表明,影响微生物气溶胶浓度的因素还有臭氧及大气化学污染物的浓度等因素.Adhikari等(2006)通过对美国辛辛那提空气状况进行连续两年的监测,发现在可吸入真菌气溶胶浓度较高的夏、秋两季,臭氧浓度也出现了峰值.通过对波兰什切青室外空气连续3年的监测,Grinn-Gofroń等(2011)发现空气中的大气化学污染物如NO2、SO2与真菌的枝孢属、链格孢属浓度呈显著负相关,而臭氧则与其呈显著正相关.显然,大气污染物的化学组分与微生物组分之间的相互作用对于理解微生物气溶胶的浓度及粒径变化有重要意义,需要在下一步的研究中重点关注.
通过对能见度、AQI(PM2.5)指数与生物气溶胶浓度的相关性进行考察可以发现,能见度与生物气溶胶浓度呈负相关,AQI(PM2.5)指数与生物气溶胶浓度呈正相关.综合上述两种气象因素与微生物气溶胶的相关性状况,发现空气质量越差,灰霾越严重,微生物气溶胶浓度越高.
3.5 采样期间微生物气溶胶的种属分布表 4列出了采样期间微生物气溶胶的种属及其比例分布.可以发现,空气中可培养细菌气溶胶中,葡萄球菌属(Staphylococcus)与微球菌属(Micrococcus)在灰霾天与非灰霾天均可被检出.其中,在非灰霾天,它们在总细菌中的比例分别为64.6%和36.4%,而在灰霾天,它们在总细菌中的比例则分别为54.5%和18.2%.此外,在灰霾天时还检出非灰霾天并未出现的奈瑟氏菌属(Neisseria),比例为27.3%.对于空气中的真菌,在非灰霾天,优势菌属为曲霉属(Aspergillus)与短梗霉属(Aureobasidium),所占比例达到87.1%.而在灰霾天,曲霉属所占比例最大(66.7%),其次为拟青霉(Paecilomyces)(25%),其它检出的种属还包括青霉属与头孢霉属(Cephalosporium),其所占比例均低于5%.
| 表4 不同天气条件下生物气溶胶的种属分布 Table 4 Species composition of bioaerosols on haze and non-haze days |
本研究中可培养细菌与真菌在非灰霾天时的分布状况与其他研究者有一些差异.方治国等(2004)调查国内部分城市后发现,优势菌属为芽孢杆菌属(Bacillus)、葡萄球菌属、微球菌属和微杆菌属(Microbacterium).Pastuszka等(2000)在波兰西里西亚室内环境中检测出微球菌属的频率为100%,占总细菌的36%,葡萄球菌属出现的频率为76%,占总细菌比例的14%.对于真菌的种属,在国内城市中发现优势菌属多为链格孢属(Alternaria)、青霉属、曲霉属和木霉属(Trichoderma),枝孢属(cladosporium)很少(方治国等,2004).国外许多地点真菌优势菌属均为枝孢属,占总数的40%~80%,其它种属依次为青霉属、链格孢属和曲霉属(Rosas et al., 1997; Shelton et al., 2002).出现上述差异的原因可能和采样地点与环境的不同有关.此外,研究表明,空气中微生物分布具有明显的季节性,其中,枝孢属是冬季的优势菌属,链格孢属主要出现在夏季,青霉属是秋季的优势菌属(Singh et al., 1990).而本研究只是在10月份13 d内对空气中可培养微生物进行采集,个别微生物浓度较低,并未达到其检出限的要求.因此,可能造成了目前的微生物气溶胶的种属分布与前人的不同.
尤其需要注意的是,在本次采样期间,相比于非灰霾天,灰霾天会检测出更多的对人体有害的种属.比如,相比于非灰霾天出现的革兰氏阳性菌(葡萄球菌属和微球菌属),灰霾天出现的革兰氏阴性菌(奈瑟氏菌属)可能会对人体造成更大的危害,研究表明,奈瑟氏菌属可能会诱发脑膜炎与淋病(Vermani et al., 2010;Tsai,2011).此外,在灰霾天大幅增长的曲霉属和拟青霉属也被发现与人类的哮喘病、过敏性鼻炎及皮肤感染等疾病有着密切的关系(吴诚华等,1982; Li et al., 1997; Fang et al., 2005).因此,有必要在未来开展灰霾天气条件下空气中微生物与人体健康效应的关系研究.
需要注意的是,本次收集的微生物气溶胶只是空气中可培养的微生物部分,其数量只占微生物气溶胶总量的1%左右.而且,作为一种传统的微生物气溶胶的采集与鉴定方法,可培养法也不能鉴定那些形态被破坏、不可培养的微生物及它们的副产物(Lighthart,2000; Reid et al., 2011).因此,目前的方法会低估空气中微生物气溶胶的浓度及种属分布.另外,目前的采样与统计分析也只是针对在西安市灰霾天气高发的10月份,没有对一年或者更长时间的灰霾天进行研究.尽管有这些局限,但从目前所得到秋季灰霾天可培养微生物气溶胶具有的高浓度、小中位径及高危害种属等结果依然不难看出:相比于非灰霾天,灰霾天气条件下微生物气溶胶对人群健康有更严重的影响.因此,更需要人们去关注灰霾天气与微生物气溶胶相关的健康危害.
4 结论(Conclusions)1)在灰霾天气时,可培养微生物气溶胶浓度不仅远高于非灰霾天时的浓度,也超过了中国科学院所推荐的标准值.这表明在灰霾暴发时,空气中微生物气溶胶浓度会显著升高,给人群健康带来潜在的危害.
2)相比于非灰霾天期间空气中大部分可培养细菌与真菌气溶胶(细菌气溶胶79.7%,真菌气溶胶74.6%)均分布在粗颗粒范围,在灰霾暴发时,细菌气溶胶浓度峰值会向细颗粒方向移动,而真菌气溶胶粒径分布变化甚微.
3)在灰霾天气,空气中优势细菌除了葡萄球菌属(Micrococcus)与微球菌属(Staphylococcus)外,还鉴定出了非灰霾天没有检测出可能会对人体产生危害的奈瑟氏菌属(Neisseria);而真菌除了曲霉属(Aspergillus)检出比例大幅提高外,还出现了非灰霾天未鉴定出的可能引发人体相关疾病的拟青霉属(Paecilomyces)与头孢霉属(Cephalosporium).
| [1] | Adhikari A,Reponen T,Grinshpun S A,et al.2006.Correlation of ambient inhalable bioaerosols with particulate matter and ozone:a two-year study[J].Environmental Pollution,140(1):16-28 |
| [2] | Andersen A A.1958.New sampler for the collection,sizing,and enumeration of viable airborne particles[J].Journal of Bacteriology,76(5):471-484 |
| [3] | Ariya P A,Amyot M.2004.New directions:the role of bioaerosols in atmospheric chemistry and physics[J].Atmospheric Environment,38(8):1231-1232 |
| [4] | Boreson J,Dillner A M,Peccia J.2004.Correlating bioaerosol load with PM2.5 and PM10cf concentrations:a comparison between natural desert and urban-fringe aerosols[J].Atmospheric Environment,38(35):6029-6041 |
| [5] | Cao C,Jiang W J,Wang B Y,et al.2014.Inhalable microorganisms in Beijing's PM2.5 and PM10 pollutants during a severe smog event[J].Environmental Science & Technology,48(3):1499-1507 |
| [6] | Cheng Z,Jiang J K,Fajardo O,et al.2013.Characteristics and health impacts of particulate matter pollution in China (2001-2011)[J].Atmospheric Environment,65:186-194 |
| [7] | de Goffau M C,Yang X M,van Dijl J M,et al.2009.Bacterial pleomorphism and competition in a relative humidity gradient[J].Environmental Microbiology,11(4):809-822 |
| [8] | Degobbi C,Lopes F D T Q S,Carvalho-Oliveira R,et al.2011.Correlation of fungi and endotoxin with PM2.5 and meteorological parameters in atmosphere of Sao Paulo,Brazil[J].Atmospheric Environment,45(13):2277-2283 |
| [9] | 方治国,欧阳志云,胡利锋,等.2004.城市生态系统空气微生物群落研究进展[J].生态学报,24(2):315-322 |
| [10] | Fang Z G,Ouyang Z Y,Hu L F,et al.2005.Culturable airborne fungi in outdoor environments in Beijing,China[J].Science of the Total Environment,350(1/3):47-58 |
| [11] | 方治国,欧阳志云,胡利锋,等.2005.北京市夏季空气真菌生态分布特征[J].环境科学学报,25(2):160-165 |
| [12] | Fang Z G,Ouyang Z Y,Zheng H,et al.2008.Concentration and size distribution of culturable airborne microorganisms in outdoor environments in Beijing,China[J].Aerosol Science and Technology,42(5):325-334 |
| [13] | Garrett M H,Rayment P R,Hooper M A,et al.1998.Indoor airborne fungal spores,house dampness and associations with environmental factors and respiratory health in children[J].Clinical and Experimental Allergy,28:459-467 |
| [14] | Griffin D W,Kellogg C A,Garrison V H,et al.2003.Atmospheric microbiology in the northern Caribbean during African dust events[J].Aerobiologia,19(3):143-157 |
| [15] | Grinn-Gofroń A,Strzelczak A,Wolski T.2011.The relationships between air pollutants,meteorological parameters and concentration of airborne fungal spores[J].Environmental Pollution,159(2):602-608 |
| [16] | Haas D,Galler H,Luxner J,et al.2013.The concentrations of culturable microorganisms in relation to particulate matter in urban air[J].Atmospheric Environment,65:215-222 |
| [17] | Jaenicke R.2005.Abundance of cellular material and proteins in the atmosphere[J].Science,308(5718):73 |
| [18] | Kirk P M,Cannon P F,David J C,et al.(2001).Ainsworth & Bisby's dictionary of the fungi (9th ed)[M].Wallingford:CAB International |
| [19] | Li C S,Hsu L Y.1997.Airborne fungus allergen in association with residential characteristics in atopic and control children in a subtropical region[J].Archives of Environmental Health:An International Journal,52(1):72-79 |
| [20] | Li M F,Qi J H,Zhang H D,et al.2011.Concentration and size distribution of bioaerosols in an outdoor environment in the Qingdao coastal region[J].Science of the Total Environment,409(19):3812-3819 |
| [21] | Li Y P,Yang L W,Meng Q L,et al.2013.Emission characteristics of microbial aerosols in a municipal sewage treatment plant in Xi'an,China[J].Aerosol and Air Quality Research,13(1):343-349 |
| [22] | Li Y P,Wang W,Guo X,et al.2015.Assessment of airborne bacteria and fungi in various university indoor environments:A case study in Chang'an University,China[J].Environmental Engineering Science,32(4):273-283 |
| [23] | Liao C M,Luo W C.2005.Use of temporal/seasonal-and size-dependent bioaerosol data to characterize the contribution of outdoor fungi to residential exposures[J].Science of the Total Environment,347(1/3):78-97 |
| [24] | Lighthart B.2000.Mini-review of the concentration variations found in the alfresco atmospheric bacterial populations[J].Aerobiologia,16(1):7-16 |
| [25] | 刘小宁,张洪政,李庆祥,等.2005.我国大雾的气候特征及变化初步解释[J].应用气象学报,16(2):220-230 |
| [26] | 陆晓波,许建华.2009.一次典型灰霾天气过程及成因分析[J].环境监控与预警,1(1):10-13 |
| [27] | Murray P R,Baron E J,Jorgenson J H,et al.2003.Manual of Clinical Microbiology (8th ed)[M].Washington,DC:ASM Press.1474-1505 |
| [28] | Okada K,Ikegami M,Zaizen Y,et al.2001.The mixture state of individual aerosol particles in the 1997 Indonesian haze episode[J].Journal of Aerosol Science,32(11):1269-1279 |
| [29] | Pastuszka J S,Paw U K T,Lis D O,et al.2000.Bacterial and fungal aerosol in indoor environment in Upper Silesia,Poland[J].Atmospheric Environment,34(22):3833-3842 |
| [30] | 邱雄辉,李彦鹏,牛铁军,等.2012.城市污水处理厂生成的微生物气溶胶的污染特性[J].环境科学,33(7):2191-2196 |
| [31] | Quan J N,Tie X X,Zhang Q,et al.2014.Characteristics of heavy aerosol pollution during the 2012-2013 winter in Beijing,China[J].Atmospheric Environment,88:83-89 |
| [32] | Reid A,Buckley M.2011.The Rare Biosphere:A report from the American Academy of Microbiology[M].Washington,DC:American Academy of Microbiology.1-28 |
| [33] | Rosas I,Calderón C,Martínez L,et al.1997.Indoor and outdoor airborne fungal propagule concentrations in Mexico City[J].Aerobiologia,13(1):23-30 |
| [34] | Shelton B G,Kirkland K H,Flanders W D,et al.2002.Profiles of airborne fungi in buildings and outdoor environments in the United States[J].Applied and Environmental Microbiology,68(4):1743-1753 |
| [35] | Singh A B,Chatterji M,Singh B P,et al.1990.Airborne viable fungi in library:before and after agitation of books[J].Indian Journal of Aerobiology,3:32-38 |
| [36] | Sun Z Q,Mu Y J,Liu Y J,et al.2013.A comparison study on airborne particles during haze days and non-haze days in Beijing[J].Science of the Total Environment,456-457:1-8 |
| [37] | Tan J H,Duan J C,He K B,et al.2009.Chemical characteristics of PM2.5 during a typical haze episode in Guangzhou[J].Journal of Environmental Sciences,21(6):774-781 |
| [38] | Tsai C M.2011.Lipooligosaccharides of Neisseria Species:Similarity Between N.polysaccharea and N.meningitidis LOSs//The Molecular Immunology of Complex Carbohydrates-3[M].US:Springer.705:381-394 |
| [39] | Vermani M,Vijayan V K,Kausar M A,et al.2010.Quantification of airborne Aspergillus allergens:redefining the approach[J].Journal of Asthma,47(7):754-761 |
| [40] | Wang Z,Reponen T,Grinshpun S A,et al.2001.Effect of sampling time and air humidity on the bioefficiency of filter samplers for bioaerosol collection[J].Journal of Aerosol Science,32(5):661-674 |
| [41] | Watson J G.2002.Visibility:science and regulation[J].Journal of the Air & Waste Management Association,52(6):628-713 |
| [42] | 吴诚华,李钟庆,齐祖同,等.1982.相隔24年期间北京上空气挟菌的比较[J].环境科学学报,2(3):255-260 |
| [43] | 吴兑.2005.关于霾与雾的区别和灰霾天气预警的讨论[J].气象,31(4):3-7 |
| [44] | 吴兑,毕雪岩,邓雪娇,等.2006.珠江三角洲大气灰霾导致能见度下降问题研究[J].气象学报,64(4):510-518 |
| [45] | 薛莲,孙杰,林云,等.2011.深圳冬季霾日的大气污染特征[J].环境科学研究,24(5):505-511 |
| [46] | Yadav A K,Kumar K,Kasim A M B H A,et al.2003.Visibility and incidence of respiratory diseases during the 1998 haze episode in Brunei Darussalam[J].Pure and Applied Geophysics,160(1):265-277 |
| [47] | Yamamoto N,Bibby K,Qian J,et al.2012.Particle-size distributions and seasonal diversity of allergenic and pathogenic fungi in outdoor air[J].The ISME Journal,6(10):1801-1811 |
| [48] | Yang F,Chen H,Du J F,et al.2012.Evolution of the mixing state of fine aerosols during haze events in Shanghai[J].Atmospheric Research,104-105:193-201 |
| [49] | Yu X N,Zhu B,Yin Y,et al.2011.A comparative analysis of aerosol properties in dust and haze-fog days in a Chinese urban region[J].Atmospheric Research,99(2):241-247 |
| [50] | Zuraimi M S,Fang L,Tan T K,et al.2009.Airborne fungi in low and high allergic prevalence child care centers[J].Atmospheric Environment,43(15):2391-2400 |
 2016, Vol. 36
2016, Vol. 36


