2. 湖南省环境保护科学研究院, 长沙 410004;
3. 中国科学院南京地理与湖泊研究所, 南京 210008
2. Hunan Research Academy of Environmental Science, Changsha 410004;
3. Nanjing Institute of Geography and Limnoligy, Chinese Academy of Scienses, Nanjing 210008
将有机废弃物在限氧热解条件下转化制备生物炭并输入土壤对于减少温室气体排放、资源化利用农业废弃物和改善耕作土壤肥力质量具有重大意义(Lehmann et al., 2009; Joseph et al., 2010; 陈温福等,2011; 何飞飞等,2014; 李冬等,2014).不但如此,越来越多的研究发现,生物炭在降低土壤和水体中重金属(张阿凤等,2009; 袁金华等,2011;Zhang et al., 2015)、持久性有机污染物(Novak et al., 2010;王萌萌等,2013; Xu et al., 2015)及新兴污染物(Shrestha et al., 2010)的迁移性和生物有效性方面具有巨大潜力.由于生物炭独特的环境与农学意义,前人已对不同有机质来源和热解峰值温度下的生物炭性质与微观结构进行了一系列探索.生物炭通常具有较为发达的孔隙结构和丰富的表面官能团(Chen et al., 2015);一般地,随着热解温度的升高,生物炭产率逐渐下降,碳(C)含量升高而氢(H)和氧(O)比例降低(陈再明等,2013);无机灰分与主要矿质元素(K、Ca、Na、Mg)含量增加(Qian et al., 2013; Guo et al., 2014; Xiao et al., 2014),并且动物粪肥基生物炭中矿质灰分总量和水溶态含量多高于木基生物炭(Singh et al., 2010).同时,热解温度的升高可使生物炭分子结构由低温热解条件下的无定形芳香多聚物逐渐转化为具有乱层结构的无序石墨微晶体(Keiluweit et al., 2010).
另一方面,生物炭在农业土壤改良与环境污染修复中的应用可能同时带来一系列不可忽视的生态与环境风险(Liesch et al., 2010; Kloss et al., 2012; Beesley et al., 2014; Gwenzi et al., 2015).例如,利用松针和麦秆制备的生物炭中多环芳烃(PAHs)含量为1.48~5.48 mg · kg-1(仓龙等,2012),在较高施用量条件下(≥4%,质量分数)易引起土壤PAHs的中度至重度污染.Zheng等(2012)在对含As-Cd-Pb复合污染水稻土的研究中发现,生物炭的加入使水稻茎部Cd、Pb 含量分别降低98%和72%,但土壤孔隙水和茎部As含量则分别升高了14.2倍和3.3倍.另外,多种生物炭的水浸提液对土壤和水生生物表现出不同程度的毒害效应(Lehmann et al., 2011; Buss et al., 2014).例如,暴露于松木生物炭的水提取液可使大型溞(Daphnia magna)活动能力下降20%~25%(Bastos et al., 2014).因此,在将生物炭作为改良剂和修复材料应用于土壤和水环境之前,应对决定生物炭环境行为和环境效应的关键特性进行系统表征分析,以保障生物炭的安全与高效利用.
我国是世界上农业废弃物产出量最大的国家,年排放量达到40多亿t.合理利用各类农业废弃物制备可持续生物炭,是有力控制农业环境污染的重要途径.其中,水稻秸秆是我国产量最高的三大作物秸秆之一;与小麦和玉米等旱地作物秸秆不同,水稻秸秆的直接还田是造成我国稻田温室气体大量排放的一个重要原因.实验表明,与稻草直接还田相比,将稻草秸秆制备成生物炭后返回稻田的3年时间内,CH4产量能够显著降低80%(Redillas et al., 2011).另一方面,我国是遭受外来植物入侵最严重的国家之一,其中,凤眼莲作为世界上危害最严重的水生植物(Invasive Species Specialist Group,ISSG),近年在我国南方多省份水域大面积频繁暴发,对水产养殖、水生生物多样性和水体质量产生了极为严重的影响(刘光涛等,2011; 吴婷婷等,2015).因此,有效管理和控制以凤眼莲为代表的有害入侵植物并实现其资源化利用对于缓解入侵植物对我国生态系统和经济发展的危害具有重要的现实意义.
本研究选择凤眼莲、稻草和剩余污泥作为3类典型生物质前体在限氧条件下于250~550 ℃低温慢热解制备生物炭,并对此3类生物炭的表面形貌、元素组成、矿物形态和一系列关键化学特性进行系统表征与比较分析,根据其具体的物理-化学特性深入探讨此3类典型生物炭在酸化土壤改良、重金属污染修复和水体富营养化控制方面的应用潜力,解析其可能产生的生态风险,以期为这3类生物炭在环境和农业中的安全与高效利用提供依据.
2 材料与方法(Materials and methods) 2.1 生物炭制备本研究分别以凤眼莲(取自于湖南省长沙市梅溪湖)、稻草秸秆(取自湖南省娄底市冷水江某农田)和剩余污泥(取自湖南省长沙市第二污水处理厂)为前体材料,自然条件下风干后粉碎至≤5 mm并置于气氛炉中(开启式真空管式炉,SK-GO6123K).首先向气氛炉中通入N2 20 min,再以6.5 ℃ · min-1升至所选定的峰值温度(250、350、450和550 ℃),于设定温度下热解1h后冷却至室温,冷却过程继续通N2,待样品冷却后研磨过2 mm筛并密封保存.需要说明的是,根据生物炭不同性质指标的测定要求,对生物炭样品还需进行两类酸洗前处理:①为明确灰分对生物炭酸碱度(pH)的影响,减少矿质元素对阳离子交换量(CEC)和表面官能团测定的干扰,需利用HCl对部分生物炭样品进行酸洗处理(见2.2.1节);②为排除矿质灰分对零净电荷点(pHpzc)测定的干扰,需依次利用HCl、HCl-HF混合酸对待测生物炭样品进行灰分脱除处理(见2.2.2节). 经以上热解过程制备的凤眼莲生物炭、污泥生物炭和稻草生物炭,分别记为 W-BCX、S-BCX和R-BCX,其中,W代表凤眼莲(Water Hyacinth),S代表污泥(Sludge),R代表稻草秸秆(Rice Straw),BC代表生物炭(Biochar),X代表热解峰值温度.本实验中,生物炭产率=热解后生物炭质量/热解前生物质质量×100%.
2.2 生物炭性质分析 2.2.1 pH值以固液比1 ∶ 20将原始和经HCl清洗后的生物炭各1 g分别与20 mL超纯水混合,充分搅拌1.5 h后静置1 h,采用pH计(Starter 3C)测定各生物炭pH值.该实验中,部分生物炭样品采用HCl清洗以去除灰分.简要过程如下:将生物炭置于HCl(pH=2)中搅拌反应3 d,再用超纯水反复清洗,直至出水中不含Cl-(采用AgNO3检测),清洗后的样品于80 ℃过夜烘干备用. 2.2.2 pHpzc测定 本实验采用质量滴定法(Yang et al., 2004)测定生物炭pHpzc.简要过程如下: CaCl2溶液(0.005 mol · L-1)煮沸去除CO2,冷却至室温,等分为5份(20 mL · 份-1)并置于离心管中;采用0.5 mol · L-1 HCl 或 NaOH分别将CaCl2溶液pH调整至2、4、6、8、10;向上述CaCl2溶液中分别加入0.06 g清洗后的待测生物炭样品,充分振荡24 h后测定pH;以各反应液终点(pHfinal)和起始pH(pHinitial)分别为纵坐标和横坐标作图,该曲线与pHfinal=pHinitial的交汇点即为pHpzc.该实验中,为充分去除Si及其他金属盐类,首先利用1 mol · L-1 HCl对生物炭进行充分振荡清洗(固液比1 ∶ 20,g/mL),接着采用HCl-HF混合酸(浓度均为1 mol · L-1,固液比1 ∶ 20,g/mL)对生物炭进行进一步清洗,最后采用去离子水彻底清洗并烘干.
2.2.3 CEC测定本实验采用氯化钡-硫酸强迫交换法(张彦雄等,2010)测定生物炭CEC值.为减少生物炭中灰分的干扰,测定前需采用2.2.1节中的清洗方法对生物炭进行充分清洗. 2.2.4 主成分分析 本实验根据美国材料与测试协会标准D1762-84对生物炭中固定碳、灰分和挥发分含量进行测定.
2.2.5 元素分析分别采用碳硫分析仪(CS-600,LECO USA)和氧氮氢分析仪(TCH-600,LECO USA)测定各类型生物炭中C、H、N、O、S 元素含量;在此基础上,计算H/C和O/C比值,以对比表征不同类型生物炭的芳香度和极性.为了测定生物炭中水溶性矿质元素含量,将生物炭与去离子水以固液比1 ∶ 10(g/mL)充分混合振荡1 h后离心,上清液中碱性阳离子(K+、Ca2+、Na+、Mg2+)和重金属(Cd、As、Pb)浓度利用ICP-AES(Baird PS-6,USA)进行检测;主要阴离子利用离子色谱(861 Advanced Compact IC,Metrosep A Supp 5-250,Metrohm USA)进行分析. 2.2.6 表面酸性官能团和碱性官能团 生物炭表面酸性和碱性官能团含量采用Boehm 滴定法(Boehm,1966)进行定量分析.由于生物炭中的碱金属和碳酸盐可能对Boehm滴定产生影响,因此,在滴定开始前,需首先利用HCl(pH=2)充分去除生物炭中的干扰成分,之后利用去离子水对样品进行充分清洗并烘干待用.
2.2.7 傅里叶转换红外线光谱分析(FTIR)生物炭和KBr以1 ∶ 20比例混合压片后利用傅里叶变换红外光谱仪(IRAffinity-1,SHIMADZU/岛津)进行分析检测,光谱扫描范围4000~400 cm-1,分辨率为4 cm-1.采用Origin 9.0对数据进行分析处理. 2.2.8 扫描电镜-能谱分析(SEM-EDX)生物炭样品喷金后利用扫描电子显微镜(JEOLJSM-6360LV)结合X-射线能谱(S1S60S,EDX-GENE)测定3类生物炭的表面形貌与表面元素组成,加速电压为25 kV,扫描时间为80 s.
2.2.9 X射线衍射(XRD)取1 g生物炭放入玻璃样品架的样品槽内,使样品表面与玻璃架表面处于同一平面内,将其置于X射线衍射仪(D/MAX 2500 diffractometer,Rigaku,Japan)中进行分析,电压为 40 kV,电流250 mA,扫描角度(2θ)5°~80°,扫描速度6° · min-1.
3 结果与分析(Results and analysis) 3.1 产率表 1总结了凤眼莲、稻草和污泥3类典型生物质在250~550 ℃条件下热解所制备的生物炭产率、酸洗前后pH值、pHpzc、CEC、主成分和表面酸碱官能团含量.实验结果表明,W-BC、S-BC和R-BC产率分别随热解峰值温度由250 ℃升高至550 ℃降低了35.7%、35.6%和42.0%.与BC250产率相比,350 ℃热解温度下3种生物炭产率的减少幅度最大(表 1),表明3种生物质前体中纤维素和半纤维素等有机大分子的快速解聚、脱水与油气挥发主要发生在350 ℃以下,这与采用玉米秸秆、牛粪、木材、禾草等为前体制备生物炭过程中的产率变化一致(Demirbas,2004; Novak et al., 2009b;Cao et al., 2010;Keiluweit et al., 2010;黄华等,2014;Liu et al., 2014).
3.2 pHpzc、表面酸碱官能团和CEC由表 1可见,250~550 ℃热解条件下3类生物炭 pHpzc值(<2.0~6.3)均低于其pH值(6.6~12.9),表明在大多数土壤与水环境中(pH 5~9),此3类生物炭表面将呈电负性.另外,R-BC的pHpzc值与其表面酸性官能团含量具有显著相关性(r=-0.806),指示生物炭表面酸性官能团是决定其pHpzc值的重要机制.
| 表1 3类生物炭基本性质表征 Table 1 Basic characteristics of the studied biochars pyrolyzed at 250~550 ℃ |
3类生物炭表面丰富的酸性含氧官能团(表 1),如羧基、酚羟基、内酯基、羰基等使其同时具有较高的CEC值.表 1中,W-BC的CEC值在450 ℃时达到最大(22.0 cmol · kg-1);而S-BC和R-BC的CEC值均随着热解温度的升高分别由15.5和33.7 cmol · kg-1(250℃)降低至11.2和30.2 cmol · kg-1(550 ℃).在250~550 ℃热解温度范围内,随热解温度升高,W-BC和R-BC中碱性官能团含量出现不同程度的增加,但污泥生物炭中碱性官能团含量却随温度升高而不断降低,对于这一现象,我们给出以下最有可能的一种推理解释:①凤眼莲和水稻秸秆的化学组成以纤维素和半纤维素为主(宋春财等,2003;邱晔平等,2008),已有研究表明,纤维素与半纤维素开始热解的温度为230~400 ℃(Keiluweit et al., 2010);②污泥的主要化学成分为分子量较低的蛋白质、核酸、多糖、脂、维生素等,这些有机质分子量较小,化学稳定性相对较差,热解起始温度相对较低;③过高和过低的热解温度都不利于表面官能团的形成(郝蓉等,2010),根据本实验结果,推测污泥中有机质裂解达到碱性官能团含量峰值的温度<250 ℃,故当热解温度>250 ℃时,污泥生物炭中碱性官能团由于高温而被不断移除.
3.3 pH值与水溶性矿质元素由表 1可见,随着热解温度由250 ℃提高至550 ℃,W-BC、S-BC和R-BC中灰分含量分别增加了20.3%、29.8%和14.6%;对应地,3类生物炭pH值迅速升高,分别由7.2、6.6和8.4升高至10.5、9.8和12.9.与原始生物炭相比,酸洗对矿质灰分的去除使3类生物炭pH值均出现不同程度的降低,例如,W-BC550、S-BC550和R-BC550酸洗后 pH值分别下降2.2、2.7和3.3.由此可见,灰分是生物炭呈碱性的重要机制,这一点可进一步由表 2和图 3加以证明,即生物炭表面含有丰富的碱性阳离子(K+、Ca2+、Na+、Mg2+)(图 3),并且具有较高的水溶性(表 2),导致3类生物炭具有较强碱性.
| 表2 三类生物炭中的水溶性矿质元素含量 Table 2 Water-soluble mineral elements of the studied biochars |
由表 3可见,热解温度的升高使3类生物炭中H、O、N、S元素含量均逐渐降低,而C元素含量出现不同程度升高(由于污泥灰分中含有较多金属元素,对元素分析仪的测定有一定干扰,因此,S-BC中C 元素含量表现出略微下降),导致3种生物炭O/C、H/C、(O + N)/C比值均逐渐降低,而C/N比值升高.
| 表3 三类生物炭主要组成元素分析 Table 3 Main component analysis of the studied biochars |
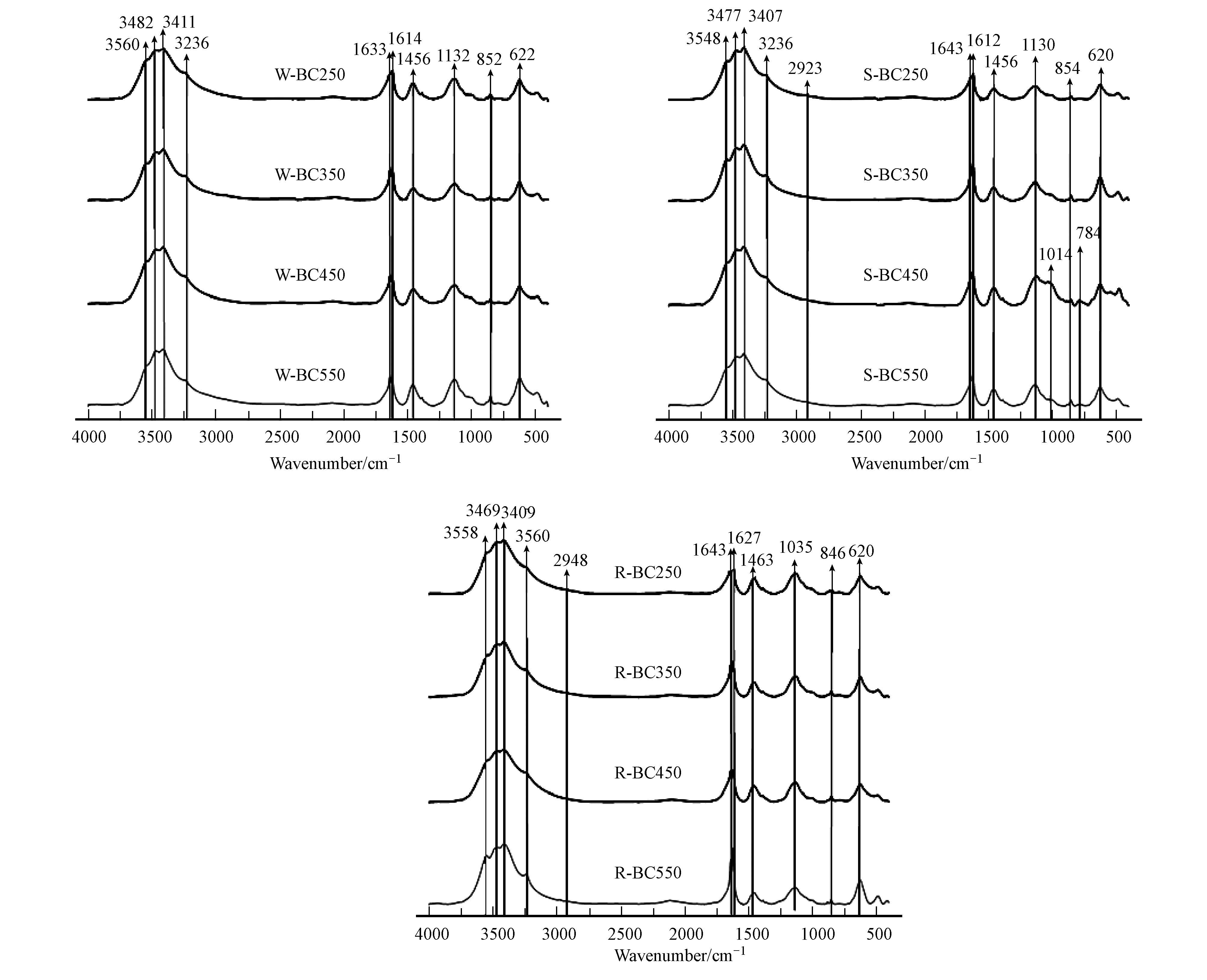
图 1是W-BC、S-BC、R-BC在250~550 ℃时的FTIR图谱,表 4是对3类生物炭红外光谱图中各吸收峰和带谱的分配信息分析.根据图 1,当热解温度升高至350 ℃时,脂肪族C—H2逐渐消失,随着热解温度的继续升高,分配频带的O—H和脂肪C—H伸缩振动明显降低甚至消失,同时,在1132~1130 cm-1处的峰强度逐渐增强,表明开链脂肪族酸酐C—O—C的发育.其中,1628~1618 cm-1和1453~1397 cm-1处峰面积的减小和峰高的降低,标志半纤维素中乙酰酯基的分解去除.
 |
| 图1 三类生物炭的傅里叶红外谱图 Fig.1 Fourier Transform Infrared Spectroscopy of the studied biochars |
| 表4 三类生物炭的红外吸收谱带分析 Table 4 Fourier Transform Infrared Spectroscopy b and assignments analysis of the studied biochars |
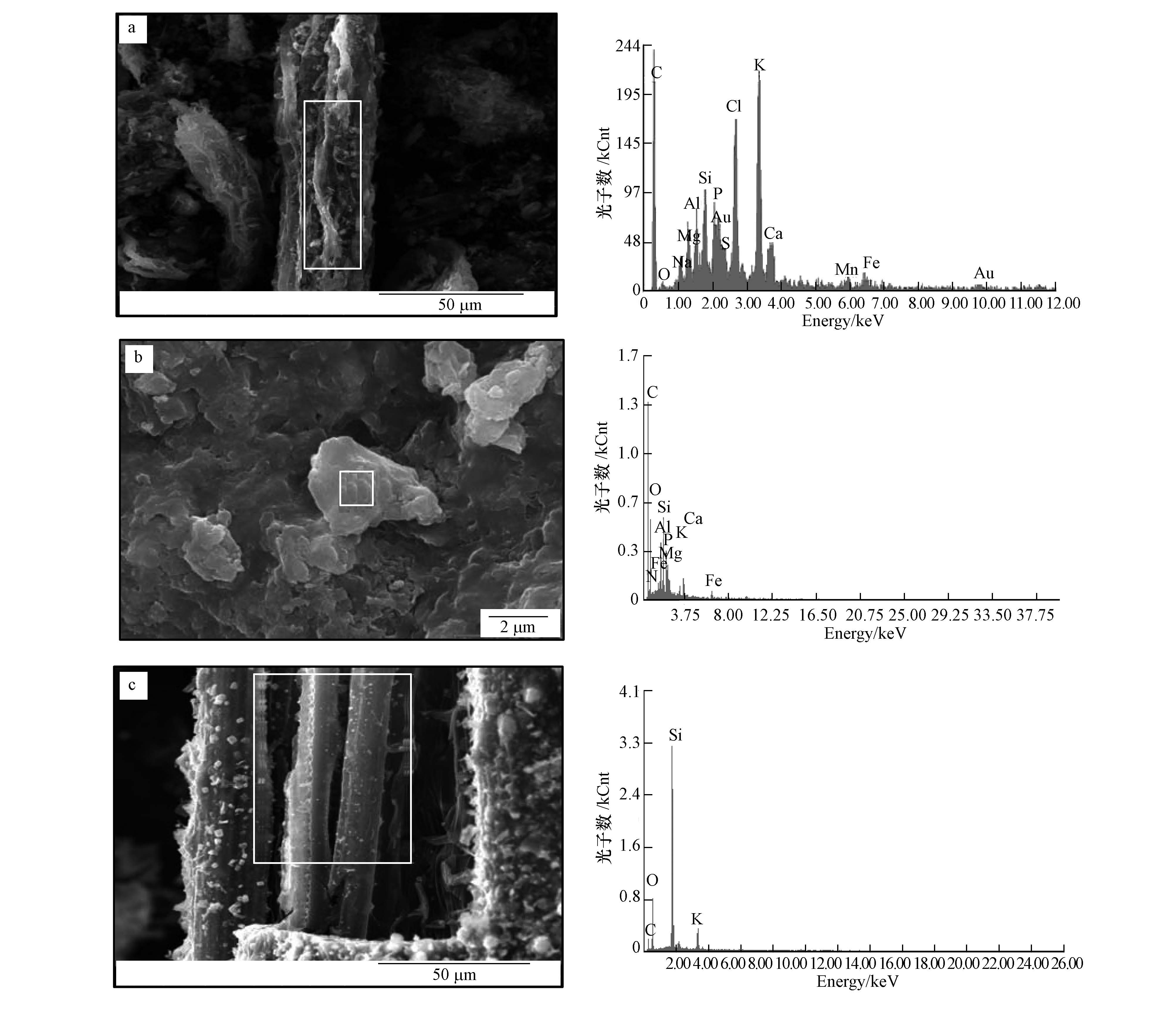
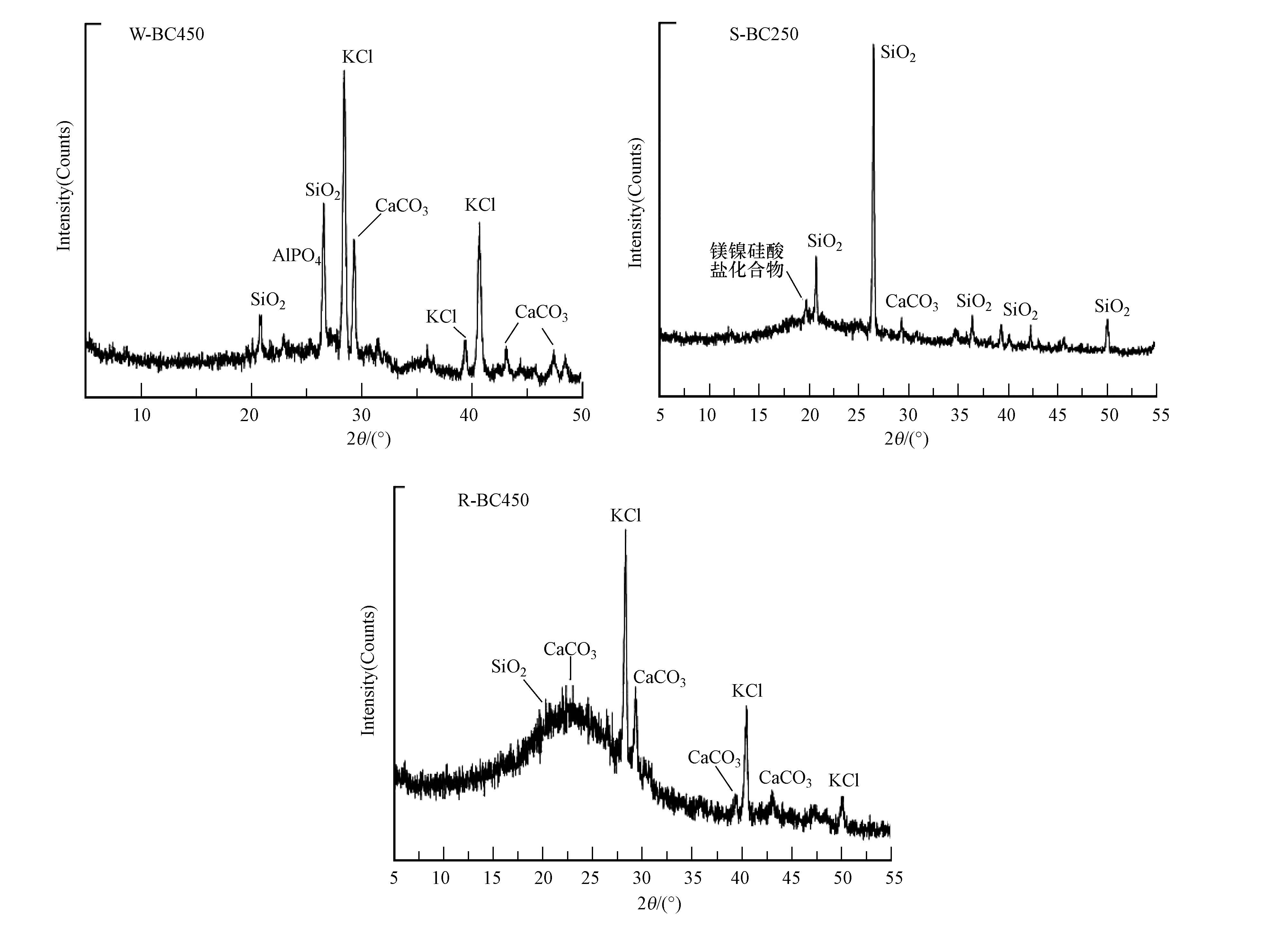
由SEM图像(图 2)可清晰看到,由于凤眼莲和水稻秸秆具有发达的通气组织,使W-BC和R-BC具有典型束筒结构,这与Xiao等(2014)对稻草生物炭微观形貌的表征结果一致.能谱图进一步显示,W-BC450表面含有较为丰富的K、Mg、Ca、P、Cl、Si、Al等矿质元素;而R-BC450表面Si含量最高.XRD分析显示(图 3),W-BC和R-BC表面均含有丰富的SiO2、CaCO3和KCl晶体,与Xiao等(2014)研究一致;而S-BC 表面CaCO3含量较少,几乎不含KCl晶体,但其表面出现了独特的(NixMgy)3(OH)4Si2O5化合物.
 |
| 图2 三类生物炭的表面形貌与元素组成(a.W-BC450,b.S-BC250,c.R-BC450) Fig.2 Surface morphology and element composition of the studied biochars |
实验表明,热解过程使大量灰分积累,导致生物炭呈碱性.不但如此,3种生物炭中的矿质元素均具有较高水溶性(表 2).例如,W-BC450中水溶性K、 Ca、 Na、Mg元素含量分别达到63.34、1.67、6.67和0.77 mg · g-1,远高于我国水稻土中4种元素的平均含量,即0.16、0.04、0.06和0.06 mg · g-1(中国环境监测总站,1990).由于含有较为丰富的水溶性矿质灰分,W-BC450可优先考虑用于增加土壤矿物养分并缓解目前我国大面积耕作土壤呈现出的快速酸化趋势(凌大炯等,2007;Guo et al., 2010),以减少矿物质淋溶,降低铝毒害,同时有利于重金属向其氢氧化物、碳酸盐或磷酸盐等难溶性形态转化(Oguntunde et al., 2004; Novak et al., 2009a; van Zwieten et al., 2010).例如,Lehmann等(2003)研究表明,将生物炭施入土壤,可以显著增加植物生长必需的K、Mg、Ca、Mn、Zn、Cu等主要矿质阳离子的可给态含量.另外,此3类生物炭均含有较为丰富的水溶性P(表 2),其中,R-BC中P含量最高,以R-BC450为例,其P含量高达930 mg · kg-1,而W-BC系列中P含量最低,约为60~180 mg · kg-1.然而,根据贾兴永等(2011)对全国14 个不同地点土样的测定,农田土壤中水溶性P的平均值为1.32 mg · kg-1,其中以祁阳为代表的湖南红壤水溶性P含量仅为0.12 mg · kg-1.由此可见,此3类生物炭,特别是R-BC在提高土壤有效态P含量方面具有突出潜力,可进一步考虑制备缓释性生物炭基P肥.值得指出的是,由于目前缺乏田间长期定位试验数据,生物炭对于我国特别是南方酸雨严重污染区土壤的酸化缓解与肥力改良作用的实际有效性和持久性需要持续跟踪监测.
 |
| 图3 三类生物炭的XRD图谱 Fig.3 XRD patterns of the studied biochars |
另一方面,根据国际生物炭联盟(International Biochar Initiative,IBI)建议的生物炭重金属含量安全阈值(表 5),W-BC350中水溶性As、Cd含量及S-BC350、S-BC550中水溶性Cd含量已超过最大允许值.因此,在利用此3类及其他类型生物炭进行土壤改良或水体修复之前,需要对来自不同环境条件下的各种生物质原料及热解产物进行严格检测和筛选,并且有必要建立生物炭在我国各主要领域安全利用的清洁标准.
| 表5 生物炭重金属含量标准限值(IBI) Table 5 Heavy metal content st and ard limit of biochars(IBI) |
250~550 ℃热解条件下的3类生物炭 pHpzc值均远低于其pH,这意味着此3类生物炭在大多数土壤和水体环境中表面将呈电负性,因此,其对于阳离子的吸附能力将高于对(含氧)阴离子或中性分子的亲和力.本课题组已有实验证实,此3类生物炭对于溶液体系中100~1000 μg · L-1 As(V)(NaH2AsO4)和As(Ⅲ)(NaAsO2)的吸附能力均低于10%.
本实验中,生物炭表面酸性官能团数量与CEC值的变化规律基本一致(表 1),表明酸性含氧官能团是生物炭表面阳离子吸附位点的主要贡献因素(Chen et al., 2015);而热解温度的升高使3类生物炭的O/C元素比值逐渐下降(表 4),指示其含氧酸性官能团不断被移除,这是造成生物炭CEC值降低的重要原因(Guo et al., 2007; Uchimiya et al., 2010;戴静等,2013).相较于大多数土壤,此3类生物炭较高的CEC值(表 6)一方面有利于增加土壤对矿质营养元素的持留量和持留时间,降低淋溶损失,提高养分利用效率,从而减少外源化肥施用量,并缓解水体富营养化(Rondon et al., 2007;陈红霞等,2011).另一方面,具有较高表面酸性含氧官能团和CEC值的生物炭可通过与重金属阳离子形成配合物降低土壤重金属生物有效性(Cao et al., 2009;安增莉等,2011).例如,本课题组已有实验表明,WBC450能够在1h内对1~50 mg · L-1 Cd实现100%吸附,而生物炭表面羧基、羰基和羟基等含氧官能团对Cd2+/Cd(OH)+的络合反应其发生的重要内在机制.但利用此3类生物炭进行土壤重金属污染修复同时存在两点潜在缺陷:①在我国南方酸雨污染严重地区,生物炭钝化土壤重金属阳离子的稳定性和长期有效性尚不明确.本课题组已有实验表明,当酸雨pH值降低至2.5时,W-BC450处理使稻田土壤淋溶液中Pb、Cd浓度显著增加,这可能是由于酸雨使生物炭所含重金属发生溶出而导致;②尽管此3类生物炭表面含有一定量的碱性官能团,但其较低的pHpzc导致其表面在大部分自然环境条件下将呈电负性,因此,其对As、Cr等重金属含氧阴离子或中性分子的吸附能力将大大减弱,并可能进一步使土壤As、Cr的水溶性和迁移性增加,威胁农产品安全.本课题组已有实验显示,当W-BC450和R-BC450在红壤性稻田土壤中施用比例达到5%(质量分数)时,土壤酸雨淋溶液中As浓度显著高于对照样.类似地,Beesley等(2014)在对As-Cu-Pb-Cd复合污染的矿区土壤研究中发现,尽管生物炭的加入能够显著降低土壤中水溶态Cd、Pb、Cu浓度,但土壤孔隙水中As浓度则由起始<200 μg · L-1上升至~1000 μg · L-1.
| 表6 三类生物炭与土壤和活性炭CEC值及官能团含量对比 Table 6 Comparison of CEC and functional groups of the studied biochars with soils and active carbon |
限氧裂解过程使生物质中易水解或易被微生物降解的不饱和C和长链脂肪C逐渐转变为饱和度大的相对稳定的芳香C形态(Singh et al., 2010;陈静文等,2014).3种生物炭中O/C、H/C、(O+N)/C比值均随温度升高而逐渐降低(表 4),表明生物炭的亲水性和极性逐渐减弱,同时芳香度增大,说明其从“软碳质”逐渐过渡到了“硬碳质”(Chen et al., 2008; 陈宝梁等,2008).Lehmann等(2006)研究表明,土壤C/N比值越大,微生物固氮能力越强.因此,具有较高C/N比值的生物炭可通过提供充分的代谢能量而使土壤微生物对氮素产生较为强烈的生物固定,从而可能导致N的作物可利用性降低,造成农作物缺N,进而对作物产量产生不同程度的抑制效应(Rondon et al., 2007).与S-BC(本实验)和铜藻基水热炭(曾淦宁等,2014)的C/N值(分别为6.9~8.9和13.2~20.5)相比,W-BC和R-BC具有相对较高的C/N比值(分别为16.8~39.9和81.3~237.5),因此,在利用W-BC和R-BC进行土壤质量改良时,尤其需要注意同时施用N肥.
根据图 1,当热解温度升高至350 ℃时,脂肪族C—H2逐渐消失,说明在这一温度段,脂肪烃逐渐解聚.例如,当热解温度升高至350 ℃时,图 1 W-BC带谱中1300 cm-1段吸收峰强度出现明显下降,标志着热解过程中多糖物质的大量分解,这是产生羧基和羰基基团的重要反应机制(Sharma et al., 2004).随着热解温度的升高,O—H伸缩振动和脂肪C—H伸缩振动明显降低甚至消失,表明热解峰值温度的提高使不稳定脂肪族化合物不断减少,该过程伴随着木质素和纤维素的脱水、脱甲基和脱甲氧基反应及芳香结构的形成.
对此3类生物炭在不同热解温度条件下的元素组成和红外光谱分析结果表明,生物质的限氧热解是富碳、去极性官能团的过程,其发生程度对于生物炭在土壤中的氧化反应性具有决定性作用:当热解温度较低时,木质素和纤维素等有机大分子发生不完全解聚,芳环化程度较低,同时H/N/O等杂环原子使C原子之间保持较大间距;而热解温度的升高有利于解聚、挥发、脱水和脱羧等反应的持续进行(Keiluweit et al., 2010; Spokas,2010),导致杂环原子不断被去除,烷基C逐步转化形成芳香C并逐渐缩合产生类似于石墨层片的稳定C分子结构,其生物化学稳定性随之升高.因此,当生物炭的制备以固定C素、减少温室气体排放为主要目的时,可在考虑制备成本的基础上,采用较高的热解温度.但值得注意的是,高温热解易导致生物炭中多环芳烃含量的上升,从而使生物炭成为潜在的环境污染源.
4.4 SEM-EDX与XRD湿生植物(凤眼莲和水稻)发达的通气组织使W-BC和R-BC的孔隙结构较S-BC更加发达(图 2),这一结论可进一步由Xiao等(2014)所报道的研究结果进行证实.因此,在改善土壤通气性方面,前两类生物炭可能具有更大优势.特别地,水稻作为喜Si作物(Liang et al., 2006;吴季荣等,2010),在其生命周期内对元素Si的大量吸收和积累导致R-BC450中富含Si,这与Xiao等(2014)研究结果相吻合,那么,R-BC向土壤中的加入是否有利于增加作物可利用态Si含量?能否进一步利用R-BC制备经济高效的生物炭基Si肥?这个问题值得在未来研究中重点考虑.另外,值得注意的是,W-BC450 表面P主要以AlPO4 等晶体形式存在,导致P水溶性较低(表 2),因此,这一特点有利于降低此类生物炭应用于水污染修复时引起水体富营养化的风险.
5 结论(Conclusions)1)利用我国典型水生入侵植物凤眼莲、农业废弃物稻草秸秆和市政污水厂大量产生的剩余污泥为前体在250~550 ℃制备的生物炭(W-BC、R-BC、S-BC),发现其表面化学特性、元素组成和矿物成分具有明显差异,这主要由生物质前体化学成分、组织结构及热解温度所决定.
2)随着热解温度升高,3类生物炭产率逐渐降低,而矿质灰分则不断积累使生物炭碱性增强.其中,W-BC450中水溶性K、Ca、Na、Mg含量最为丰富,分别达到中国土壤背景值的395.9、41.8、111.2和12.8倍.因此,凤眼莲生物炭可优先考虑用于减缓耕作土壤酸化,提高土壤矿质养分含量;但此3类生物炭均不适用于盐碱地,否则会加重土壤盐碱化,影响养分的生物有效性.
3)R-BC的CEC值(30.2~33.7 cmol · kg-1)和表面酸性官能团含量(0.40~1.19 mmol · kg-1)在此3类生物炭中最为突出,其CEC值约为我国红壤的3.5倍,且pHpzc<3.5,因此,稻草生物炭在提高耕作土壤矿质元素持留性、降低养分淋溶损失方面具有较大应用潜力.
4)基于湿生植物凤眼莲和水稻秸秆而制备的W-B和R-BC具有发达的孔隙结构,这对于改善土壤通气性具有重要应用价值.另外,W-BC450中P主要以AlPO4晶体形态存在,水溶性P含量最低,因此,W-BC450应用于水污染修复时可避免由于过量P溶出而产生水体富营养化问题.
5)本实验中部分样品(W-BC350、S-BC350/550)所含水溶性Cd、As浓度高于IBI建议的安全阈值.因此,为确保生物炭在各类环境介质中的安全利用,应对不同来源的有机质前体和热解产物进行严格检测和筛选,以避免其中重金属和多环芳烃等潜在污染物可能造成的生态安全问题.特别需要强调的是,利用生物炭针对农业土壤进行的改良工程应建立在系统分析土壤理化特性和肥力特征基础上,由实验室和温室规模实验逐步拓展至田间微区试验和大田试验,并进行长期跟踪监测,以不断优化生物炭制备和应用参数,减少其可能带来的各类环境和农业风险.
| [1] | 安增莉,侯艳伟,蔡超,等. 2011.水稻秸秆生物炭对Pb(Ⅱ)的吸附特性[J].环境化学,30(11):1851-1857 |
| [2] | Bastos A C,Prodana M,Abrantes N,et al.2014.Potential risk of biochar-amended soil to aquatic systems:an evaluation based on aquatic bioassays[J].Ecotoxicology,23(9):1784-1793 |
| [3] | Beesley L,Inneh S O,Norton J G,et al.2014.Assessing the influence of compost and biochar amendments on the mobility and toxicity of metals and arsenic in a naturally contaminated mine soil[J].Environmental Pollution,186:195-202 |
| [4] | Boehm H P.1966.Chemical identification of surface groups[J].Advances in Catalysis,16:179-274 |
| [5] | Buss W,Mašek O.2014.Mobile organic compounds in biochar-A potential source of contamination-phytotoxic effects on cress seed (Lepidium sativum) germination[J].Journal of Environmental Management,137:111-119 |
| [6] | 仓龙,向东,汪玉,等.2012.生物质炭中的污染物含量及其田间施用的环境风险预测[J].农业工程学报,28(15):163-167 |
| [7] | Cao X D,Ma L N,Gao B,et al.2009.Dairy-manure derived biochar effectively sorbs lead and atrazine[J].Environmental Science & Technology,43(9):3285-3291 |
| [8] | Cao X D,Harris W.2010.Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J].Bioresource Technology,101(14):5222-5228 |
| [9] | Chen B L,Zhou D D,Zhu L Z.2008.Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J].Environmental Science & Technology,42(14):5137-5143 |
| [10] | 陈宝梁,周丹丹,朱利中,等.2008.生物碳质吸附剂对水中有机污染物的吸附作用及机理[J].中国科学B辑:化学,38(6):530-537 |
| [11] | 陈红霞,杜章留,郭伟,等.2011.施用生物炭对华北平原农田土壤容重、阳离子交换量和颗粒有机质含量的影响[J].应用生态学报,22(11):2930-2934 |
| [12] | 陈静文,张迪,吴敏,等.2014.两类生物炭的元素组分分析及其热稳定性[J].环境化学,33(3):417-422 |
| [13] | 陈温福,张伟明,孟军,等.2011.生物炭应用技术研究[J].中国工程科学,13(2):83-89 |
| [14] | 陈学泽,韩京龙,江頭和彦.2005.湖南省丘陵区森林红壤化学性质研究[J].西北农林科技大学学报(自然科学版),33(12):85-88 |
| [15] | 陈再明,陈宝梁,周丹丹.2013.水稻秸秆生物碳的结构特征及其对有机污染物的吸附性能[J].环境科学学报,33(1):9-19 |
| [16] | Chen Z M,Xiao X,Chen B L,et al.2015.Quantification of chemical states,dissociation constants and contents of oxygen-containing groups on the surface of biochars produced at different temperatures[J].Environmental Science & Technology,49(1):309-317 |
| [17] | 程先富,朱华,郝李霞,等.2008.丘陵山区土壤阳离子交换量(CEC)的空间分布预测[J].应用与环境生物学报,14(4):484-487 |
| [18] | 戴静,刘阳生.2013.生物炭的性质及其在土壤环境中应用的研究进展[J].土壤通报,44(6):1520-1525 |
| [19] | Demirbas A.2004.Effects of temperature and particle size on bio-char yield from pyrolysis of agricultural residues[J].Journal of Analytical and Applied Pyrolysis,72(2):243-248 |
| [20] | Guo J H,Liu X J,Zhang Y,et al.2010.Significant acidification in major chinese croplands[J].Science,327(5968):1008-1010 |
| [21] | Guo J H,Chen B L.2014.Insights on the molecular mechanism for the recalcitrance of biochars:interactive effects of carbon and silicon components[J].Environmental Science & Technology,48(16):9103-9112 |
| [22] | Guo Y P,Rockstraw D A.2007.Activated carbons prepared from rice hull by one-step phosphoric acid activation[J].Microporous and Mesoporous Materials,100(1/3):12-19 |
| [23] | Gwenzi W,Chaukura N,Mukome F N D,et al.2015.Biochar production and applications in sub-Saharan Africa:Opportunities,constraints,risks and uncertainties[J].Journal of Environmental Management,150:250-261 |
| [24] | 郝蓉,彭少麟,宋艳暾,等.2010.不同温度对黑碳表面官能团的影响[J].生态环境学报,19(3):528-531 |
| [25] | 何飞飞,梁运姗,吴爱平,等.2014.不同生物炭用量对酸性菜地土硝化作用的影响[J].环境科学学报,34(9):2376-2383 |
| [26] | 何腾兵,董玲玲,刘元生,等.2006.贵阳市乌当区不同母质发育的土壤理化性质和重金属含量差异研究[J].水土保持学报,20(6):157-162 |
| [27] | 黄华,王雅雄,唐景春,等.2014.不同烧制温度下玉米秸秆生物炭的性质及对萘的吸附性能[J].环境科学,35(5):1884-1890 |
| [28] | Inyang M,Gao B,Pullammanappallil P,et al.2010.Biochar from anaerobically digested sugarcane bagasse[J].Bioresource Technology,101(22):8868-8872 |
| [29] | 贾兴永,李菊梅.2011.土壤磷有效性及其与土壤性质关系的研究[J].中国土壤与肥料,(6):76-82 |
| [30] | Joseph S D,Camps-Arbestain M,Lin Y,et al.2010.An investigation into the reactions of biochar in soil[J].Soil Research,48(7):501-515 |
| [31] | Keiluweit M,Nico P S,Johnson M G,et al.2010.Dynamic molecular structure of plant biomass-derived black carbon (biochar)[J].Environmental Science & Technology,44(4):1247-1253 |
| [32] | Kloss S,Zehetner F,Dellantonio A,et al.2012.Characterization of slow pyrolysis biochars:effects of feedstocks and pyrolysis temperature on biochar properties[J].Journal of Environmental Quality,41(4):990-1000 |
| [33] | Lehmann J,da Silva J P Jr,Steiner C,et al.2003.Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin:fertilizer,manure and charcoal amendments[J].Plant and Soil,249(2):343-357 |
| [34] | Lehmann J,Gaunt J,Rondon M.2006.Bio-char sequestration in terrestrial ecosystems-A review[J].Mitigation and Adaptation Strategies for Global Change,11(2):395-419 |
| [35] | Lehmann J,Joseph S.2009.Biochar for Environmental Management:Science and Technology[M].England:Earthscan Publications.251-270 |
| [36] | Lehmann J,Rillig M C,Thies J,et al.2011.Biochar effects on soil biota-A review[J].Soil Biology and Biochemistry,43(9):1812-1836 |
| [37] | 李冬,陈蕾,夏阳,等.2014.生物炭改良剂对小白菜生长及低质土壤氮磷利用的影响[J].环境科学学报,34(9):2384-2391 |
| [38] | Liang Y C,Hua H X,Zhu Y G,et al.2006.Importance of plant species and external silicon concentration to active silicon uptake and transport[J].New Phytologist,172(1):63-72 |
| [39] | Liesch M A,Weyers L S,Gaskin W J,et al.2010.Impact of two different biochars on earthworm growth and survival[J].Annals of Environmental Science,4:1-9 |
| [40] | 凌大炯,章家恩,黄倩春,等.2007.模拟酸雨对砖红壤盐基离子迁移和释放的影响[J].土壤学报,44(3):444-450 |
| [41] | 刘光涛,周长芳,孙利芳,等.2011.凤眼莲化感物质对铜绿微囊藻、斜生栅藻生长及细胞数相对比例的影响[J].环境科学学报,31(10):2303-2311 |
| [42] | 刘世全,蒲玉琳,张世熔,等.2004.西藏土壤阳离子交换量的空间变化和影响因素研究[J].水土保持学报,18(5):1-5 |
| [43] | 刘守新,陈曦,张显权.2008.活性炭孔结构和表面化学性质对吸附硝基苯的影响[J].环境科学,29(5):1192-1196 |
| [44] | Liu X,Li Z F,Zhang Y Z,et al.2014.Characterization of human manure-derived biochar and energy-balance analysis of slow pyrolysis process[J].Waste Management,34(9):1619-1626 |
| [45] | Novak J M,Busscher W J,Laird D L,et al.2009a.Impact of biochar amendment on fertility of a southeastern coastal plain soil[J].Soil Science,174(2):105-112 |
| [46] | Novak J M,Lima I,Xing B S,et al.2009b.Characterization of designer biochar produced at different temperatures and their effects on a loamy sand[J].Annals of Environmental Science,3:195-206 |
| [47] | Novak J M,Busscher W J,Watts D W,et al.2010.Short-term CO2 mineralization after additions of biochar and switchgrass to a Typic Kandiudult[J].Geoderma,154(3/4):281-288 |
| [48] | Oguntunde P G,Fosu M,Ajayi A E,et al.2004.Effects of charcoal production on maize yield,chemical properties and texture of soil[J].Biology and Fertility of Soils,39(4):295-299 |
| [49] | Qian L B,Chen B L.2013.Dual role of biochars as adsorbents for aluminum:the effects of oxygen-containing organic components and the scattering of silicate particles[J].Environmental Science & Technology,47(15):8759-8768 |
| [50] | 邱晔平,杨晓瑞,朱建良,等.2008.降解水葫芦中纤维素的优良菌株的筛选[J].纤维素科学与技术,16(2):53-58 |
| [51] | Redillas M C F R,Jeong J S,Srtasser R J,et al.2011.JIP analysis on rice (Oryza sativa cv Nipponbare) grown under limited nitrogen conditions[J].Applied Biological Chemistry,54(5):827-832 |
| [52] | Rondon M A,Lehmann J,Ramírez J,et al.2007.Biological nitrogen fixation by common beans (Phaseolus vulgaris L.) increases with bio-char additions[J].Journal of the Korean Society for Biology and Fertility of Soils,43(6):699-708 |
| [53] | Sharma R K,Wooten J B,Baliga V L,et al.2004.Characterization of chars from pyrolysis of lignin[J].Fuel,83(11/12):1469-1482 |
| [54] | Shrestha G,Traina S J,Swanston C W.2010.Black carbon's properties and role in the environment:a comprehensive review[J].Sustainability,2(1):294-320 |
| [55] | Singh B,Singh B P,Cowie A L.2010.Characterisation and evaluation of biochars for their application as a soil amendment[J].Australian Journal of Soil Research,48(7):516-525 |
| [56] | 宋春财,胡浩权.2003.秸秆及其主要组分的催化热解及动力学研究[J].煤炭转化,26(3):91-97 |
| [57] | Spokas K A.2010.Review of the stability of biochar in soils:predictability of O:C molar ratios[J].Carbon Management,1(2):289-303 |
| [58] | Uchimiya M,Lima I M,Klasson K T,et al.2010.Immobilization of heavy metal ions (CuⅡ,CdⅡ,NiⅡ,and PbⅡ) by broiler litter-derived biochars in water and soil[J].Agricultural and Food Chemistry,58(9):5538-5544 |
| [59] | van Zwieten L,Kimber S,Morris S,et al.2010.Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J].Plant and Soil,327(1/2):235-246 |
| [60] | 王萌萌,周启星.2013.生物炭的土壤环境效应及其机制研究[J].环境化学,32(5):768-780 |
| [61] | 翁诗甫.2005.傅里叶变换红外光谱仪[M].北京:化学工业出版社 |
| [62] | 吴季荣,龚俊义.2010.水稻硅营养的研究进展[J].中国稻米,16(3):5-8 |
| [63] | 吴婷婷,刘国锋,韩士群,等.2015.蓝藻水华聚集对水葫芦生理生态的影响[J].环境科学,36(1):114-120 |
| [64] | Xiao X,Chen B L,Zhu L Z.2014.Transformation,morphology,and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures[J].Environmental Science & Technology,48(6):3411-3419 |
| [65] | Xu W Q,Pignatello J J,Mitch A W.2015.Reduction of nitroaromatics sorbed to black carbon by direct reaction with sorbed sulfides[J].Environmental Science & Technology,49(6):3419-3426 |
| [66] | 杨奇勇,杨劲松.2010.基于GIS和GS+的耕地土壤阳离子交换量的序贯高斯模拟[J].中国农业科学,43(18):3759-3766 |
| [67] | Yang Y N,Chun Y,Sheng G Y,et al.2004.pH-dependence of pesticide adsorption by wheat-residue-derived black carbon[J].Langmuir,20(16):6736-6741 |
| [68] | 袁金华,徐仁扣.2011.生物质炭的性质及其对土壤环境功能影响的研究进展[J].生态环境学报,20(4):779-785 |
| [69] | 曾淦宁,伍希,艾宁,等.2014.铜藻基生物炭的水热制备及性能表征[J].环境科学学报,34(2):392-397 |
| [70] | 张阿凤,潘根兴,李恋卿.2009.生物黑炭及其增汇减排与改良土壤意义[J].农业环境科学学报,28(12):2459-2463 |
| [71] | Zhang F,Wang X,Yin D X,et al.2015.Efficiency and mechanisms of Cd removal from aqueous solution by biochar derived from water hyacinth (Eichornia crassipes)[J].Journal of Environmental Management,153:68-73 |
| [72] | 张彦雄,李丹,张佐玉,等.2010.两种土壤阳离子交换量测定方法的比较[J].贵州林业科技,38(2):45-49 |
| [73] | Zheng R L,Cai C,Liang J H,et al.2012.The effects of biochars from rice residue on the formation of iron plaque and the accumulation of Cd,Zn,Pb,As in rice (Oryza sativa L.) seedlings[J].Chemosphere,89(7):856-862 |
| [74] | 中国环境监测总站.1990.中国土壤元素背景值[M].北京:中国环境科学出版社.148-163 |
 2015, Vol. 35
2015, Vol. 35


