2. 福建师范大学环境科学与工程学院, 福州 350007;
3. 福建师范大学地理研究所, 福州 350007;
4. 湿润亚热带生态-地理过程教育部重点实验室, 福州 350007;
5. 福建师范大学湿地研究中心, 福州 350007
2. School of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007;
3. Institute of Geography, Fujian Normal University, Fuzhou 350007;
4. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007;
5. Research Centre of Wetlands in Subtropical Region, Fujian Normal University, Fuzhou 350007
土壤/沉积物反硝化作用是湿地实现脱氮的主要过程,同时因反硝化过程中间产物N2O的产生,其在湿地氮素生物地球化学循环中的作用及环境效应引起了广泛关注(Kana et al., 1998;Seitzinger et al., 2006; Hou et al., 2007; Baggs,2008; Jordan et al., 2011;孙文广等,2014).河口区受河流径流和海洋潮汐作用的共同影响,距海远近差异形成不同盐度的潮汐湿地,盐度是河口潮汐湿地的重要环境因子.然而,盐度变化对河口湿地土壤氮转化过程的影响较为复杂,虽然目前一些研究已表明河口湿地沉积物反硝化作用随盐度的增加而减弱(Seo et al., 2008;Craft et al., 2009;Santoro,2010;娄焕杰等,2013),然而Fear等(2005)对美国Eutrophic Neuse河口区盐度梯度上沉积物的研究表明,反硝化速率随盐度不同而发生的变化并不显著.特别地,目前鲜见关于分布在河口区淡水-微咸水区间内盐度值较低且盐度变化幅度较窄的潮汐沼泽湿地沉积物反硝化作用的比较研究.目前用于测定湿地沉积物反硝化速率较成熟的方法包括15N同位素技术(Giblin et al., 2010)、乙炔抑制法(Scaroni et al., 2011)和N2产生测定法(Burgin et al., 2010).虽然乙炔抑制法可能会低估反硝化作用,主要是因为乙炔在低NO3-浓度条件下不能完全抑制反硝化,并且可抑制硝化作用进而影响硝化反硝化耦合作用(Goffman et al., 2006).但是,乙炔抑制法具有快速、灵敏、重现性好、操作简便、费用较低等优点(Nielsen et al., 1996; 王东启等,2007),特别是原状土柱方法在操作过程中对沉积物扰动小,十分适合自然状态下的湿地沉积物反硝化速率的测定.
基于此,本研究采用结合原状土柱的乙炔抑制法,对分布在闽江河口区道庆洲上的短叶茳芏(Cyperus malaccensis)淡水沼泽湿地及分布在鳝鱼滩上的短叶茳芏微咸水沼泽湿地沉积物反硝化速率进行测定,以期探讨在淡水-微咸水范围内,河口潮汐沼泽湿地沉积物反硝化作用的变化,以及盐度和其他环境因子对其的影响,旨在进一步认识亚热带河口沼泽湿地土壤氮生物地球化学循环过程.
2 材料与方法(Materials and methods) 2.1 研究区和采样点概况闽江河口区位于中亚热带与南亚热带海洋性季风气候的过渡区,气候暖热湿润,年均温19.85 ℃,年降水量1905.73 mm.该区天然湿地沿河流两岸高低河漫滩呈带状分布,典型土著植物短叶茳芏广布(刘剑秋等,2005).闽江口受潮汐作用影响显著,潮汐特征表现为口外正规半日潮,口内非正规半日浅海潮,水体盐度随潮汐变化而呈周期性变化,并表现出从入海口到向陆方向盐-淡水更替的特征(王维奇等,2012).本研究以闽江河口区道庆洲西南部分布的潮汐淡水短叶茳芏湿地(盐度:0.20‰±0.02‰),以及鳝鱼滩中西部高潮滩分布的潮汐微咸水短叶茳芏湿地(盐度:3.79‰±1.35‰)为试验样地,分别设置3 m×3 m的试验小区,地理坐标分别为25°57′21.4″N、119°24′25.6″E和26°01′48.0″ N、119°37′35.3″E(图 1).
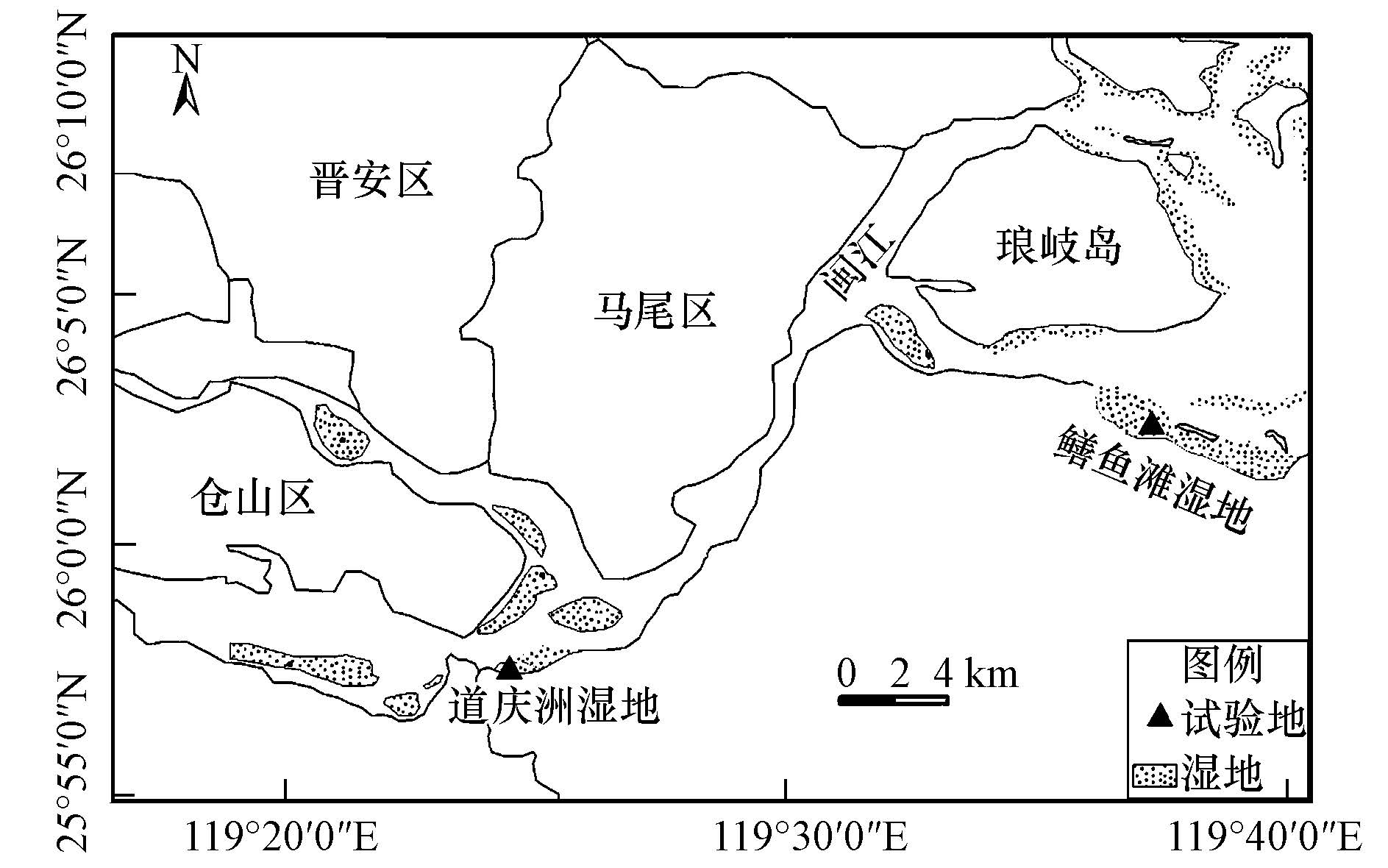 |
| 图1 试验地示意图 Fig.1 Location of experimental field in two wetl and s in the Min River estuary |
分别在2013年11月,以及2014年的2、5、8月(代表秋、冬、春、夏4个季节)的1个小潮日,在试验小区内设间距约为1.5 m的4个采样点(作为4个重复),使用内径5 cm、长30 cm的PVC管采集0~15 cm深的原状土柱,每个采样点0.25 m×0.25 m范围内取3个土柱,两个试验小区共24个土柱,采样过程中尽量避免对沉积物表层的扰动,采样完成后用塑料塞将其底部密封.用塑料桶采集试验小区附近上覆水用于培养实验,每个试验地取水约15 L.
2.2.2 室内培养、N2O浓度测定及计算土柱样运回实验室后,向沉积物上方小心注入所采上覆水,平衡2 h后将每个采样点的3个土柱样作为一组进行3种处理.第1种处理作为0时刻初始样,开始培养时迅速抽取沉积物上方的水样注入预先装有0.3 mL 38%甲醛溶液的60 mL顶空瓶中,盖紧避光保存.第2种处理加入乙炔饱和水(用所采上覆水通乙炔制取),用于测定反硝化速率.用乙炔饱和水取代10%体积的上覆水,并用微量注射器沿沉积物的垂直方向每隔2 cm,从4个方向透过培养管壁(预先钻1 mm孔并填充硅橡胶)每孔注入0.2 mL乙炔饱和水,完成后迅速用保鲜膜密封.第3种处理作为不加任何抑制剂的参照样,用于测定沉积物-水界面N2O交换通量,平衡结束后迅速用保鲜膜密封.为了保证培养管内水相各要素的均匀性和界面间的物质交换并且不产生大的扰动,将后2种处理的土柱样置于回旋振荡器上轻微振荡,避光培养8 h,培养结束后迅速抽取沉积物上方的水样注入预先装有0.3 mL 38%甲醛溶液的60 mL顶空瓶中,盖紧避光保存(Kim et al., 1997;杨晶等,2011).培养0 h和8 h采用便携式电导计(2265FS,USA)和盐度计(EUTECH Instruments SALT 6+,USA)分别测定抽出上覆水的温度和盐度.
水样中N2O浓度采用静态顶空-气相色谱法测定(Walter et al., 2005).先用气密性注射器向装满所采水样的60 mL顶空瓶内注入30 mL 纯N2(>99.99%)置换出30 mL水以形成瓶内顶空,在室温下将顶空瓶剧烈振荡30 min,使瓶内的气液两相达到平衡;然后用气密性注射器抽取顶空气体约15 mL,装入50 mL铝箔气样袋(大连德霖气体包装有限公司生产),采用气相色谱仪(Shimadzu GC—2014,Japan)测定顶空气中N2O浓度.参考Weiss等(1980)和徐继荣等(2005)的海水中溶解性N2O浓度计算方法,根据平衡温度、水样盐度和顶空气中N2O浓度计算出水样中N2O浓度,公式如下:
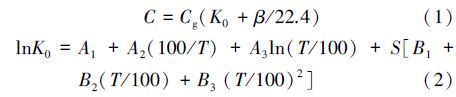
反硝化速率利用乙炔抑制样与0时刻初始样水柱中N2O浓度的差值计算得出,沉积物-水界面N2O交换通量利用参照样与0时刻初始样水柱中N2O浓度的差值计算得到,计算公式如下(杨晶等,2011):
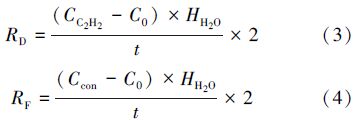
与采集培养实验土柱同步,在每个柱状土样采样点附近取0~15 cm深的土样(每试验地4个重复),装入自封袋中密封.将采回的鲜土样品自然风干后,挑去残体根系,研磨过2 mm筛、0.154 mm筛,分别放入自封袋中密封,待实验备用.土壤电导率和pH值在水土质量比为2.5 ∶ 1,振荡30 min,静置30 min后分别用便携式电导计(2265FS,USA)和便携式pH计(STARTER 300,USA)测定;土壤铵态氮(NH4+-N)和硝态氮(NO3--N)含量用2 mol · L-1的KCl浸提后通过连续流动分析仪(SKALAR SAN++,Netherl and s)测定(回收率为92.00%~111.10%);土壤有机质采用浓硫酸、重铬酸钾外加热法测定,土壤全碳(Total Carbon,简称TC)、全氮(Total Nitrogen,简称TN)含量采用CN元素分析仪(Elementar Vario MAX CN,Germany)测定(回收率为97.00%~105.00%);土壤粒径采用激光粒度分析仪(Master Sizer 2000,UK)测定,按国际制分为黏粒(<2 μm)、粉粒(2~20 μm)和砂粒(>20 μm).
与采集上覆水同步,在上覆水采样点附近用水样瓶取水样,每试验地4个重复,带回实验室后先用盐度计(EUTECH Instruments SALT 6+,USA)测定盐度,经过滤处理后采用离子色谱仪(Dionex ICS-2100,Japan)测定上覆水中的Cl-、SO42-等理化指标(回收率为95.00%~105.00%),采用流动注射分析仪(SKALAR San++,Netherl and s)分析水样中NH4+-N、NO3--N含量(回收率为92.00%~110.00%),采用总有机碳分析仪(Shimadzu TOC-VCPH,Japan)测定水样的DOC含量(回收率为95.00%~105.00%).
2.4 数据处理与分析实验数据整理采用Microsoft Excel 2013软件进行,统计分析使用SPSS17.0软件进行,制图在Origin8.0软件上完成.数据在分析之前先进行正态分布检验(Kolmogorov-Smirnov检验)和方差同质性检验(Levene检验),否则先将数据进行对数转换后再分析.采用单因素方差分析(one-way ANOVA)检验两组变量之间的差异性,采用皮尔逊相关系数(Pearson′s correlation coefficient)分析两组变量之间的相关性,对数据标准化处理后再进行线性回归分析.
3 结果与分析(Results and analysis) 3.1 沉积物理化性质的季节变化从表 1可以看出,除道庆洲沉积物pH值、道庆洲与鳝鱼滩黏粒、粉粒和砂粒各季节间差异均不显著外,两地其他理化指标均随季节表现出一定的显著变化特征,同时,不同理化指标的最高和最低值出现的季节不一致,存在较大变异性.两试验地沉积物电导率、NH4+-N和NO3--N含量季节变异系数均较大,随季节变化十分明显,而其他理化性质季节变化较小.将道庆洲和鳝鱼滩沉积物理化性特征进行比较,沉积物电导率、pH值、NO3--N含量和粉粒含量表现为鳝鱼滩显著高于道庆洲(p<0.05),NH4+-N含量、TC含量、C/N和砂粒含量则表现为道庆洲显著高于鳝鱼滩(p<0.05),其他理化指标两地间差异不明显.
| 表1 道庆洲和鳝鱼滩湿地沉积物理化性质的季节变化 Table 1 Seasonal variation of sediment physical and chemical characteristics in the Daoqingzhou and Shanyutan wetl and s |
2个沼泽上覆水理化特征的季节变化见表 2.道庆洲上覆水理化性质除盐度秋季与冬季之间,NH4+-N含量夏季与春季之间、春季、冬季与秋季之间,NO3--N含量春季与夏季之间差异不显著外,其他两两之间均存在显著差异(p<0.05).上覆水不同理化指标的最高和最低值出现的季节不一致,存在较大变异性.上覆水盐度的季节变异系数最小,表明其随季节的变化不明显.鳝鱼滩上覆水盐度、Cl-、SO42-、NH4+-N、NO3--N和DOC含量4个季节之间均存在显著差异(p<0.05),并且不同理化指标的最高和最低值出现的季节亦不一致,存在较大变异性.鳝鱼滩上覆水除DOC含量外其他理化指标的季节变异系数均大于道庆洲,表明前者随季节的变化更大.将道庆洲和鳝鱼滩上覆水理化性质进行比较,各季节上覆水盐度、Cl-、SO42-、NH4+-N含量均表现为鳝鱼滩明显高于道庆洲(p<0.05),NO3--N含量则表现为道庆洲显著高于鳝鱼滩(p<0.05).
| 表2 道庆洲和鳝鱼滩湿地上覆水理化性质的季节变化 Table 2 Seasonal variation of physical and chemical characteristics of overlying water in the Daoqingzhou and Shanyutan wetl and s |
2个沼泽湿地沉积物反硝化速率季节变化见图 2.秋季、冬季、春季、夏季道庆洲和鳝鱼滩沉积物反硝化速率分别为(3.37±1.18)、(9.14±6.46)、(37.47±12.37)、(80.91±19.57)μmol · m-2 · h-1(以N计,下同)和(0.39±0.08)、(0.33±0.14)、(11.46±1.64)、(7.70±1.22)μmol · m-2 · h-1,最高(最低)值分别出现在夏季(秋季)和春季(冬季),变异系数分别为108.23%和111.52%.道庆洲和鳝鱼滩沉积物反硝化速率的变异系数均较大,结合差异性检验结果(图 2),表明其沉积物反硝化速率随季节的变化均十分明显.将道庆洲和鳝鱼滩沉积物反硝化速率进行比较,秋季、冬季、春季、夏季沉积物反硝化速率均表现为道庆洲显著高于鳝鱼滩(p<0.05).综合4个季节的沉积物反硝化速率,道庆洲(平均值为(32.72±19.15)μmol · m-2 · h-1)显著高于鳝鱼滩((4.97±2.64)μmol · m-2 · h-1)(p<0.05).
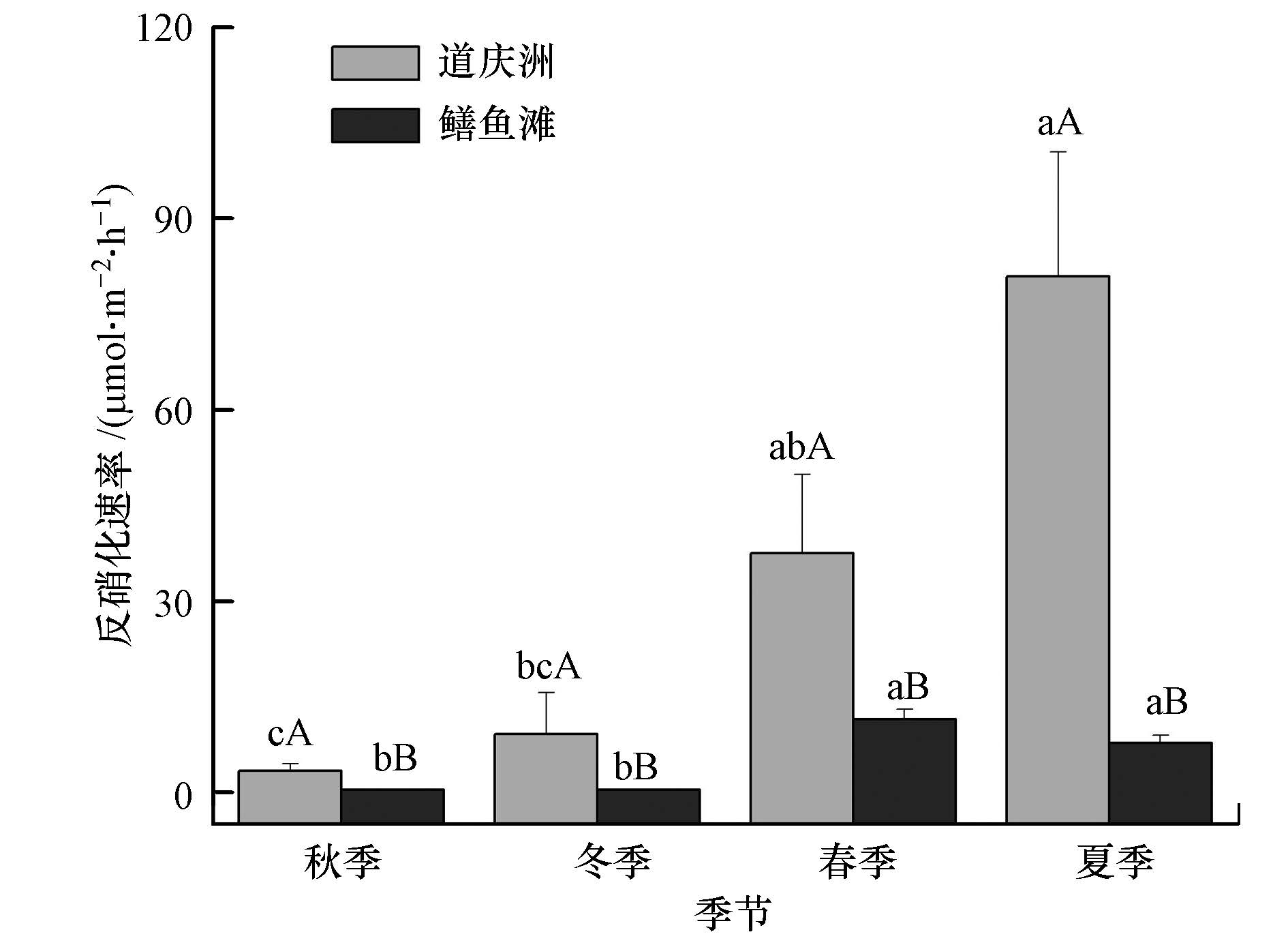 |
| 图2 道庆洲和鳝鱼滩湿地不同季节沉积物反硝化速率(误差线为标准误,不同小写字母表示同一试验地不同季节差异性显著,不同大写字母表示同一季节不同试验地差异性显著,下同) Fig.2 Sediment denitrification rate of different seasons in the Daoqingzhou and Shanyutan wetl and s(Error bar represents st and ard error,different lowercase letters mean different seasons exist significant differences in the same experimental field,different capital letters mean different experimental fields exist significant differences in the same season,the same below) |
2个沼泽湿地沉积物-水界面N2O交换通量的季节变化见图 3.秋季、冬季、春季、夏季道庆洲和鳝 鱼滩沉积物-水界面N2O交换通量分别为(0.12±0.07)、(0.40±0.31)、(0.13±0.07)、(0.15±0.13)μmol · m-2 · h-1(以N计,下同)和(0.08±0.05)、(-0.02±0.02)、(-0.02±0.13)、(-0.04±0.01)μmol · m-2 · h-1,最高(最低)值分别出现在冬季(秋季)和秋季(夏季).差异性检验表明,道庆洲和鳝鱼 滩沉积物-水界面N2O交换通量各季节之间差异均不显著,表明其季节变化不明显.将道庆洲和鳝鱼滩沉积物-水界面N2O交换通量进行比较,除冬季沉积物-水界面N2O交换通量道庆洲显著高于鳝鱼滩外(p<0.05),秋季、春季、夏季两地之间差异均不显著,综合4个季节的沉积物-水界面N2O交换通量,道庆洲(平均值为(0.20±0.17)μmol · m-2 · h-1)显著高于鳝鱼滩(0.00±0.07 μmol · m-2 · h-1)(p<0.05).道庆洲和鳝鱼滩沉积物-水界面N2O交换通量均较小,甚至出现负值,而反硝化速率明显高于N2O交换通量,可能是因为沉积物反硝化作用过程中N2O还原作用较明显.
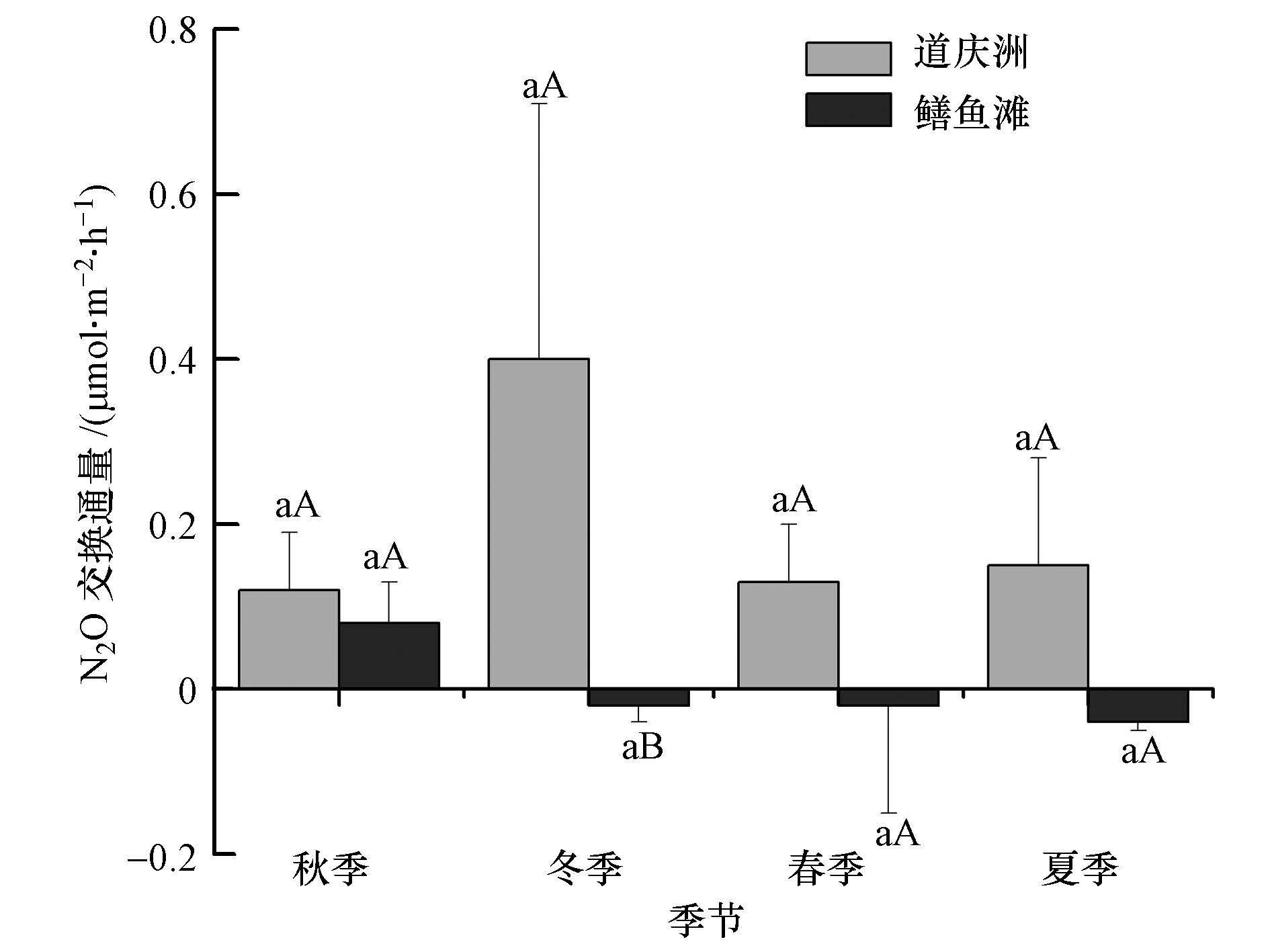 |
| 图3 道庆洲和鳝鱼滩湿地不同季节沉积物-水界面N2O交换通量 Fig.3 N2O exchange flux from the interface between sediment and water of different seasons in the Daoqingzhou and Shanyutan wetl and s |
秋季、冬季、春季和夏季沉积物反硝化速率培养水温分别为(24.00±0.08)、(18.40±0.50)、(28.00±0.16)和(30.50±0.08)℃,本文同时探讨温度对道庆洲和鳝鱼滩沉积物反硝化速率的影响,结果如图 4所示.线性回归分析表明,道庆洲和鳝鱼滩沉积物反硝化速率均表现出随温度增加而显著升高的特征(图 4),温度是影响沉积物反硝化速率的重要因素.
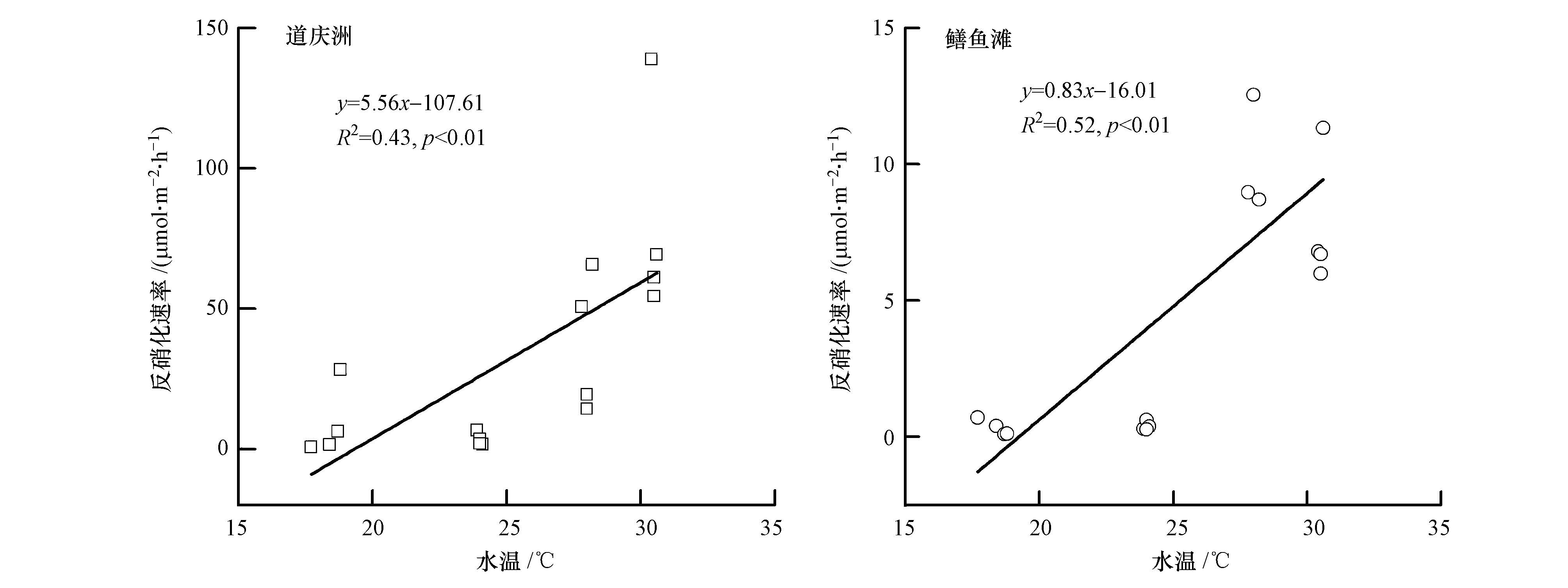 |
| 图4 道庆洲和鳝鱼滩湿地沉积物反硝化速率与温度的回归分析 Fig.4 Regression analysis between sediment denitrification rate and temperature in the Daoqingzhou and Shanyutan wetl and s |
由表 3可知,两地沉积物反硝化速率与理化性质的相关关系存在不一致,道庆洲沉积物反硝化速率与电导率存在显著负相关关系(n=16,p<0.05),与NH4+-N含量存在显著正相关关系(n=16,p<0.05),与C/N存在显著负相关关系(n=16,p<0.01);鳝鱼滩沉积物反硝化速率与电导率存在显著负相关关系(n=16,p<0.01),与TN含量存在显著正相关关系(n=16,p<0.01);其中,沉积物电导率对两地反硝化速率均产生显著的抑制作用.
| 表3 道庆洲和鳝鱼滩湿地沉积物理化性质与反硝化速率的Pearson相关性分析 Table 3 Pearson′s correlation coefficient between sediment physical and chemical properties and denitrification rate in Daoqingzhou and Shanyutan wetl and s |
由表 4可知,道庆洲沉积物反硝化速率与上覆水Cl-含量显著负相关(n=16,p<0.05),与SO42-和NO3--N含量显著负相关(n=16,p<0.01),与NH4+-N含量显著正相关(n=16,p<0.05);鳝鱼滩沉积物反硝化速率与上覆水盐度、Cl-、SO42-含量显著负相关(n=16,p<0.01),与NH4+-N含量显著正相关(n=16,p<0.01),与DOC含量显著负相关(n=16,p<0.01).由相关性分析可知,上覆水各理化性质对淡水和微咸水湿地沉积物反硝化速率产生的影响表现出方向一致性.
| 表4 道庆洲和鳝鱼滩湿地上覆水理化性质与沉积物反硝化速率的Pearson相关性分析 Table 4 Pearson′s correlation coefficient between physical and chemical properties of overlying water and sediment denitrification rate in Daoqingzhou and Shanyutan wetl and s |
为探讨道庆洲和鳝鱼滩沉积物反硝化速率的主要影响因素,利用多元回归分析的逐步回归法(Stepwise)建立道庆洲和鳝鱼滩沉积物反硝化速率(分别为YD和YS)与温度(X1)、沉积物电导率(X2)、pH值(X3)、NH4+-N含量(X4)、NO3--N含量(X5)、有机质含量(X6)、TC含量(X7)、TN含量(X8)、C/N(X9)、黏粒(X10)、粉粒(X11)、砂粒(X12)、上覆水盐度(X13)、Cl-含量(X14)、SO42-含量(X15)、NH4+-N含量(X16)、NO3--N含量(X17)及DOC含量(X18)之间的最优回归方程(表 5).结果表明,道庆洲沉积物反硝化速率主要受上覆水SO42-含量的影响,复相关系数达到0.01显著性水平(R2=0.54);鳝鱼滩沉积物反硝化速率主要受上覆水盐度和NO3--N含量的作用,复相关系数达到0.01显著性水平(R2=0.86).
| 表5 道庆洲和鳝鱼滩湿地沉积物反硝化速率与环境影响因素的多元回归方程 Table 5 Multiple regression equations between sediment denitrification rate and environmental factors in Daoqingzhou and Shanyutan wetl and s |
道庆洲和鳝鱼滩沉积物反硝化速率均存在十分明显的季节变化,两地沉积物反硝化速率的最高(最低)值分别出现在夏季(秋季)和春季(冬季),沉积物反硝化速率随温度增加而显著升高(图 4),温度是影响反硝化速率季节变化的重要因素.孙文广等(2014)研究发现反硝化作用最适宜温度为25 ℃左右,本研究培养温度介于18.40~30.50 ℃之间,是较适宜反硝化作用发生的温度范围.王东启等(2007)的研究认为,温度是控制长江口潮滩沉积物反硝化速率的决定因素,温度可通过影响微生物活性和反应速度控制反硝化速率.较高温度条件下,沉积物微生物活性较强,反硝化潜力大,同时沉积物表层产生较高的矿化和硝化作用可为缺氧亚表层中的反硝化作用提供所需NO3-,因而反硝化速率较高(Livingstone et al., 2000).温度亦可通过控制沉积物中的耗氧速率影响反硝化速率,沉积物孔隙水溶解氧是控制反硝化作用的关键因素,只有当环境中溶解氧降低,微生物转而利用NO3-作为电子受体时,反硝化作用才开始进行(Martin et al., 1999).本研究未测定沉积物和上覆水中溶解氧含量,但发现道庆洲和鳝鱼滩沉积物反硝化速率与沉积物NO3--N含量的相关性均不显著(表 3),表明温度并非主要通过控制沉积物中的耗氧速率影响反硝化速率.
4.2 盐度对河口潮汐湿地沉积物反硝化速率的影响道庆洲沉积物反硝化速率((32.72±19.15)μmol · m-2 · h-1)明显高于鳝鱼滩((4.97±2.64)μmol · m-2 · h-1),并且秋季、冬季、春季、夏季沉积物反硝化速率均表现为道庆洲显著高于鳝鱼滩(p<0.05),表明淡水湿地沉积物反硝化速率明显高于微咸水湿地.与此研究结果较为一致的如Zimmerman等(1994)对墨西哥湾加尔维斯顿海湾沉积物的研究表明,最大反硝化速率出现在夏季盐度较低的上游地段;娄焕杰等(2013)运用主成分分析的结果表明,盐度是影响长江口潮滩沉积物反硝化速率的主导因素之一,对沉积物反硝化速率产生显著抑制作用.
盐度对河口湿地沉积物反硝化速率具有抑制作用.本研究沉积物电导率、上覆水盐度和Cl-含量等表征盐度的指标均与反硝化速率存在显著负相关关系(表 3、表 4),是抑制反硝化速率的重要因素;同时,各季节沉积物电导率、上覆水盐度和Cl-含量均表现为鳝鱼滩明显高于道庆洲,表明盐度是造成鳝鱼滩沉积物反硝化速率明显低于道庆洲的重要原因.盐度对沉积物反硝化速率产生抑制作用的主要途径包括:①盐度不利于沉积物对NH4+的吸收进而影响反硝化速率.Zimmerman等(1994)的研究表明,盐度小于6‰时,阳离子交换间的相互作用对沉积物铵的滞留产生重要影响,导致上游地段土壤具有较高的反硝化速率.单独分析,道庆洲及鳝鱼滩沉积物电导率与NH4+-N含量均无显著相关性(道庆洲,n=16,r=-0.224,p>0.05;鳝鱼滩,n=16,r=-0.417,p>0.05),但综合分析,两地沉积物电导率与NH4+-N含量呈显著负相关关系(n=32,r=-0.557,p<0.01),鳝鱼滩沉积物较高的电导率影响其对NH4+的吸收,使其沉积物NH4+-N含量显著低于道庆洲,而沉积物NH4+-N含量与反硝化速率存在正相关关系(表 3),是造成鳝鱼滩沉积物反硝化速率较道庆洲低的原因.目前针对NH4+-N含量对反硝化速率影响的研究报道较少,但NH4+作为氨氧化细菌的起始底物,是控制硝化作用的重要因素,可影响硝化-反硝化耦合作用.②盐度通过影响氨氧化细菌、硝化细菌和反硝化细菌活性,进而影响反硝化速率.氨氧化过程是硝化作用的起始阶段,其中,氨氧化菌(AOB)起重要作用,虽然单一理化参数不能完全解释河口环境中AOB的多样性,但盐度确能影响滨海河口湿地沉积物氨氧化菌多样性和分布(Francis et al., 2003),一般情况下硝化细菌多样性最低的群落出现在盐度最高的地点(Mosier et al., 2008; Moin et al., 2009).Wang等(2010)对黄河三角洲退化湿地微生物群落的研究结果显示,高盐水平导致微生物群落的数量和活性降低.本研究未测定影响沉积物反硝化速率的相关微生物,未能阐释盐度作用的微生物机制,深入的研究有待于今后进一步加强.
同时有研究表明,盐度与沉积物反硝化速率并未表现出明显的负相关关系.王东启等(2006;2007)研究发现,长江口潮滩水环境的广盐性,以及潮滩耐盐反硝化细菌的存在使得盐度的升高对反硝化作用的抑制不明显.Fear等(2005)对美国Eutrophic Neuse河口不同盐度沉积物的研究表明,反硝化速率随盐度不同而产生的变化并不明显,上游取样点沉积物有机碳水平最低,其反硝化速率与沉积物需氧量关系密切,这种关系并未出现在盐度较高的采样点,表明沉积物盐度不同,影响硝化-反硝化速率的主导因素也在发生变化.因此,为单独研究盐度对沉积物反硝化速率的作用,需在排除其他关键影响因素的条件下进行;而河口湿地复杂环境下沉积物反硝化作用又必然受多种因素的综合影响,因而深入探讨其主要影响因素更具实际意义.
4.3 河口潮汐湿地沉积物反硝化速率的其他影响因素本研究中,道庆洲和鳝鱼滩上覆水SO42-含量季节变化明显并与沉积物反硝化速率均存在显著负相关关系(表 2、表 4),是抑制反硝化速率的重要因素;同时,各季节上覆水SO42-含量均表现为鳝鱼滩明显高于道庆洲,表明SO42-是造成鳝鱼滩沉积物反硝化速率明显低于道庆洲的重要原因.已有的研究表明,滨海湿地SO42-含量的增加易形成强SO42-还原环境,SO42-还原产生的H2S可影响微生物活性并增强硝酸盐异化还原为铵(DNRA)过程而不利于反硝化作用的进行(Larsen et al., 2010).H2S对敏感的生物分子(如酶)具有毒害作用,环境中高H2S含量可对反硝化作用序列的最后两个还原酶产生抑制作用,从而使反硝化作用序列分流至另一个过程(如DNRA)(Brunet et al., 1996; Senga et al., 2006).同时,本研究道庆洲上覆水SO42-含量明显低于鳝鱼滩,并且前者的季节变异系数明显低于后者(表 2),但上覆水SO42-却是道庆洲沉积物反硝化速率的最主要影响因素(表 5),可以认为淡水湿地反硝化速率对SO42-影响的响应较微咸水湿地更为敏感.
反硝化菌在呼吸作用中以硝酸盐代替氧原子作为电子受体,进而将硝酸盐还原为N2O或N2,因此,硝酸盐是反硝化作用的必要底物,上覆水硝酸盐是反硝化的限制性因素(唐陈杰等,2014).王东启等(2006)采用与本研究相似的培养方法探讨沉积物上覆水体N2O的主要来源,认为反硝化作用主要发生于沉积物中,水体的反硝化作用可以忽略.因此,沉积物NO3--N含量对反硝化起重要作用.但本研究两地沉积物NO3--N含量与反硝化速率均不显著相关(表 3),而上覆水NH4+-N和NO3--N作为外源无机氮与沉积物反硝化速率表现出显著相关性,前者对反硝化速率产生促进作用,后者则主要表现为抑制(表 4).可能是由于两地沉积物直接利用NO3--N进行的反硝化作用较弱,更多地表现为硝化-反硝化的耦合作用.
反硝化速率的理想条件是高NO3--N含量、易分解的有机碳含量和厌氧(Robertson et al., 2007;张琛等,2013),土壤有机质作为参与反硝化过程的微生物的电子供体和细胞能源,其有效性显著影响土壤的反硝化速率.如刘荣芳等(2013)的研究结果显示,在培养初期(10 d内)沉积物NO3--N浓度、有机质含量较高,有利于反硝化作用的进行,反硝化速率较大,之后随着反应底物的减少反硝化速率降低.本研究沉积物有机质、TC含量与反硝化速率的相关关系均不显著,仅道庆洲沉积物C/N与反硝化速率显著负相关(表 3).一般而言,土壤C/N越低,土壤有机碳分解速率越快,则易分解的有机碳含量更高(王绍强等,2008),有机质分解过程中大量耗氧,易形成厌氧环境利于反硝化过程的发生.厌氧条件有利于反硝化速率,孙志高等(2008)指出,土壤质地主要通过影响NO3-的渗漏性和通气状况及水分条件来作用于反硝化作用过程,本研究黏粒、粉粒和砂粒质量分数与反硝化速率均无显著相关性(表 3).沉积物pH值对反硝化亦可产生重要影响,其主要影响反硝化产物的N2O/N2比(Šimek et al., 2002).Čuhel等(2010)研究了pH对反硝化过程的影响,结果显示,虽然N2O的通量未发生变化,但N2O/(N2O+N2)的比值随pH值的降低而升高,说明pH在决定反硝化最终产物方面起了重要作用.本研究中虽然两地沉积物可能N2O还原作用明显,但未发现沉积物反硝化速率与pH值的显著相关关系(表 3).
5 结论(Conclusions)1)闽江河口区淡水和微咸水潮汐沼泽湿地沉积物反硝化速率均存在明显的季节变化,最高(最低)值分别出现在夏季(秋季)和春季(冬季),温度是影响反硝化速率季节变化的重要因素.
2)在盐度值区间较窄的情况下,闽江河口区淡水潮汐沼泽湿地沉积物反硝化速率仍显著高于微咸水潮汐沼泽湿地.盐度和上覆水SO42-含量对淡水和微咸水湿地沉积物反硝化速率具有抑制作用,是造成后者明显低于前者的两个重要因素.盐度主要通过抑制沉积物对NH4+-N的吸收而可能影响硝化-反硝化耦合作用,进而影响反硝化速率,同时淡水湿地反硝化速率对SO42-影响的响应较微咸水湿地更为敏感.
| [1] | Baggs E M.2008.A review of stable isotope techniques for N2O source partitioning in soils:recent progress, remaining challenges and future considerations[J].Rapid Communications in Mass Spectrometry,22(11):1664-1672 |
| [2] | Brunet R C,Garcia-Gil L J.1996.Sulfide-induced dissimilatory nitrate reduction to ammonia in anaerobic freshwater sediments[J].FEMS Microbiology Ecology,21(2):131-138 |
| [3] | Burgin A J,Groffman P M,Lewis D N.2010.Factors regulating denitrification in a riparian wetland[J].Soil Science Society of America Journal,74(5):1826-1833 |
| [4] | Craft C,Clough J,Ehman J,et al.2009.Forecasting the effects of accelerated sea-level rise on tidal marsh ecosystem services[J].Frontiers in Ecology and the Environment,7(2):73-78 |
| [5] | Čuhel J,Šimek M,Laughlin R J,et al.2010.Insights into the effect of soil pH on N2O and N2 emissions and denitrifier community size and activity[J].Applied and Environmental Microbiology,76(6):1870-1878 |
| [6] | Fear J M,Thompson S P,Gallo T E,et al.2005.Denitrification rates measured along a salinity gradient in the eutrophic Neuse River Estuary,North Carolina,USA[J].Estuaries,28(4):608-619 |
| [7] | Francis C A,O'Mullan G D,Ward B B.2003.Diversity of ammonia monooxygenase (amoA) genes across environmental gradients in Chesapeake Bay sediments[J].Geobiology,1(2):129-140 |
| [8] | Giblin A E,Weston N B,Banta G T,et al.2010.The effects of salinity on nitrogen losses from an oligohaline estuarine sediment[J].Estuaries and Coasts,33(5):1054-1068 |
| [9] | Goffman P M,Altabet M A,Böhlke J K,et al.2006.Methods for measuring denitrification:diverse approaches to a difficult problem[J].Ecological Applications,16(6):2091-2122 |
| [10] | Hou L J,Liu M,Xu S Y,et al.2007.The effects of semi-lunar spring and neap tidal change on nitrification,denitrification and N2O vertical distribution in the intertidal sediments of the Yangtze estuary,China[J].Estuarine,Coastal and Shelf Science,73(3/4):607-616 |
| [11] | Jordan S J,Stoffer J,Nestlerode J A.2011.Wetlands as sinks for reactive nitrogen at continental and global scales:a meta-analysis[J].Ecosystems,14(1):144-155 |
| [12] | Kana T M,Sullivan M B,Cornwell J C,et al.1998.Denitrification in estuarine sediments determined by membrane inlet mass spectrometry[J].Limnology and Oceanography,43(2):334-339 |
| [13] | Kim D H,Matsuda O,Yamamoto T.1997.Nitrification,denitrification and nitrate reduction rates in the sediment of Hiroshima Bay,Japan[J].Journal of Oceanography,53(4):317-324 |
| [14] | Larsen L,Moseman S,Santoro A E,et al.2010.A complex-systems approach to predicting effects of sea level rise and nitrogen loading on nitrogen cycling in coastal wetland ecosystems[J].Ecological Dissertations in the Aquatic Sciences Symposium Proceedings VⅢ,5:67-92 |
| [15] | 刘剑秋,曾从盛,陈宁.2005.闽江河口湿地研究[M].北京:科学出版社.70-76 |
| [16] | 刘荣芳,张林海,林啸,等.2013.闽江口短叶茳芏湿地土壤反硝化潜力[J].生态学杂志,32(11):2865-2870 |
| [17] | Livingstone M W,Smith R V,Laughlin R J.2000.A spatial study of denitrification potential of sediments in Belfast and Strangford Loughs and its significance[J].Science of the Total Environment,251-252:369-380 |
| [18] | 娄焕杰,王东启,陈振楼,等.2013.环境因子对长江口滨岸沉积物反硝化速率影响[J].环境科学与技术,36(4):114-118 |
| [19] | Martin T L,Kaushik N K,Trevors J T,et al.1999.Review:denitrification in temperate climate riparian zones[J].Water,Air,and Soil Pollution,111(1/4):171-186 |
| [20] | Moin N S,Nelson K A,Bush A,et al.2009.Distribution and diversity of archaeal and bacterial ammonia oxidizers in salt marsh sediments[J].Applied and Environmental Microbiology,75(23):7461-7468 |
| [21] | Mosier A C,Francis C A.2008.Relative abundance and diversity of ammonia-oxidizing archaea and bacteria in the San Francisco Bay estuary[J].Environmental Microbiology,10(11):3002-3016 |
| [22] | Nielsen L P,Glud R N.1996.Denitrification in a coastal sediment measured in situ by the nitrogen isotope pairing technique applied to a benthic flux chamber[J].Marine Ecology Progress Series,137:181-186 |
| [23] | Robertson G P,Groffman P M.2007.Nitrogen transformations//Paul E A.Soil Microbiology,Ecology and Biochemistry (3rd ed)[M].Burlington,Massachusetts:Academic Press.341-364 |
| [24] | Santoro A E.2010.Microbial nitrogen cycling at the saltwater-freshwater interface[J].Hydrogeology Journal,18(1):187-202 |
| [25] | Scaroni A E,Nyman J A,Lindau C W.2011.Comparison of denitrification characteristics among three habitat types of a large river floodplain:Atchafalaya River Basin,Louisiana[J].Hydrobiologia,658(1):17-25 |
| [26] | Seitzinger S,Harrison J A,Böhlke J K,et al.2006.Denitrification across landscapes and waterscapes:a synthesis[J].Ecological Applications,16(6):2064-2090 |
| [27] | Senga Y,Mochida K,Fukumori R,et al.2006.N2O accumulation in estuarine and coastal sediments:The influence of H2S on dissimilatory nitrate reduction[J].Estuarine,Coastal and Shelf Science,67(1/2):231-238 |
| [28] | Seo D C,Yu K W,Delaune R D.2008.Influence of salinity level on sediment denitrification in a Louisiana estuary receiving diverted Mississippi River water[J].Archives of Agronomy and Soil Science,54(3):249-257 |
| [29] | Šimek M,Cooper J E.2002.The influence of soil pH on denitrification:progress towards the understanding of this interaction over the last 50 years[J].European Journal of Soil Science,53(3):345-354 |
| [30] | 孙文广,孙志高,甘卓亭,等.2014.黄河口不同恢复阶段湿地土壤N2O产生的不同过程及贡献[J].环境科学,35(8):3110-3119 |
| [31] | 孙志高,刘景双.2008.湿地土壤的硝化-反硝化作用及影响因素[J].土壤通报,39(6):1462-1467 |
| [32] | 唐陈杰,张路,杜应旸,等.2014.鄱阳湖湿地沉积物反硝化空间差异及其影响因素研究[J].环境科学学报,34(1):202-209 |
| [33] | Walter S,Peeken I,Lochte K,et al.2005.Nitrous oxide measurements during EIFEX,the European iron fertilization experiment in the subpolar South Atlantic Ocean[J].Geophysical Research Letters,32(23):L23613,doi:10.1029/2005GL024619 |
| [34] | 王东启,陈振楼,许世远,等.2006.长江口崇明东滩沉积物反硝化作用研究[J].中国科学D辑:地球科学,36(6):544-551 |
| [35] | 王东启,陈振楼,许世远,等.2007.长江口潮滩沉积物反硝化作用及其时空变化特征[J].中国科学B辑:化学,37(6):604-611 |
| [36] | 王绍强,于贵瑞.2008.生态系统碳氮磷元素的生态化学计量学特征[J].生态学报,28(8):3837-3947 |
| [37] | 王维奇,王纯,曾从盛,等.2012.闽江河口不同河段芦苇湿地土壤碳氮磷生态化学计量学特征[J].生态学报,32(13):4087-4093 |
| [38] | Wang Z Y,Xin Y Z,Gao D M,et al.2010.Microbial community characteristics in a degraded wetland of the Yellow River Delta[J].Pedosphere,20(4):466-478 |
| [39] | Weiss R F,Price B A.1980.Nitrous oxide solubility in water and seawater[J].Marine Chemistry,8(4):347-359 |
| [40] | 徐继荣,王友绍,殷建平,等.2005.静态顶空气相色谱法测定海水中溶解的N2O[J].海洋环境科学,24(4):59-62 |
| [41] | 杨晶,张桂玲,赵玉川,等.2011.胶州湾河口潮滩沉积物中N2O的产生和释放及其影响因素[J].环境科学学报,31(12):2723-2732 |
| [42] | 张琛,张俊生,郑娟.2013.硝化反硝化细菌菌落与N2O排放关系研究[J].水土保持应用技术,(4):4-6 |
| [43] | Zimmerman A R,Benner R.1994.Denitrification,nutrient regeneration and carbon mineralization in sediments of Galveston Bay,Texas,USA[J].Marine Ecology Progress Series,114:275-288 |
 2015, Vol. 35
2015, Vol. 35


