亚硝酸盐污染不仅是环境恶化带来的结果,也是硝化作用和反硝化作用的中间产物,因此广泛存在于自然水体中.然而水体中亚硝酸盐毒性大(廖绍安等,2006),长期饮用高浓度亚硝酸盐水,会导致智力低下,甚至死亡(朱济成,1995),水生动物因其积累亚硝酸盐而对亚硝酸毒性更为敏感(Kroupova et al., 2005).已有研究表明虾蟹池亚硝酸盐氮含量通常超过0.3 mg · L-1,有的高达50 mg · L-1甚至更高(洪美玲等,2011).因此减少或去除水体中亚硝酸盐对水体安全十分重要.去除水体中亚硝酸盐的方法包括物理方法、化学方法和生物方法,生物方法因其能有效去除多种含氮化合物且不带来二次污染得到了广泛研究,是最行之有效且绿色环保的方法之一(周超等,2011;赵翠娟等,2013).微生物除氮包括硝化作用和反硝化作用除氮,反硝化除氮能将多种含氮化合物转化为气态含氮物质,可从根本上解决水体中氮化合物超标的问题,被认为是生物除氮中最有效的除氮方式,但反硝化脱氮效率会受温度、溶解氧、pH、接种量、碳源以及氮含量等影响(Čuhel et al..,2010;Guo et al., 2013;Ji et al., 2014; Ellis et al., 1998),其中低温是抑制反硝化除氮的关键因素之一,当温度低于20 ℃,硝化和反硝化性能将会急剧下降,当温度低于15 ℃时,硝化和反硝化性能会变得很微弱,当温度低于10 ℃时,将会强烈抑制硝化作用和反硝化作用的进行(Kroupova et al., 2005;Rodriguez-Caballero et al., 2012;陈忠祥等,2011).本实验室从长期淹水的稻田土壤中分离获得一株能在15 ℃快速高效去除水体亚硝酸盐氮和总氮的菌株(Y-12),结合形态、16S rRNA和磷脂脂肪酸组成分析将菌株Y-12鉴定为Pseudomonas putida,是一株耐冷的好氧反硝化细菌,目前尚未见该类菌能在如此低温条件下快速进行反硝化作用的报道,因此,明确该耐冷菌株脱氮条件对实际应用具有重要意义,本实验研究了温度、溶解氧、pH、接种量、碳源以及亚硝酸盐氮含量等对菌株Y-12脱氮能力的影响,在此基础上,考察了该菌脱氮产生的CO2和N2O含量以及对富营养化景观水体的净化能力,以期为实际应用提供理论支撑.
2 材料与方法(Material and methods) 2.1 菌源实验菌株由本实验室分离筛选获得,已通过形态学、特异性磷脂脂肪酸和16S rRNA同源性分析,鉴定该菌株为Pseudomonas putida,命名为Y-12.
反硝化培养基(Song et al., 2011):乙酸钠4.72 g · L-1,NaNO2 0.075 g · L-1,KH2PO4 1.5 g · L-1,Na2HPO4 0.42 g · L-1,MgSO4·7H2O 0.1 g · L-1,调pH至7.2,在0.11 MPa、121 ℃下灭菌30 min,备用.反硝化脱氮影响因素以及景观水处理实验均在在250 mL锥形瓶中进行,反硝化脱氮产物中温室气体检测实验在500 mL的锥形瓶中进行.
2.3 耐冷菌株的好氧反硝化特性将含1.0×108 CFU的处于对数生长期的Y-12菌悬液分别接入装有100 mL反硝化培养基的250 mL锥形瓶中,研究Y-12菌株在不同初始温度(5、10、15、20、25、30、35 ℃和40 ℃)、pH值(5.0、6.0、7.0、8.0和9.0)、转速(0、50、100、150、200 r · min-1)、碳源(柠檬酸钠、丁二酸钠、乙酸钠、蔗糖和葡萄糖)以及不同起始亚硝酸盐氮浓度(10、50、100、150、200 mg · L-1)条件下对亚硝酸盐氮和总氮的去除能力的影响,同时考察了不同接种量(0.5×108、1.0×108、1.5×108、2.0×108 CFU和2.5×108 CFU的菌悬液)于100 mL反硝化培养基对该菌脱氮能力的影响,以上实验除了温度影响条件外均在15 ℃条件进行,48 h后分别测定各亚硝酸盐氮浓度和总氮浓度,计算亚硝酸盐氮和总氮的去除率,确定该菌株的好氧反硝化特性.
2.4 反硝化产物中温室气体的检测将1.0×108 CFU的菌量转接到灭菌后100 mL(采用500 mL锥形瓶)以柠檬酸钠为唯一碳源的反硝化培养基中作为实验组,同等条件下以不接菌为对照组,采用多层保鲜膜封闭带有封口膜的锥形瓶以保证整个实验过程有充足的溶解氧,同时防止漏气,然后于150 r · min-1和15 ℃条件下振荡培养48 h后,采集气体,通过气相色谱仪测定产生N2O和CO2的峰面积并计算气体浓度,同时检测总氮的去除量.
2.5 实验室摇瓶培养处理富营养化景观水本实验采集了富营养化的景观水体,在未灭菌条件下,取600 mL鲜样平均分装于6个250 mL锥形瓶中,其中3个不接种Y-12菌作为对照组(CK),余下3个接入1.0×108 CFU 处于对数生长期的Y-12菌作为实验组(Disposal),并立即从对照组和实验组中取出等量水体检测亚硝酸盐氮和总氮初始含量;然后将2组实验同时置于15 ℃,150 r · min-1条件下振荡培养,48 h后分别测定各处理中亚硝酸盐氮和总氮终浓度,计算其去除率.
2.6 检测方法与数据处理分析总氮浓度采用碱性过硫酸钾消解紫外分光光度法测定(环境保护部,2012);亚硝酸盐氮浓度采用N-(1-萘基)-乙二胺光度法测定(国家环境保护总局,2002);菌体量采用OD600光电比浊法.亚硝酸盐氮和总氮的去除率均以: Rv=(T1-T2)/T1×100%进行计算;其中,Rv为亚硝酸盐氮或总氮的去除率,T1为反硝化培养基中亚硝酸盐氮或总氮的初始浓度,T2为培养48 h后亚硝酸盐氮或总氮的终浓度.每组实验设3组平行,采用Excel、SPSS Statistics17.0和origin8.6软件对实验结果进行统计分析与作图.
3 结果与分析(Results and analysis) 3.1 耐冷菌株的好氧反硝化特性 3.1.1 pH对菌株去除亚硝酸盐氮和总氮的影响环境中氢离子浓度不仅影响微生物生存,而且还影响酶活性,反硝化还原亚硝酸盐氮是一个产碱过程(周影茹等,2013;王茹等,2013),极容易改变环境中的pH,因此,研究菌株Y-12的最适pH 范围显得十分必要;本研究结果表明该菌在初始pH为6.0以下的反硝化培养基中几乎丧失脱氮能力,当pH由6.0增加至7.0时对亚硝酸氮的去除率迅速增加至99.6%,再增大pH对亚硝酸盐氮的去除没有显著影响;当pH升高至7.0时,总氮的去除率显著增加,由15.72 mg · L-1降至6.70 mg · L-1,去除率为57.4%;当pH增加至9.0时,总氮的去除率显著下降至21.7%,总氮浓度由15.73 mg · L-1下降至12.32 mg · L-1,(图 1),表明该菌最佳脱氮pH为7.0~8.0.
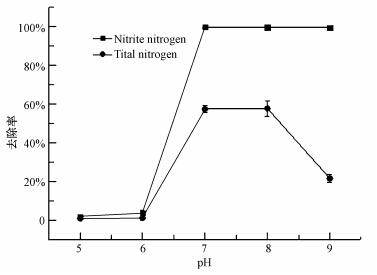 |
| 图 1 pH对菌株Y-12除氮影响 Fig.1 Effects of pH on nitrogen removal by strain Y-12 |
溶解氧不仅能作为反硝化过程的电子受体,还会抑制一氧化二氮还原酶基因活性(Bonin et al., 2002),如于爱茸等(2005)对反硝化细菌的耐氧特性研究表明,菌株W2和YJ06在溶解氧小于1 mg · L-1时表现出显著反硝化能力,但当溶解氧大于2 mg · L-1时,YJ06基本丧失反硝化能力,而W2在溶解氧达到4.9 mg · L-1的条件下除氮率还可达92.0%,由此可见不同反硝化细菌对溶解氧的耐受能力具有显著差异.本实验研究了5个不同转速相应的溶解氧水平对菌株Y-12脱氮能力的影响如图 2所示,该菌对亚硝酸盐氮和总氮的去除率随着转速增加而增加,当转速为50 r · min-1时,对亚硝酸盐氮的去除率为86.6%,总氮由15.76 mg · L-1降至9.33 mg · L-1,去除率为40.8%;转速为200 r · min-1时,对亚硝酸盐氮的去除率为99.9%,总氮由15.78 mg · L-1降至3.30 mg · L-1,其去除率达到79.1%.增加转速可以提高溶解氧浓度已有研究报道,当转速为170 r · min-1时,反硝化培养基中的溶解氧可达(7.7±0.5)mg · L-1(Pei et al..,2013),本实验研究的Y-12菌株在转速为200 r · min-1的条件下依然表现出了较好的反硝化脱氮特性,由图 2可见,增加转速显然有利于该菌进行生物脱氮,这可能与反硝化脱氮途径和参与反硝化脱氮过程的还原酶种类相关,反硝化脱氮途径复杂,酶催化过程并没有完全研究清楚,在反硝化脱氮过程中有多种酶参与脱氮反应,有的反硝化细菌不含硝酸盐还原酶或N2O还原酶基因,但仍然能进行反硝化脱氮作用(Poth and Focht,1985;Philippot et al.,2011),此外,虽然N2O还原酶对氧极为敏感,但含N2O还原酶基因的反硝化细菌在有氧的条件下也能进行反硝化脱氮作用.目前,反硝化细菌中是否存在对氧不敏感的亚硝酸盐还原酶基因还不清楚,因此增加溶解氧促进Y-12反硝化脱氮作用有待进一步研究,在实际应用中可通过增强曝气提高其脱氮能力.
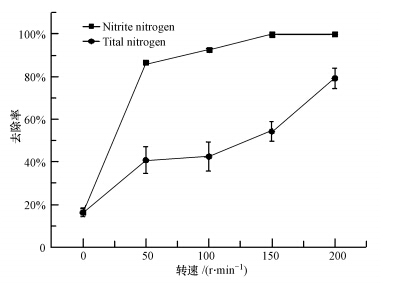 |
| 图 2 转速对菌株Y-12除氮影响 Fig.2 Effects of shaking speed on nitrogen removal by strain Y-12 |
生物量大小是影响生物除氮的重要因素,接种量不足达不到反硝化除氮的作用,接种量过多会引起生物竞争营养物而致使部分细菌死亡,导致环境总氮含量去除不明显,适当的接种量有助于提高反硝化除氮效率,如熊焰等(2010)对巨大芽孢杆菌SZ-3研究认为,初始菌液浓度为106~107 CFU · mL-1不及菌液浓度高于1.0×108 CFU · mL-1对亚硝酸盐氮去除效果好.本实验对接种量研究结果如图 3所示,当作用菌浓度由0.5×106 CFU · mL-1增加至1.0×106 CFU · mL-1时,48 h内该菌对亚硝酸盐氮的去除率由39.3%显著增加至96.2%;当菌浓度为2.0×106 CFU · mL-1,Y-12菌株对培养基中的亚硝酸盐氮和总氮的去除率均达到最大值,分别为99.9%和67.6%,总氮由15.69 mg · L-1降至5.08 mg · L-1;当菌浓度为2.5×106 CFU · mL-1时,该菌对亚硝酸盐氮的去除高达100%,但对总氮的去除率下降至57.2%,因此,为了同时有效去除亚硝酸盐氮和总氮,菌浓度保持在1.5×106~2.0×106 CFU · mL-1比较适宜.
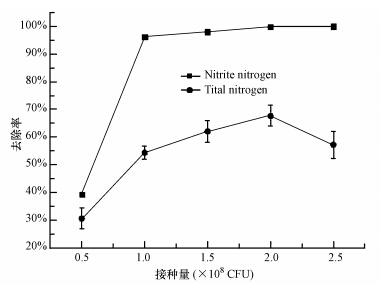 |
| 图 3 接种量对菌株Y-12除氮的影响 Fig.3 Effects of inoculated quantity on nitrogen removal by strain Y-12 |
碳源主要为反硝化过程提供能源和电子,能直接或间接影响反硝化脱氮过程,如傅利剑等(2005)的研究结果表明,相对柠檬酸钠而言,甘油促进异养反硝化细菌HP1(Pseudomonas alcaligenes)产生N2O,这证明不同碳源能够影响氧化亚氮还原酶的活性.因此研究不同碳源对菌株Y-12反硝化活性的影响可以对实际污水处理时添加碳源提供依据.结果如图 4所示,柠檬酸钠、丁二酸钠、乙酸钠或葡萄糖为碳源时,Y-12对亚硝酸盐氮去除率均为99%以上;以蔗糖为碳源时,对亚硝酸盐氮的去除率只有20.0%;菌株Y-12以柠檬酸钠为唯一碳源时的总氮去除率最大,由15.69 mg · L-1 降至2.86 mg · L-1,其去除率达81.8%;丁二酸钠和乙酸钠也利于Y-12对总氮的去除,但蔗糖和葡萄糖不利于Y-12对总氮的去除.
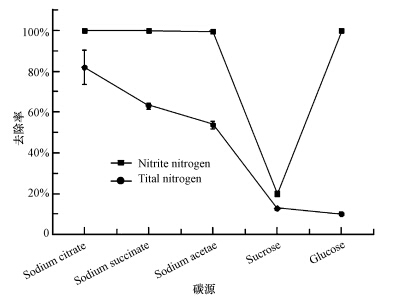 |
| 图 4 碳源对菌株Y-12除氮影响 Fig.4 Effects of carbon source on nitrogen removal by strain Y-12 |
亚硝酸盐对动物和人类均具有毒害作用,高浓度的亚硝酸盐对微生物也可能具有抑制作用,但目前有关亚硝酸盐氮对反硝化除氮的影响还鲜见报道.本研究通过设置亚硝酸盐氮不同起始浓度,考察了不同亚硝酸盐氮浓度对菌株Y-12反硝化活性的影响,结果表明,该菌对亚硝酸盐氮和总氮的去除率随着亚硝酸盐氮含量增加而降低,对10 mg · L-1至200 mg · L-1的亚硝酸盐氮的去除率由99.5%降至22.4%,对总氮的去除率由58.9%降至19.3%(图 5),表明低浓度亚硝酸盐氮有利于Y-12菌株进行反硝化作用,高浓度亚硝酸盐氮会抑制该菌的脱氮能力,但Y-12菌株对亚硝酸盐氮浓度的耐受程度能够满足污水脱氮要求,对治理亚硝酸盐污染水体具有较好的应用潜力.
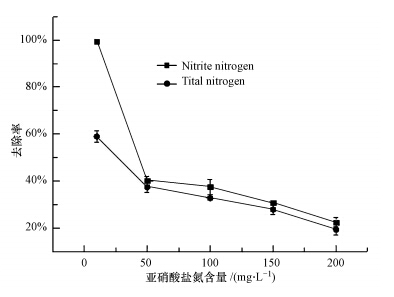 |
| 图 5 亚硝酸盐氮含量对菌株Y-11除氮影响 Fig.5 Effects of nitrite content on nitrogen removal by strain Y-12 |
温度是影响反硝化作用最显著的因素之一,当温度低于10 ℃时, 将会强烈抑制硝化作用和反硝化作用的进行(Carrera et al., 2003; Rodriguez-Caballero et al., 2012).如李军等(2012)从冬季淹水泥土中分离到一株耐冷反硝化细菌Y2,在25 ℃条件下3 d内对硝酸盐氮的去除率为51.6%,相应的15 ℃只有12.9%.本实验菌株Y-12在不同温度条件下对亚硝酸盐氮和总氮的去除率如图 6所示,该菌在5~35 ℃条件下均能有效地进行反硝化作用,在5 ℃条件下对15.59 mg · L-1和15.77 mg · L-1的亚硝酸盐氮和总氮去除率分别可达33.0%和24.0%,高于李军等报道的Y2菌株在15 ℃条件下的反硝化活性;随着温度升高,该菌对亚硝酸盐氮和总氮去除率增加,温度为20 ℃时,对亚硝酸盐氮和总氮的去除率分别为100%和60.1%;温度在25~35 ℃之间时对亚硝酸盐氮和总氮去除率无显著差异;再升高温度,其总氮和亚硝酸盐氮的去除率受到完全抑制.Y-12菌株具有较广的温度适宜范围,在南方的各个季节都具有较好的应用潜力.
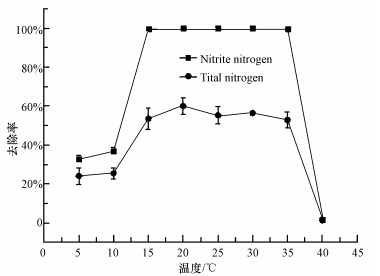 |
| 图 6 温度对菌株Y-12除氮影响 Fig.6 Effects of temperature on nitrogen removal by strain Y-12 |
不同种类的好氧反硝化细菌脱氮产物具有差异,如周影茹等(2013)报道的菌株RWX31在好氧条件下进行反硝化作用的产物为N2O.Otte等(1996)研究发现连续培养的粪产碱杆菌(Alcaligenes faecalis)TUD好氧反硝化产物为N2O.Takaya等(2003)也认为好氧条件下反硝化作用产生的主要是N2O.但好氧反硝化作用不产生N2O也有研究报道,如Shi等(2013)对善变副球菌属LYM研究认为,该菌能同时进行异养硝化和好氧反硝化作用,中间未检测出N2O温室气体.N2O是一种会导致臭氧层空洞的强烈温室气体,对环境的温室效应潜势是CO2的300多倍(Hu et al., 2012;Kim et al..,2010),因此分析反硝化脱氮产物N2O的含量对保护环境显得尤为重要.本实验通过收集气体检测分析,菌株Y-12在脱氮过程中产生CO2和N2O如表 1所示,由此可看出,反硝化脱氮过程中产生了大量的CO2,但只产生了少量的N2O,表明该菌脱氮产生的N2O对造成温室效应程度小,在实际应用中比较安全.培养基中总氮浓度由15.78 mg · L-1降至7.94 mg · L-1,在1L反硝化培养基中除去了7.84 mg氮,但只产生了少量的N2O,根据氮平衡应有其它种类的气体氮产生(如NO和N2),仍需进一步研究.
| 表 1 反硝化作用产生的CO2和N2O Table 1 The concentration of CO2 and N2O production with denitrification |
景观水是城市人居环境中重要的组成部分,但多数景观水为流动性差或静止水体,自净能力低,易污染,富营养化景观水环境条件复杂,因此研究菌株Y-12对未灭菌景观水的脱氮处理效果对指导该菌实际应用具有重要意义.研究结果表明,Y-12菌株在15 ℃,150 r · min-1条件下振荡培养48 h后能将景观水体中的亚硝酸盐氮和总氮由0.53 mg · L-1和10.42 mg · L-1降低至0.33 mg · L-1和5.09 mg · L-1,去除率分别可达37.7%和51.5%;对照组(CK)中亚硝酸盐氮和总氮由0.56 mg · L-1和9.53 mg · L-1降低至0.50 mg · L-1和8.92 mg · L-1,去除率分别为10.7%和6.4%(图 7),这表明该水体中部分微生物也能进行一定的脱氮作用,但添加Y-12可显著提高水体中亚硝酸盐氮和总氮的去除率,说明该菌能较好适应现实复杂环境条件,具有较好的实际应用潜力.
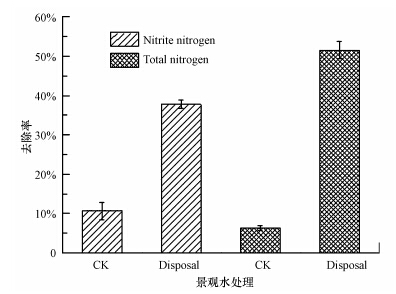 |
| 图 7 菌株Y-12对景观水中亚硝酸盐氮和总氮的去除效果 Fig.7 The nitrite and total nitrogen removal by strain Y-12 in l and scape water |
由于在实际应用中环境因素较为复杂,实验室条件下的脱氮效果并不能代表现实应用效果,如何伟等(2009)在实验室条件下以分离的反硝化产碱杆菌BMB2N6为基础制成的混合菌剂,在35 ℃条件下,12 h内对亚硝酸盐去除率高达94.0%,而在实际应用中7 d对亚硝酸盐的去除率只有80.0%.由图 7可见,Y-12菌株对亚硝酸盐氮的去除率显著小于对总氮的去除效率,这可能与景观水中除了亚硝酸盐氮外还有其它含氮化合物存在,从实验结果可以推测该菌除了能有效去除亚硝酸盐氮外,对其他氮化合物依然有脱氮作用;此外,Y-12菌株对景观水中亚硝酸盐氮和总氮的去除效率显著低于在反硝化培养基的去除效率,这可能是景观水体中的物质组成成分和细菌种类不同有关,在反硝化培养基中,氮源单一,细菌只能利用亚硝酸盐氮作为氮源进行生长繁殖,因此对亚硝酸盐氮消耗快,进而表现出在反硝化培养基中脱氮率高于景观水处理;碳源也是以一个重要的影响因素,总所周知,分子简单的碳源比起分子相对复杂的碳源更有利于细菌生长繁殖和功能基因表达,在反硝化培养基中,细菌利用乙酸钠为唯一碳源,而在景观水中,碳源分子和碳源种类均相对复杂,细菌生长缓慢,脱氮效率低;此外,景观水中除了接种耐冷反硝化细菌Y-12菌悬液外,还存在其它的微生物,这些微生物不仅会与新接种的Y-12菌株竞争营养物质,而且还有可能将其他含氮物质转化为亚硝酸盐氮和生物量,间接降低了Y-12菌株处理景观水时的脱氮效率.以上所述原因均有可能导致Y-12菌株在复杂环境条件下脱氮效率降低,因此,该菌株的实际应用条件有待进一步优化.
4 结论(Conclusions)1)Pseudomonas putida Y-12菌株进行生物脱氮的最适pH 为7.0~8.0,温度为20 ℃,菌浓度为2.0×106 CFU · mL-1,高浓度的溶解氧和低浓度的亚硝酸盐有利于该菌进行反硝化作用,最佳碳源为柠檬酸钠,丁二酸钠次之,以柠檬酸钠为唯一碳源时对亚硝酸盐氮和总氮的去除率分别达到了100%和81.8%.
2)菌株Y-12以柠檬酸钠为唯一氮源进行反硝化脱氮时,总氮浓度由15.78 mg · L-1降至7.94 mg · L-1,产生了19559.82 mg · m-3 CO2和0.11 mg · m-3 N2O.
3)菌株Y-12在实验室条件下,15 ℃,48 h内对景观水体中亚硝酸盐氮和总氮的去除率高达37.7%和51.5%,对低温条件下自然景观水治理具有一定的应用潜力.
| [1] | Bonin P, Tamburini C, Michotey V. 2002. Determination of the bacterial processes which are sources of nitrous oxide production in marine samples[J]. Water Research, 36(3):722-732 |
| [2] | Carrera J, Vicent T, Lafuente F J. 2003. Influence of temperature on denitrification of an industrial high-strength nitrogen wastewater in a two-sludge system[J]. Water SA, 29(1):11-16 |
| [3] | 陈忠祥, 曹广斌, 杨谦, 等. 2011. 低温硝化细菌的筛选及特性研究[J]. 江苏农业科学, 39(4):284-286 |
| [4] | Čuhel J, Šimek M, Laughlin R J, et al. 2010. Insights into the effect of soil pH on N2O and N2 emissions and denitrifier community size and activity[J]. Applied and Environmental Microbiology, 76(6):1870-1878 |
| [5] | Ellis S, Howe M T, Goulding K W T, et al. 1998. Carbon and nitrogen dynamics in a grassland soil with varying pH:Effect of pH on the denitrification potential and dynamics of the reduction enzymes[J]. Soil Biology and Biochemistry, 30(3):359-367 |
| [6] | 傅利剑, 郭丹钊, 史春龙, 等. 2005. 碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J]. 农村生态环境, 21(2):42-45 |
| [7] | 国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京:中国环境科学出版社. 268-271 |
| [8] | Guo L Y, Chen Q K, Fang F, et al. 2013. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water[J]. Bioresource Technology, 142:45-51 |
| [9] | 何伟, 王薇, 王洁, 等. 2009. 一株好氧反硝化菌的分离鉴定及其混合应用特性研究[J]. 生态与农村环境学报, 25(2):88-93 |
| [10] | 洪美玲, 陈立侨, 孙新谨, 等. 2011. 亚硝酸盐急性胁迫对中华绒螯蟹幼体相关免疫指标和应激蛋白(HSP70)表达的影响[J]. 应用与环境生物学报, 17(5):688-693 |
| [11] | Hu Z, Lee J W, Chandran K, et al. 2012. Nitrous oxide (N2O) emission from aquaculture:a review[J]. Environmental Science & Technology, 46(12):6470-6480 |
| [12] | 环境保护部. 2012. HJ 636-2012 水质总氮的测定碱性过硫酸钾消解紫外分光光度法[S]. 北京:中国环境科学出版社 |
| [13] | Ji B, Wang H Y, Yang K. 2014. Tolerance of an aerobic denitrifier (Pseudomonas stutzeri) to high O2 concentrations[J]. Biotechnology Letters, 36(4):719-722 |
| [14] | Kim S W, Miyahara M, Fushinobu S, et al. 2010. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria[J]. Bioresource Technology, 101(11):3958-3963 |
| [15] | Kroupova H, Machova J, Svobodova Z. 2005. Nitrite influence on fish:a review[J]. Veterinarni Medicina-UZPI (Czech Republic), 50(11):461-471 |
| [16] | 李军, 闫爽, 邓娴, 等. 2012. 一株耐冷反硝化菌的分离鉴定及其反硝化特性[J]. 沈阳建筑大学学报(自然科学版), 28(4):722-727 |
| [17] | 廖绍安, 郑桂丽, 王安利, 等. 2006. 养虾池好氧反硝化细菌新菌株的分离鉴定及特征[J]. 生态学报, 26(11):3718-3724 |
| [18] | Otte S, Grobben N G, Robertson L A, et al. 1996. Nitrous oxide production by Alcaligenes faecalis under transient and dynamic aerobic and anaerobic conditions[J]. Applied and Environmental Microbiology, 62(7):2421-2426 |
| [19] | Pei H Y, Ji Y, Hu W R, et al. 2013. Denitrifying characterization and identification of a novel soil bacterium XP-2[J]. Desalination and Water Treatment, 52(37/39):6996-7003 |
| [20] | Philippot L, Andert J, Jones C M, et al. 2011. Importance of denitrifiers lacking the genes encoding the nitrous oxide reductase for N2O emissions from soil[J]. Global Change Biology, 17(3):1497-1504 |
| [21] | Poth M, Focht D D. 1985. 15N kinetic analysis of N2O production by Nitrosomonas europaea:An examination of nitrifier denitrification[J]. Applied and Environmental Microbiology, 49(5):1134-1141 |
| [22] | Rodriguez-Caballero A, Hallin S, Påhlson C, et al. 2012. Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J]. Water Science & Technology, 65(2):197-204 |
| [23] | Shi Z, Zhang Y, Zhou J T, et al. 2013. Biological removal of nitrate and ammonium under aerobic atmosphere by Paracoccus versutus LYM[J]. Bioresource Technology, 148:144-148 |
| [24] | Song Z F, An J, Fu G H, et al. 2011. Isolation and characterization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds[J]. Aquaculture, 319(1/2):188-193 |
| [25] | Takaya N, Catalan-Sakairi M A B, Sakaguchi Y, et al. 2003. Aerobic denitrifying bacteria that produce low levels of nitrous oxide[J]. Applied and Environmental Microbiology, 69(6):3152-3157 |
| [26] | 王茹, 郑平, 厉巍, 等. 2013. 耐碱反硝化菌株的分离鉴定与功能检测[J]. 微生物学报, 53(4):372-378 |
| [27] | 熊焰, 刘力源, 罗睿, 等. 2010. 1株亚硝酸盐降解菌的筛选、鉴定、降解条件及效果[J]. 中国水产科学, 17(6):1264-1271 |
| [28] | 于爱茸, 李尤, 俞吉安. 2005. 一株耐氧反硝化细菌的筛选及脱氮特性研究[J]. 微生物学杂志, 25(3):77-81 |
| [29] | 赵翠娟, 宋文军, 朱高雄, 等. 2013. 除氨氮菌在污水处理中的研究进展[J]. 生物技术通报, 1(2):31-34 |
| [30] | 周超, 高乃云, 楚文海, 等. 2011. 水体中亚硝酸盐生物毒性和去除的研究进展[J]. 给水排水, 37(5):104-108 |
| [31] | 周影茹, 陆玉芳, 施卫明. 2013. 一株根际好氧反硝化菌的筛选及其反硝化条件研究[J]. 土壤, 45(4):683-690 |
| [32] | 朱济成. 1995. 关于地下水硝酸盐污染原因的探讨[J]. 北京地质, (2):20-26 |
 2015, Vol. 35
2015, Vol. 35


