2. 中国农业科学院农业资源与农业区划研究所, 北京 100081;
3. 浙江大学环境与资源学院教育部环境修复与生态健康重点实验室, 杭州 310058
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081;
3. Ministry of Education Key Laboratory of Environment Remediation and Ecological Health, College of Environmental & Resource Sciences, Zhejiang University, Hangzhou 310058
锰毒害是酸性土壤中限制作物生长的重要因子,给农业生产带来了巨大的危害.在渍水条件下,土壤的氧化还原电位值迅速下降,可溶性锰明显增加会导致水稻锰毒害.研究表明,锰毒害严重影响了水稻的生长发育,高锰胁迫下,水稻敏感品种茎和根干重分别降低了17.4%和20.8%(Li et al., 2012),产量显著下降(李玉影等,2010).同时,高锰胁迫下,水稻植株体内抗氧化系统被破坏,根系和叶片受到伤害(李萍等,2011;Li et al., 2012).Si对许多作物的生长是有益的,水稻是典型的喜Si作物,水稻中SiO2含量占地上部分干重的10%~15%.施硅能促进水稻根系发育(李玉影等,2009),降低根冠比(刘平等,1987),改善水稻株型(冯元琦,2000),增加抗倒性(周青等,2001),增大最适叶面积,促进光合作用(柯玉诗等,1997)及增加产量(田福平等,2007;王远敏,2007)等.研究表明,加硅处理可以增加植物对生物和非生物胁迫的抵御能力(Dragišić Maksimović et al. 2007;Liang et al., 2007; Ma,2004;Neumann et al., 1997),其中,Si缓解镉毒( Da Cunha et al., 2009; Song et al., 2009)、铝毒(Zsoldos et al., 2003)和锌毒(Kaya et al., 2009;Song et al., 2011,2014)的效果显著.目前,Si缓解锰毒害的相关研究主要集中在Si 降低Mn的吸收(Horiguchi,1988),抑制Mn从根到茎的转运(Li et al., 2012),影响Mn的分布(Iwasaki et al., 1999; Rogalla et al., 2002; Iwasaki et al., 2002; Führs et al., 2009,2012; Doncheva et al., 2009),提高抗氧化系统活性(Shi et al., 2005; Dragišić Maksimović et al. 2007 Feng et al., 2009; Führs et al., 2009,2012; Li et al., 2012)等方面.
植物体内的重金属多是以结合态的形式存在,如细胞内的有机酸、氨基酸、谷胱甘肽这些小分子物质及金属硫蛋白等大分子物质都可以通过与重金属反应形成沉淀或鳌合物来降低植株体内自由态的重金属含量,从而减轻重金属对植物的毒害.重金属在植物体内的分布及形态常因植物种类和重金属类型的不同而存在差异.因此,了解植物体内重金属的分布和化学形态变化,对于阐明植物对重金属的富集和解毒机理十分重要.同步辐射X-射线荧光(SRXRF)具有高亮度、高灵敏度、对样品破坏小及可以同时快速检测多种元素等优点(Shi et al., 2004),因此,SRXRF通常被应用于植物组织中的元素定位分析,特别是一些含量低的元素.目前,SRXRF常用作定性分析,但其荧光计数(counts)可以代表元素的相对含量,因此,同一元素不同处理间具有可比性.X-射线吸收精细结构(XAFS)可以直接得到植物体内微量元素的氧化态、近边原子和配位数等化学信息,而不需要对样品进行复杂的提取和分离等前处理,可以直接对复杂的植物活体样品进行无损分析(Pierzynski,1998),因此,在研究植物体内元素的化学形态及其分布方面具有独特的优势,已逐渐成为环境和生物领域中进行形态分析的重要手段(Parsons et al., 2002).同步辐射技术为研究植物对金属元素吸收、转运及重金属离子解毒等提供了更加灵敏和精准的分析方法,但目前普遍用于土壤元素形态和价态研究,如铜、锌、锰.植物上的研究主要集中在砷超积累植物(陈同斌等,2004;黄泽春等,2003)、锰超积累植物(徐向华等,2008)及植物对重金属污染响应(曹清晨等,2009;娄玉霞等,2011)等方面.
前期研究表明,锰胁迫下,水稻生长受到抑制,水稻植株体内抗氧化系统受到破坏,施硅之后这些锰毒害症状会得到缓解(李萍等,2011;Li et al., 2012).但硅对锰胁迫下水稻体内营养元素含量的影响还不清楚,因此,本文采用SRXRF和XAFS研究水稻叶中元素的分布特征和Mn 的价态变化,以揭示 Mn 胁迫下硅影响元素在水稻组织水平上的分布和形态机制,为减轻锰毒提供理论依据.
2 材料与方法(Materials and methods) 2.1 植物培养试验材料:供试水稻品种为新香优640(锰敏感型XXY)和株两优99(耐锰型ZLY),品种根据重金属耐性指数(TI=L处理/L对照,其中,L为根长)(Monni et al., 2001)筛选获得.
试验处理:Mn的浓度分别为6.7 μmol·L-1(正常锰,Kimura B营养液中的浓度)和2 mmol·L-1(高锰,MnSO4·H2O),Si的浓度分别为0 mmol·L-1和1.5 mmol·L-1(硅酸钠NaSiO3·9H2O),采用二因素随机区组设计,共4个处理,3次重复.试验处理Mn浓度设计依据文献(李萍等,2011).
植物培养:将水稻种子用0.5%次氯酸钠溶液消毒15 min后,浸种12 h,在28 ℃下催芽72 h,然后在人工气候室用育苗盘培养.当水稻长到一叶一心时,移到具有带孔盖板的塑料桶(直径19 cm,高18 cm)中培养.第1周使用0.5倍浓度的 Kimura B(Liang et al., 2006)营养液,1周后再用完全Kimura B营养液,调 pH 值至5.6,每4 d 换1次营养液.水稻的培养在中国农业科学院资源区划所人工生长室内进行,白天室温27 ℃,夜晚室温23 ℃,每天光照时间12 h.生长到五叶一心时,进行处理,处理3 d进行元素含量的测定.
2.2 元素含量测定叶片的扫描在中国科学院高能物理研究所正负电子对撞机的4W1A 同步辐射X射线荧光分析实验站上进行.测定时贮存环的电子能量为2.2 GeV,束流强度为78~120 mA.处理3 d后选取完全展开的第2片水稻叶片和根系,用去离子水淋洗,表面干燥后将样品用3M胶带固定在微机程控三维样品移动平台上进行XRF 扫描,移动平台步进精度为5 μm·步-1.调节水平和垂直两个狭缝,将入射白光的光斑限为50 μm×50 μm,样品与入射光束成45°,样品与探测器的距离为6.5 cm.通过光学显微镜准确定位扫描点的位置,测量的荧光信号输入多道能谱仪,得到同步辐射X 射线微束激发植物样品的能谱图.采用PyMca4.41软件对获得的XRF 数据进行解谱,得到样品 XRF 谱线中各元素特征峰的峰面积,采用能谱的As峰对各元素的特征峰面积进行归一,得到各元素的相对含量.多元素的方差分析采用SAS 8.0软件进行,作图软件使用0rigin 8.0软件进行.
2.3 X射线吸收光谱(XAS)的测定样品中Mn 的K边吸收峰在中国科学院高能物理研究所正负电子对撞机的4W1A光束线扩展X射线吸收精细结构光谱(EXAFS)实验站上测量.储存环能量和最大电流强度分别为2.2 GeV和140 mA.单色器 Si(111)平面双晶,通过偏转Si(111)平面双晶的平行度使光强比最大光强低30%来消除高次谐波对X射线吸收光谱信号的干扰.将样品置于Lytle型荧光电离室内,用荧光法探测Mn的K边吸收谱信号(Mn的K边为6539 eV),荧光电离室探测器充Ar,采用Cr滤波片.荧光法测定Mn的参比物质如氯化锰、柠檬酸锰、草酸锰和组氨酸锰,而其他参比物质二氧化锰、硫酸锰和乙酸锰粉末用透射法进行测定.用IFEFFIT 软件对XANES谱进行最小二乘法拟合.
2.4 数据分析实验数据在Excel下建立数据库,用Sigmaplot作图,并用 Sigmastat 统计软件进行方差分析和差异显著性分析.
3 结果(Results) 3.1 锰及与其他元素在水稻叶片组织水平的分布特征利用SRXRF同时检测到水稻叶片和根系中Cl、Ar、K、Ca、Mn、Fe、Cu、Zn等元素的特征峰(图 1).同一组织中相同元素在不同处理下的含量是不相同的(图 2),但各个元素之间存在一定的相关性.在叶中,与对照相比,锰处理下耐性品种和敏感品种Mn的含量都显著增高,但耐性品种增加较多,敏感品种增加36倍,耐性品种增加88倍.Mn胁迫下,施硅处理显著降低了两个品种的Mn含量(图 2a).与对照相比,仅施硅处理会降低敏感品种叶片中K、Ca、Fe和Zn的元素含量,耐性品种影响不大(图 2b、c、d、f).
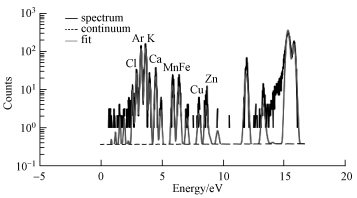 |
| 图 1 水稻组织切片典型的SRXRF图谱 Fig.1 A typical SRXRF spectrum of rice slice |
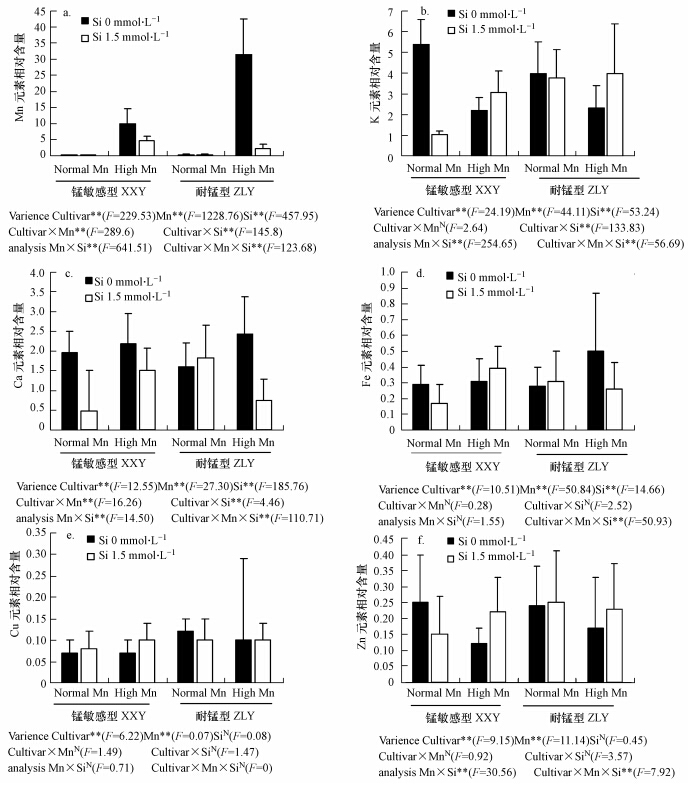 |
| 图 2 SRXRF 测定水稻叶片组织各元素的相对含量 Fig.2 The relative content in leaves of rice measured by SRXRF |
与对照相比,锰胁迫处理显著降低了两个品种叶片中的K和Zn元素含量(图 2b、f),敏感品种K含量降低了59.4%,Zn含量降低了52%,耐性品种K含量降低了41.6%,Zn元素含量降低了29.2%.Mn胁迫下,施硅后两个品种的K和Zn元素含量又显著增加.
与对照相比,锰胁迫下,敏感品种叶片中的Ca、Fe和Cu元素含量不受影响,而耐性品种的Ca和Fe元素含量显著增高,Ca含量增加了52.8%,Fe含量增加了78.6%,Cu元素含量稍有下降(图 2c、d、e).Mn胁迫下,加硅处理后与单Mn处理相比,敏感品种的Fe和Cu元素含量显著提高(图 2d、e).
3.2 锰及与其他元素在水稻根系组织水平的分布的特征与对照相比,Mn 处理下耐性品种和敏感品种根尖 Mn 的含量显著增高,但耐性品种增加较多,敏感品种 Mn 含量增加了78.3%,耐性品种却增加了16倍.Mn胁迫下,施Si后两个品种的Mn含量都显著降低(图 3a).与对照相比,Mn 胁迫下,敏感品种根尖 K元素含量显著增高,而耐性品种却显著降低,敏感品种增加了258%,耐性品种降低了56.7%(图 3b).Mn 胁迫下,施 Si 后,两个品种的 K 元素变化正好相反,敏感品种显著降低,耐性品种显著升高(图 3b).
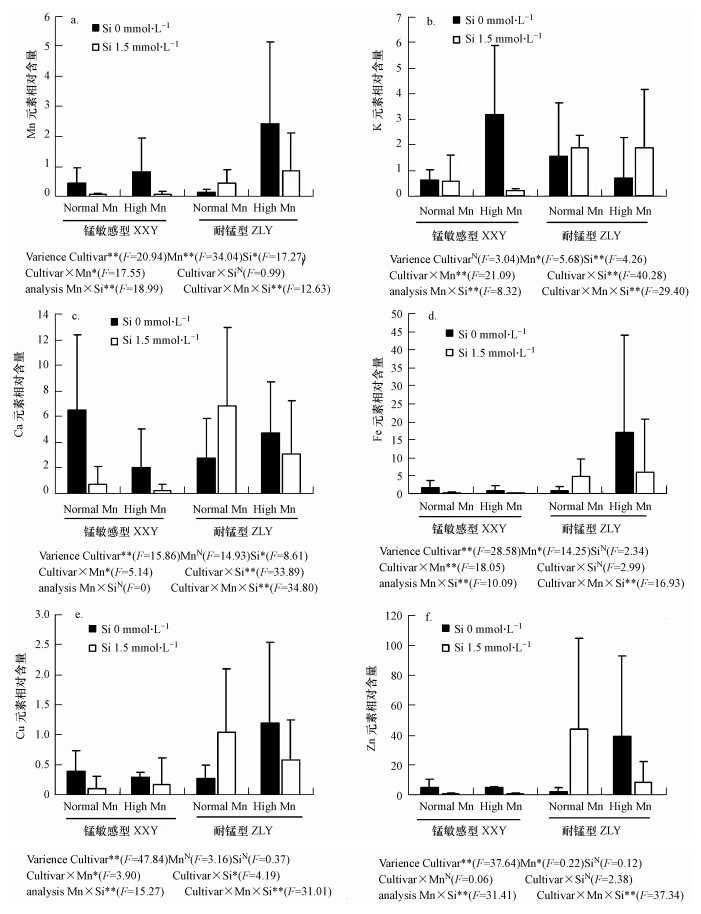 |
| 图 3 SRXRF 测定水稻根尖组织各元素的相对含量 Fig.3 The relative content in roots of rice measured by SRXRF |
与对照相比,Mn 胁迫下,敏感品种根尖的 Ca 元素含量显著降低,而耐性品种却显著增加,敏感品种降低了65.6%,耐性品种增加了73%(图 3c).与对照相比,Mn 胁迫下,敏感品种根尖的Fe、Cu和Zn 元素含量不受影响,而耐性品种这3种元素含量却显著增加(图 3d、e、f).无论是在正常Mn浓度下还是高 Mn浓度下,施Si处理对敏感品种Fe元素含量有抑制作用;高Mn浓度下,施硅后,耐性品种Fe元素含量显著降低.高Mn胁迫下,与正常 Mn 处理相比,施硅后基本不影响敏感品种的 Cu和Zn 元素含量,而耐性品种的 Cu和Zn 元素含量显著降低.
3.3 锰在水稻叶片的化学形态XANES给我们提供了吸收原子的氧化状态,通过Mn的K-边吸收峰的能量位置表征,Mn的价态越低其K-边吸收峰出现的能量就越低.各种参比物质中Mn的K-边吸收峰所出现的能量位置均在6539 eV处左右,从图 4可以看到,两个样品的K-边吸收峰也出现在同样的位置,表明两个水稻品种吸收Mn后,Mn的价态并未发生改变,均以二价Mn的形式存在,且主要是硫酸锰.施硅后,水稻体内的锰形态不发生改变.
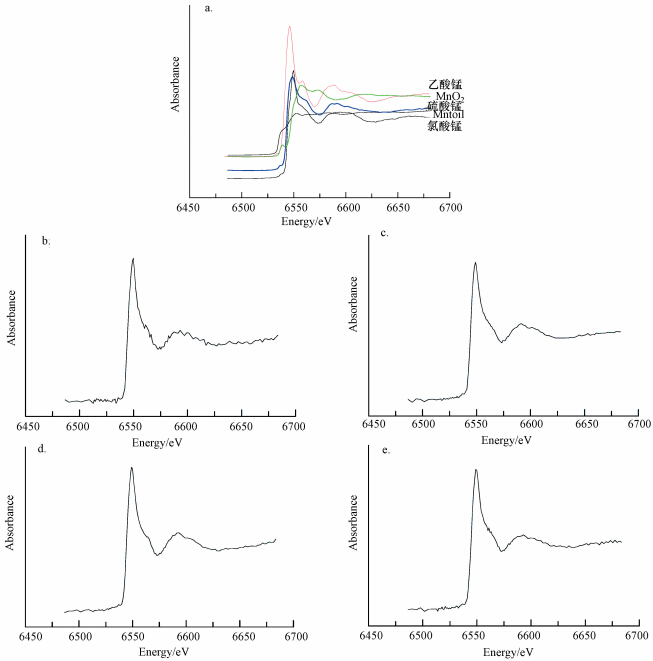 |
| 图 4 参比物质(a)、敏感品种(b、c)和耐性品种(d、e)水稻叶片中Mn的K边 EXAFS谱 Fig.4 Mn K-edge EXAFS spectra for some Mn reference compounds(a) and for the plant samples(b.Mn treatment in Mn sensitive cultivar,c.Mn+Si treatment in Mn sensitive cultivar,d.Mn treatment in Mn tolerant cultivar,e.Mn+Si treatment in Mn tolerant cultivar) |
前期研究表明,锰胁迫下,敏感品种受到显著伤害,叶片卷曲,出现暗褐色斑点(Li et al., 2012),根系受到伤害(李萍等,2011),根系(李萍等,2011)和叶片(Li et al., 2012)的抗氧化系统平衡受到破坏;而耐性品种毒害症状不明显.本研究继续对锰胁迫水稻下营养元素含量变化进行研究.锰胁迫下,耐性品种根系和叶片中的锰含量都显著高于敏感品种,施硅之后都显著降低.锰胁迫对两个水稻品种根系中元素含量的影响是截然相反的,高锰胁迫下,敏感品种除K含量显著增加外,其它元素Ca、Cu、Fe和Zn含量都下降.而耐性品种除K含量显著下降外,其它元素Ca、Cu、Fe和Zn含量都显著增加.高锰条件下诱导的敏感品种元素缺乏导致营养不平衡是锰毒发生的机理之一.高锰胁迫会诱导钙、镁、铁等元素缺乏,从而导致大麦体内的营养不平衡致使锰毒害发生(Alam et al., 2002).Alam等(2003)的研究表明,水稻幼苗中K含量的提高有利于锰毒害的降低.本研究中高锰胁迫抑制了敏感品种K元素从根部向叶片的转移,而降低了耐性品种根部吸收K元素的能力,这有可能因为高Mn 胁迫下,K+通道被破坏,从而降低了K元素的吸收和转移. Le Bot等(1990)研究表明,高锰胁迫会显著降低西红柿叶片中钙的浓度.本研究中高Mn毒害下,敏感品种根系的Ca元素含量也显著降低,这表明敏感品种Mn与Ca竞争转运载体,Mn和Ca之间表现拮抗关系.研究表明,过量的锰降低了大麦对铁的吸收(Beauchamp et al., 1972).但Morita等(2006)研究表明,过量的锰不会影响茶叶对Fe的吸收,但会引起Fe功能的失调,使有生理活性的Fe2+转变成钝化的Fe3+,从而使铁积累在生物体内产生毒害.本研究中高Mn毒害下,敏感品种的叶片和根系的Fe元素含量不受影响,这表明敏感品种在锰毒害下有可能Fe功能失调,钝化成Fe3+.Korshunova(1999)研究表明,Zn转运蛋白IRT1通过运输锰来增强对锰毒的耐性.López-Millán等(2004)的研究也表明豆类植物的MtZIP上调表达也能增加锰的运输,这表明Mn和Zn可能利用相同的运输载体进行吸收和运输,因此,二者之间为拮抗关系,这也可以解释敏感品种锰胁迫下叶片中的Zn含量显著降低是由于大量的Mn和Zn竞争运输载体,导致输送到叶片的Zn显著减少.但锰胁迫下,耐锰性水稻,还有锰超积累植物商陆(段海风等,2012)Fe、Zn的含量显著增加.耐性品种在锰胁迫下Ca 元素含量显著增加,类似的报道在锰超级累植物商陆在锰胁迫下茎中Ca 元素相对含量也显著增加(段海风等,2012).如此看来,锰与其他离子之间的相互关系比较复杂,受品种因素影响,要了解其真正的机制还需要进行深入研究.
硅对水稻品种根系中元素含量的影响也是截然相反的,正常锰浓度下,施Si后,敏感品种除K元素外其余各元素含量显著下降,而耐性品种各元素含量却显著增加.李晓艳(2013)也报道了喜硅作物水稻在高硅处理下元素含量下降的现象.高锰胁迫下,施硅后,锰-硅离子的交互作用使敏感品种和耐性品种(除K元素外)各元素含量都显著降低.过量的锰会影响植物对其它营养元素的吸收和利用,但施硅之后,这种毒害被缓解,这可能因为硅使水稻根系氧化力提高,水稻根际的Mn2+易被根系氧化成不溶形态并沉积在根系表面,减少了水稻对锰的吸收(Islam et al., 1969),从而降低了对K+通道的破坏.锰胁迫下施硅后,敏感品种根系中的Ca含量显著下降,可能是因为硅易与钙结合沉积在根系外部,阻碍游离钙进入根系内部(Marschner,2001).硅降低敏感品种根系Cu含量可能是因为硅酸根与Cu 形成硅酸化合物沉淀或因硅肥增加了水稻根际氧化能力,氧化Cu 降低其溶解度等综合原因导致有效态Cu 含量降低(卢志红等,2013).Si可能使Zn绑定在细胞壁上从而降低敏感品种根系中Zn的含量,类似的研究见Neumann 等(1997)的报道.硅能逆转锰胁迫对耐性品种根系中营养元素含量的不利影响,锰胁迫下K含量显著下降,其它元素Ca、Cu、Fe和Zn含量都显著增加,施硅后K含量显著增加,其它元素Ca、Cu、Fe和Zn含量都显著下降,叶片中的变化趋势也是如此.因此,Si对耐性品种中各元素含量保持相对平衡具有重要作用.
水稻叶片中的锰主要以硫酸锰的形式存在,这可能是因为营养液中是以硫酸锰的形式施入过量锰,所以水稻体内的锰形式大部分是硫酸锰,施硅后锰等形态不发生改变.
由于用光机时有限、光的能量及样品制备方法等限制,对茎中各元素含量没有进行测定,该工作仅处于初步阶段,有待于进一步研究.
5 结论(Conclusions)过量Mn胁迫下,水稻体内营养元素平衡会被破坏,尤其是对敏感品种破坏较大.高Mn胁迫下,加Si后,两个品种的根系和叶片中 Mn 的含量都显著降低,并使锰胁迫下各元素含量保持相对平衡,从而减轻锰毒害.水稻体内的锰形式大部分是硫酸锰,施硅后锰的形态不发生改变.
| [1] | Alam S,Rhanman M H,Kamei S,et al.2002.Alleviation of manganese toxicity and manganese-induced iron deficiency in barley by additional potassium supply in nutrient solution[J].Soil Science and Plant Nutrition,48(3):387-392 |
| [2] | Alam S,Kamei S,Kwaai S.2003.Amelioration of manganese toxicity in young rice seedlings with potassium[J].Journal of Plant Nutrition,26(6):1301-1304 |
| [3] | Beauchmap E G,Rossi N.1972.Effects of Mn and Fe supply on the growth of barley in nutrient solution[J].Canadian Journal of Plant Science,52(4):575-581 |
| [4] | 曹清晨,娄玉霞,张元勋,等.2009.同步辐射XRF和XANES研究重金属污染环境中小羽藓体内硫元素的生物指示作用[J].环境科学,30(12):3663-3668 |
| [5] | 陈同斌,黄泽春,黄宇营,等.2004.蜈蚣草羽叶中砷及植物必需营养元素的分布特点[J].中国科学C辑 生命科学,34(4):304-309 |
| [6] | Da Cunha K P V,Do Nascimento C W A.2009.Silicon effects on metal tolerance and structural changes in Maize (Zea mays L.) grown on a cadmium and zinc enriched soil[J].Water,Air,and Soil Pollution,197(1/4):323-330 |
| [7] | Doncheva Sn,Poschenrieder C,Stoyanova Zl,et al.2009.Silicon amelioration of manganese toxicity in Mn-sensitive and Mn-tolerant maize varieties[J].Environmental and Experimental Botany,65(2/3):189-197 |
| [8] | Dragišić Maksimović J,Bogdanović J,Maksimović V,et al.2007.Silicon modulates the metabolism and utilization of phenolic compounds in cucumber (Cucumis sativus L.) grown at excess manganese[J].Journal of Plant Nutrition and Soil Science,170(6):739-744 |
| [9] | 段海风,刘四喜,郭志强,等.2012.锰胁迫对商陆生长和吸收钙、镁、铁、锌二价离子的影响[J].湖南农业科学,(19):71-74 |
| [10] | Feng J P,Shi Q H,Wang X F.2009.Effects of exogenous silicon on photosynthetic capacity and antioxidant enzyme activities in chloroplast of cucumber seedlings under excess manganese[J].Agricultural Sciences in China,8(1):40-50 |
| [11] | 冯元琦.2000.硅肥应成为我国农业发展中的新肥种[J].化肥工业,27(4):9-11; 36 |
| [12] | Führs H,G tze S,Specht A,et al.2009.Characterization of leaf apoplastic peroxidases and metabolites in Vigna unguiculata in response to toxic manganese supply and silicon[J].Journal of Experimental Botany,60(6):1663-1678 |
| [13] | Führs H,Specht A,Erban A,et al.2012.Functional associations between the metabolome and manganese tolerance in Vigna unguiculata[J].Journal of Experimental Botany,63(1):329-340 |
| [14] | Horiguchi T. 1988.Mechanism of manganese toxicity and tolerance of plants. IV. effect of silicon on alleviation of manganese toxicity of rice plants[J]. Soil Science and Plant Nutrition, 34:65-73 |
| [15] | 黄泽春,陈同斌,雷梅,等.2003.砷超富集植物中砷化学形态及其转化的EXAFS研究[J].中国科学C辑,33(6):488-494 |
| [16] | Islam A,Saha R C.1969.Effects of silicon on the chemical composition of rice plants[J].Plant and Soil,30(3):446-458 |
| [17] | Iwasaki K,Matsumura A.1999.Effect of silicon on alleviation of manganese toxicity in pumpkin (Cucurbita moschata Duch cv.Shintosa)[J].Soil Science and Plant Nutrition,45(4):909-920 |
| [18] | Iwasaki K,Maier P,Fecht M,et al.2002.Effects of silicon supply on apoplastic manganese concentrations in leaves and their relation to manganese tolerance in cowpea (Vigna unguiculata (L.) Walp.)[J].Plant and Soil,238(2):281-288 |
| [19] | Kaya C,Tuna A L,Sonmez O,et al.2009.Mitigation effects of silicon on maize plants grown at high zinc[J].Journal of Plant Nutrition,32(10):1788-1798 |
| [20] | 柯玉诗,黄小红,张壮塔,等.1997.硅肥对水稻氮磷钾营养的影响及增产原因分析[J].东北农业科学,(5):25-27 |
| [21] | Korshunova Y O,Eide D,Clark W G,et al.1999.The IRT1 protein from Arabidopsis thaliana is a metal transporter with a broad substrate range[J].Plant Molecular Biology,40(1):37-44 |
| [22] | Le Bot J,Kirkby E A,Van Beusicchem M L.1990.Manganese toxicity in tomato Plants:Effects on cation uptake and distribution[J].Journal of Plant Nutrition,13(5):513-525 |
| [23] | Li P,Song A L,Li Z J,et al.2012.Silicon ameliorates manganese toxicity by regulating manganese transport and antioxidant reactions in rice (Oryza sativa L.)[J].Plant and Soil,354(1/2):407-419 |
| [24] | 李萍,宋阿琳,李兆君,等.2011.硅对过量锰胁迫下水稻根系抗氧化系统和膜脂质过氧化作用的调控机理[J].环境科学学报,31(7):1542-1549 |
| [25] | 李晓艳.2013.不同吸硅型植物硅同位素组成和营养元素分布特征[D].杭州:浙江大学.43-51 |
| [26] | 李玉影,刘颖,刘双全,等.2009.黑龙江省水稻硅肥效果研究[J].黑龙江农业科学,(3):60-63 |
| [27] | 李玉影,刘颖,刘双全,等.2010.铁锰胁迫条件下水稻硅肥效果研究[A]//中国植物营养与肥料学会2010年学术年会论文集[C].北京:中国植物营养与肥料学会 |
| [28] | Liang Y C,Hua H X,Zhu Y G,et al.2006.Importance of plant species and external silicon concentration to active silicon uptake and transport[J].New Phytologist,172(1):63-72 |
| [29] | Liang Y C,Sun W C,Zhu Y G,et al.2007.Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants:A review[J].Environmental Pollution,147(2):422-428 |
| [30] | 刘平,何继英,贺宁,等.1987.硅浓度对水稻生长、含水量、根冠比和过氧化物酶活性的影响[J].贵州农业科学,16(3):6-9 |
| [31] | López-Millán A F,Ellis D R,Grusak M A.2004.Identification and characterization of several new members of the ZIP family of metal ion transporters in Medicago truncatula[J].Plant Molecular Biology,54(4):583-596 |
| [32] | 娄玉霞,张元勋,俞鹰浩,等.2011.基于同步辐射光源的X 射线荧光分析技术研究匐枝青藓对铅污染的生物响应[J].环境科学学报,31(1):193-198 |
| [33] | 卢志红,谭雪明,朱美英,等.2013.硫硅配施对土壤铜形态和水稻吸收铜的影响[J].农业环境科学学报,32(9):1806-1813 |
| [34] | Ma J F.2004.Role of silicon in enhancing the resistance of plants to biotic and abiotic stresses[J].Soil Science and Plant Nutrition,50(1):11-18 |
| [35] | Marschner H.2001.高等植物的矿质营养[M].李春俭,译.北京:中国农业大学出版社.289-306 |
| [36] | Morita A,Yokota H,Ishka M R,et al.2006.Changes in peroxidase activity and lignin content of cultured tea cells in response to excess manganese[J].Soil Science and plant Nutrition,52(1):26-31 |
| [37] | Monni S,Uhlig C,Hansen E,et al.2001.Ecophysiological responses of Empetrum nigrum to heavy metal pollution[J].Environmental Pollution,112(2):121-129 |
| [38] | Neumann D,Zur Nieden U,Schwieger W,et al.1997.Heavy metal tolerance of Minuartia verna[J].Journal of Plant Physiology,151(1):101-108 |
| [39] | Parsons J G,Aldrich M V,Gardea-Torresdey J L.2002.Environmental and biological applications of extended X-ray absorption fine structure (EXAFS) and X-ray absorption near edge structure (XANES) spectroscopies[J].Applied Spectroscopy Reviews,37(2):187-222 |
| [40] | Pierzynski G M.1998.Past,present,and future approaches for testing metals for environmental concerns and regulatory approaches[J].Communications in Soil Science and Plant Analysis,29(11/14):1523-1536 |
| [41] | Rogalla H,R mheld V.2002.Role of leaf apoplast in silicon-mediated manganese tolerance of Cucumis sativus L[J].Plant,Cell and Environment,25(4):549-555 |
| [42] | Shi J Y,Chen Y X,Hunag Y Y,et al.2004.SRXRF microprobe as a technique for studying elements distribution in Elsholtzia Splendens[J].Micro,35(7):557-564 |
| [43] | Shi Q H,Bao Z Y,Zhu Z J,et al.2005.Silicon-mediated alleviation of Mn toxicity in Cucumis sativus in relation to activities of superoxide dismutase and ascorbate peroxidase[J].Phytochemistry,66(13):1551-1559 |
| [44] | Song A L,Li Z J,Zhang J,et al.2009.Silicon-enhanced resistance to cadmium toxicity in Brassica chinensis L.is attributed to Si-suppressed cadmium uptake and transport and Si-enhanced antioxidant defense capacity[J].Journal of Hazardous Materials,172(1):74-83 |
| [45] | Song A L,Li P,Li Z J,et al.2011.The alleviation of zinc toxicity by silicon is related to zinc transport and antioxidative reactions in rice[J].Plant and Soil,344(1/2):319-333 |
| [46] | Song A L,Li P,Li Z J,et al.2014.The effect of silicon on photosynthesis and expression of its relevant genes in rice (Oryza sativa L.) under high-zinc stress[J].PLoS One,9(11):e113782 |
| [47] | 田福平,陈子萱,张自和,等.2007.硅对植物抗逆性作用的研究[J].中国土壤与肥料,(3):10-14 |
| [48] | 王远敏.2007.硅对水稻生长发育及产量品质的影响研究[D].重庆:西南大学.15-28 |
| [49] | 徐向华,施积炎,陈新才,等.2008.锰在商陆叶片的细胞分布及化学形态分析[J].农业环境科学学报,27(2):515-520 |
| [50] | 周青,潘国庆,施作家,等.2001.不同时期施用硅肥对水稻群体质量及产量的影响[J].耕作与栽培,(3):25-27 |
| [51] | Zsoldos F,Vashegyi A,Pecsvaradi A,et al.2003.Influence of silicon on aluminium toxicity in common and durum wheats[J].Agronomy,23(4):349-354 |
 2015, Vol. 35
2015, Vol. 35


