砷是一种自然界中普遍存在的非金属元素,价态有+5、+3、0、-3等4种(Smedley et al., 2002).在自然环境中砷通常以砷酸(H3AsO4)、亚砷酸(H3AsO3)及其阴离子存在.由于农药、含砷废水等外源的进入以及生物转化的作用,有机砷如二甲基砷酸盐(DMA)、一甲基砷酸盐(MMA)等也在地下水、湖泊和河流中发现(徐忠厚和孟晓光,2011;Mandal and Suzuki, 2002).毒理学研究表明,一些有机砷(包括DMA,MMA)的毒性比最初预想强很多(Petrick et al., 2000).
相对无机砷的去除工作,甲基砷(DMA和MMA)的去除研究鲜有报道,而且主要集中在使用活性碳、锰绿砂、氧化铁包覆砂以及纳米TiO2等材料(Guan et al., 2012),并且去除效率远低于无机砷.因此如果甲基砷能够高效转化为无机砷,这样就能够通过去除无机砷间接去除甲基砷.纳米二氧化钛(TiO2)因具有较大比表面积,性质稳定且无毒,作为环境中常见的纳米材料应用于去除环境污染物,如无机砷(As(V)和As(III))等(Luo et al., 2010).纳米TiO2同时也具有强光催化性能,在紫外(UV)作用下,电子发生跃迁,使原来的空带上获得带负电的高活性电子e,在原来的满带上形成带正电的空穴h+,所生成的电子和空穴对能够与吸附的氧气等反应产生多种活性氧自由基(Linsebigler et al., 1995).作为一种高效的光催化剂,应用纳米TiO2催化As(III)氧化为As(V)的研究已有不少报道(Bissen et al., 2001;Dutta et al., 2005;Lee and Choi, 2002),但应用纳米TiO2催化转化DMA,MMA的报道较少(Jing et al., 2005;Xu et al., 2008),尤其是就其光催化转化产物解析,二次吸附及二次污染等方面仍值得进一步研究.
本实验室前期通过水解硫酸氧钛的方法合成了纳米TiO2,能够高效去除无机砷(Luo et al., 2010).为了有效去除甲基砷(DMA和MMA),本文应用此纳米TiO2研究了甲基砷(DMA和MMA)光催化转化过程,主要考察了不同光照条件和pH条件的影响,通过测定液相及固相中的不同组分,解析光催化转化产物,考察纳米TiO2对甲基砷的去除性能,为后续的实际应用提供理论依据.
2 材料与方法(Materials and methods) 2.1 材料与试剂二甲基胂酸(DMA,C2H7AsO2),购自Sigma Chemical.一甲基胂酸(MMA,CH3H2AsO3),购自Chem Service.DMA和MMA在不同pH条件下的形态分布见图 1.实验中配制浓度为1000 mg · L-1的储备液,避光保存于4 ℃.实验过程中应用1 mol · L-1 硝酸(优级纯)和氢氧化钾(优级纯)调节pH值.实验中所用纳米TiO2是在4 ℃条件下水解硫酸氧钛制得,比表面积为196 m2 · g-1,等电点为5.8(Luo et al., 2010).
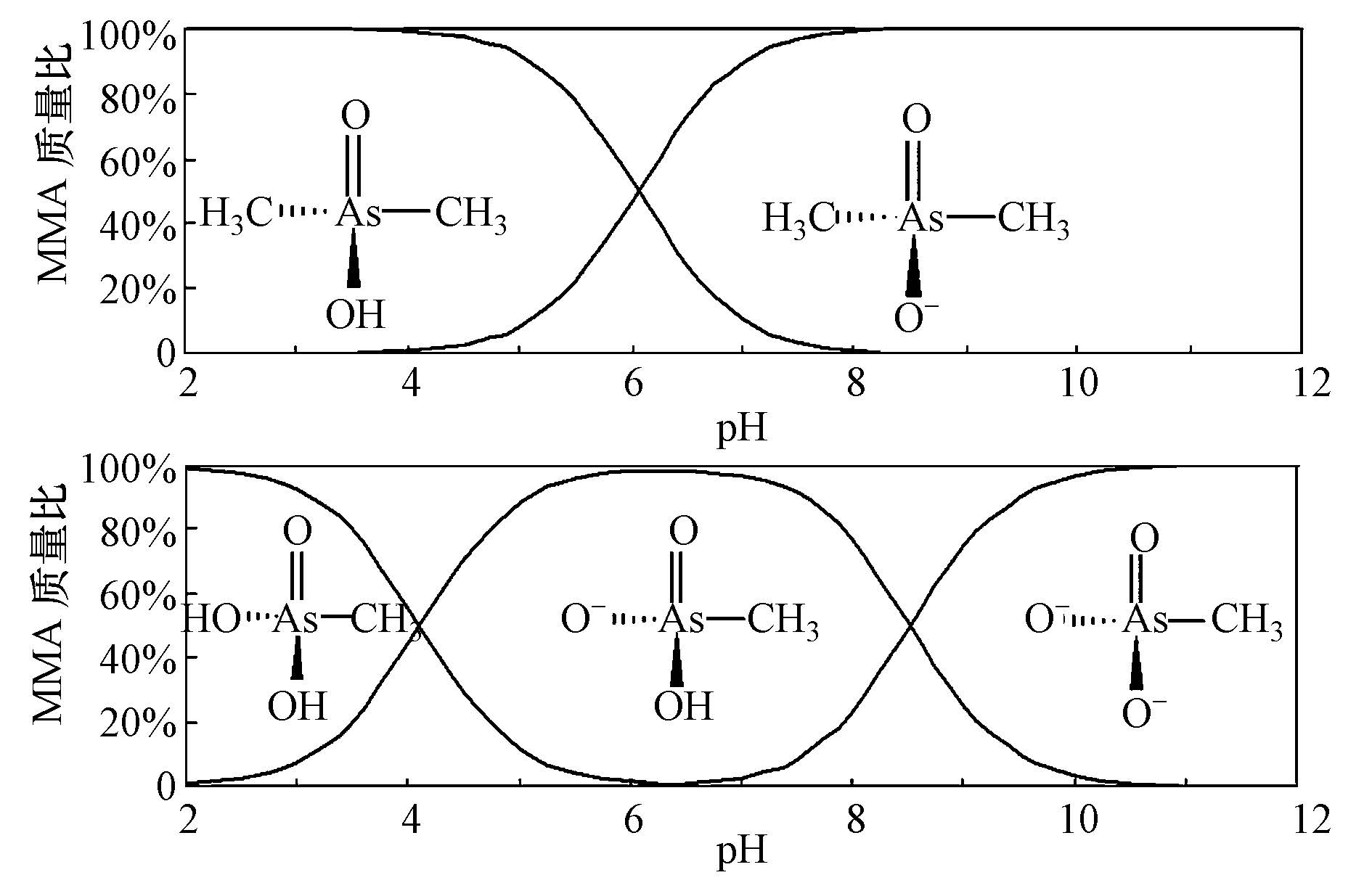 |
| 图1 DMA和MMA在不同pH下的形态分布 Fig.1 Species distribution of DMA and MMA at different pH |
通过稀释DMA、MMA的储备液分别配制浓度为1 mg · L-1的DMA和MMA溶液.称取0.01 g纳米TiO2分别加入50 mL DMA和MMA溶液中,调节溶液pH值为3,5,7和9.在旋转培养器(WH-962,华利达实验设备公司)上旋转反应240 min,定时取样并用0.22 μm 滤膜过滤,滤液经0.1% HNO3酸化后,用HPLC-AFS(吉天,中国)分别测定滤液中DMA和MMA的浓度,计算不同时刻纳米TiO2对DMA和MMA的去除率.
为考察纳米TiO2对DMA和MMA的光催化转化效率,在光化学反应器(UV,λ=254 nm,CEL-WLPM10-254,中教金源科技有限公司)重复上述步骤,计算UV光下不同时刻纳米TiO2对DMA和MMA的去除率.
实验过程中,自然光中紫外光(λ=254 nm)的强度为1.5 μW · cm-2;光化学反应器的紫外光(λ=254 nm)的强度为4030 μW · cm-2.
2.2.2 转化产物测定为分析DMA和MMA的光转化产物,配制100 μg · L-1的DMA和MMA溶液中,投加0.01 g · L-1纳米TiO2,调节pH值为5.旋转培养1440 min,定时取样过滤测定滤液中DMA,MMA和As(V)的浓度,计算不同时刻下DMA和MMA的转化率.上述过程分别在光化学反应器,暗室以及不做任何光照处理下进行,以考察UV光、自然光及无光条件对纳米TiO2催化转化DMA和MMA的影响.
为测定固相上纳米TiO2吸附的产物,将反应结束后的悬浊液用0.45 μm 滤膜过滤,过滤得到的纳米TiO2滤饼与0.1 mol · L-1 NaOH混合1 h,用0.22 μm 滤膜过滤.滤液经0.1% HNO3酸化,用HPLC-AFS测定不同形态砷浓度,并计算不同形态砷所占的比率.
3 结果与讨论(Results and discussion) 3.1 pH及光照对纳米TiO2去除DMA和MMA的影响pH对纳米TiO2在自然光(Room)和紫外光(UV)下去除DMA和MMA的影响实验结果(图 2)表明,在试验时间(240 min)内,在所有pH条件下纳米TiO2对DMA和MMA均存在一定程度的去除.
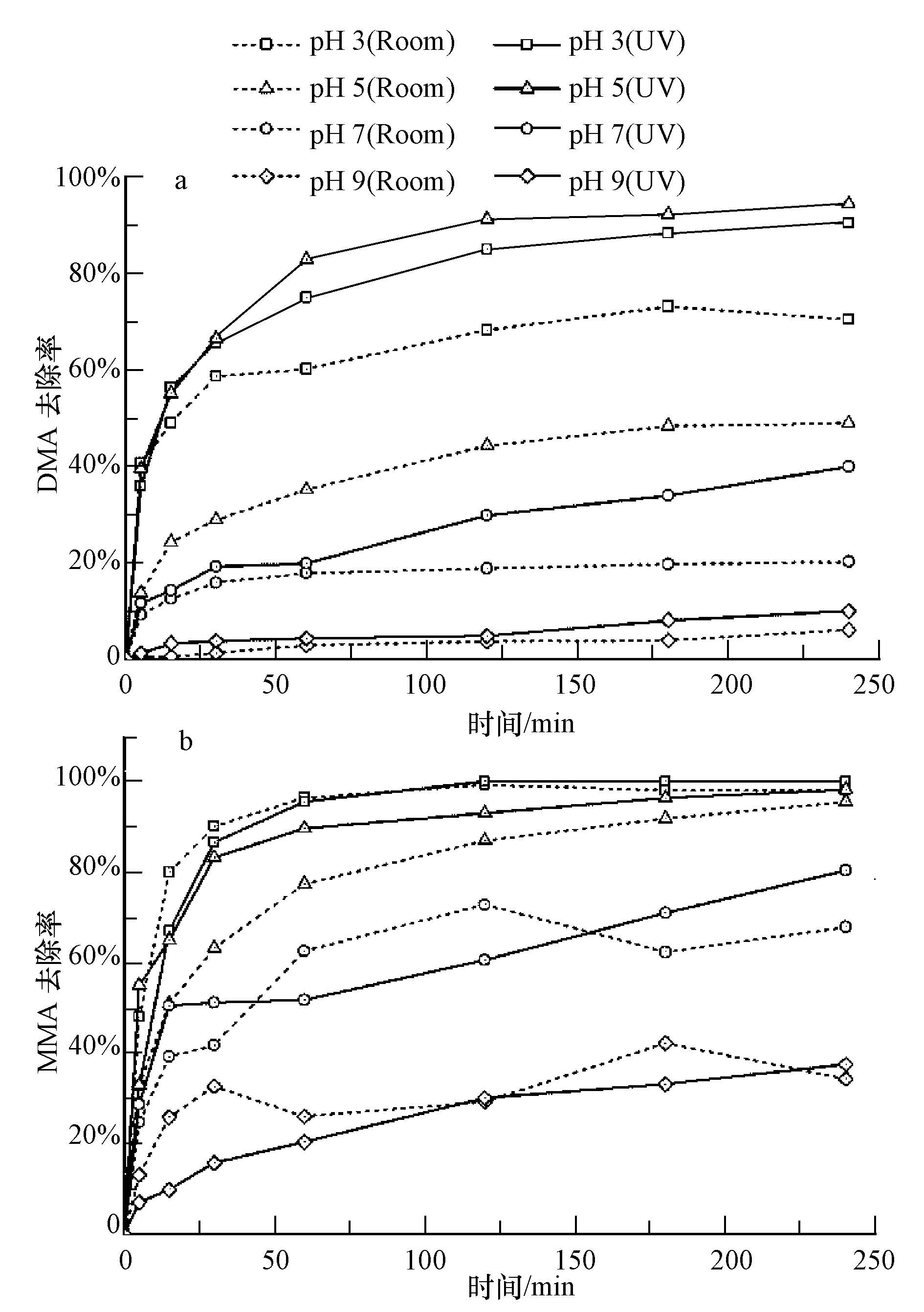 |
| 图2 在自然光(Room)和紫外光(UV)下去除DDMA和MMA的影响 Fig.2 Effect of pH on DMA and MMA removal by nano TiO2 at the exposure of light and UV radiation |
(1)在自然光(虚线)下,随着时间的增加,纳米TiO2对DMA和MMA的去除率逐渐增加,至反应240 min 时,去除率达到最大(图 2).在低pH条件下,纳米TiO2对DMA的去除率较高,如pH为3时,纳米TiO2对DMA的去除率最大,可达70.4%.随着pH值的增加,TiO2对DMA的去除率逐渐下降,在pH为9时,去除率降至6.0%.pH对MMA去除的影响与DMA类似,即随着pH值的增加(3到9),TiO2对MMA的去除率逐渐下降.pH为3时,去除率最高达98.1%;pH为9时,去除率最低至34.3%.
纳米TiO2对DMA和MMA去除,均是在低pH条件(pH为3、5)下去除率高,而在高pH条件(pH为7、9)下去除率低.这与纳米TiO2的等电点(pHpzc=5.8)有关,根据以下方程式(Lu et al., 2014):

由于在低pH条件下,溶液中pH值低于纳米TiO2的pHpzc,此时TiO2表面带正电荷,而DMA不带电(图 1),MMA不带电或带一个单位负电荷(图 1),纳米TiO2可通过静电(吸引)作用捕获DMA和MMA,因此去除率较高;在高pH条件下,即pH高于pHpzc时,TiO2表面带负电荷,DMA和MMA带负电荷(图 1),此时纳米TiO2与DMA和MMA存在静电相斥作用,导致去除率较低.
(2)在UV(λ=254 nm)光照下,纳米TiO2对DMA和MMA的去除曲线(实线)如图 2所示.pH值对纳米TiO2去除DMA和MMA的影响与在自然光下相同,在低pH条件下的去除率高于在高pH条件下的去除率.纳米TiO2对DMA的去除率在pH为5时,达到最高为94.4%,随pH升高,去除率逐渐降低,在pH为9时,去除率最低至9.9%;纳米TiO2对MMA的去除率在pH为3时,仅反应60 min后达到100%,在溶液不断变碱的过程中,TiO2对MMA的去除率逐渐下降至37.5%.实验说明,光照条件不改变pH值对纳米TiO2去除DMA和MMA的影响.
UV光照下,相比自然光下,纳米TiO2对DMA和MMA去除率在不同pH下均有提高.UV光下TiO2对DMA的最大去除率(94.4%)相比自然光下(70.4%)提高了24.0%;TiO2对MMA的去除率(100.0%)相比自然光下(98.0%)提高了2.0%.这与Xu等(Xu and O′Shea,2007)的结果相似,UV光照提高了纳米TiO2对DMA和MMA的去除率.
3.2 甲基砷DMA,MMA 在不同光照条件下转化产物解析为进一步研究甲基砷DMA和MMA的光催化转化过程,本实验考察了在pH为5条件下,以不同光照处理下溶液中DMA和MMA的浓度及其形态变化,以及反应后纳米TiO2固相表面DMA和MMA的形态分布.
(1)DMA及其转化产物在不同光照处理下浓度变化见图 3所示,可看出:在黑暗(Dark)和自然光(Room)的环境下,无TiO2时,溶液中DMA浓度变化不大且并无检测到其他物质;有TiO2时,溶液中DMA浓度随时间下降,但并无检测到其他物质.在紫外(UV)光照下,无TiO2时,随反应时间,溶液中DMA浓度有部分下降,且MMA和As(V)的浓度不断增加,均在反应240 min 后达到平衡;有TiO2时,溶液中DMA浓度不断下降至0,MMA的浓度则先增加后下降至0,As(V)的浓度不断增加至反应360 min 后达到平衡.实验结果表明,无TiO2时,在水溶液中,在黑暗和自然光下,DMA不发生转化,而在UV光下,因检出MMA和As(V),说明DMA发生转化,推测为DMA先脱一个甲基形成MMA,MMA继续脱一个甲基形成As(V)(Nakajima et al., 2005;Sun et al., 2007).这可能是由于DMA在紫外光下光敏化,水溶液中的溶解氧会在此过程中转化为单线态氧1O2(Zhu et al., 2014),之后1O2因化学性质活泼与DMA发生一系列链式反应,发生转化,生成MMA及As(V).
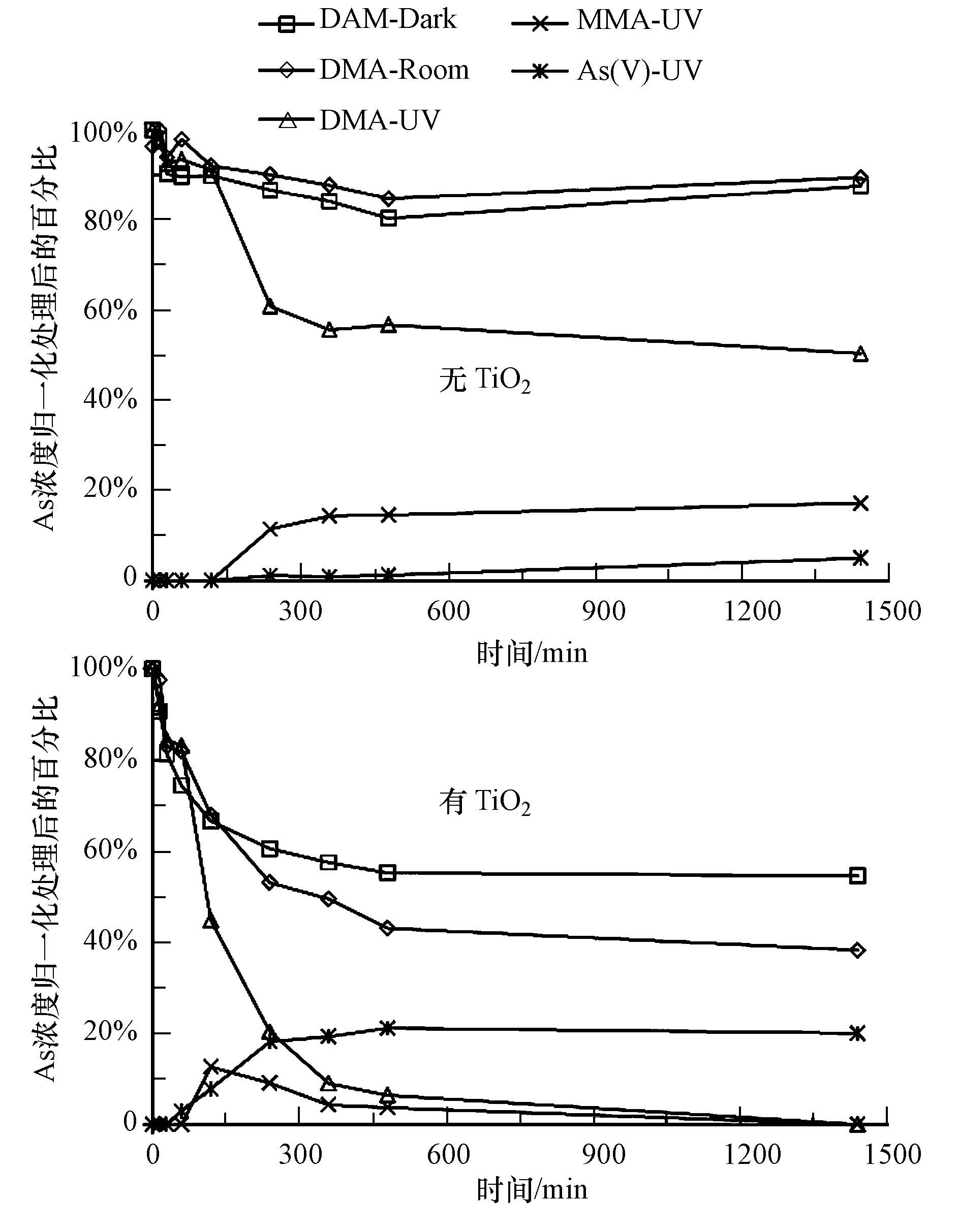 |
| 图3 不同光照条件下DMA在有无TiO2处理下浓度及其形态变化 Fig.3 Varitions of DMA,MMA and As(V)under the exposure of dark,natural light and UV in the water with and without TiO2 |
进一步分析TiO2对DMA转化的影响,对其反应结束后纳米TiO2固相表面砷形态进行分析,结果见图 4.在黑暗下,TiO2表面只有DMA,与液相中DMA浓度下降结果结合说明在此情况下,纳米TiO2对DMA只有吸附作用.在自然光下,TiO2表面有大量的DMA(79.6%),同时还有20.4%的MMA,因液相中仅有DMA浓度下降,并未检测出其他物质,说明,在自然光下,TiO2催化少量DMA发生转化形成MMA,同时纳米TiO2吸附DMA及转化形成的MMA.在UV光下,TiO2表面主要是As(V)(86.9%)及少量的DMA,结合液相中DMA,MMA和As(V)变化,说明:在UV光下,TiO2催化DMA脱甲基形成MMA,同时MMA进一步快速脱甲基形成As(V),因MMA转化为As(V)在此反应可能较快,所以在固相上并未检测到MMA.
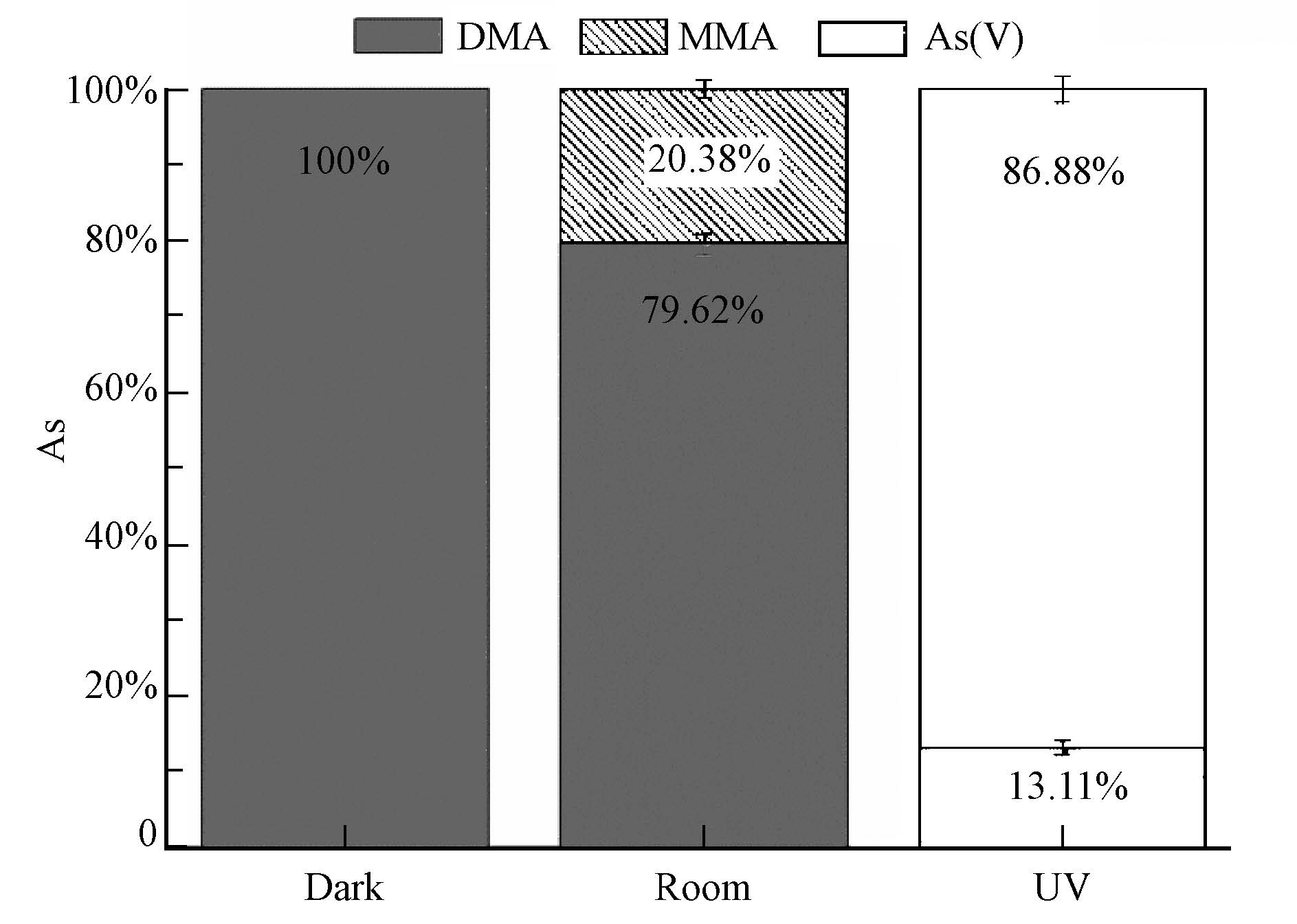 |
| 图4 不同光照处理下纳米TiO2固相表面砷形态分布 Fig.4 Distribution of DMA,MMA and As(V)on the nano TiO2 surface under the exposure of dark,light and UV conditions |
(2)MMA及其转化产物在不同光照处理下浓度变化如图 5所示.在无光和自然光时,MMA在无TiO2情况下,浓度基本无变化;但在有TiO2情况下,随光照时间浓度大幅度减少,但并无其他物质检出.在UV光照时,MMA在无TiO2情况下,浓度随时间部分下降,同时As(V)浓度逐渐增加;在有TiO2情况下,MMA浓度急速减少至0,但并没有检测出其他物质.实验说明,在水溶液中,无TiO2情况下,在无光和自然光下,MMA无任何变化,但在UV时,同时检出MMA和As(V),说明MMA发生转化,即MMA去甲基化形成As(V).MMA在此情况下发生转化的原因同DMA相同,也可能是水中的溶解氧在UV光敏MMA的过程中形成单线态氧1O2,随后,1O2催化MMA转化形成As(V).但由于水溶液中的溶解氧有限且单线态氧1O2寿命较短暂,所以在无TiO2时,仅UV光下,只有少量DMA和MMA发生转化.
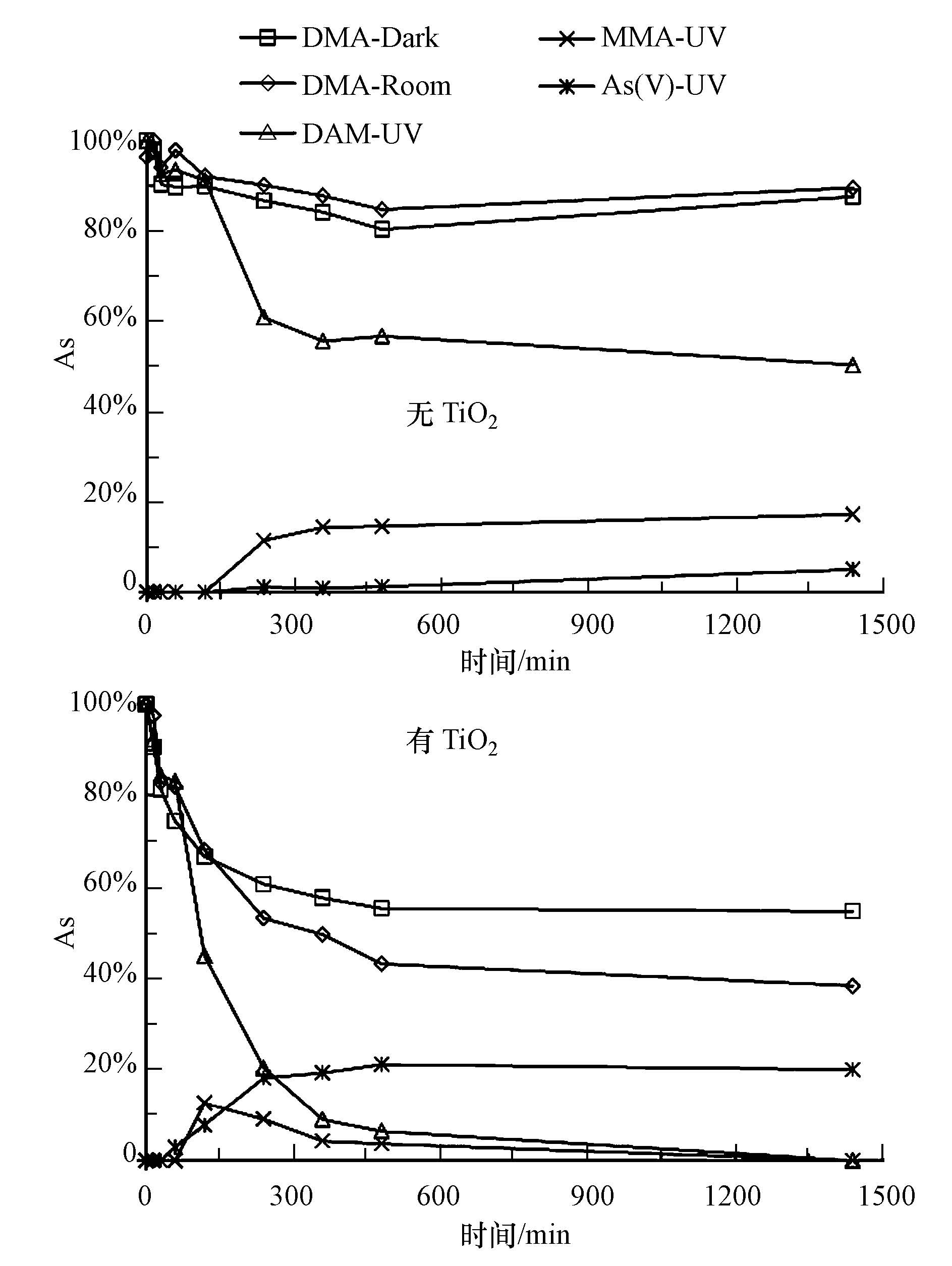 |
| 图5 不同光照条件下MMA在有无TiO2处理下浓度及其形态变化 Fig.5 Change of MMA and As(V)under the exposure of dark,light and UV in the water with and without TiO2 |
由于在TiO2时,任何光照条件下,溶液中都只检出MMA变化,并无检出其他物质.为探究MMA的转化,将反应结束后吸附于纳米TiO2表面物质进行分析,结果如图 6所示.在无光时,只有MMA检出,在液相中MMA浓度大量减少,说明MMA不发生任何转化且纳米TiO2能够吸附大量MMA.自然光时,TiO2表面除有74.2%的MMA,还有25.8%的As(V),说明在自然光时,存在少量MMA转化为As(V),且纳米TiO2能够吸附大部分MMA和全部As(V).在UV光下,TiO2表面吸附有97.2%的As(V),只有2.8%的MMA,由于在溶液中并无检出MMA,说明在UV光下,TiO2催化MMA大量转化As(V),同时纳米TiO2可将全部转化的As(V)和剩余MMA吸附,完全去除溶液中的MMA.
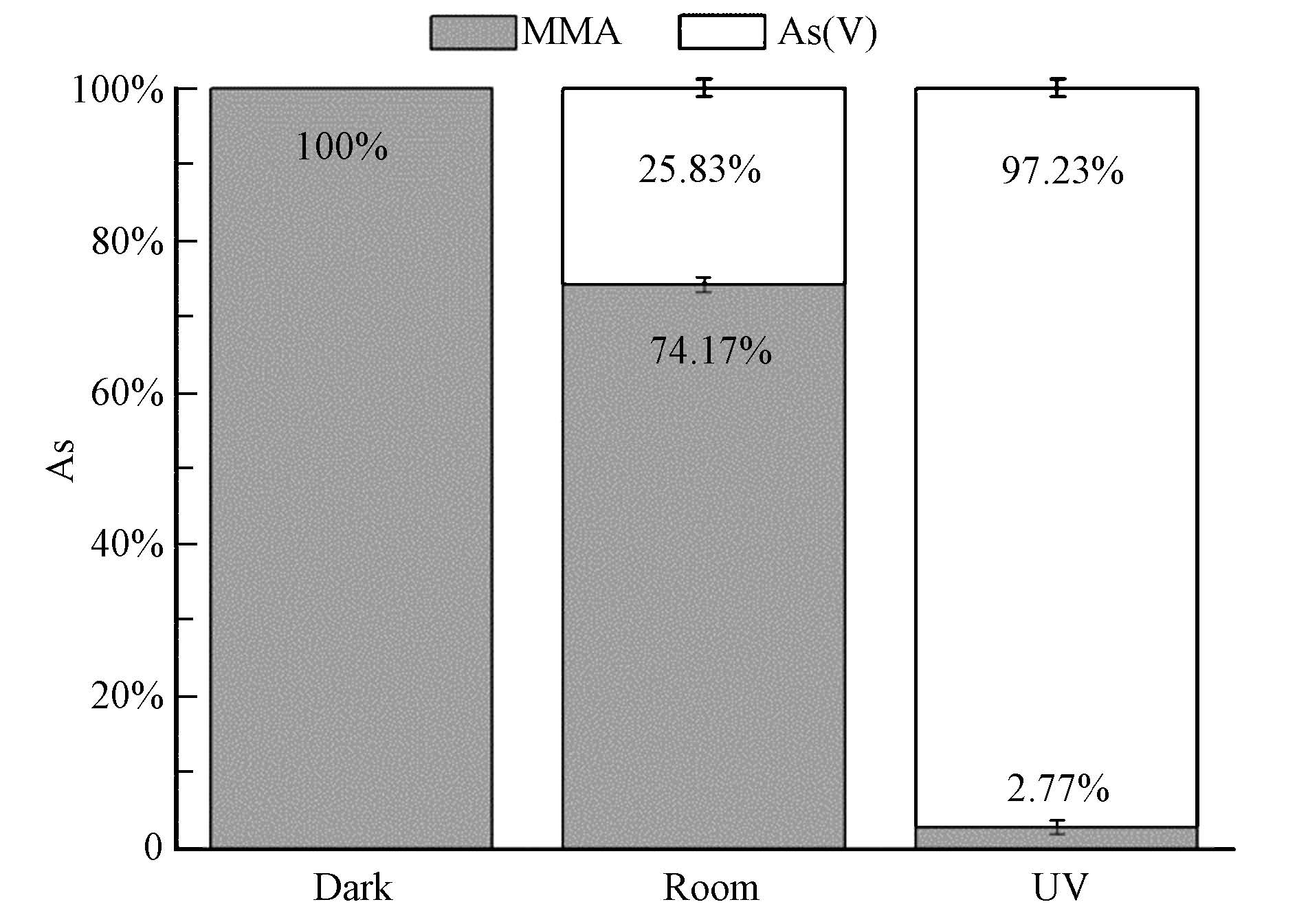 |
| 图6 同光照处理下纳米TiO2固相表面砷形态分布 Fig.6 Distribution of MMA and As(V)on the nano TiO2 surface under the exposure of dark,light and UV |
在前人报道(Xu et al., 2008)中,甲基砷经过光催化转化后,只有少量的砷吸附于固相纳米TiO2上,这是由于实验中采用较高的As/TiO2(10 mg/0.02 g)比.为更接近于实际环境,本实验采用了As/TiO2(100 μg/0.01 g)比,经光催化转化后,液相中仅有少量砷,通过对固相产物解析,发现纳米TiO2能够二次吸附甲基砷的光催化产物,从而解决甲基砷的二次污染问题.
UV光照下,纳米TiO2对DMA和MMA的去除率相比自然光下有显著提高.通过对在UV光照下,DMA和MMA转化产物分析,大约90%的DMA通过连续去甲基转化为As(V),同样,几乎100%的MMA去甲基作用后转化为As(V).而根据我们之前的实验结果,此纳米TiO2对As(V)吸附效率较高(Luo et al., 2010),因此通过在UV光照下,纳米TiO2光催化DMA和MMA转化为更易吸附的As(V)后,纳米TiO2有效吸附As(V),继而实现对DMA和MMA的高效去除.
在UV光照下,纳米TiO2可能发生的反应方程如下所示(Hoffmann et al., 1995):
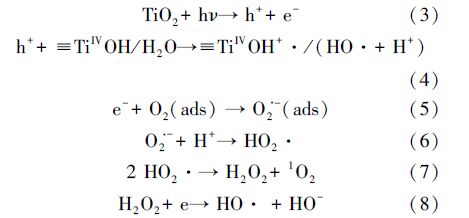
由上述反应式(3)~(8)可知,该反应过程中可产生羟基自由基(HO ·)、超氧阴离子(O2· -)、氢过氧自由基(HO2 ·)和单线性氧(1O2).Xu等(Xu et al., 2008)利用活性氧基团猝灭剂,研究各猝灭剂对DMA和MMA降解速率的影响,研究表明羟基自由基(· OH)是DMA和MMA光降解的主要活性氧基团.羟基自由基是强氧化剂,能够促进多种反应.除了其强氧化性的特点,羟基自由基能够通过加成至芳香环或烯烃上,而不是通过外层电子转移反应(Xu et al., 2008;Oh et al., 2003).某种程度上,羟基自由基能够从氢饱和的碳原子上提取氢.因此,羟基自由基可能可以攻击DMA和MMA的砷氧双键,或者是DMA和MMA上的甲基,DMA转化为MMA后,继续脱甲基形成As(V),MMA直接脱甲基转化为As(V).而DMA和MMA所脱去的甲基基团在此过程中转化为稳定的有机碳分子,如甲酸、甲醇等(Guan et al., 2012).
4 结论(Conclusions)1)UV光照下,相比自然光时,纳米TiO2对DMA和MMA的去除率在不同pH条件下均有提高.pH值的影响为:在低pH条件(pH为3、5)下去除率高,而在高pH条件(pH为7、9)下去除率低.这主要是由纳米TiO2的等电点决定的.
2)DMA和MMA的转化:无光条件下,DMA和MMA均不发生转化;在自然光条件下,纳米TiO2催化少量DMA和MMA发生进一步转化,分别形成MMA和As(V);在紫外光条件下,纳米TiO2能够催化几乎全部的DMA和MMA彻底转化,形成As(V).
3)在UV光照下,纳米TiO2催化DMA和MMA转化为As(V),同时此纳米TiO2对As(V)有较强的吸附能力,因此,UV光照能够显著提高纳米TiO2对DMA和MMA的去除率.
| [1] | Bissen M, Vieillard-Baron M M, Schindelin A J, et al. 2001. TiO2-catalyzed photooxidation of arsenite to arsenate in aqueous samples[J]. Chemosphere, 44(4):751-757 |
| [2] | Dutta P K, Pehkonen S O, Sharma V K, et al. 2005. Photocatalytic oxidation of arsenic(Ⅲ):Evidence of hydroxyl radicals[J]. Environmental Science & Technology, 39(6):1827-1834 |
| [3] | Guan X H, Du J S, Meng X G, et al. 2012. Application of titanium dioxide in arsenic removal from water:A review[J]. Journal of Hazardous Materials, 215-216:1-16 |
| [4] | Hoffmann M R M, Martin S T, Choi W Y, et al. 1995. Environmental applications of semiconductor photocatalysis.[J]. Chemical Reviews, 95(1):69-96 |
| [5] | Jing C Y, Meng X G, Liu S Q, et al. 2005. Surface complexation of organic arsenic on nanocrystalline titanium oxide[J]. Journal of Colloid and Interface Science, 290(1):14-21 |
| [6] | Lee H, Choi W Y. 2002. Photocatalytic oxidation of arsenite in TiO2 suspension:Kinetics and mechanisms[J]. Environmental Science & Technology, 36(17):3872-3878 |
| [7] | Linsebigler A L, Lu G Q, Yates J T. 1995. Photocatalysis on TiO2 surfaces:principles, mechanisms, and selected results[J]. Chemical Reviews, 95(3):735-758 |
| [8] | Lu D L, Ji F, Wang W, et al. 2014. Adsorption and photocatalytic decomposition of roxarsone by TiO2 and its mechanism[J]. Environmental Science and Pollution Research, 21(13):8025-8035 |
| [9] | Luo T, Cui J L, Hu S, et al. 2010. Arsenic removal and recovery from copper smelting wastewater using TiO2[J]. Environmental Science & Technology, 44(23):9094-9098 |
| [10] | Mandal B K, Suzuki K T. 2002. Arsenic round the world:a review[J]. Talanta, 58(1):201-235 |
| [11] | Nakajima T, Xu Y H, Mori Y, et al. 2005. Combined use of photocatalyst and adsorbent for the removal of inorganic arsenic(Ⅲ) and organoarsenic compounds from aqueous media[J]. Journal of Hazardous Materials, 120(1/3):75-80 |
| [12] | Oh Y C, Bao Y, Jenks W S. 2003. Isotope studies of photocatalysis:TiO2-mediated degradation of dimethyl phenylphosphonate[J]. Journal of Photochemistry and Photobiology A:Chemistry, 161(1):69-77 |
| [13] | Petrick J S, Ayala-Fierro F, Cullen W R, et al. 2000. Monomethylarsonous acid (MMAⅢ) is more toxic than arsenite in chang human hepatocytes[J]. Toxicology and Applied Pharmacology, 163(2):203-207 |
| [14] | Smedley P L, Kinniburgh D G. 2002. A review of the source, behaviour and distribution of arsenic in natural waters[J]. Applied Geochemistry, 17(5):517-568 |
| [15] | Sun Y C, Chen Y J, Tsai Y N. 2007. Determination of urinary arsenic species using an on-line nano-TiO2 photooxidation device coupled with microbore LC and hydride generation-ICP-MS system[J]. Microchemical Journal, 86(1):140-145 |
| [16] | Xu T L, Cai Y, O'Shea K E. 2007. Adsorption and photocatalyzed oxidation of methylated arsenic species in TiO2 suspensions[J]. Environmental Science & Technology, 41(15):5471-5477 |
| [17] | Xu Z H, Jing C Y, Li F S, et al. 2008. Mechanisms of photocatalytical degradation of monomethylarsonic and dimethylarsinic acids using nanocrystalline titanium dioxide[J]. Environmental Science & Technology, 42(7):2349-2354 |
| [18] | 徐忠厚,孟晓光. 2011.纳米材料在砷水处理中的应用[J].环境化学, 30(1):63-76 |
| [19] | Zhu X D, Wang Y J, Liu C, et al. 2014. Kinetics, intermediates and acute toxicity of arsanilic acid photolysis[J]. Chemosphere, 107:274-281 |
 2016, Vol. 36
2016, Vol. 36


