2. 放射性废物处理北京市重庆实验室, 清华大学, 北京 100084
2. Beijing Key Laboratory of Radioactive Waste Treatment, INET, Tsinghua University, Beijing 100084
随着工业生产、矿业开采及科学研究的不断发展,大量重金属及其化合物被排放入水体中,其中含有Fe、Cu、Zn、Pb、As、Co、Ni、Cd、Mn、Bi、Hg、Cr、Ti、Au、Ag、U等多种高浓度有毒重金属,甚至含有放射性元素(Wang et al., 2006;2009; 魏广芝等,2007; Ali,2012).这些废水将对周围的水体、土壤及生态环境造成严重污染,其中含有的重金属难生物降解,进入环境或生态系统后留存、积累和迁移,对人类健康构成了严重威胁.
国内外对重金属废水的处理方法主要包括吸附法、化学沉淀法、离子交换法、电化学法、气浮法、微生物法、生态湿地等(Wang et al., 2006;吴胜举等,2009;王建龙等,2010;2013;顾祝禹等,2014).这些方法各有优缺点,其中,吸附法因具有操作简单、效果较好、经济效益较高等优点,成为废水处理领域近年来关注的热点之一.
目前,研究较多的吸附剂主要有:合成有机吸附剂,如聚乙烯(Choi et al., 1999)、树脂(朱娜等,2013)等;天然有机吸附剂,如壳聚糖(Chen et al., 2011;2012a;Zhu et al., 2012b)、木质素(Dong et al., 2013)等;无机吸附剂,如活性炭、碳纳米管等碳材料(Pyrzyńska et al., 2010;万祥云等,2013)、铁氧化物(栾兆坤等,1994)、粉煤灰(王英刚等,2009)、膨润土(肖丽萍等,2013)等;生物吸附剂(李中华等,2007).有机吸附剂仍存在着吸附效率低、热稳定性较差、抗污染能力低、使用寿命不长等问题.为了克服这些缺点,无机吸附剂的应用受到了广泛关注.
无机吸附剂与其他吸附剂相比,具有吸附效率高、化学稳定性好、耐酸碱、耐辐射、耐高温、使用寿命长等优点,在废水处理中表现出良好的应用前景.本课题组成功进行了有关零价铁、磁性壳聚糖、秸秆等材料的制备及改性,并将其应用于吸附去除Cu(Ⅱ)、Zn(Ⅱ)、Pb(Ⅱ)、Sr(Ⅱ)、Co(Ⅱ)等重金属离子(陈玉伟等,2009a;2009b;Chen et al., 2011;2012b; Zhu et al., 2012b; Dong et al., 2013; Zhu et al., 2014).研究新型无机吸附剂,尤其是石墨烯及其改性材料处理废水中重金属的性能、动力学/热力学及机理,对于处理重金属废水具有十分重要的理论意义和应用价值.
石墨烯(Graphene)是一种新型二维碳材料,由碳原子以sp2杂化轨道组成六角形呈蜂窝状晶格的平面结构,具有非常大的理论比表面积(2630 m2 · g-1);其表面存在大量的环氧基团、羟基、羧基等含氧官能团,具有吸附容量大、吸附迅速等特点(Zong et al., 2013; 汤龙程等,2013; 王思雨等,2014).但石墨烯材料也有一些自身不能克服的缺点,如易团聚,导致表面官能团减少,从而吸附效果与吸附选择性较差;使用后不易于从溶液中分离出来.大量的研究报道了使用含功能基团,如氨基(· NH2)、羟基(· OH)、羧基(· COOH)的化合物来改性石墨烯,这些活性基团对重金属离子具有很强的配位络合作用,可以减少石墨烯团聚现象的发生,增加其吸附容量及吸附选择性(肖蓝等,2013;周丽等,2013).采用磁性材料改性石墨烯,也受到了广泛关注,改性后的材料既可高效快速地去除重金属,又可通过外部磁场作用将其从溶液中分离回收(Hu et al., 2013; Zhang et al., 2013b; Zhou et al., 2013; Zong et al., 2013).本文概述了石墨烯的合成及改性方法,综述了该类材料去除废水中重金属离子的研究进展,预测了其发展前景,并对今后的研究方向提出了建议.
2 石墨烯的合成与改性(Synthesis and modification of graphene)目前,广泛采用的是化学剥离氧化石墨片层制备石墨烯(Graphene,GN)和氧化石墨烯(Graphene Oxide,GO),其中,Hummers等(1958)报道的液相氧化法最为常用,其主要过程是以石墨粉为原料,采用强酸(浓硫酸)和强氧化性物质(高锰酸钾)将石墨剥离为石墨烯薄片;然后将该石墨烯薄片进一步经过还原法(如硼氢化钾、液肼等)制得石墨烯,称为还原氧化石墨烯(Reduced Graphene Oxide,RGO).氧化石墨烯对Cu(Ⅱ)、Zn(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)、Co(Ⅱ)、Cr(Ⅵ)、U(Ⅵ)等离子都具有很好的吸附效果(Zhao et al., 2011a;2010b; Li et al., 2012b; Kumar et al., 2013; Wang et al., 2013; Wu et al., 2013a).Mi等(2012)采用单向冷冻干燥法,将氧化石墨烯进一步制成多孔氧化石墨烯气凝胶,实验结果表明,该材料对Cu(Ⅱ)吸附性能优良,在15 min内即可达到吸附平衡.
为了增加石墨烯表面的活性官能团,以得到更好的吸附性能,人们利用有机分子对石墨烯进行功能化改性,主要包括共价键功能化和非共价键功能化两种.由于GO含有大量的羟基、羧基和环氧键等活性基团,可以通过多种化学反应对石墨烯进行共价键功能化.
Madadrang等(2012)首先采用改进的Hummers法合成GO,然后利用硅烷化乙二胺四乙酸(EDTA-Silane)中硅烷的三烷氧基水解产生的—Si—OH基团与石墨烯上的C—OH反应,制得EDTA改性的石墨烯(EDTA-GO);在溶液pH值为6.8时,该材料对Pb(Ⅱ)的吸附容量可达(479±46)mg · g-1,吸附过程在20 min内即可完成.Yang等(2012a)首先将GO表面的羟基转化为羧基(GO-COOH),然后通过EDC/NHS交联法制得藻青菌金属硫蛋白(SmtA)改性的石墨烯(SmtA-GO);该功能化石墨烯对重金属镉具有很高的选择吸附性.
对石墨烯进行非共价键功能化主要通过离子键、π-π相互作用及氢键等非共价键作用.Wu等(2013b)选用一种阳离子表面活性剂溴化十六烷基三甲铵(CTAB),通过非共价反应对石墨烯功能化改性,主要利用GO上带负电的羧基基团与CTAB上带正电的铵离子进行离子相互作用得到CTAB-GN;在反应温度为293 K条件下,该材料对Cr(Ⅵ)的吸附容量为21.57 mg · g-1.Kumar等(2013)利用三辛胺(TOA)与氧化石墨烯之间的孤对电子-π相互作用和氢键作用改性氧化石墨烯,该TOA-EGO吸附剂对Cr(Ⅵ)的吸附容量为232.55 mg · g-1.Kumar等(2013)报道了一种室温离子液体(季铵盐Aliquat-336)功能化氧化石墨烯,主要通过季铵阳离子与GO表面的羟基基团之间的静电亲和力作用制得IL-EGO,该材料对Cr(Ⅵ)的吸附性能优越,其吸附容量高达285.71 mg · g-1.此外,Thakur等(2013)采用一步法合成硫纳米粒子改性还原氧化石墨烯(SRGO),选用柠檬汁中含有的高浓度弱有机酸来促进硫代硫酸盐的歧化反应,该纳米复合物在溶液pH值范围为6~8时可快速高效地去除Hg(Ⅱ).
采用无机材料功能化石墨烯,可赋予石墨烯新的性能,其中,最为重要的材料是磁性铁系物质改性石墨烯,将其应用于重金属污染水体治理中,既可高效快速去除重金属离子,又可用磁分离法将其回收利用.大量的研究表明,采用Fe3O4功能化石墨烯可有效去除Cu(Ⅱ)(Hu et al., 2013)、Cd(Ⅱ)(Zhang et al., 2013b)、Cr(Ⅵ)(Zhou et al., 2013)、Pb(Ⅱ)(Zhang et al., 2013b)、Co(Ⅱ)(Liu et al., 2011)、U(Ⅵ)(Zong et al., 2013)等重金属离子.Vadahanambi等(2013)采用一步微波法,制备了石墨烯-碳纳米管-氧化铁三维纳米复合物(3D G-CNT-Fe),该三维材料对砷的吸附容量是二维石墨烯-氧化铁复合物(2D G-Fe)的2倍.Yang等(2012b)合成了GO-铁氧化物和RGO-铁氧化物,在pH值为6.5±0.1和反应温度为303 K条件下,这两种材料对Pb(Ⅱ)的最大吸附容量分别为588.24和454.55 mg · g-1.Zhang等(2010)往GO和FeSO4 · 7H2O混合液中逐步加入H2O2和氢氧化铵溶液反应,制得GO/氢氧化铁复合物(GO-Fe),该改性石墨烯对As(V)的吸附容量为23.78 mg · g-1.Zhu等(2011;2012a)采用核-壳结构的Fe-Fe2O3纳米粒子改性石墨烯,得到磁性石墨烯片状纳米颗粒(MGNCs),对Cr(Ⅵ)和As(Ⅲ)的吸附容量分别为1.03和11.34 mg · g-1.Jabeen等(2011;2013)在氩气保护条件下,利用硼氢化钠还原氧化石墨烯和氯化铁,制得纳米零价铁颗粒改性石墨烯复合物(G-nZVI),改性后的石墨烯表现出磁性,对Cr(Ⅵ)和Pb(Ⅱ)的去除性能也得到了大幅提高.除了这些铁系材料,其它纳米材料,如MnO2(Ren et al., 2011)、SiO2(Hao et al., 2012)等也被用来改性石墨烯,通过改性可同时阻止纳米材料和石墨烯的团聚,保持复合材料中各组分的反应活性,从而促进石墨烯对重金属离子的去除能力.Sreeprasad等(2011)将Ag和MnO2负载到还原氧化石墨烯上,得到RGO-Ag和RGO-MnO2材料,改性后的材料对Hg(Ⅱ)的吸附容量比GO和RGO都要高.Yuan等(2013a)通过Al(NO3)3 · 9H2O、Mg(NO3)2 · 6H2O和GO之间的水热反应,得到石墨烯/MgAl层状双氢氧化物(G-MgAl-LDH)纳米复合物,对Cr(Ⅵ)的最大吸附容量为172.55 mg · g-1.此外,沙子也被用来改性石墨烯,对Hg(Ⅱ)的去除效果要远远好于沙子(Gao et al., 2011).
由于很多聚合物或共聚物如聚苯胺(Sun et al., 2013)、聚吡咯(Chandra et al., 2011; Li et al., 2012a)、聚酰胺(Yuan et al., 2013b)、聚乙烯咔唑(Musico et al., 2013)、壳聚糖(Liu et al., 2012)等自身含有大量的胺基或羟基,也常被用于改性石墨烯.
Sun等(2013)采用化学氧化法制备聚苯胺改性氧化石墨烯(PANI@GO),在溶液pH值为3.0和反应温度为298 K条件下,该材料对U(Ⅵ)的最大吸附容量为1.03 mmol · g-1.Li等(2012a)通过聚合作用将吡咯嫁接到GO纳米片表面,得到聚吡咯/氧化石墨烯(PPy/GO)复合物,在溶液pH值为3.0时反应24 h后,对Cr(Ⅵ)的最大吸附容量高达497.1 mg · g-1.Chandra等(2011)制备了聚吡咯-还原氧化石墨烯(PPy-RGO)复合物,该材料对Hg(Ⅱ)具有很好的选择吸附性,其吸附容量高达980 mg · g-1.Yuan等(2013b)采用嫁接法合成了聚酰胺改性氧化石墨烯,该材料对Fe(Ⅲ)、Cr(Ⅲ)、Zn(Ⅱ)、Pb(Ⅱ)和Cu(Ⅱ)的吸附容量分别为0.53、0.08、0.20、0.05和0.14 mmol · g-1.Musico等(2013)采用聚乙烯咔唑改性石墨烯(PVK-GO),在pH值为7.0±0.5条件下反应90 min后,该材料对Pb(Ⅱ)的最大吸附容量为887.98 mg · g-1.Liu等(2012)制备了壳聚糖/氧化石墨烯(CSGO)复合物,将其应用于去除溶液中的Au(Ⅲ)和Pd(Ⅱ),最大吸附容量分别为1076.65和216.92 mg · g-1.
3 去除重金属离子的研究(Removal of heavy metals) 3.1 吸附容量目前,对石墨烯及其改性材料去除水中重金属离子的研究较为广泛,其吸附容量见表 1.如表 1所示,石墨烯及其改性材料对Ag(I)、Cr(Ⅲ)、Fe(Ⅲ)和Ni(Ⅱ)的吸附容量约为50 mg · g-1,对As(Ⅲ)的吸附容量为6.57~138.79 mg · g-1,对As(V)的吸附容量为23.78~141.92 mg · g-1,对Zn(Ⅱ)的吸附容量为12.97~246 mg · g-1,对Cu(Ⅱ)的吸附容量为19.65~294 mg · g-1,对Fe(Ⅱ)和U(Ⅵ)的吸附容量约为300 mg · g-1左右,对Co(Ⅱ)的吸附容量为370 mg · g-1,对Cd(Ⅱ)的吸附容量为530 mg · g-1;对Au(Ⅲ)、Cr(Ⅵ)、Hg(Ⅱ)和Pb(Ⅱ)的吸附容量较大,最大吸附容量达到1000 mg · g-1.从表 1中石墨烯及其改性材料去除Cr(Ⅵ)可知,不同材料对该重金属离子的去除效果差别较大,最大吸附容量范围可从1.03 mg · g-1至1149.4 mg · g-1;由于聚合物含有大量的胺基或羟基,因此,改性后的石墨烯对Cr(Ⅵ)的吸附效果明显增强;虽然纳米铁系材料改性石墨烯对Cr(Ⅵ)的吸附容量不大,但该类材料具有磁性,易分离回收,具有重要的应用价值.
| 表 1 石墨烯及其改性材料去除水中的重金属及核素 Table 1 Removal of heavy metals and nuclides by graphene and its modified materials |
石墨烯及其改性材料去除重金属离子的研究中,影响去除效率的因素主要有吸附时间、溶液pH值、吸附剂用量、重金属初始浓度、反应温度、离子强度等.
重金属在石墨烯材料表面的吸附过程,通常在几十分钟至几小时内完成.随着吸附时间的增加,重金属的去除率提高,吸附容量增大.Hao等(2012)研究了吸附时间对SiO2/石墨烯复合物去除Pb(Ⅱ)的影响,结果发现,Pb(Ⅱ)的吸附过程非常快,在反应前10 min其去除率就高达95%,此后随时间的延长,Pb(Ⅱ)的去除率增长缓慢,30 min后吸附达到平衡.Li等(2012b)报道,氧化石墨烯纳米片对U(Ⅵ)的吸附平衡时间为1 h.Yuan等(2013a)的研究表明,在最初的4 h内,石墨烯/MgAl层状双氢氧化物纳米复合物对Cr(Ⅵ)的吸附速率很快,此后吸附速率缓慢降低,直至反应24 h后达到吸附平衡.
溶液pH值不仅影响吸附剂表面官能团的质子化程度,还影响重金属离子在溶液中的存在形式和化学性质,因此,研究溶液pH值对重金属吸附的影响具有重要意义.大多数金属离子,如Cd、Co、Cu、Hg、Ni、Pb、Zn等,在溶液中以阳离子形式存在.但是,有些金属离子在溶液中以多价态形式存在,还有些以含氧阴离子形式出现.例如,As有三价(AsO33-)和五价(AsO3-4),Cr有三价和六价(Cr2O2-7,CrO2-4)(Jabeen et al., 2011; Mishra et al., 2011).
对于以阳离子形式存在的重金属,石墨烯材料对重金属离子的吸附量,随着溶液pH值的增大而增加;当溶液pH值接近中性时,吸附量呈下降趋势.Liu等(2012)研究了溶液pH值为1.0~6.0范围内,壳聚糖改性氧化石墨烯对Au(Ⅲ)和Pd(Ⅱ)的吸附过程,结果显示,随着pH值的增加,Au(Ⅲ)和Pd(Ⅱ)的吸附容量都增大;当pH从5.0增加到6.0时,由于金属离子与溶液中的OH-形成了氢氧化物微沉淀,阻碍了吸附过程的进行,其吸附容量下降.Liu等(2011)的研究结果表明,当pH值从3增加到6时,磁铁矿/氧化石墨烯对Co(Ⅱ)的吸附效率缓慢增加;当pH值进一步从6增加到8.5时,吸附效率急剧增大;最后pH>8.5时,吸附效率一直维持在最大值.Li等(2012b)考察了pH值对氧化石墨烯纳米片吸附U(Ⅵ)的影响,其最佳pH值范围为4~8;在不同的pH值条件下,铀在水溶液中的存在形态不同,其去除效率也不同;pH≤4时,U(Ⅵ)主要以UO22+形式存在,pH为4~7.5时,UO22+、UO2OH+、(UO2)2(OH)22+、(UO2)3O(OH)3+、UO2(OH)2和UO2(CO3)并存,由于静电引力和铀的沉淀作用,在该pH值范围内U(Ⅵ)的去除率达到最大.
对于以阴离子形式出现的重金属离子,石墨烯材料对重金属离子的吸附量随着溶液pH值的增大而减小.Kumar等(2013)的研究结果表明,IL-EGO材料吸附Cr(Ⅵ)的最佳pH值为3.5;当pH < 3.5时,石墨烯材料表面带正电性,由于静电引力的作用促进了Cr(Ⅵ)的吸附;当pH>3.5时,随着pH值的增加,石墨烯材料的羟基基团去质子化使得其表面呈电负性,从而降低了Cr(Ⅵ)的去除率.
吸附剂用量对重金属吸附过程的影响,主要体现在吸附剂表面的吸附位点上.当吸附剂用量增加时,对重金属吸附起作用的吸附位点增多,去除效率增加.Liu等(2011)考察了磁铁矿/氧化石墨烯用量对Co(Ⅱ)去除率的影响,结果发现,当吸附剂用量从0.2 g · L-1增加到0.6 g · L-1时,Co(Ⅱ)的去除率从20%增大到60%以上.将CTAB改性石墨烯用量从0.1 g增加到0.4 g时,Cr(Ⅵ)的去除率从78.3%增大到98.2%;当吸附剂用量进一步从0.4 g增大到1.0 g时,其去除率并未进一步增大,Cr(Ⅵ)的吸附达到平衡(Wu et al., 2013b).
重金属离子的初始浓度对其吸附过程也有影响.重金属的去除率随着初始浓度的增加而减小,说明重金属浓度较高时,应增加吸附剂用量才能达到较高的去除率;而平衡吸附量随着初始浓度的增加而增大,这是由于随着初始浓度的增大,被吸附的重金属离子的数量增多.Yuan等(2013a)考察了Cr(Ⅵ)的初始浓度对石墨烯/MgAl层状双氢氧化物纳米复合物去除Cr(Ⅵ)的影响,结果表明,随着Cr(Ⅵ)初始浓度的增加,其吸附容量显著增大,而Cr(Ⅵ)的去除率降低;当Cr(Ⅵ)初始浓度从50 mg · L-1增加到250 mg · L-1时,反应24 h后,Cr(Ⅵ)的去除率从95%减小到66.84%.Jabeen等(2013)发现,当Pb(Ⅱ)初始浓度从50 ppm增大到250 ppm时,纳米零价铁颗粒改性石墨烯对Pb(Ⅱ)的吸附容量从230 mg · g-1增加到450 mg · g-1.
重金属的去除率,随着反应温度的增加而增大,表明该吸附过程是吸热反应过程.Jabeen等(2011)的研究表明,随着温度从10 ℃增加到50 ℃,纳米零价铁颗粒改性石墨烯对Cr(Ⅵ)的吸附容量增大,这是由于温度的升高增大了材料的孔径,并且激活了吸附剂表面的活性位点.Jabeen等(2013)认为,升高反应温度会改变金属离子在溶液中的扩散速率、Pb(Ⅱ)的存在形态及迁移率,增加纳米零价铁颗粒改性石墨烯材料表面的化学反应和吸附位点,从而提高Pb(Ⅱ)的去除效果.
实际废水中还存在着很多其他离子,它们对重金属的吸附过程也有影响.Sitko等(2013)研究了Cu(Ⅱ)、Zn(Ⅱ)、Cd(Ⅱ)和Pb(Ⅱ)在氧化石墨烯表面的竞争吸附过程,亲和力顺序表现为:Pb(Ⅱ)> Cu(Ⅱ)>>Cd(Ⅱ)> Zn(Ⅱ).Kumar等(2013)考察了共存离子对三辛胺改性氧化石墨烯去除Cr(Ⅵ)的影响,结果表明,250 mg · L-1的Cu(Ⅱ)、Pb(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)、Cd(Ⅱ)和Co(Ⅱ)离子对Cr(Ⅵ)的去除没有影响;250 mg · L-1的Fe(Ⅱ)和Mn(Ⅱ)对吸附有干扰,150 mg · L-1的阴离子(Cl-和SO2-4)对吸附也有干扰.Liu等(2011)研究了NaCl、MgCl2、KCl、NaNO3和NaClO4对磁铁矿/氧化石墨烯吸附Co(Ⅱ)的影响,pH < 9时共存阳离子对吸附有抑制作用,抑制作用的强弱顺序为Mg2+>Na+>K+;离子强度对磁铁矿/氧化石墨烯吸附Co(Ⅱ)的影响可忽略.Li等(2012b)考察了离子强度对氧化石墨烯纳米片吸附U(Ⅵ)的影响,结果表明,NaClO4的添加对吸附的影响不大;但Hao等(2012)的研究显示,离子强度的增加会降低SiO2/石墨烯材料对Pb(Ⅱ)的吸附容量;也有研究表明,随着离子强度的增加,纳米零价铁颗粒改性石墨烯对Pb(Ⅱ)的吸附容量也增大(Jabeen et al., 2013).
目前,石墨烯及其改性材料去除重金属的研究几乎都处于实验室阶段,且大多针对单一吸附组分进行,多组分的竞争吸附则研究较少.在处理实际废水中,往往多种重金属离子和其他离子共存,所以,研究石墨烯材料对共存离子和多组分的吸附过程,更具有实际意义.
3.3 吸附动力学/热力学吸附动力学作为评价吸附剂性能的重要指标,描述了吸附剂对重金属离子的吸附速率.常用的动力学模型为准一级(式(1))、准二级动力学方程(式(2))、Elovich模型(式(3))或内部粒子扩散模型(式(4))(周洪英等,2006; Zhu et al., 2011).
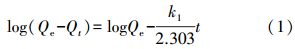

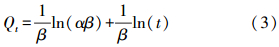

式中,Qe和Qt分别是在吸附平衡和反应时间t时对重金属离子的吸附量(mg · g-1);k1是准一级吸附动力学的吸附速率常数(min-1);kad是准二级吸附动力学的吸附速率常数(g · mg-1 · min-1);α和β是Elovich模型中初始吸附速率和脱附常数;kdif是内部粒子扩散速率常数;C提供了关于边界层厚度的相关信息.
石墨烯及其改性材料对重金属离子的吸附过程一般符合准二级动力学模型,具体见表 2.Zhou等(2013)采用准一级、准二级、Elovich和内部粒子扩散模型,对RGO-Fe3O4复合物吸附Cr(Ⅵ)进行了动力学拟合,得到的R2值分别为0.743、0.999、0.874和0.681,说明该吸附过程较符合准二级动力学模型.Sreeprasad等(2011)的研究结果表明,GO、RGO、RGO-Ag和RGO-MnO2材料对Hg(Ⅱ)的吸附过程更符合准一级动力学模型.Hu等(2013)发现,磺化磁性氧化石墨烯对Cu(Ⅱ)的吸附过程符合准二级动力学模型,说明该过程为化学吸附过程;内部粒子扩散模型拟合结果表明,Cu(Ⅱ)的吸附过程中粒子的内部扩散为限速步骤.Mishra等(2011)采用Elovich模型和内部粒子扩散模型,拟合了功能化石墨烯对As(Ⅲ)和As(V)的吸附过程,其中,Elovich模型描述了化学反应动力学过程,内部粒子扩散模型描述了扩散过程,结果表明该吸附过程更加符合内部粒子扩散模型.
| 表 2 石墨烯及其改性材料吸附重金属离子的动力学模型 Table 2 Kinetic models for adsorption of heavy metals by graphene and its modified materials |
根据反应温度的影响可分析其吸附热力学过程,吸附等温线模型主要有经典Langmuir方程(L型,单层吸附,式(5))、Freundlich方程(F型,多分子层吸附,式(6))、Temkin模型等.


式中,Qe是单位质量的吸附剂在吸附平衡时对重金属离子的吸附量(mg · g-1);Ce是重金属离子的平衡浓度(mg · L-1);a是最大吸附容量(mg · g-1);b是与吸附自由能有关的常数(L · mg-1);k(mg · g-1)和1/n是吸附常数.
大量文献利用经典L型和F型方程,较好地描述了石墨烯材料吸附重金属离子过程(表 3).根据吸附等温线模型可计算出相关热力学参数,如活化 能(Ea)、吉布斯自由能(ΔG°)、熵值(ΔS°)和焓值(ΔH°).Kumar等(2013)采用Langmuir模型、Freundlich模型、Redlich-Peterson模型、Dubinin-Radushkevich模型、Temkin模型和Elovich模型,拟合了三辛胺改性氧化石墨烯吸附Cr(Ⅵ)过程,结果表明,Langmuir模型和Temkin模型的拟合效果较好;ΔG°值在303、313、323和333 K时分别为-10.54、-4.94、-3.89和-2.89 kJ · mol-1;ΔH°和ΔS°值分别为-83.42 kJ · mol-1和-262.48 J · mol-1 · K-1,说明该吸附过程为自发和放热过程.Hu等(2013)的研究结果表明,磺化磁性氧化石墨烯对Cu(Ⅱ)的吸附符合Langmuir吸附等温线模型,ΔG°值在285.15、303.15和323.15 K时分别为-20.196、-22.273和-24.349 kJ · mol-1,说明该吸附为自发过程,温度升高有利于吸附反应的进行;ΔH°和ΔS°值分别为9.205 kJ · mol-1和103.835 J · mol-1 · K-1,说明该吸附过程为吸热过程.
| 表 3 石墨烯及其改性材料去除重金属离子及核素的吸附等温线模型 Table 3 Adsorption isotherm models for removal of heavy metals and nuclides by graphene and its modified materials |
石墨烯及其改性材料对重金属的吸附作用机理主要有静电引力、化学键合作用(包括离子交换、络合作用等)和吸附沉积作用.
Hao等(2012)的研究结果表明,Pb(Ⅱ)在SiO2/石墨烯材料表面的吸附作用主要是由于静电引力作用.Wang等(2013)推测氧化石墨烯对Zn(Ⅱ)的吸附主要是由于化学吸附作用(如离子交换),此过程中静电引力也起作用.Zhao等(2011b)的研究显示,Pb(Ⅱ)在氧化石墨烯上的吸附主要是由于Pb(Ⅱ)与氧化石墨烯表面的含氧官能团之间的络合作用.Jabeen等(2013)报道了纳米零价铁颗粒改性石墨烯对Pb(Ⅱ)的吸附去除过程,其主要机理为静电吸附、络合作用、还原和沉淀作用.Li等(2012b)的研究结果表明,U(Ⅵ)在单层氧化石墨烯表面的吸附主要是其表面含氧官能团的作用.Zong等(2013)和Liu等(2011)发现,pH值较低时,磁铁矿/氧化石墨烯对U(Ⅵ)和Co(Ⅱ)的吸附主要为内球体表面络合作用;而pH值较高时,则为沉淀和内球体表面络合的共同作用.对于重金属离子在固体表面吸附形态的差异及其在固-液界面上的微观吸附机制,目前研究不多,有待进一步阐述.
目前,主要采用各种分析表征手段来研究石墨烯负载改性前后的物理化学性质变化,分析反应过程中材料表面分子/原子尺度的作用过程,从而进一步研究微观机制.已有的研究中,常采用X射线衍射(XRD)、扫描电镜(SEM)、透射电镜(TEM)、红外光谱(FTIR)、X射线光电子能谱(XPS)等仪器分析技术,来表征反应前后材料的结构特性(Jabeen et al., 2011; Sreeprasad et al., 2011; Hu et al., 2013; Vadahanambi et al., 2013; Yuan et al., 2013a).但是,其他分析技术则应用较少,如X射线吸收精细结构(EXAFS)、荧光分光光度计(FS)、核磁共振技术(NMR)等.
EXAFS可以通过对固-液界面体系中目标元素原子的周围结构环境进行研究,提供被研究元素周围原子的种类、个数及原子间距等物质局域结构信息.Li等(2012b)采用EXAFS技术,证实了氧化石墨烯与U(Ⅵ)之间的表面络合作用.
荧光分光光度计可从各个角度反映分子的成键和结构情况,不仅可进行定性定量分析,还可以推断分子在各种环境下的构象变化,从而阐明分子结构与功能之间的关系.这些技术已广泛应用于地质、材料、生命科学、医学等领域.但是,目前在重金属治理研究中的应用报道还较少,尤其在综合利用各种技术阐明有关吸附机理方面.
综合利用多种现代仪器分析技术和表面分析技术,结合重金属的水合离子半径参数、配位理论及络合作用等理论知识,进一步系统研究石墨烯及其改性材料对重金属的吸附去除机理,对影响因素的控制、吸附量的提高及石墨烯材料的实际应用,都具有重要的意义.
4 结论(Conclusions)石墨烯作为一种新型二维碳材料,具有比表面积大、吸附性能强、抗辐射性能好等优点,关于其功能化改性及相关应用研究,已取得很大的进展.但是,石墨烯及其改性材料去除重金属离子,尚属试验和探索阶段,要实现该类材料在废水处理上的实际应用,还有许多问题亟待解决,主要有:①开发出成本低、吸附性能良好且易分离回收的石墨烯材料,这是该技术广泛应用的前提.②不仅要研究单一金属离子的去除过程及无机离子对吸附过程的影响,还要研究多组分共存体系的吸附去除过程,为石墨烯及其改性材料应用于处理实际废水提供一定的理论基础.③强化动力学和机理研究,开发出新的数学模型,并与吸附机理的探讨相结合;联合利用多样化的分析、检测、表征手段,对吸附机理进行多角度、多层次的深入探讨,以研发和改性吸附性能优良的新型石墨烯类材料.
| [1] | Ali I. 2012. New generation adsorbents for water treatment[J]. Chemical Reviews, 112(10): 5073-5091 |
| [2] | Chandra V, Kim K S. 2011. Highly selective adsorption of Hg2+ by a polypyrrole-reduced graphene oxide composite[J]. Chemical Communications, 47(13): 3942-3944 |
| [3] | Chang C F, Truong Q D, Chen J R. 2013. RETRACTED: Graphene sheets synthesized by ionic-liquid-assisted electrolysis for application in water purification[J]. Applied Surface Science, 264: 329-334 |
| [4] | 陈玉伟, 王建龙. 2009a. 辐射诱导合成水凝胶及其处理重金属废水的研究进展[J]. 化学进展, 21(10): 2250-2256 |
| [5] | 陈玉伟, 王建龙. 2009b. 零价铁(ZVI)去除Cu2+的特性及机制研究[J]. 环境科学, 30(11): 3353-3357 |
| [6] | Chen Y W, Wang J L. 2011. Preparation and characterization of magnetic chitosan nanoparticles and its application for Cu (Ⅱ) removal[J]. Chemical Engineering Journal, 168(1): 286-292 |
| [7] | Chen Y W, Wang J L. 2012a. The characteristics and mechanism of Co (Ⅱ) removal from aqueous solution by a novel xanthate-modified magnetic chitosan[J]. Nuclear Engineering and Design, 242: 452-457 |
| [8] | Chen Y W, Wang J L. 2012b. Removal of radionuclide Sr2+ ions from aqueous solution using synthesized magnetic chitosan beads[J]. Nuclear Engineering and Design, 242: 445-451 |
| [9] | Choi S H, Nho Y C, Kim G T. 1999. Adsorption of Pb2+ and Pd2+ on polyethylene membrane with amino group modified by radiation-induced graft copolymerization[J]. Journal of Applied Polymer Science, 71(4): 643-650 |
| [10] | Dong J, Hu J, Wang J L. 2013. Radiation-induced grafting of sweet sorghum stalk for copper (Ⅱ) removal from aqueous solution[J]. Journal of Hazardous materials, 262: 845-852 |
| [11] | Gao W, Majumder M, Alemany L B, et al. 2011. Engineered graphite oxide materials for application in water purification[J]. ACS Applied Materials & Interfaces, 3(6): 1821-1826 |
| [12] | 顾祝禹, 艾克拜尔·伊拉洪, 吐尔逊·吐尔洪. 2014. 电化学方法去除污泥中重金属的研究[J]. 环境科学学报, 34(10): 2547-2551 |
| [13] | Hao L Y, Song H J, Zhang L C, et al. 2012. SiO2/graphene composite for highly selective adsorption of Pb (Ⅱ) ion[J]. Journal of Colloid and Interface Science, 369(1): 381-387 |
| [14] | Hu X J, Liu Y G, Wang H, et al. 2013. Removal of Cu (Ⅱ) ions from aqueous solution using sulfonated magnetic graphene oxide composite[J]. Separation and Purification Technology, 108: 189-195 |
| [15] | Hummers W S Jr, Offeman R E. 1958. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 80(6): 1339-1339 |
| [16] | Jabeen H, Chandra V, Jung S, et al. 2011. Enhanced Cr (Ⅵ) removal using iron nanoparticle decorated graphene[J]. Nanoscale, 3(9): 3583-3585 |
| [17] | Jabeen H, Kemp K C, Chandra V. 2013. Synthesis of nano zerovalent iron nanoparticles-Graphene composite for the treatment of lead contaminated water[J]. Journal of Environmental Management, 130: 429-435 |
| [18] | Kumar A S K, Kakan S S, Rajesh N. 2013. A novel amine impregnated graphene oxide adsorbent for the removal of hexavalent chromium[J]. Chemical Engineering Journal, 230: 328-337 |
| [19] | Kumar A S K, Rajesh N. 2013. Exploring the interesting interaction between graphene oxide, Aliquat-336 (a room temperature ionic liquid) and chromium (Ⅵ) for wastewater treatment[J]. RSC Advances, 3(8): 2697-2709 |
| [20] | Li S K, Lu X F, Xue Y P, et al. 2012a. Fabrication of polypyrrole/graphene oxide composite nanosheets and their applications for Cr (Ⅵ) removal in aqueous solution[J]. Plos One, 7(8): e43328 |
| [21] | 李中华, 尹华, 叶锦韶, 等. 2007. 固定化菌体吸附矿山废水中重金属的研究[J]. 环境科学学报, 27(8): 1245-1250 |
| [22] | Li Z J, Chen F, Yuan L Y, et al. 2012b. Uranium (Ⅵ) adsorption on graphene oxide nanosheets from aqueous solutions[J]. Chemical Engineering Journal, 210: 539-546 |
| [23] | Liu L, Li C, Bao C L, et al. 2012. Preparation and characterization of chitosan/graphene oxide composites for the adsorption of Au (Ⅲ) and Pd (Ⅱ)[J]. Talanta, 93: 350-357 |
| [24] | Liu M C, Chen C L, Hu J, et al. 2011. Synthesis of magnetite/graphene oxide composite and application for cobalt (Ⅱ) removal[J]. The Journal of Physical Chemistry C, 115(51): 25234-25240 |
| [25] | 栾兆坤, 汤鸿宵. 1994. 硫酸铁氧化物的表征及其对重金属吸附作用的研究[J]. 环境科学学报, 14(2): 129-136 |
| [26] | Madadrang C J, Kim H Y, Gao G H, et al. 2012. Adsorption behavior of EDTA-graphene oxide for Pb (Ⅱ) removal[J]. ACS Applied Materials & Interfaces, 4(3): 1186-1193 |
| [27] | Mi X, Huang G B, Xie W S, et al. 2012. Preparation of graphene oxide aerogel and its adsorption for Cu2+ ions[J]. Carbon, 50(13): 4856-4864 |
| [28] | Mishra A K, Ramaprabhu S. 2011. Functionalized graphene sheets for arsenic removal and desalination of sea water[J]. Desalination, 282: 39-45 |
| [29] | Musico Y L F, Santos C M, Dalida M L P, et al. 2013. Improved removal of lead (Ⅱ) from water using a polymer-based graphene oxide nanocomposite[J]. Journal of Materials Chemistry A, 1(11): 3789-3796 |
| [30] | Pyrzyńska K, Bystrzejewski M. 2010. Comparative study of heavy metal ions sorption onto activated carbon, carbon nanotubes, and carbon-encapsulated magnetic nanoparticles[J]. Colloids and Surfaces (A: Physicochemical and Engineering Aspects), 362(1/3): 102-109 |
| [31] | Ren Y M, Yan N, Wen Q, et al. 2011. Graphene/δ-MnO2 composite as adsorbent for the removal of nickel ions from wastewater[J]. Chemical Engineering Journal, 175: 1-7 |
| [32] | Sitko R, Turek E, Zawisza B, et al. 2013. Adsorption of divalent metal ions from aqueous solutions using graphene oxide[J]. Dalton Transactions, 42(16): 5682-5689 |
| [33] | Sreeprasad T S, Maliyekkal S M, Lisha K P, et al. 2011. Reduced graphene oxide-metal/metal oxide composites: Facile synthesis and application in water purification[J]. Journal of Hazardous materials, 186(1): 921-931 |
| [34] | Sui Z Y, Meng Q H, Zhang X T, et al. 2012. Green synthesis of carbon nanotube-graphene hybrid aerogels and their use as versatile agents for water purification[J]. Journal of Materials Chemistry, 22(18): 8767-8771 |
| [35] | Sun Y B, Shao D D, Chen C L, et al. 2013. Highly efficient enrichment of radionuclides on graphene oxide-supported polyaniline[J]. Environmental Science & Technology, 47(17): 9904-9910 |
| [36] | 汤龙程, 万艳君, 高晓宇, 等. 2013. 石墨烯/聚合物纳米复合材料研究进展[J]. 科技导报, 31(27): 71-79 |
| [37] | Thakur S, Das G, Raul P K, et al. 2013. Green one-step approach to prepare sulfur/reduced graphene oxide nanohybrid for effective mercury ions removal[J]. The Journal of Physical Chemistry C, 117(15): 7636-7642 |
| [38] | Vadahanambi S, Lee S H, Kim W J, et al. 2013. Arsenic removal from contaminated water using three-dimensional graphene-carbon nanotube-iron oxide nanostructures[J]. Environmental Science & Technology, 47(18): 10510-10517 |
| [39] | 万祥云, 朱泮民. 2013. 颗粒状污泥活性炭流化床吸附处理含铜矿山废水[J]. 化工环保, 33(4): 312-315 |
| [40] | Wang H, Yuan X Z, Wu Y, et al. 2013. Adsorption characteristics and behaviors of graphene oxide for Zn (Ⅱ) removal from aqueous solution[J]. Applied Surface Science, 279: 432-440 |
| [41] | Wang J L, Chen C. 2006. Biosorption of heavy metals by Saccharomyces cerevisiae: A review[J]. Biotechnology Advances, 24(5): 427-451 |
| [42] | Wang J L, Chen C. 2009. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances, 27(2): 195-226 |
| [43] | 王建龙, 陈灿. 2010. 生物吸附法去除重金属离子的研究进展[J]. 环境科学学报, 30(4): 673-701 |
| [44] | 王建龙, 刘海洋. 2013. 放射性废水的膜处理技术研究进展[J]. 环境科学学报, 33(10): 2639-2656 |
| [45] | 王思雨, 谭欣, 于涛. 2014. TiO2-石墨烯(Gn)复合材料光催化降解O3研究[J]. 环境科学学报, 34(2): 325-330 |
| [46] | 王英刚, 孙丽娜, 张富韬. 2009. 水热法改性粉煤灰去除矿山酸性废水中金属离子[J]. 生态学杂志, 28(8): 1584-1588 |
| [47] | 魏广芝, 徐乐昌. 2007. 低浓度含铀废水的处理技术及其研究进展[J]. 铀矿冶, 26(2): 90-95 |
| [48] | 吴胜举, 吴翠荣, 李风亭. 2009. 新型介孔吸附剂的制备及吸附性能[J]. 环境科学学报, 29(9): 1897-1904 |
| [49] | Wu W Q, Yang Y, Zhou H H, et al. 2013a. Highly efficient removal of Cu (Ⅱ) from aqueous solution by using graphene oxide[J]. Water, Air, and Soil Pollution, 224: 1372 |
| [50] | Wu Y, Luo H J, Wang H, et al. 2013b. Adsorption of hexavalent chromium from aqueous solutions by graphene modified with cetyltrimethylammonium bromide[J]. Journal of Colloid and Interface Science, 394: 183-191 |
| [51] | 肖蓝, 王祎龙, 于水利, 等. 2013. 石墨烯及其复合材料在水处理中的应用[J]. 化学进展, 25(2/3): 419-430 |
| [52] | 肖丽萍, 高小雨, 丁蕊, 等. 2013. 膨润土复合吸附剂中碱性材料筛选及对酸性矿山废水处理[J]. 非金属矿, 36(5): 60-63 |
| [53] | Yang T, Liu L H, Liu J W, et al. 2012a. Cyanobacterium metallothionein decorated graphene oxide nanosheets for highly selective adsorption of ultra-trace cadmium[J]. Journal of Materials Chemistry, 22(41): 21909-21916 |
| [54] | Yang X, Chen C L, Li J X, et al. 2012b. Graphene oxide-iron oxide and reduced graphene oxide-iron oxide hybrid materials for the removal of organic and inorganic pollutants[J]. RSC Advances, 2(23): 8821-8826 |
| [55] | Yuan X Y, Wang Y F, Wang J, et al. 2013a. Calcined graphene/MgAl-layered double hydroxides for enhanced Cr (Ⅵ) removal[J]. Chemical Engineering Journal, 221: 204-213 |
| [56] | Yuan Y, Zhang G H, Li Y, et al. 2013b. Poly (amidoamine) modified graphene oxide as an efficient adsorbent for heavy metal ions[J]. Polymer Chemistry, 4(6): 2164-2167 |
| [57] | Zhang K, Dwivedi V, Chi C Y, et al. 2010. Graphene oxide/ferric hydroxide composites for efficient arsenate removal from drinking water[J]. Journal of Hazardous materials, 182(1/3): 162-168 |
| [58] | Zhang S W, Zeng M Y, Xu W Q, et al. 2013a. Polyaniline nanorods dotted on graphene oxide nanosheets as a novel super adsorbent for Cr(Ⅵ)[J]. Dalton Transactions, 42(22): 7854-7858 |
| [59] | Zhang W J, Shi X H, Zhang Y X, et al. 2013b. Synthesis of water-soluble magnetic graphene nanocomposites for recyclable removal of heavy metal ions[J]. Journal of Materials Chemistry A, 1(5): 1745-1753 |
| [60] | Zhao G X, Li J X, Ren X M, et al. 2011a. Few-layered graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management[J]. Environmental Science & Technology, 45(24): 10454-10462 |
| [61] | Zhao G X, Ren X M, Gao X, et al. 2011b. Removal of Pb (Ⅱ) ions from aqueous solutions on few-layered graphene oxide nanosheets[J]. Dalton Transactions, 40(41): 10945-10952 |
| [62] | 周洪英, 王学松, 李娜, 等. 2006. 关于海藻吸附水溶液中重金属离子的研究进展[J]. 科技导报, 24(12): 61-66 |
| [63] | Zhou L, Deng H P, Wan J L, et al. 2013. A solvothermal method to produce RGO-Fe3O4 hybrid composite for fast chromium removal from aqueous solution[J]. Applied Surface Science, 283: 1024-1031 |
| [64] | 周丽, 邓慧萍, 万俊力, 等. 2013. 石墨烯基铁氧化物磁性材料的制备及在水处理中的吸附性能[J]. 化学进展, 25(1): 145-155 |
| [65] | Zhu J H, Wei S Y, Gu H B, et al. 2011. One-pot synthesis of magnetic graphene nanocomposites decorated with core@double-shell nanoparticles for fast chromium removal[J]. Environmental Science & Technology, 46(2): 977-985 |
| [66] | Zhu J H, Sadu R, Wei S Y, et al. 2012a. Magnetic graphene nanoplatelet composites toward arsenic removal[J]. ECS Journal of Solid State Science and Technology, 1(1): M1-M5 |
| [67] | 朱娜, 黄丽, 马龙, 等. 2013. 树脂吸附处理某黄金矿山含铜废水的试验研究[J]. 黄金科学技术, 21(1): 62-64 |
| [68] | Zhu Y H, Hu J, Wang J L. 2012b. Competitive adsorption of Pb (Ⅱ), Cu (Ⅱ) and Zn (Ⅱ) onto xanthate-modified magnetic chitosan[J]. Journal of Hazardous materials, 221-222: 155-161 |
| [69] | Zhu Y H, Hu J, Wang J L. 2014. Removal of Co2+ from radioactive wastewater by polyvinyl alcohol (PVA)/chitosan magnetic composite[J]. Progress in Nuclear Energy, 71: 172-178 |
| [70] | Zong P F, Wang S F, Zhao Y L, et al. 2013. Synthesis and application of magnetic graphene/iron oxides composite for the removal of U(Ⅵ) from aqueous solutions[J]. Chemical Engineering Journal, 220: 45-52 |
 2015, Vol. 35
2015, Vol. 35


