挥发性含硫气体是自然界硫循环的重要组成部分,二甲基硫醚(DMS)、羰基硫(COS)、二硫化碳(CS2)和二甲二硫(DMDS)是大气中重要的挥发性有机硫化物(VOSCs).其中,DMS占全球总VOSCs排放量的75%以上(Lomans et al., 2002).DMS具有高反应活性,首先,DMS能够与大气中OH、NO3 等自由基发生氧化反应生成SO2、甲基磺酸(MSA)等,并进一步形成硫酸盐(SO42-),对酸雨的形成有重要贡献;其次,这些物质可形成云凝结核(CCN)和硫酸盐气溶胶,对地球辐射平衡和气候变化有着重要的影响(Andreae and Crutzen, 1997;Charlson et al., 1987;Quinn and Bates, 2011).
土壤是大气中DMS的重要来源之一,其年排放量为(0.29±0.17)Tg(Watts,2000).全球耕地面积超过15亿公顷,占全球陆地面积的12%;中国耕地面积约1亿公顷,为世界上耕地面积第二大国家(FAO,2013).农田土壤能释放大量的DMS,对大气DMS具有重要贡献(Yi et al., 2008;聂亚峰等,2001b).Yang 等(1998)实验室模拟测定中国不同地区水稻土DMS的排放量为0.2~6.7 mg · S · g-1.Yi等(2008)野外观测亚热带水稻田土壤DMS的排放速率为(3.8±2.8)pmol · m-2 · s-1.
研究表明,土壤DMS释放主要是一个微生物参与的代谢过程.土壤微生物将土壤中的甲硫氨酸、半胱氨酸等含硫氨基酸分解转化生成甲硫醇(MT),然后进一步甲基化生成DMS(Lomans et al., 2002;Higgins et al., 2006).近年来,已从食品、水体、森林土壤等中分离得到不同种类的产DMS微生物,包括布氏假单胞菌(Pseudomonas brenneri)、恶臭假单胞菌(Pseudomonas putida)、罗氏假单胞菌(Pseudomonas rhodesiae)(Morales et al., 2005)、暗杆菌属(Pelobacter)(Bak et al., 1992)、土生空团菌(Cenococcum geophilum)(Bäcket al., 2010)等.但目前从农田土壤中筛选产DMS微生物的研究尚未见报道.此外,土壤微生物参与释放DMS等VSCs的过程较复杂,除受遗传因素影响之外,还受底物种类与浓度、环境温度与pH等因素的影响(Gamliel,1993;乔维川等,2000;聂亚峰等,2001a;刘俊锋等,2004). 因此,很有必要从农田土壤中分离筛选参与DMS释放的关键微生物并对其释放DMS的影响机理进行入深研究.
因此,本研究采用以甲硫氨酸为唯一碳源和氮源的改良基础盐培养基(MBM),从安徽省不同地区农田土壤中富集筛选产DMS细菌,并通过研究不同温度、pH及不同碳源、氮源对高效产DMS细菌菌株产DMS能力的影响来探讨其产DMS的特性,这将为揭示农田土壤DMS释放的微生物学机制提供理论基础.
2 材料与方法(Materials and methods) 2.1 材料 2.1.1 土样选择安徽省4个不同农田分布区(安庆市潜山县、蚌埠市五河县、芜湖市鸠江区和芜湖市芜湖县)典型农田地块,采用五点采样法,铲去表土,取15~20 cm深处土壤装入无菌袋中,注明采集地点、日期、土样号,带回实验室及时进行DMS产生细菌的分离.4个不同地区土样理化性质参照文献分析(鲍士旦,2000),结果如表 1所示.
| 表1 土壤样品的基本特征 Table 1 Basic characteristics of the soil samples |
①产DMS细菌的富集、分离和纯化培养基为改良基础盐培养基(MBM),其主要配方参照文献(李立,2011),具体如下:KH2PO4,0.6 g · L-1; K2HPO4,0.9 g · L-1;MgSO4 · 7H2O,0.2 g · L-1;CaCl2 · 2H2O,0.075 g · L-1;Fe-EDTA,0.0295 g · L-1;MnSO4,0.1599 g · L-1;H3BO3,0.28 g · L-1;CuSO4 · 5H2O,0.0079 g · L-1;ZnSO4,0.024 g · L-1;Na2MoO4 · 2H2O,0.126 g · L-1;(NH4)2SO4,0.06 g · L-1;NaCl,1.17 g · L-1;Yeast extract,0.05 g · L-1;vitamin B12,2 μg · L-1;p-氨基苯,10 μg · L-1;核黄素,10 μg · L-1;vitamin B6,10 μg · L-1;烟酸B5,10 μg · L-1;vitamin C,10 μg · L-1;vitamin Bl,10 μg · L-1;D-(+)-生物素,10 μg · L-1.培养基终pH为7.0,高压灭菌后贮藏于冰箱.在培养基冷却后,于无菌条件下加入过滤除菌(通过孔径为0.22 μm滤膜)的甲硫氨酸母液,使甲硫氨酸最终质量浓度为10 mmol · L-1(1.492 g · L-1).固体培养基加入15 g · L-1 的琼脂.②产DMS细菌保藏培养基(NA):牛肉膏 3 g,NaCl 5 g,蛋白胨10 g,琼脂18 g,蒸馏水1000 mL,pH 7.2~7.4.③产DMS细菌种子培养基(LB):胰蛋白胨 10 g,酵母提取物5 g,NaCl 5 g,蒸馏水1000 mL,pH 7.2~7.4.高压蒸汽灭菌(121 ℃,30 min).
2.1.3 主要试剂和仪器①仪器:QP2010A气相色谱与QP2010Plus质谱联用(GC/MS,Shimadzu,Japan),TurboMatrix顶空进样器(HS)及顶空瓶(PerkinElmer,USA),722 可见分光光度计(上海佑科仪器仪表公司),Biometra PCR 仪(Biometra,Germany),DYY-10三恒电泳仪,Biorad GelDoc XR凝胶成像系统(BioRad,America).②试剂:二甲基硫醚(DMS)标样(Sigma-Aldrich,USA),DMS-d6氘代内标(Sigma-Aldrich,USA),甲硫氨酸(上海蓝技科技发展有限公司,上海),细菌基因组DNA快速抽提试剂盒(上海生工,上海),AxyPrep TM PCRA纯化试剂盒(Axygen Biotech,杭州).
2.2 农田土壤产DMS细菌富集、分离及筛选 2.2.1 产DMS细菌的初筛采用MBM培养基富集产DMS细菌.具体方法如下:将50 mL不含甲硫氨酸的MBM装入100 mL三角瓶中灭菌,冷却后在无菌条件下加入过滤除菌的甲硫氨酸母液,使甲硫氨酸最终质量浓度为10 mmol · L-1,同时加入2.5 g土壤样品于30 ℃、180 r · min-1振荡培养4 d后,取0.1 mL发酵液涂布于MBM平板上置于30 ℃下培养4 d.挑取平板上颜色和菌落大小有明显区别的菌落纯化多次,直至通过平板和镜检观察确定其为纯培养物后,挑取单菌落转至NA斜面培养2~3 d,然后置于4 ℃冰箱保存.
2.2.2 产DMS细菌的复筛将获得的产DMS潜力菌株活化后接种于LB种子培养基,30 ℃振荡培养18~24 h(OD600约为1.0)制成种子液,取0.5 mL种子液接种于含50 mL MBM培养液的100 mL三角瓶中,同时加入过滤除菌的甲硫氨酸母液使其最终质量浓度为10 mmol · L-1,pH为7.0,以接种0.5 mL空白种子液的MBM培养液为空白对照,每个处理3个重复,30 ℃、180 r · min-1振荡培养48 h 后,取5 mL发酵液至22 mL顶空瓶中,同时加入DMS-d6内标(终浓度100 ng · mL-1),立即加含特氟龙垫片顶空瓶盖密封,利用HS-GC/MS测定各菌株产DMS的能力(Arfi et al., 2003).
2.3 细菌的鉴定 2.3.1 菌株的形态及生理生化特征菌株的形态鉴定参照文献(东秀珠和蔡妙英,2001)进行.参照《微生物实验技术》(姚占芳和吴云汉,1998)对筛选出的菌株进行革兰氏染色试验和生理生化试验,包括氧化酶、接触酶、甲基红、V-P反应、硝酸盐还原、水解甘露醇、水解淀粉、葡萄糖利用、柠檬酸盐利用、产吲哚试验.
2.3.2 细菌的16SrRNA分析 挑取单菌落置于LB培养基中,于30 ℃、180 r · min-1振荡过夜培养,利用细菌DNA提取试剂盒按照其说明书进行菌株总DNA提取.以菌株DNA为模板,利用细菌通用引物5′-AGAGTTTGATCMTGGCTCAG-3′(Escherichia coli bases 8 to 27)和5′-ACGGTTACCTTGTTACGACTT-3′(Escherichia coli bases 1507 to 1487)进行16S rRNA基因的PCR扩增;构建30 μL反应体系:总DNA模板 1 μL,2.5 μmol · L-1 dNTP 2 μL,10 × Taq buffer 5 μL,2.5 U · μL-1 Taq 酶 1 μL,10 μmol · L-1正反向引物各1 μL,ddH2O 19 μL.PCR反应条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火4 s,72 ℃延伸1.5 min,共30个循环;72 ℃延伸10 min;4 ℃保持.PCR扩增产物经1.0% 琼脂糖凝胶电泳检测后,利用 Promega DNA 纯化试剂盒进行回收纯化,然后与pEASY-T3载体连接,转化到大肠杆菌DH5α感受态细胞,挑选阳性克隆提取质粒进行测序.16S rRNA测序由上海生工生物工程有限公司完成.
2.3.3 序列对比及系统发育分析将测序得 到 的 序 列 登 陆EzTaxon server(http: //www. EzTaxon.org)进行BLAST分析,与模式菌株核酸数据进行比对,并用Mega5.05软件构建系统进化树(Bootstrap=1000).
2.4 高效产DMS菌株Pseudomonas putida BB3 产DMS的影响因素测定 2.4.1 不同温度对BB3菌株产DMS能力的影响将BB3菌株活化后接种于LB种子培养基,30 ℃ 振荡培养18~24 h制成种子液,取0.5 mL种子液接种于含50 mL MBM培养液的100 mL三角瓶中,同时加入过滤除菌的甲硫氨酸母液使其终浓度为10 mmol · L-1,pH 7.0,以接种0.5 mL空白种子液的MBM培养液为空白对照,分别置于20、25、30、35、40、45 ℃和50 ℃,180 r · min-1振荡培养48 h后取5 mL培养液,按2.2.2节中的方法测定不同温度对BB3菌株产DMS能力的影响,每个处理3个重复.
2.4.2 不同初始pH对BB3菌株产DMS能力的影响将BB3菌株活化后接种于LB种子培养基,30 ℃ 振荡培养18~24 h制成种子液,取0.5 mL种子液接种于含50 mL MBM培养液的100 mL三角瓶中,同时加入过滤除菌的甲硫氨酸母液使其终浓度为10 mmol · L-1,以接种0.5 mL空白种子液的MBM培养液为空白对照,调节培养液初始pH至4.0、5.0、6.0、7.0、8.0、9.0和10.0,35 ℃,180 r · min-1振荡培养48 h后取5 mL培养液,按2.2.2节中的方法测定不同初始pH对BB3菌株产DMS能力的影响,每个处理设置3个重复.
2.4.3 不同碳源添加对BB3菌株产DMS能力的影响将BB3菌株活化后接种于LB种子培养基,30 ℃ 振荡培养18~24 h制成种子液,取0.5 mL种子液接种于含50 mL MBM培养液的100 mL三角瓶中,同时加入过滤除菌的甲硫氨酸母液使其终浓度为10 mmol · L-1后,以接种0.5 mL空白种子液的MBM培养液为空白对照,分别加入淀粉、葡萄糖、蔗糖和半乳糖使其终浓度为2g · L-1,pH 7.0,35 ℃,180 r · min-1振荡培养48 h后取5 mL培养液,按2.2.2节中的方法测定添加不同碳源对BB3菌株产DMS能力的影响,每个处理设置3个重复.
2.4.4 不同氮源添加对BB3菌株产DMS能力的影响将BB3菌株活化后接种于LB种子培养基,30 ℃ 振荡培养18~24 h制成种子液,取0.5 mL种子液接种于含50 mL MBM培养液的100 mL三角瓶中,同时加入过滤除菌的甲硫氨酸母液使其终浓度为10 mmol · L-1后,以接种0.5 mL空白种子液的MBM培养液为空白对照,分别加入硝酸钾、氯化铵、酵母提取物和蛋白胨使其终浓度为2g · L-1,pH为7.0,35 ℃,180 r · min-1振荡培养48 h后取5 mL培养液,按2.2.2节中的方法测定添加不同氮源对BB3菌株产DMS能力的影响,每个处理设置3个重复.
2.5 HS-GM/MS分析 2.5.1 仪器及条件样品中DMS经顶空进样器预处理后,进入GC/MS进行分析测定.顶空的条件为:载气(He)压力为19 psi,炉温80 ℃,取样针温度为90 ℃,传输线温度为100 ℃,平衡时间为15 min,加压时间为1 min,进样时间为0.04 min,拔针时间为0.5 min,GC循环时间设定为30 min.GC条件为:HP-1毛细管色谱柱(30 m × 0.25 mm × 0.25 μm);GC升温程序为:初始温度为30 ℃,保持3 min,然后以20 ℃ · min-1升至250 ℃,保持10 min;载气为高纯氦(99.999%),流速1.5 mL · min-1.MS条件为:离子源、接口温度为250 ℃;电离方式为电子电离(EI),电离能量70 eV;采用选择离子模式(SIM)检测,DMS主要特征离子质荷比(m:z)为47和62,DMS-d6主要特征离子为50和68.
2.5.2 DMS定性与定量分析样品中DMS通过对照标样的保留时间进行定性分析,采用内标法建立标准曲线根据峰面积进行定量.DMS标样先用不含甲硫氨酸的MBM培养液稀释获得质量浓度约为1.0 mg · mL-1储备液,再逐级稀释得到质量浓度分别为0(不含甲硫氨酸的MBM培养液)、10、50、100、200、500和1000 ng · mL-1系列标样,分别取5 mL置于顶空瓶中,并加入DMS-d6作为内标(终浓度为100 ng · mL-1),然后进行仪器分析.DMS在0~1000 ng · mL-1质量浓度范围内线性良好(R2>0.99);方法检测限分别为10 ng · mL-1;连续检测质量浓度为200 ng · mL-1的DMS标样10次,相对标准偏差(RSDs)为4.6%.
2.6 数据分析采用SPSS16. 0 统计软件进行单因素方差多重分析(One-Way ANOVA),显著性水平p<0.05.
3 结果与分析(Results and analysis) 3.1 农田土壤产DMS细菌的初筛用富集培养基分离所采集的安徽4个不同地区农田土壤,获得26株产DMS细菌的潜力菌株,这些菌株能在以甲硫氨酸为唯一碳氮源平板上生长.其中,安庆市潜山县4株、蚌埠市五河县9株、芜湖市鸠江区6株和芜湖县土样中获得7株.
3.2 产DMS细菌的复筛将初筛获得的26株产DMS细菌的潜力菌株按2.2.2节所述方法分别测定其产DMS的能力.通过HS-GM/MS分析结果表明,共有 8株细菌能利用甲硫氨酸进行代谢产生DMS,各菌株DMS产量均明显高于对照(0.06 μg),不同处理间差异显著(见表 2).8株产DMS细菌DMS产量在0.63~3.06 μg 之间.如表 2中所示,菌株BB3 、BB2、AQ1和BB1产DMS能力明显高于其它菌株,为高效产DMS菌株,DMS产量分别高达3.06 μg、2.65 μg、1.96 μg和1.73 μg.
| 表2 8株产DMS细菌产DMS能力的测定 Table 2 DMS-producing ability of eight DSPB strains |
把4株高效产DMS细菌在NA平板上划线生长4 d,观察其菌落形态.菌株AQ1菌落特征为圆形、淡黄色、粘稠、中间隆起、边缘整齐.菌株BB1和BB3菌落特征较相似,为圆形,乳白色,表面光滑湿润但不透明,边缘整齐,有光泽.菌株BB2菌落形态为圆形,白色,菌落直径较大,表面光滑,边缘完整规则.
3.3.2 产DMS细菌的生理生化特性对4 株高效产DMS细菌的各项生理生化鉴定项目包括:革兰氏染色、氧化酶、接触酶、甲基红、V-P反应、硝酸盐还原、水解甘露醇、水解淀粉、葡萄糖利用、柠檬酸盐 利用和产吲哚.菌株AQ1、BB1、BB2和BB3 的各项 生理生化鉴定结果见表 3.每个生理生化鉴定实验重复3次,结果稳定.4株菌均呈革兰氏阴性(G-),氧化酶、接触酶和葡萄糖代谢均呈阳性,甲基红和淀粉水解均呈阴性;菌株BB2的V-P试验呈阳性,其他3株菌均呈阴性;菌株BB2的硝酸盐还原呈阴性,其它3株菌均呈阳性;菌株AQ1的柠檬酸盐利用和产吲哚均呈阳性,其它3株菌均呈阴性.
| 表3 4株高效产DMS细菌生理生化特征 Table 3 Physiological and biochemical characteristics of four DSPB strains with high DMS-producing potential |
rRNA 分析鉴定 以菌株AQ1、BB1、BB2和BB3的总DNA 为模板,使用一对细菌通用引物分别扩增出长约1457 bp、1479 bp、1395 bp和1447 bp的片段,将所测16S rRNA序列登录http: //www. EzTaxon.org进行BLAST比对,获得同源性数值,运用ClustalX 软件进行分析,形成一个多重复匹配列阵,利用MEGA5.05 采用Neighbor-Joining 法构建系统发育树.4株菌株通过BLAST比对,都能在数据库中找到同源性非常高的相似菌株序列.菌株AQ1、BB1、BB3分别与假单胞菌属,菌株BB2与剑菌属具有较高的序列相似性.从图 1的发育树可以看出,菌株AQ1、BB1、BB3、BB2的遗传进化距离分别与硝基还原假单胞菌(Pseudomonas nitroreducens)、恶臭假单胞菌(Pseudomonas putida)、恶臭假单胞菌(Pseudomonas putida)和附着剑菌(Ensifer adhaerens)亲缘关系较近.因此,综合4株产DMS细菌的培养特征、生理生化特征和系统发育分析结果,分别将菌株AQ1和BB2准确鉴定为硝基还原假单胞菌(Pseudomonas nitroreducens)和附着剑菌(Ensifer adhaerens),菌株BB1和BB3准确鉴定为恶臭假单胞菌(Pseudomonas putida).
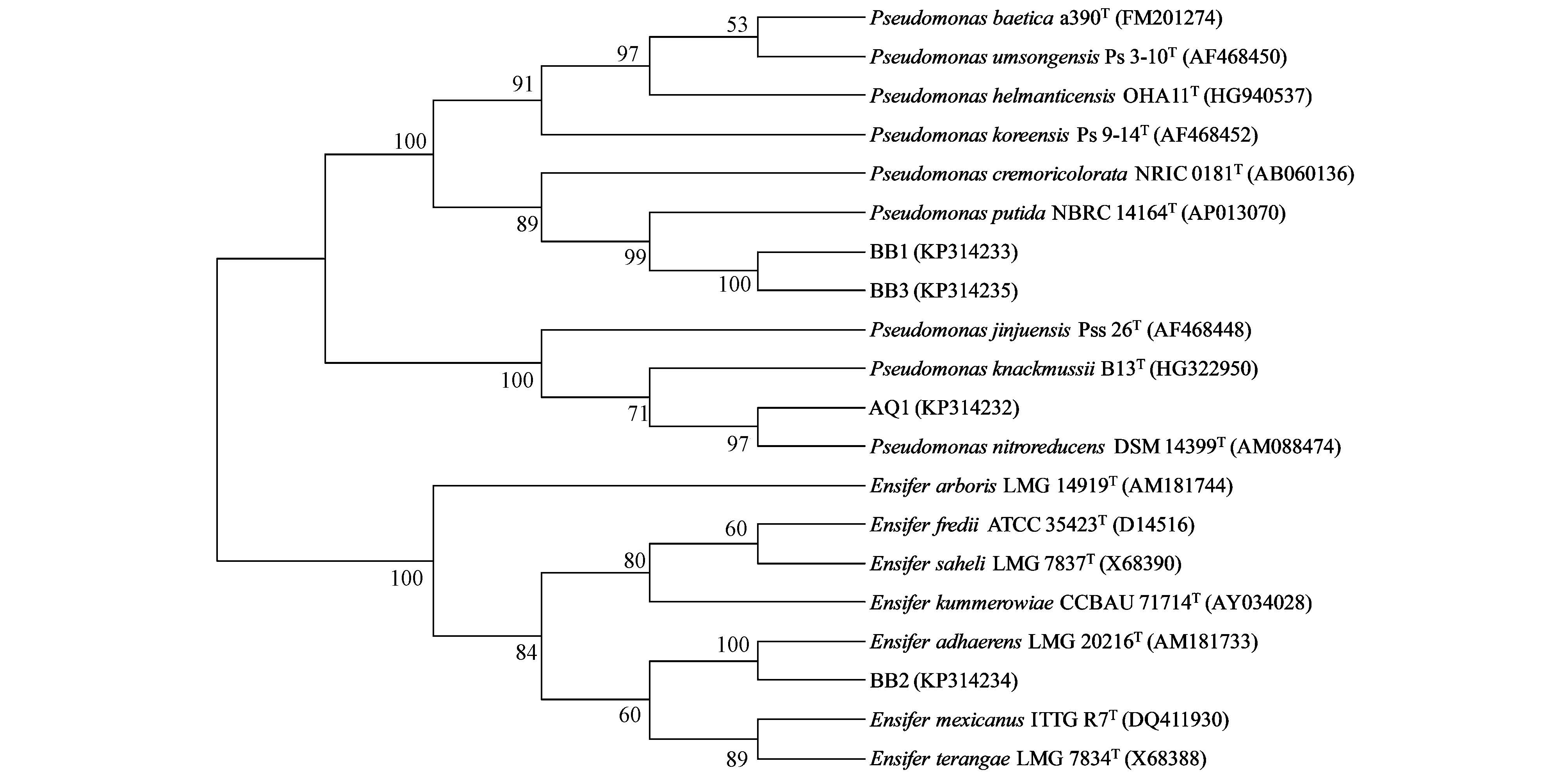 |
| 图1 依据16S rRNA 基因序列构建的4 株高效产DMS菌株的系统发育树 Fig.1 Phylogenetic tree based on the 16S rRNA sequence of four DSPB strains with high DMS-producing potential |
从图 2可以看出,不同的培养温度可显著影响BB3菌株产DMS的能力.其中,当温度在25~40 ℃时,BB3菌株具有较强产DMS能力;当温度为35 ℃时,该菌株产DMS能力达到最大,DMS的产量为4.97 μg;其次是在温度30 ℃和40 ℃时,BB3菌株产DMS的量分别为2.78 μg和3.22 μg;但在温度为20 ℃、45 ℃和50 ℃时,BB3菌株产DMS的能力显著下降,DMS的产量较小.
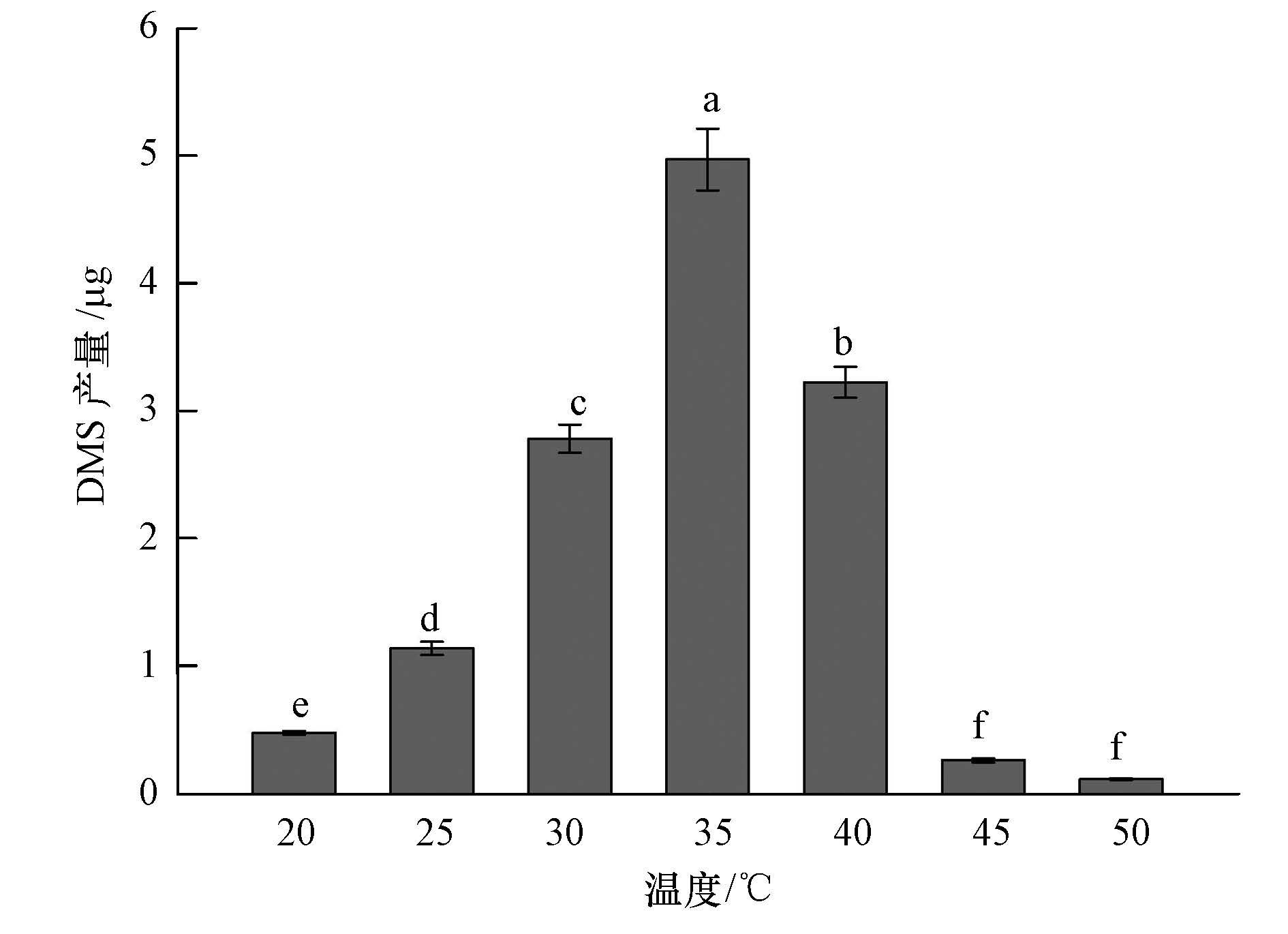 |
| 图2 不同温度对Pseudomonas putida BB3菌株产DMS能力的影响 Fig.2 Effects of temperature on DMS production by Pseudomonas putida BB3 |
从图 3可以看出示,不同初始pH可显著影响BB3菌株产DMS的能力(p<0.05).其中,当初始pH为6.0~8.0时,BB3菌株产DMS的能力均较强;当初始pH为7.0时,BB3菌株产DMS的能力最强,DMS产量为4.97 μg;但当pH≤5.0或pH≥9.0时,BB3菌株产DMS的量急剧下降,几乎接近于零.
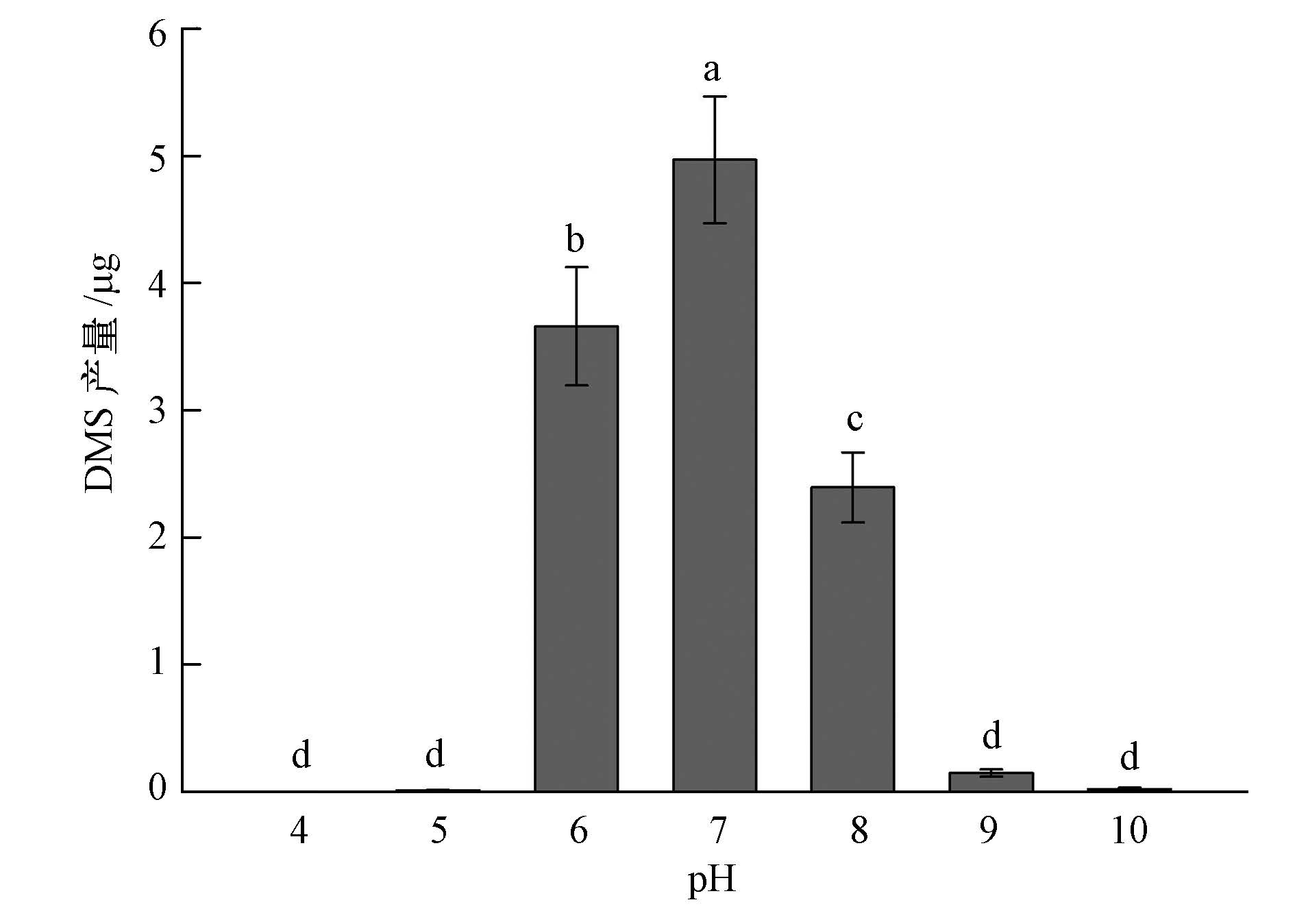 |
| 图3 不同初始pH对Pseudomonas putida BB3菌株产DMS能力的影响 Fig.3 Effects of primary pH on DMS production by Pseudomonas putida BB3 |
通过添加葡萄糖、淀粉、蔗糖、半乳糖等土壤环境中常见的碳源来研究其对BB3菌株产DMS能力的影响.从图 4中可以看出,添加不同的碳源物质可显著影响BB3菌株产DMS的能力(p<0.05).其中,淀粉添加可显著提高BB3菌株产DMS能力(p<0.05),DMS产量为7.16 μg,是对照组(4.97 μg)的1.4倍.相反,葡萄糖和蔗糖添加对BB3菌株产DMS的能力均有显著的抑制作用(p<0.05),DMS产量分别为3.53 μg和2.73 μg,是对照组的0.7和0.5倍.添加半乳糖后,菌株BB3产DMS能力没有明显的变化,DMS产量为4.56 μg.
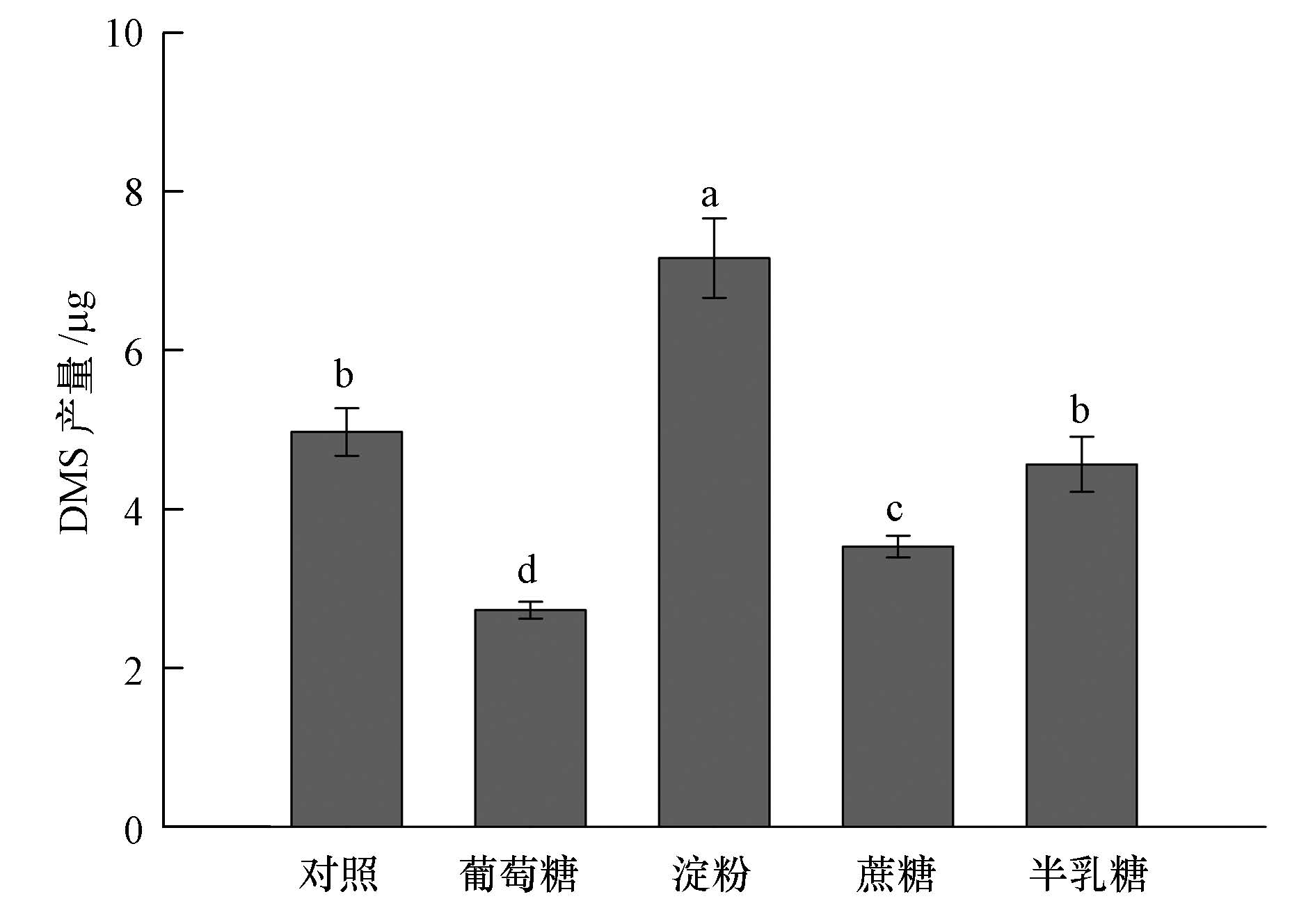 |
| 图4 不同碳源添加对Pseudomonas putida BB3菌株产DMS的影响 Fig.4 Effect of carbon sources on DMS production by Pseudomonas putida BB3 |
通过添加农业生产中常用肥料物质氯化铵和硝酸钾以及细菌培养过程常用氮源物质蛋白胨和酵母提取物来探究氮源对BB3菌株产DMS的影响.从图 5可以看出,添加不同的氮源可显著影响BB3菌株产DMS的能力(p<0.05).其中,添加硝酸钾和氯化铵可显著提高BB3菌株产DMS的能力(p<0.05),DMS产量分别为11.68 μg和12.71 μg,是对照组(4.97 μg)的2.4和2.6倍.添加酵母提取物和蛋白胨后,BB3菌株产DMS的能力没有明显的变化,DMS产量分别为3.81 μg和3.60 μg.
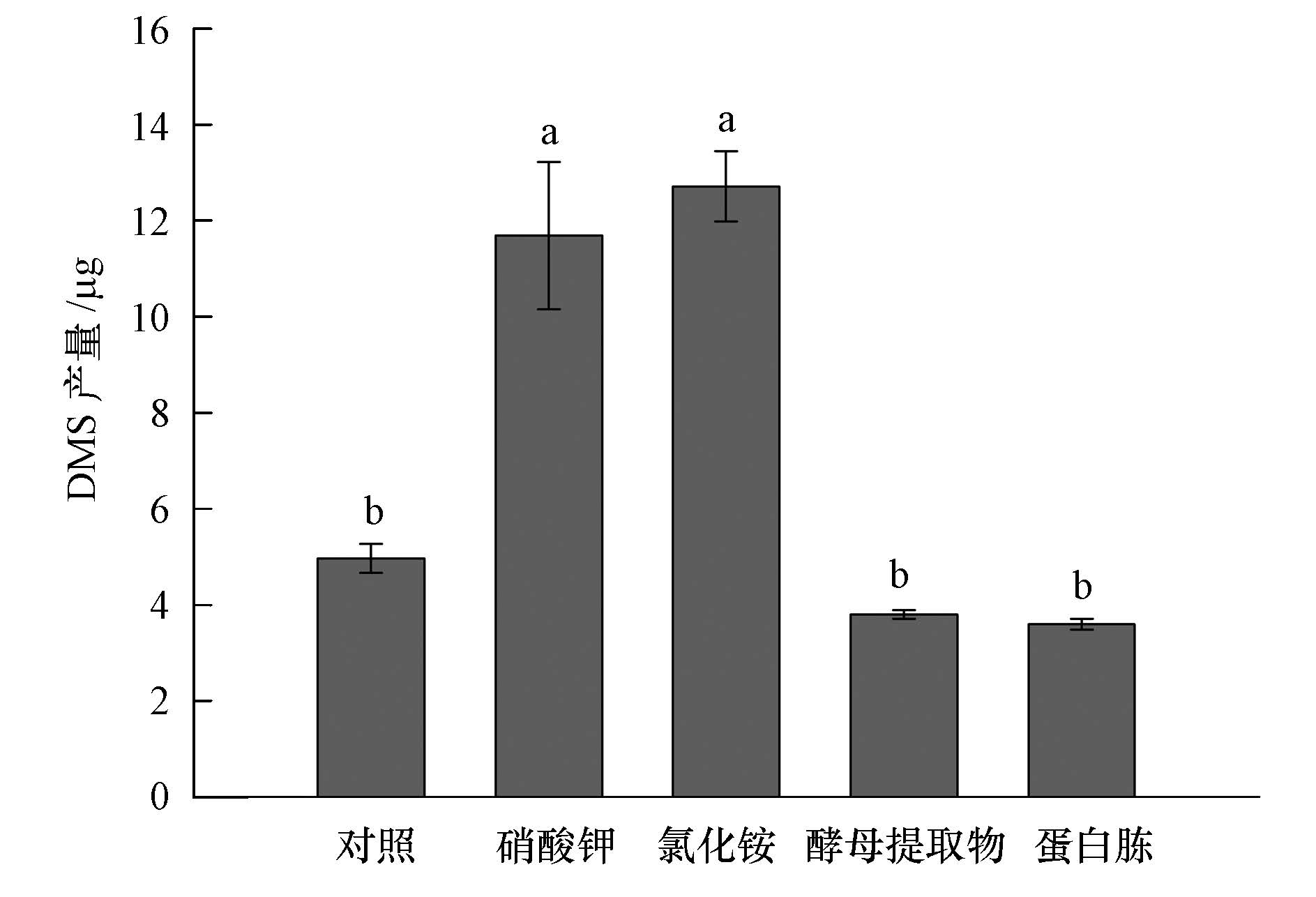 |
| 图5 不同氮源添加对Pseudomonas putida BB3产DMS的影响 Fig.5 Effect of nitrogen sources on DMS production by Pseudomonas putida BB3 |
挥发性有机硫化物(VOSCs)作为对区域大气污染和全球气候变化有重要贡献的物质,其产生机理和排放规律受到国内外学者的广泛关注.DMS作为VOSCs的重要组分,对大气环境效应有重要影响.自然界中DMS重要来源之一是由微生物降解二甲基巯基丙酸内盐(DMSP)和甲硫氨酸产生的.前者主要存在于海洋及盐碱地的浮游生物体内,在微生物DMSP裂解酶的作用下生成DMS(张麋鸣等,2013),后者是广泛存在陆地和淡水环境中,在微生物甲硫氨酸裂解酶的作用下生成DMS(Lomans et al., 2002).本研究从农田土壤中筛选出4株高效产DMS细菌,通过培养特征、生理生化特征和16S rRNA系统发育分析,菌株AQ1和BB2分别鉴定为硝基还原假单胞菌(Pseudomonas nitroreducens)和附着剑菌(Ensifer adhaerens),菌株BB1和BB3均鉴定为恶臭假单胞菌(Pseudomonas putida).其中,Pseudomonas putida BB3菌株产DMS的能力最强,其在30 ℃下培养48 h后DMS产量高达3.06 μg,显著高于其他菌株(p<0.05).据文献报道,从沿海红树林生境筛选出的产DMS细菌,包括恶臭假单胞菌(Pseudomonas putida)、假单胞菌(Pseudomonas sp.)等也能降解DMSP生成DMS(李立,2011).这可能说明假单胞菌属(Pseudomonas)的细菌既能通过降解DMSP途经生成DMS,又能通过降解甲硫氨酸途径生成DMS,因而其在自然生态系统对DMS排放可能有着重要的贡献.截至目前,尚未发现剑菌属(Ensifer)产DMS的研究报道,但是与其同样归属于根瘤菌科(Rhizobiaceae)的根瘤菌属(Rhizobium)菌株R8021被证实能通过甲基化作用使硫化物转化成MT(Drotar et al., 1987),而MT是微生物降解产DMS的过程中的一个重要的中间产物(Higgins et al., 2006).
土壤微生物活动与环境温度与pH等因素密切相关.本研究的结果表明,不同培养温度与初始pH对Pseudomonas putida BB3菌株产DMS能力具有显著影响(p<0.05),该菌株产DMS适宜的温度范围为25~40 ℃,pH为 6.0~8.0.其中,当培养温度为35 ℃,初始pH为7.0时该菌株产DMS的能力最强,这可能是由于微生物降解甲硫氨酸产生DMS主要是一个甲硫氨酸裂解酶(L-methionine γ-lyase)参与作用的过程(Lomans et al., 2002),该酶在较温和的温度和偏中性的酸碱条件下活性最强,过低或过高的温度和过酸或过碱的环境均会抑制该酶的活性甚至导致失活,从而使得微生物转化甲硫氨酸产生DMS的量下降.另有研究表明,在一定的温度范围内,土壤微生物活动和DMS等VOSCs排放通量均随温度升高而升高(Gamliel et al., 1993;聂亚峰等,2001a),但当温度超过一定范围后,土壤微生物活动和DMS等VOSCs排放通量反而随温度升高而下降(刘俊锋等,2004).乔维川等(2000)研究发现,微生物分解胱氨酸、半胱氨酸、甲硫氨酸、硫酸二乙酯4种有机硫源产生DMS等VOSCs最适pH 范围为3.25~8.62.
某些细菌在分解甲硫氨酸时往往需要其他有机物共同提供碳氮源和能量供其生长(Segal and Starkey, 1969;Sreekumar et al., 2009).但是不同碳氮源的加入使培养基中C /N 比发生改变,对微生物的养料供应情况也发生了相应变化,这使微生物的活性和对甲硫氨酸的利用发生了改变,产生了竞争关系,最终导致DMS产量的变化.本研究结果表明,淀粉、氯化铵和硝酸钾添加对BB3菌株产DMS能力有显著的促进作用(p<0.05),而蔗糖和葡萄糖添加对BB3菌株产DMS能力有显著的抑制作用(p<0.05).这可能是由于淀粉、氯化铵和硝酸钾的添加促进了BB3菌株的生长和活性,从而增加了其转化底物甲硫氨酸产生DMS的能力,而葡萄糖和蔗糖作为碳源更容易被BB3菌株代谢,从而减少其对甲硫氨酸的利用,并导致其转化甲硫氨酸产生DMS的能力下降.目前尚未见碳氮源添加对假单胞菌属降解甲硫氨酸产生DMS影响的相关报道.虽然Arfi等(2003)研究报道了甘油和葡萄糖添加可显著增加白地霉菌(Geotrichum c and idum)转化甲硫氨酸产生DMS的量,乔维川等(2000)研究发现硝酸铵的添加可降低稻田土壤微生物分解甲硫氨酸产生羰基硫(COS)的量显著降低,但是由于这些报道中菌的种属或产物与本研究不同,其结果无法比对.此外,本研究发现蔗糖和葡萄糖添加显著降低了BB3菌株产DMS的量,这对农业生产过程控制还原性含硫气体排放具有一定指导意义.
5 结论(Conclusions)1)筛选到4株高效产DMS细菌,分别命名为AQ1、BB1、BB3和BB2.经培养特征、生理生化特征和16S rRNA系统发育分析.4株产DMS细菌分别鉴定为硝基还原假单胞菌(Pseudomonas nitroreducens)、恶臭假单胞菌(Pseudomonas putida)、恶臭假单胞菌(Pseudomonas putida)和附着剑菌(Ensifer adhaerens).
2)不同温度和初始pH对BB3菌株产DMS能力具有显著影响,该菌株产DMS适宜的温度范围为25~40 ℃,pH 6.0~8.0.其中,温度35 ℃,初始pH 7.0 时,BB3菌株产DMS的能力最强.
3)淀粉添加能显著提高BB3菌株产DMS的能力,而蔗糖和葡萄糖添加显著抑制了BB3菌株产DMS的能力,半乳糖添加对BB3菌株产DMS的能力没有明显影响.
4)氯化铵和硝酸钾显著的提高了BB3菌株产DMS的能力,而蛋白胨和酵母提取物对BB3菌株产DMS能力的影响不显著.
| [1] | Andreae M O, Crutzen P J. 1997. Atmospheric aerosols:biogeochemical sources and roles in atmospheric chemistry[J]. Science, 276(5315):1052-1058 |
| [2] | Arfi K, Tâche R, Spinnler H E, et al. 2003. Dual influence of the carbon source and L-methionine on the synthesis of sulphur compounds in the cheese-ripening yeast Geotrichum candidum[J]. Applied Microbiology and Biotechnology, 61(4):359-365 |
| [3] | Bäck J, Aaltonen H, Hellén H, et al. 2010. Variable emissions of microbial volatile organic compounds (MVOCs) from root-associated fungi isolated from Scots pine[J]. Atmospheric Environment, 44(30):3651-3659 |
| [4] | Bak F, Finster K, Rothfuß F. 1992. Formation of dimethylsulfide and methanethiol from methoxylated aromatic compounds and inorganic sulfide by newly isolated anaerobic bacteria[J]. Archives of Microbiology, 157(6):529-534 |
| [5] | 鲍士旦. 2000.土壤农化分析(第3版)[M].北京:中国农业出版社 |
| [6] | Charlson R J, Lovelock J E, Andreae M O, et al. 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate[J]. Nature, 326(6114):655-661 |
| [7] | 东秀珠,蔡妙英. 2001.常见细菌系统鉴定手册[M].北京:科学出版社 |
| [8] | Drotar A, Burton G A Jr, Tavernier J E, et al. 1987. Widespread occurrence of bacterial thiol methyltransferases and the biogenic emission of methylated sulfur gases[J]. Applied and Environmental Microbiology, 53(7):1626-1631 |
| [9] | Food and Agricultural Organization (FAO). 2013. FAO Statistical Yearbook 2013. FAOSTAT[OL]. http://issuu.com/faooftheun/docs/syb2013issuu |
| [10] | Gamliel A. 1993. Characterization of antifungal volatile compounds evolved from solarized soil amended with cabbage residues[J]. Phytopathology, 83(7):899-905 |
| [11] | Higgins M J, Chen Y C, Yarosz D P, et al. 2006. Cycling of volatile organic sulfur compounds in anaerobically digested biosolids and its implications for odors[J]. Water Environment Research, 78(3):243-252 |
| [12] | 李立. 2011.红树林生境土壤DMS产生细菌的分离和多样性分析[D].武汉:华中农业大学 |
| [13] | 刘俊锋,耿春梅,牟玉静,等. 2004.羰基硫(COS)在土壤中的吸收与转化[J].环境化学, 23(6):615-620 |
| [14] | Lomans B P, van der Drift C, Pol A, et al. 2002b. Microbial cycling of volatile organic sulfur compounds[J]. Cellular and Molecular Life Sciences, 59(4):575-588 |
| [15] | Morales P, Fernández-García E. Nuñez M. 2005. Volatile compounds produced in cheese by Pseudomonas strains of dairy origin belonging to six different species[J]. Journal of Agricultural and Food Chemistry, 53(17):6835-6843 |
| [16] | 聂亚峰,席淑琪,张晋华,等. 2001a.环境因素对土壤含硫气体释放的影响[J].环境化学, 20(1):38-42 |
| [17] | 聂亚峰,张晋华,席淑琪,等. 2001b.小麦田中有机硫气体的释放[J].环境科学, 22(4):25-28 |
| [18] | 乔维川,席淑琪,张晋华,等. 2000.土壤理化条件变化对含硫气体释放的影响[J].环境科学, 21(1):78-80 |
| [19] | Quinn P K, Bates T S. 2011. The case against climate regulation via oceanic phytoplankton sulphur emissions[J]. Nature, 480(7375):51-56 |
| [20] | Segal W, Starkey R L. 1969. Microbial decomposition of methionine and identity of the resulting sulfur products[J]. Journal of Bacteriology, 98(3):908-913 |
| [21] | Sreekumar R, Al-Attabi Z, Deeth H C, et al. 2009. Volatile sulfur compounds produced by probiotic bacteria in the presence of cysteine or methionine[J]. Letters in Applied Microbiology, 48(6):777-782 |
| [22] | Watts S F. 2000. The mass budgets of carbonyl sulfide, dimethyl sulfide, carbon disulfide and hydrogen sulfide[J]. Atmospheric Environment, 34(5):761-779 |
| [23] | Yang Z, Kong L, Zhang J, et al. 1998. Emission of biogenic sulfur gases from Chinese rice paddies[J]. The Science of the Total Environment, 224(1/3):1-8 |
| [24] | 姚占芳,吴云汉. 1998.微生物学实验技术[M].北京:气象出版社 |
| [25] | Yi Z G, Wang X M, Sheng G Y, et al. 2008. Exchange of carbonyl sulfide (OCS) and dimethyl sulfide (DMS) between rice paddy fields and the atmosphere in subtropical China[J]. Agriculture, Ecosystems and Environment, 123(1/3):116-124 |
| [26] | 张麋鸣,陈立奇,汪建君. 2013.南大洋二甲基硫海-气交换过程研究进展[J].地球科学进展, 28(9):1015-1024 |
 2016, Vol. 36
2016, Vol. 36


