20世纪生物科学技术的发展,特别是70年代DNA重组技术的成功(Friedmann,1992),为维护人体健康带来了无限光明. 而基因组学的发展让人们畅想未来人类免受疾病的危害(Chapman and Hill,2012; Lander et al., 2001). 但人类基因组学技术的进步,并未为疾病控制带来本质上的变化(Hirschhorn et al., 2002; Mullighan et al., 2008),因为对于大多数疾病而言,基因与环境等多种因素共同影响疾病的发生(Edwards and Myers, 2007; Manolio et al., 2006). 科学家认为基因对人类疾病的影响可能只占到<10%(Arnaud,2010; Lichtenstein et al., 2000; Manolio et al., 2009). 例如美国Brigham and Women′s Hospital的Nina Paynter等(Paynter et al., 2010)对影响心脏病101种基因进行研究,历经12年跟踪调查19000名妇女后发现这些基因标记难以预测心脏病的发作情况,英国伦敦皇家学院的Jeremy Nicholson针对其工作提出自己见解,认为“仅知道基因风险因素绝对是无济于事的”. 导致人体健康风险的主要因素则是环境暴露(environmental exposure),但是目前对于基因组研究的投入力度要远远大于研究环境如何影响人体健康的投入(Hamzelou,2011).
鉴于环境对人体健康影响的重要性,越来越多的人们开始关注这一研究领域. 近年来,人体暴露于外在污染物的研究得到了空前重视,一些新技术和方法逐渐引入到该领域中,同时一些新的概念也逐渐为人们所认识. Christopher Paul Wild(Wild,2005; Wild,2012)于2005年提出了暴露组(exposome)的概念,大大地拓展了人体暴露科学的内涵和外延. 自从这一概念提出以来,得到了广泛关注,相关报道亦日趋增多. 在Google Scholar和Web of Science中分别收录了1190条和115篇相关文献,且呈现逐年增多的趋势(图 1). 近年来美国和欧洲均建立了各种研究中心并开展了相关的研究项目,例如美国成立了暴露生物学中心(Center for Exposure Biology)和人类暴露组中心(Human Exposome Center),其目的在于开展人类暴露组项目(Human Exposome Project,HEP)(http://humanexposomeproject.com).
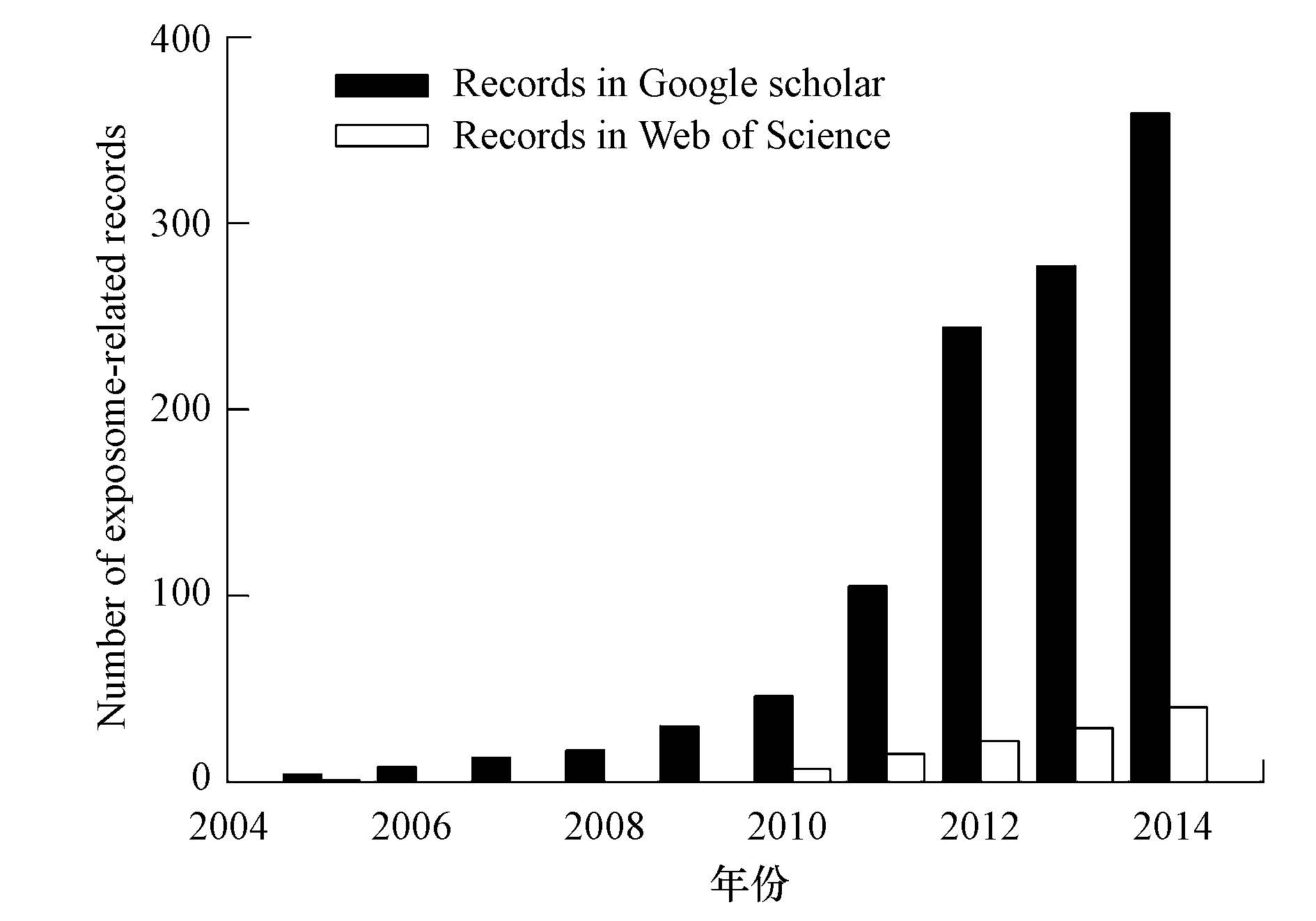 |
| 图1 2005—2014年关于暴露组文献数量趋势(注,搜索关键词为“exposome”) Fig.1 The number of exposomerelated records in Google Scholar and (black bar) and in Web of Science(white bar)during 2005—2014(keyword: exposome) |
同时欧盟亦开展了生命早期暴露组项目的研究(Human EarlyLife Exposome,HELIX)(Vrijheid et al., 2014). 这些项目的实施意味着欧美等国家已全面开展了暴露组研究. 我国对于该方面的研究鲜有报道(任爱国,2012; 郑国巧和夏昭林,2014),在该方面研究中仅有一项得到国家自然科学基金资助(数据来源于Pubmed.cn收录,搜索关键词为“暴露组”). 近期国家自然科学基金委发布的“十二五”第3批重大项目申请指南中已将“环境与遗传因素及其交互作用对慢性非传染性疾病影响的队列研究”作为一个重要课题(http://www.nsfc.gov.cn/Portal0/InfoModule_396/51920.htm). 由此可见,我国已开始重视暴露组的研究. 本文将主要从暴露组概念的内涵和发展、研究方法、具体技术以及未来的展望方面介绍这一新概念,并以此更多地关注环境因素引起的健康问题.
2 暴露组的概念(Concept of exposome)暴露组(exposome)是指一个人从胚胎到生命终点一生中各种暴露,包括内暴露和外暴露. 这些暴露涉及在外界环境中化学污染物暴露下的身体对疾病和心理压力的总记录(Wild,2005). 此概念包含2个方面的内涵,① 人类暴露于各类复杂的化学、物理和社会环境中,并与之相互作用. 人的一生中接触到成千上万种化学物质,如重金属和持久性有机污染物等,同时还暴露于噪声、振动波等物理性污染; 社会因素和个人的生活方式亦能影响人们的暴露组,前者如生活区域的人口密度和文化气息等; 后者包括饮食、运动和睡眠等. ②整个生命过程中,时刻存在暴露,不同时期暴露特征不同. 如婴幼儿时期母乳是许多污染物的主要暴露途径(Gascon et al., 2012); 幼年时期玩具和室内灰尘可能是这些污染物的主要暴露载体(Harrad et al., 2010),成年期间职业暴露可能是影响人体健康的关键因素(Fang et al., 2010; Gardner,2003; Perry,2008),而老年时期居室环境则是影响人体健康的重要因子(Lord et al., 2006). 由于无法完全获知每个人的终生环境暴露,研究不同成长过程中关键和敏感时期的暴露特征对于认识整个暴露组极为重要. Rappaport和Smith(Arnaud,2010)用电影来比喻暴露组,个人的暴露组可以理解为一部2 h的电影,每一个画面都是一次暴露事件,如果将2 h的电影浓缩至30 s的预告片,这些极少但很关键的画面对于认识整部电影极为重要. 动态特征是暴露组一个最难以表征的特点,在暴露组无数的组成中必须考虑时间上的变化. 实际上,在任何一个时间点上,每一个人都具有自己特有的暴露组成. 因此在研究个体暴露过程中,我们可以通过无数次某一时刻定量的暴露组成,建立起一个累计的时效暴露组. 如图 2a所示,人生不同阶段的暴露组成亦随着职业、生活方式、外界环境等的改变而发生改变. 如果能研究出每一个过程中的特征暴露组成,则可以建立起个人终身暴露组.
暴露组将暴露细分为内暴露、外暴露和社会暴露(图 2b). 之前,内暴露是指摄入体内的物质实际上被机体组织吸收的量,即吸收. 通过测定生物样品(血液、尿液等)中污染物或其代谢产物的含量来确定. 如以血铅、血汞的含量分别代表铅和汞的暴露剂量(bBjörkman et al., 2007; Lanphear et al., 1998); 血液中尼古丁或可铁宁的含量可作为香烟暴露的暴露剂量(Etzel,1990; Okoli et al., 2007). 暴露组所指的内暴露则包含了外界摄入物质在体内留下的痕迹,以及自身机体的变化过程,如内在循环的荷尔蒙、体型变化、内脏区微生物、感染、脂肪过氧化、氧化应激以及老化过程等(Wild,2012). 外暴露可分为广义的外暴露和狭义的外暴露. 广义的外暴露指实际存在于环境中有害因子的量,通常的环境监测即是监测这种暴露. 狭义的外暴露指外环境中的暴露因子进入体内量,即摄入. 通常是测定人群接触的环境介质中某种环境因素的浓度或含量,根据人体接触的特征(如接触的时间、途径等),估计个体的暴露水平. 而外在的社会暴露主要是指个人所处的社会环境、经济状况等所带来的机体响应及其变化,如社会能力、教育程度、经济状况、精神压力、气候等因素影响人们机体的响应及其暴露.
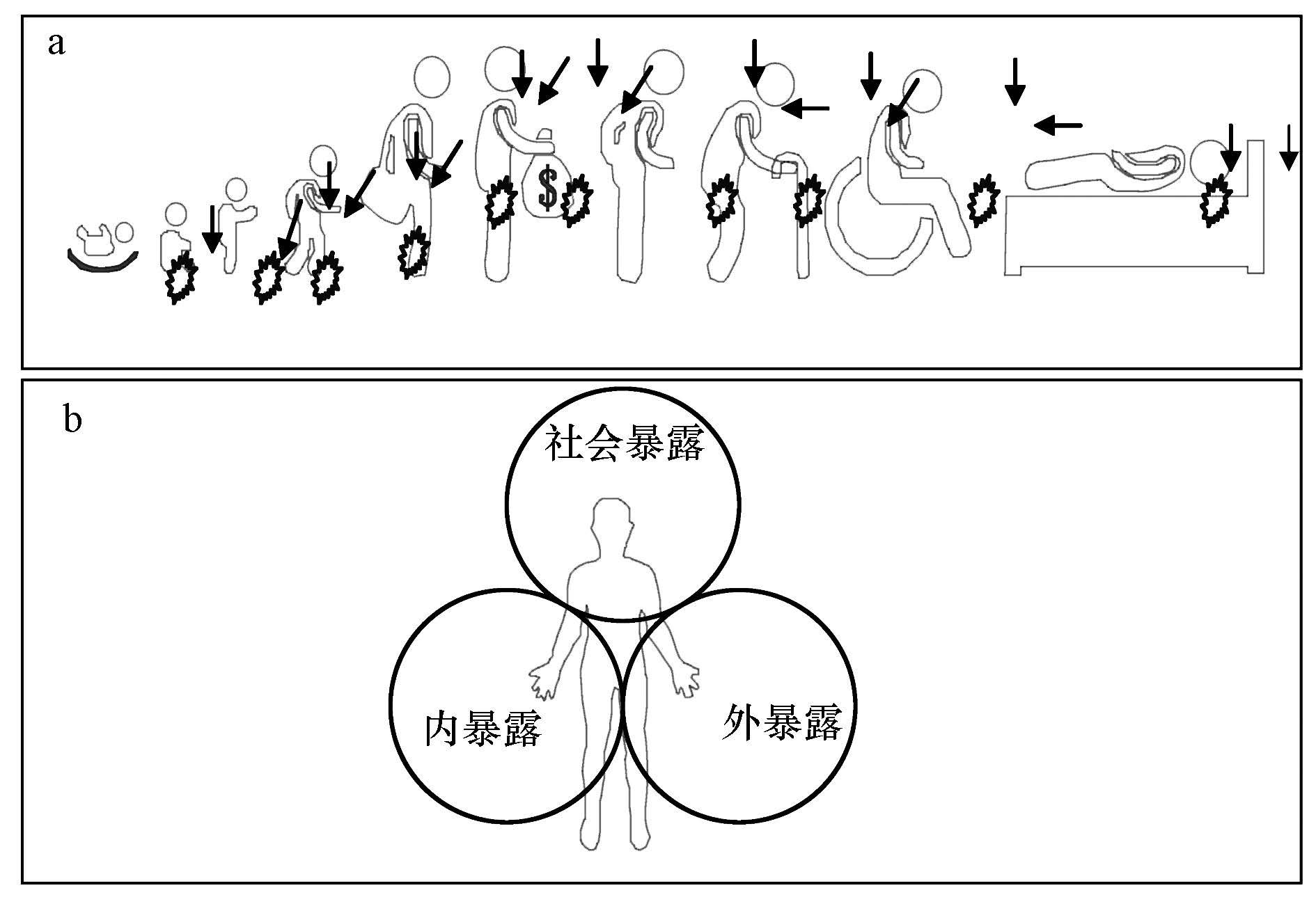 |
| 图2 (a): 一生各阶段瞬时暴露组(注:箭头仅表征暴露的总途径,与各种过程无关);(b): 暴露组的组成 Fig.2 Exposures characteristics over time across the lifecourse of individual person(a), and three different domains of the exposomes(b) |
暴露组包括了一个人终身接受到所有暴露的总和,为科学家们提供了一种思路去观察环境因素造成的疾病(Lioy and Smith,2013). 从这一层含义上也可以把环境认定为身体内化学环境的一部分. 暴露组亦包括了由于各种生物、生物化学和化学过程引发的生物标志物的发生和改变,而这些过程能解释人体暴露易导致的感染和疾病,因此也可以把暴露定义为内环境中生物活性化学物质水平. 随着对人们暴露组研究的深入,每个人的暴露组会与疾病人群和健康人群形成对照,也会与每个人不同生命阶段的个人用药形成对比,找出造成疾病的原因,从而确认、减少或消除有害暴露. 正如Linda Birnbaum(Brown,2012)所言,我们无法改变遗传带给我们的基因,但是我们可以改变生存环境和生活方式以减少疾病的发生.
3 暴露组学的内涵和外延 (Connotation and denotation of exposome)暴露组概念是建立在先前研究的基础上,尤其先前暴露科学(exposure science)和环境基因组(environmental genome)的研究为这一概念的提出奠定了基础. 全面理解暴露组学的内涵与外延需从暴露科学与环境基因组入手.
暴露科学是环境科学家们常用的科学概念,主要研究人体暴露于某一类有毒有害物质的总量,并用暴露总量来权衡人体接受到的环境影响和危害(Lioy and Rappaport, 2011). 暴露分为不同途径,主要有摄食、呼吸和皮肤接触(McKone and MacLeod, 2003; Ni et al., 2013)等,同时还包括医学上的注射、移植、结膜滴注和栓剂等(Fattinger et al., 2000). 这些研究大多数针对某一特殊人群或者一类特殊毒害物质的暴露进行展开. 如Ding等人(Ding et al., 2013)研究了深圳市区人群通过摄食多环芳烃(PAHs)和卤代PAHs的暴露,结果表明该区域人群暴露的PAHs和卤代PAHs的毒性当量低于严重风险水平(serious risk level),而高于可接受风险水平(acceptable risk level),其中摄食米饭和肉质食品是最重要的方式,与其他研究比较,和美国(Menzie et al., 1992)、英国(Dennis et al., 1983)、荷兰(de Vos et al., 1990)、意大利(Lodovici et al., 1995)、西班牙(Martorell et al., 2010)等国家报道的暴露风险相似,却远远低于北京(李新荣等,2009)和天津(李新荣等,2005). 最近研究发现在电子垃圾拆卸区(台州)居民通过灰尘暴露多氯联苯(PCBs)非常微小(Xing et al., 2011). 人体暴露灰尘中的污染物与人群的年龄、社会角色以及生活习性息息相关,比如中国人群通过居室灰尘暴露邻苯二甲酸二(2乙基己基)酯仅占总暴露量的2%~5%,而美国人群却通过灰尘摄入此类污染物占总暴露量的10%~60%(Guo and Kannan,2011). 但是目前这类研究多数基于暴露模型的估算(Ali et al., 2012; Guo and Kannan,2011; JonesOtazo et al., 2005). 不同途径暴露的污染物质,只有部分能被人体所利用,最终表现为生物机体的毒性响应. 与人体产生作用的这一部分物质被认为具有生物可利用性(bioavailability,即进入人体内循环)的污染物(Bosma et al., 1996; Semple et al., 2004). 污染物的生物可利用性可以通过动物的活体实验(in vivo)(Ruus et al., 2010)和动物或人体的体外实验(in vitro,或称模拟实验)(Juhasz et al., 2010)实现,但前者实验周期长、费用高、风险大,并带来伦理方面的问题,后者为当前暴露科学的研究热点. 综上所述,暴露科学着重研究人体通过不同途径暴露于外在污染物的总量,以及这些污染物进入人体后可能对机体产生影响的量. 这些研究仅仅局限于对特定人群或特定污染物进行研究,大部分暴露途径并不能直接测定,而是通过模型估算而来,因此参数的选择会导致结果的不确定性. 同时这些研究和人体健康及其疾病的直接关联性较小,尽管有些学者尝试使用生物标志物的方法来表征环境暴露(Lowry,1995; Waidyanatha et al., 2001),但目前这些研究仍然无法直接将环境暴露与人体健康进行关联.
1997年美国国立环境卫生科学研究所(National Institute of Environmental Health Sciences)提出环境基因组(environmental genome)计划,主要研究因环境因素导致的疾病下,化学损伤易感性基因的多态性,并确定不同个体差异的遗传因素(Albers,1997). 实际上,环境基因组与毒理基因组密切相关,均为生物科学家们试图研究毒害物质对机体损伤或者基因表达的影响、交互作用及其个体差异性. 这些功能性基因组学(functional genomics)亦称为后基因组学(postgenome)已成为生物学的重要研究分支和技术(Rava et al., 2015). 这些研究多数聚焦于人体中易感基因的筛选和鉴定. 例如美国的环境基因组计划研究中确定了10类与环境因素密切相关的候选基因,包括DNA修复基因、外源化合物代谢及解毒基因、代谢基因等(巴月等,2003; 于军,2013). 在这一领域里,特定暴露下基因的易感性和多态性也得到不少人关注,但是他们主要通过疾病发生去寻找特定的易感基因,比如在高浓度血铅患者体内鉴定出δ氨基乙酰丙酸脱水酶2(ALAD2)等位基因(欧梅等,2004; 杨汉策等,2014); 又如,前列腺癌、乳腺癌和卵巢癌易感性和参与类胆固醇类激素代谢酶基因的SNP息息相关(Chang et al., 2002; Clendenen et al., 2013). 因此这些研究主要着眼于在特定外来物质的影响下,鉴别机体尤其是基因的易感性和多态性,而涉及真实环境暴露下人体的外界暴露、机体响应和健康状态的研究极其有限.
可见,环境科学家们关注的人体暴露与生物学家们关注的环境基因组之间存在明显的鸿沟,需要一个桥梁将二者有效地连接在一起,才能真正理解环境污染与人体健康之间的关系,而暴露组概念的引入有效地将二者连接起来. 暴露组将人体暴露的各种因素囊括在内,并考虑到社会、文化和心理因素的差异,确定其不同阶段的特征暴露组,并充分利用生物基因学技术,研究不同特征暴露组下基因的易感性和多态性,有效地将暴露科学和环境基因组学结合起来,建立起“污染过程人体暴露基因表达人体响应”研究路线.
4 暴露组研究方法学(Methodologies of exposome)暴露组概念引入以来,人们最大的困惑是如何着手研究. 暴露科学研究,人们主要从外界环境关注人体健康,如空气、水、食物等的污染强度,以及与人体接触的途径(呼吸、摄食以及皮肤接触),评价人体可能受到的影响(JonesOtazo et al., 2005),或者估算这些暴露过程的暴露剂量(Dougherty et al., 2000),或者比较暴露人群与非暴露人群的健康指标(van Loon et al., 1997). Rappaport S.M.教授和Smith M.T.教授(Rappaport and Smith, 2010)将这种通过研究外界环境,确定主要暴露过程和剂量的研究方法定义为“自下而上”法(“bottomup” strategy)(图 3). 分子生物学和分子流行病学的兴起发现了很多生物标志物,而这些标志物可以表征机体各组织内污染物的残留或者代谢产物; 或者表征某类疾病. 而这种通过探讨人体暴露后在机体组织中留下的生物标志物去确定主要的暴露过程的研究思路则认为是“自上而下”法(“topdown” strategy). “自下而上”法则关注于外暴露,通过监测外在环境中各类污染物(包括大气、水、日常饮食、辐射和生活方式等)的污染强度,估算个人暴露组,这一研究思路可以长期监测同一环境介质中污染物浓度,更好地了解和认识个体暴露的主要过程和途径,以便消除或减小个体暴露,但这一方法要求去观测各种环境介质中的大量未知污染物,同时缺少对内暴露信息的了解,难以与疾病建立直接关联. 而“自上至下”法则应用生物监测的方法测定体液中的暴露特征,根据这些特征寻找暴露途径和污染物来源. 尤其有些科学家呼吁应用非靶性组学包括各种基因组、蛋白质组和代谢组学等方法去测定体液中暴露组特征,用生物监测如血液中基因表达、蛋白质加合物和代谢产物等方法去评价内暴露程度. 这种方法更有利于研究疾病人群和健康人群中的组学特点来对照全基因组关联分析(genomewide association study)(Patel et al., 2010),便于探讨内暴露过程及人体发病原因,但丢失了外暴露的信息,不利于及时提出有效削减暴露的方案.
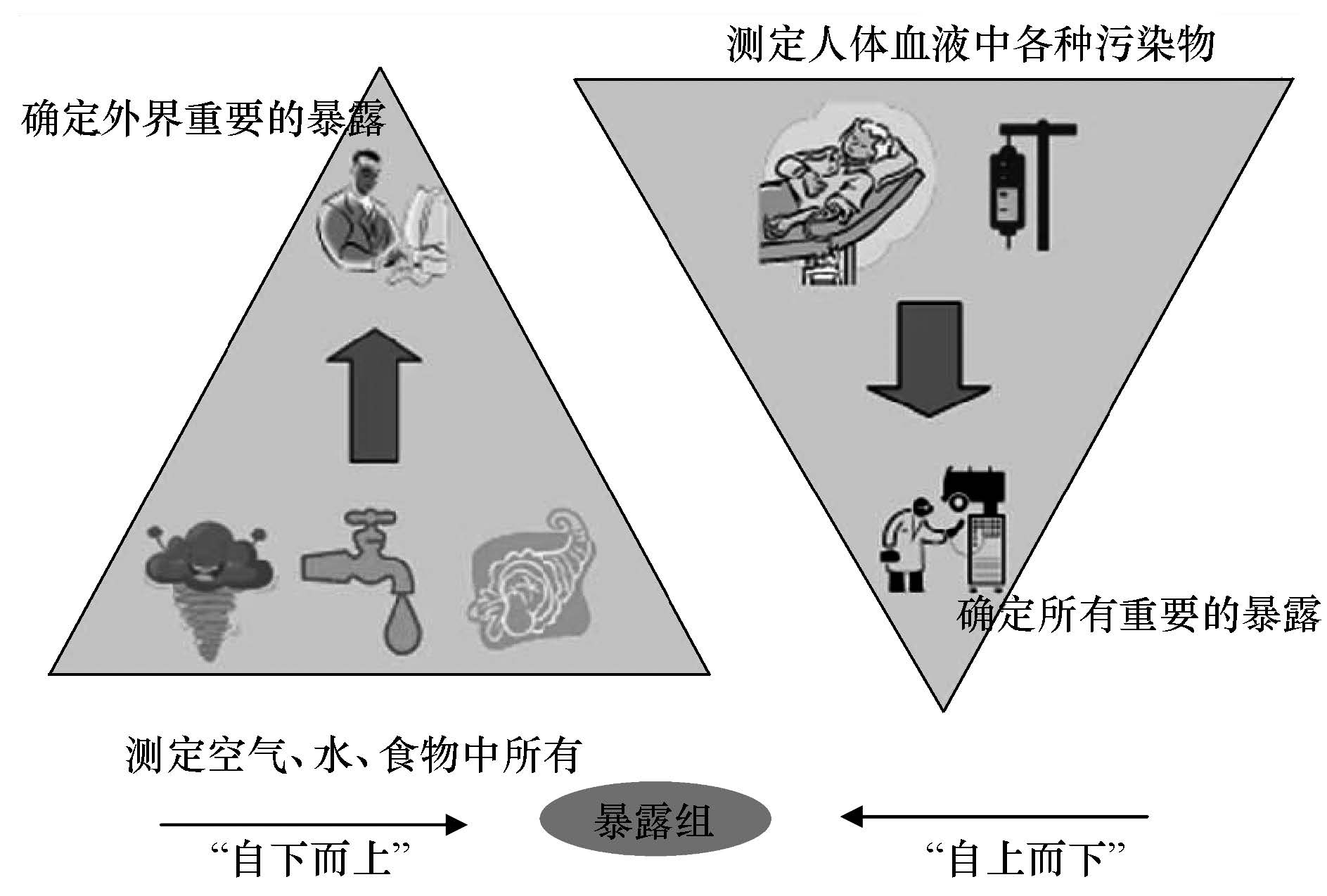 |
| 图3 研究暴露组的“自下而上”法和“自上而下”法 Fig.3 Bottomup(left) and top down(right)strategies used for characterizing exposomes |
然而人体疾病的因素与环境、基因以及二者相互作用等因素均息息相关,密不可分,同时暴露也非常复杂,难以通过简单的几个假定污染指标加以全面地认识,因此要想正确认识这些因素导致的健康问题,就必须像全基因组关联研究一样,进行无目标设计的研究,全面了解个体外环境胁迫因素(各类自然的或人为的化学物质、物理性污染因素以及社会环境因素),以及这些胁迫导致的机体反应留下的痕迹(各类污染物消化吸收过程、机体内反应等),只有这种无目标的研究才能在没有明确的假设条件下寻找出影响人体健康的关键暴露因素.
5 测量暴露组的技术手段 (Measurement of exposome)如何准确地测量暴露组已成为了当前的难题,测量暴露组必须理顺其理论组成,避免毫无目的地尝试各种方法. 同时暴露组概念的内涵与外延决定了单一的分析手段不可能完成暴露组的测量. 因此必须将分析方法、分子技术、遥感系统及生物信息技术有效地结合起来才可能完整地测量一个人的暴露组.
5.1 遥感技术人体暴露存在显著的空间性,3种传统的地理信息技术(RS、GIS和GPS)为暴露评价提供了更为全面、及时、准确和客观的信息. 过去的几十年中,这些技术已广泛地应用于各种环境暴露评价中(Brody et al., 2002; Jensen,1998; Nuckols et al., 2004; Ward et al., 2007). 同时近年来,各类便携式环境监测仪器的研发更易于与其他技术结合,将地理信息技术与便携式监测仪器结合可以得到及时的空间暴露数据,让暴露评价更为精准. 个人手提电话及其网络的发展为暴露组的研究带来了巨大前景. 个人手提电话已成为人们现代生活的必需品,在全球,拥有配置移动、音频、可视和定位系统的便携式电话用户已超过10亿,手机用户已超过52亿,如果在手机内部配置相应的环境检测系统(如大气颗粒物和挥发性有机污染物的监测装置)及其软件和网络,每位用户的暴露信息传输至终端形成巨大的环境暴露数据库,将为研究人体暴露提供一种可靠的数据(National Research Council of the National Academies,2012). Michael Jerrett(Jerrett et al., 2013)认为个人遥感技术能全面逼真地评价我们面对的外暴露. 带有遥感式空间参照技术和模型的装置能持续、时效、真实地评价因地理位置、活动以及生活方式等因子造成个人暴露的差异. 例如一个人的活动强度、类型及地理位置能反映空气呼吸暴露、接触与吞食毒害污染物.
为了完全示踪污染物对人体健康影响的整个过程,研发低价、高灵敏、高选择性的传感器是关键,Tao教授(Negi et al., 2011; Tsow et al., 2009)利用音叉传感器将化学信号转化为机械信号,研发出一种能在严酷环境中工作的个人暴露监测系统,通过该系统能定量和时效测量多种挥发性有机污染物、酸类污染物和湿度等. 此装置中将监测系统模块接入一个智能手机中,感应器戴在手臂上,以此提供个人暴露的呼吸区数据,实时的暴露数据存储在手机中,并将这些数据转入研究者可以进入的计算机服务器中. Tao课题组(Chen et al., 2012)利用这种装置监测了2010年4月英国石油公司石油泄漏之后墨西哥湾烃类化合物,并绘制了该区域烃类化合物的空间分布,获得的烃类化合物平均浓度与美国EPA监测站提供的数据相似,但他们发现了动态的时空变化,用烃类化合物浓度的位置信息为周围工作生活的人们提供指导. 由于运动可以更改一个人的暴露和对污染物的响应,因此准确地测量体育运动对于研究暴露组极为重要,Stephen Intille等(Albinali et al., 2010)研发了Wocket系统,该系统可测量个人体育活动数据并将数据发送至个人手机. Wocket系统能持续测量个人体育运动强度、持续性和地理位置,这样的测量能持续数月或数年. Jerret等(DonaireGonzalez et al., 2013)开展了利用遥感系统调查个人暴露和运动的研究,研究者给志愿者们佩戴了2个体育运动检测装置和1个装有新型软件的智能手机,该装置可用于记录体育运动,及其时间和位置. 研究者获得这些运动和位置的数据,结合空气污染物空间变化估算每个人呼吸空气中氮氧化物的总量. 他们发现旅行对个人暴露剂量呈现不相称的贡献,因为他们比步行者和骑自行车人群的活动更多.
研发的各种新型装置可以让研究人员获取关键性的暴露数据和个人暴露结果,与以前数据比较,这些暴露研究结果更加完善和科学. 过去科学家们关心人体暴露的5个关键信息: 谁暴露(who)、暴露了什么(what)、暴露的时间(when)、暴露的地点(where)和为什么产生了暴露(why),简称5个W信息. 但仅知道这5个W信息是不够的,仍无法建立暴露与疾病的真正关系. 而要解决这一问题就必须知道第6个重要的W信息: 哪一种暴露造成疾病(which). 各种组学及其分子技术学的介入有助于更清楚地了解第6个W信息. 但是基于遥感技术监测人体外暴露和记录个人行为活动的研究处于起步阶段,而这些技术也只仅适用于特定人群和监测特定污染物,仍然无法完全获知人体暴露组的外暴露全部信息,亦无法适用于公共人群的健康管理中,如何全面记录个体和普通人群外暴露全部信息仍然是当前的一大难题.
5.2 分子技术理论上说,分子技术方法是组学技术的一部分,但与组学技术最大的差别在于这些分子技术手段是有目标性的研究手段(targeted),而通常所说的组学技术是无目标性研究(untargeted). 通过这些有目标性的技术去研究特殊的暴露及其相应的分子组成特征,结合多种分子技术,对于表征总的暴露组特征极有价值. 例如Avi Spira(Beane et al., 2011)利用人体通气道中基因表达组分去发现身体对抽烟暴露响应的分子标志物. 现存的诊断测试肺癌技术包括层析成像与支气管镜检查法,两种方法结合起来诊断早期肺癌的灵敏度仅50%. 通过从正常的支气管上皮细胞中提取RNA,并在微阵列上运行,发现了吸烟者体中存在80个明显不同的基因表达从而导致氧化还原酶的增加,而这些基因表达是否最终发展为肺癌?采用生物标志物芯片法诊断早期肺癌的发病率的灵敏度超过80%,如果与支气管镜检查法结合可高达95%. 目前,独立队列研究中证实了生物芯片技术可大大提高生物标志物的灵敏度(Kavsak et al., 2009),期望会成为一种支气管镜检查法的辅助诊断手段. 又如,由于许多生殖方面的事件如排卵和受精不能直接观察,而且存在较大的个体差异性,美国National Institutes of Health的Rajeshwari Sundaram(Louis et al., 2011)开发了一种简单可行的手段去认识环境暴露与生殖结局之间的关系. Sundaram等应用商业化的受精监测仪,检测了参与人员中妇女体内生殖荷尔蒙(estrone3glucuronide and luteinizing hormone)的波动. 这种低廉、易于操作且可靠的监测仪将荷尔蒙组成直接上传到网络数据分析系统中,根据合适的受孕时间及检测中丢失的数据及时向参与者提供反馈. 这种监测仪是纵向观察受精与环境研究(longitudinal investigation of fertility and the environment study,LIFE)的基本部分(Buck Louis et al., 2013),这一研究主要评价持久性环境化学物影响人类生殖与发展. LIFE研究让501对夫妻尝试怀孕,研究者分析了参与志愿者血清中残留的有机氯农药、多氯和多溴联苯、多溴联苯醚和全氟化合物,并面访评价部分生活方式等影响因子,分析了持久性污染物的暴露对生殖能力的影响.
分子技术方法是一门较为成熟的技术手段,已广泛应用于临床医学. 暴露组研究中借用分子技术手段,主要目的在于研究特殊暴露对人体健康的影响和复杂疾病病原的探究,当前这些研究仍然无法全面阐明疾病与人体暴露之间的关联,暴露组研究中借用该技术旨在明确二者之间的关系.
5.3 组学技术从某种意义上说,暴露组的概念来源于基因组,因此有必要借鉴人类基因组研究的高通量技术手段去表征细胞、组织或体液中RNA表达(转录组)、蛋白质(蛋白组)和代谢物(代谢组)等后期生物事件. 由于不同生长环境和时期下相同细胞的基因表达情况不完全相同,转录组可以记录特定功能下细胞全部转录本,不同人群暴露于外界环境不同,因此机体内细胞基因表达亦会不同,例如在一些动物实验中揭示环境汞的暴露对大鼠脑即刻早期基因cjun、cfos mRNA转录和cjun、cfos蛋白表达存在明显的影响(程金平等,2003). 因此通过转录组学可以更清楚地记录环境因子对机体基因表达的影响. 蛋白质是生命的物质基础,生物机体中所有细胞及其重要组成部分都有蛋白质的参与,机体的细微变化都会引起蛋白质谱的差异,各类疾病的发生同样可以导致蛋白质的改变; 反之,蛋白质的改变可以导致疾病的发生,例如蛋白质的过氧化可以导致衰老、糖尿病、慢性肾衰和感染等(郝春燕等,2004). 通过开展蛋白质组学的研究记录一个组织或细胞的全部蛋白质表达水平、氨基酸序列和翻译后加工以及蛋白质相互作用等信息,在此基础上可以了解细胞的各种生物化学过程以及病理反应. 同样,环境暴露的污染物进入机体,可能在机体中反应,产生各种生物化学代谢物,通过代谢组学的研究可以清楚地记录机体受到外界刺激(如暴露于环境污染等)后代谢产物的图谱及其动态变化. Elaine Holmes和她的同事(Holmes et al., 2008)表征了人类和其他动物对化学暴露以及生活方式等因子或事件(如饮食以及早产)响应的代谢特征. 研究的突破点在于动态检测多种化合物. 利用核磁共振光谱或质谱,以及主成分分析从体液或组织中获取多种指纹. 研究发现,如果哺乳期的母亲服用一种可以治疗胀气和发烧以及减缓病痛的非处方药: 扑热息痛,在婴儿的尿液中亦能监测出来. 然而这一研究捕捉非常短期的暴露和剂量,并不能代表扑热息痛的暴露会对将来健康产生影响(Loo et al., 2012). 同时该研究小组也能观测出当野生动物暴露于WHO推荐的暴露下限Cd浓度时,肾脏内羟基丁二酸和乙酸酯增加,谷氨酸盐和支链氨基酸却减少(Bailey et al., 2003). 在一项调查中,Holmes小组可以通过评价早期代谢产物的变化区分出成人属于正常出生还是早产. 她解释道,当一个婴儿出生时,如早产等许多因素会影响肠道微生物的生长,这些细菌随着人群变化巨大,但依然能反映健康和疾病影响的代谢组成(Thomas et al., 2011). 众所周知,早产可以导致后期心血管疾病、代谢综合征、肾脏疾病和其他负面健康,Thomas等(Thomas et al., 2011)评价了30个年轻成年人的代谢组成,发现早产人一些代谢产物明显增加,这些代谢产物可用于识别炎症或炎症前期的症状. 因此代谢组可以精确地记录生命期中与疾病息息相关的暴露.
内外暴露将不断引起机体生物化学信息库的改变,而这些信息不仅与暴露相关,同时也与疾病的发生密不可分. 高通量组学技术的应用让我们知道这些暴露在机体内发生变化,同时也让我们了解了疾病发生的机理. 在疾病保护和诊断上确认有用的分子标志物,并根据个人的暴露组特征去发展新型的治疗方法. 组学技术的发展,为了解疾病发病机理提供有价值的信息. 由于近年来人类基因组计划(Human Genome Project,HGP)的成功实施,各种组学技术得到了快速的发展,尤其在无目标性研究其中关键作用,全面地记录了基因表达,转录,和代谢等全部信息,让人们更加清楚自己机体发展的一切变化. 暴露组研究中必须运用这些高通量技术全面记录人体暴露过程中机体的一切改变,因此组学技术的运用将决定暴露组研究的成败.
6 挑战及其展望(Challenges and perspectives)尽管暴露组的概念刚刚提出,但其内涵和外延得到了不断的完善和更新,生物标志、个体检测器、影像学等技术的进步也会为暴露组的研究带来空前的发展. 然而在当前的技术手段和分析方法上仍然无法准确定量一个人的暴露组,开展暴露组研究仍然需要从概念的内涵上加以发展,同时分析技术手段和方法亦需要进一步完善. 当前下,暴露组研究面临着诸多困难,概括而言,主要包括以下四个方面.
1)暴露组是个动态的概念,这一动态不仅体现在研究每个人每时每刻的总暴露,而且这一概念还受到其他学科和技术的发展而不断扩展其内涵与外延. 暴露组研究人体从出生至生命结束整个生命过程中每时每刻暴露于外界环境(空气、水、饮食),以及社会环境和个人发展阶段及行为,因此是在一个动态的状态下探讨人体暴露与机体响应的一门科学. 同时随着各种新型产品和污染物的出现,社会文化的发展、各种交往的渗透,气候环境的变迁,暴露组的内涵将逐渐加深,而外延也将不断地扩展. 由于很多因素在当前的认识下无法预测,因此也为暴露组的研究增加了许多不确定因素.
2)暴露组是建立在暴露科学基础上,并借鉴了基因组学的研究思路和统计方法,目前关于这些研究的信息多为零星和分散的,如何将这些数据整合归纳起来为暴露组的研究提供更有针对性的指导方案是一项巨大的工程. 关于人体暴露途径、职业病调研、个别疾病的生物指标和分子流行病等研究都已有了不同程度的开展,暴露组研究的开展应借鉴这些方法和思路进行更具有针对性的研究. 如何将这些已存在的结果整合起来,并建立其各种相互偶合关联,为暴露组的研究思路和方法提供有效的信息,亦亟需开展. 同时暴露组检测方法的进步其发现的信息有利于个体健康保护,但公共健康影响才是暴露组的研究目标,因此在当前乃至今后很长一段时间内,暴露组研究的最大障碍是如何将其应用到公共人群的健康风险预测和疾病控制等方面. 个体暴露组信息的完善是建立完整的公众暴露组的第一步.
3)暴露组的研究将借助各种组学技术,但是如何把这些组合技术手段结合起来,发挥其最大作用,需要不断地摸索. 而且这些技术并不能完全地解决暴露组的研究问题. 例如暴露组的研究重点在于捕捉各种内在的分子标志物,而并不是所有的污染物. 因此必须优化这些技术手段的组合配置. 同时还需要加强国际合作,鼓励多方位的金融投资,将特定人类染色体测序的工作分配给全世界不同的研究小组来共同完成,在地区层面上获得当地暴露信息研究的成功,从而促进暴露组数据库的建立和共享,通过这种方式才可能使暴露组研究得到最快速地发展.
4)随着各种技术手段的发展,对污染物暴露途径、分子作用机理和疾病发生原委的认识逐步清晰,然而由于社会经济等因素引发的社会暴露在这些技术手段上难以表征,解决社会干预、生物效应和疾病风险之间复杂的关系必须通过社会学家、环境科学家、流行病学家、分子生物学家和其他领域科学家之间的密切合作才能共同完成.
因此暴露组以一个全新的概念展现在人们面前,而且为人类健康带来了无限希望,同时更多地为人们提供了了解自我的机会,亦为科学家们提供了更大的研究平台和思考空间. 在可以预见的未来,随着各种技术手段的进步,各个学科的融合和交叉,以及各个领域科学家的紧密合作,逐步建立健全人类暴露组信息数据库,揭开人体暴露、作用机制和疾病成因的本质,为人类健康保护和疾病预防发挥重要作用.
| [1] | Albers J W. 1997. Understanding gene-environment interactions[J]. Environmental Health Perspectives, 105(6):578-580 |
| [2] | Ali N, Van den Eede N, Dirtu A C, et al. 2012. Assessment of human exposure to indoor organic contaminants via dust ingestion in Pakistan[J]. Indoor Air, 22(3):200-211 |
| [3] | Arnaud C H. 2010. Exposing the exposome[J]. Chemical & Engineering News, 88(33):42-44 |
| [4] | 巴月,吴逸明,王国领. 2003.环境基因组计划(EGP)对预防医学发展的影响[J].医学与哲学, 24(2):1-4 |
| [5] | Bailey N J C, Oven M, Holmes E, et al. 2003. Metabolomic analysis of the consequences of cadmium exposure in Silene cucubalus cell cultures via 1H NMR spectroscopy and chemometrics[J]. Phytochemistry, 62(6):851-858 |
| [6] | Beane J, Vick J, Schembri F, et al. 2011. Characterizing the impact of smoking and lung cancer on the airway transcriptome using RNA-Seq[J]. Cancer Prevention Research, 4(6):803-817 |
| [7] | Björkman L, Lundekvam B F, Laegreid T, et al. 2007. Mercury in human brain, blood, muscle and toenails in relation to exposure:an autopsy study[J]. Environmental Health, 6:30 |
| [8] | Bosma T N P, Middeldorp P J M, Schraa G, et al. 1996. Mass transfer limitation of biotransformation:Quantifying bioavailability[J]. Environmental Science & Technology, 31(1):248-252 |
| [9] | Brody J G, Vorhees D J, Melly S J, et al. 2002. Using GIS and historical records to reconstruct residential exposure to large-scale pesticide application[J]. Journal of Exposure Analysis and Environmental Epidemiology, 12(1):64-80 |
| [10] | Buck Louis G M, Sundaram R, Schisterman E F, et al. 2013. Persistent environmental pollutants and couple fecundity:the LIFE study[J]. Environmental Health Perspectives, 121(2):231-236 |
| [11] | Chang B L, Zheng S L, Hawkins G A, et al. 2002. Joint effect of HSD3B1 and HSD3B2 genes is associated with hereditary and sporadic prostate cancer susceptibility[J]. Cancer Research, 62(6):1784-1789 |
| [12] | Chapman S J, Hill A V S. 2012. Human genetic susceptibility to infectious disease[J]. Nature Reviews Genetics, 13(3):175-188 |
| [13] | Chen C, Campbell K D, Negi I, et al. 2012. A new sensor for the assessment of personal exposure to volatile organic compounds[J]. Atmospheric Environment, 54:679-687 |
| [14] | 程金平,王文华,贾金平. 2003.氯化甲基汞对大鼠脑c-fos和c-jun基因表达的影响[J].环境科学, 24(1):52-56 |
| [15] | Clendenen T, Zeleniuch-Jacquotte A, Wirgin I, et al. 2013. Genetic variants in hormone-related genes and risk of breast cancer[J]. PLoS One, 8(7):e69367 |
| [16] | de Vos R H, van Dokkum W, Schouten A, et al. 1990. Polycyclic aromatic hydrocarbons in Dutch total diet samples (1984-1986)[J]. Food and Chemical Toxicology, 28(4):263-268 |
| [17] | Dennis M J, Massey R C, McWeeny D J, et al. 1983. Analysis of polycyclic aromatic hydrocarbons in UK total diets[J]. Food and Chemical Toxicology, 21(5):569-574 |
| [18] | Ding C, Ni H G, Zeng H. 2013. Human exposure to parent and halogenated polycyclic aromatic hydrocarbons via food consumption in Shenzhen, China[J]. Science of the Total Environment, 443:857-863 |
| [19] | Donaire-Gonzalez D, de Nazelle A, Seto E, et al. 2013. Comparison of physical activity measures using mobile phone-based CalFit and Actigraph[J]. Journal of Medical Internet Research, 15(6):e111 |
| [20] | Dougherty C P, Holtz S H, Reinert J C, et al. 2000. Dietary exposures to food contaminants across the United States[J]. Environmental Research, 84(2):170-185 |
| [21] | Edwards T M, Myers J P. 2007. Environmental exposures and gene regulation in disease etiology[J]. Environmental Health Perspectives, 115(9):1264-1270 |
| [22] | Etzel R A. 1990. A review of the use of saliva cotinine as a marker of tobacco smoke exposure[J]. Preventive Medicine, 19(2):190-197 |
| [23] | Fang S C, Cassidy A, Christiani D C. 2010. A systematic review of occupational exposure to particulate matter and cardiovascular disease[J]. International Journal of Environmental Research and Public Health, 7(4):1773-1806 |
| [24] | Fattinger K, Roos M, Vergères P, et al. 2000. Epidemiology of drug exposure and adverse drug reactions in two Swiss departments of internal medicine[J]. British Journal of Clinical Pharmacology, 49(2):158-167 |
| [25] | Friedmann T. 1992. A brief history of gene therapy[J]. Nature Genetics, 2(2):93-98 |
| [26] | Gardner R. 2003. Overview and characteristics of some occupational exposures and health risks on offshore oil and gas installations[J]. The Annals of Occupational Hygiene, 47(3):201-210 |
| [27] | Gascon M, Fort M, Martínez D, et al. 2012. Polybrominated diphenyl ethers (PBDEs) in breast milk and neuropsychological development in infants[J]. Environmental Health Perspectives, 120(12):1760-1765 |
| [28] | Guo Y, Kannan K. 2011. Comparative assessment of human exposure to phthalate esters from house dust in China and the United States[J]. Environmental Science & Technology, 45(8):3788-3794 |
| [29] | Hamzelou J. 2011. Welcome to the exposome[J]. New Scientist, 208(2792):6-7 |
| [30] | 郝春燕,苏海翔,姚侃. 2004.蛋白质氧化性损伤与疾病研究进展[J].国外医学临床生物化学与检验学分册, 25(5):468-470 |
| [31] | Harrad S, Goosey E, Desborough J, et al. 2010. Dust from U.K. primary school classrooms and daycare centers:the significance of dust as a pathway of exposure of young U.K. children to brominated flame retardants and polychlorinated biphenyls[J]. Environmental Science & Technology, 44(11):4198-4202 |
| [32] | Hirschhorn J N, Lohmueller K, Byrne E, et al. 2002. A comprehensive review of genetic association studies[J]. Genetics in Medicine, 4(2):45-61 |
| [33] | Holmes E, Loo R L, Stamler J, et al. 2008. Human metabolic phenotype diversity and its association with diet and blood pressure[J]. Nature, 453(7193):396-400 |
| [34] | Jensen S S. 1998. Mapping human exposure to traffic air pollution using GIS[J]. Journal of Hazardous Materials, 61(1/3):385-392 |
| [35] | Jerrett M, Burnett R T, Beckerman B S, et al. 2013. Spatial Analysis of air pollution and mortality in california[J]. American Journal of Respiratory and Critical Care Medicine, 188(5):593-599 |
| [36] | 贾海鹰,赵大勇,吴兵,等. 2006.环境基因组学的研究进展[J].现代生物医学进展, 6(12):118-122 |
| [37] | Jones-Otazo H A, Clarke J P, Diamond M L, et al. 2005. Is house dust the missing exposure pathway for PBDEs? An analysis of the urban fate and human exposure to PBDEs[J]. Environmental Science & Technology, 39(14):5121-5130 |
| [38] | Juhasz A L, Weber J, Naidu R, et al. 2010. Determination of cadmium relative bioavailability in contaminated soils and its prediction using in vitro methodologies[J]. Environmental Science & Technology, 44(13):5240-5247 |
| [39] | Kavsak P A, Henderson M, Moretto P, et al. 2009. Biochip arrays for the discovery of a biomarker surrogate in a phase I/Ⅱ study assessing a novel anti-metastasis agent[J]. Clinical Biochemistry, 42(10/11):1162-1165 |
| [40] | Lander E S, Linton L M, Birren B, et al. 2001. Initial sequencing and analysis of the human genome[J]. Nature, 409(6822):860-921 |
| [41] | Lanphear B P, Burgoon D A, Rust S W, et al. 1998. Environmental exposures to lead and urban children's blood lead levels[J]. Environmental Research, 76(2):120-130 |
| [42] | 李新荣,李本纲,陶澍,等. 2005.天津地区人群对多环芳烃的暴露[J].环境科学学报, 25(7):989-993 |
| [43] | 李新荣,赵同科,于艳新,等. 2009.北京地区人群对多环芳烃的暴露及健康风险评价[J].农业环境科学学报, 28(8):1758-1765 |
| [44] | Lichtenstein P, Holm N V, Verkasalo P K, et al. 2000. Environmental and heritable factors in the causation of cancer-analyses of cohorts of twins from Sweden, Denmark, and Finland[J]. The New England Journal of Medicine, 343(2):78-85 |
| [45] | Lioy P J, Rappaport S M. 2011. Exposure science and the exposome:an opportunity for coherence in the environmental health sciences[J]. Environmental Health Perspectives, 119(11):a466-a467 |
| [46] | Lioy P J, Smith K R. 2013. A discussion of exposure science in the 21st century:a vision and a strategy[J]. Environmental Health Perspectives, 121(4):405-409 |
| [47] | Lodovici M, Dolara P, Casalini C, et al. 1995. Polycyclic aromatic hydrocarbon contamination in the Italian diet[J]. Food Additives & Contaminants, 12(5):703-713 |
| [48] | Loo R L, Chan Q, Brown I J, et al. 2012. A comparison of self-reported analgesic use and detection of urinary ibuprofen and acetaminophen metabolites by means of metabonomics:The INTERMAP study[J]. American Journal of Epidemiology, 175(4):348-358 |
| [49] | Lord S R, Menz H B, Sherrington C. 2006. Home environment risk factors for falls in older people and the efficacy of home modifications[J]. Age and Ageing, 35(Suppl 2):ii55-ii59 |
| [50] | Louis G M B, Lum K J, Sundaram R, et al. 2011. Stress reduces conception probabilities across the fertile window:evidence in support of relaxation[J]. Fertility and Sterility, 95(7):2184-2189 |
| [51] | Lowry L K. 1995. Role of biomarkers of exposure in the assessment of health risks[J]. Toxicology Letters, 77(1/3):31-38 |
| [52] | Manolio T A, Bailey-Wilson J E, Collins F S. 2006. Genes, environment and the value of prospective cohort studies[J]. Nature Reviews Genetics, 7(10):812-820 |
| [53] | Manolio T A, Collins F S, Cox N J, et al. 2009. Finding the missing heritability of complex diseases[J]. Nature, 461(7265):747-753 |
| [54] | Martorell I, Perelló G, Martí-Cid R, et al. 2010. Polycyclic aromatic hydrocarbons (PAH) in foods and estimated PAH intake by the population of Catalonia, Spain:Temporal trend[J]. Environment International, 36(5):424-432 |
| [55] | McKone T E, MacLeod M. 2003. Tracking multiple pathways of human exposure to persistent multimedia pollutants:Regional, continental, and global-scale models[J]. Annual Review of Environment and Resources, 28(1):463-492 |
| [56] | Menzie C A, Potocki B B, Santodonato J. 1992. Exposure to carcinogenic PAHs in the environment[J]. Environmental Science & Technology, 26(7):1278-1284 |
| [57] | Mullighan C G, Miller C B, Radtke I, et al. 2008. BCR-ABL1 lymphoblastic leukaemia is characterized by the deletion of Ikaros[J]. Nature, 453(7191):110-114 |
| [58] | Negi I, Tsow F, Tanwar K, et al. 2011. Novel monitor paradigm for real-time exposure assessment[J]. Journal of Exposure Science & Environmental Epidemiology, 21(4):419-426 |
| [59] | Ni K, Lu Y L, Wang T Y, et al. 2013. A review of human exposure to polybrominated diphenyl ethers (PBDEs) in China[J]. International Journal of Hygiene and Environmental Health, 216(6):607-623 |
| [60] | Nuckols J R, Ward M H, Jarup L. 2004. Using geographic information systems for exposure assessment in environmental epidemiology studies[J]. Environmental Health Perspectives, 112(9):1007-1015 |
| [61] | Okoli C T C, Kelly T, Hahn E J. 2007. Secondhand smoke and nicotine exposure:A brief review[J]. Addictive Behaviors, 32(10):1977-1988 |
| [62] | 欧梅,孙东红,李凭建,等. 2004. δ-氨基乙酰丙酸脱水酶基因多态性对职业铅接触工人血铅和锌原卟啉的影响[J].环境与职业医学, 21(3):175-179 |
| [63] | Patel C J, Bhattacharya J, Butte A J. 2010. An Environment-Wide Association Study (EWAS) on type 2 diabetes mellitus[J]. PLoS One, 5(5):e10746 |
| [64] | Paynter N P, Chasman D I, Paré G, et al. 2010. Association between a literature-based genetic risk score and cardiovascular events in women[J]. JAMA, 303(7):631-637 |
| [65] | Perry M J. 2008. Effects of environmental and occupational pesticide exposure on human sperm:a systematic review[J]. Human Reproduction Update, 14(3):233-242 |
| [66] | Rappaport S M, Smith M T. 2010. Environment and disease risks[J]. Science, 330(6003):460-461 |
| [67] | Rava M, Smit L A M, Nadif R. 2015. Gene-environment interactions in the study of asthma in the postgenomewide association studies era[J]. Current Opinion in Allergy and Clinical Immunology, 15(1):70-78 |
| [68] | 任爱国. 2012.暴露组与暴露组学[J].中华劳动卫生职业病杂志, 33(9):973-976 |
| [69] | Ruus A, Bøyum O, Grung M, et al. 2010. Bioavailability of PAHs in aluminum smelter affected sediments:Evaluation through assessment of pore water concentrations and in vivo bioaccumulation[J]. Environmental Science & Technology, 44(24):9291-9297 |
| [70] | Semple K T, Doick K J, Jones K C, et al. 2004. Peer reviewed:defining bioavailability and bioaccessibility of contaminated soil and sediment is complicated[J]. Environmental Science & Technology, 38(12):228A-231A |
| [71] | Thomas E L, Parkinson J R, Hyde M J, et al. 2011. Aberrant adiposity and ectopic lipid deposition characterize the adult phenotype of the preterm infant[J]. Pediatric Research, 70(5):507-512 |
| [72] | Tsow F, Forzani E, Rai A, et al. 2009. A wearable and wireless sensor system for real-time monitoring of toxic environmental volatile organic compounds[J]. IEEE Sensors Journal, 9(12):1734-1740 |
| [73] | van Loon A J, Kant I J, Swaen G M, et al. 1997. Occupational exposure to carcinogens and risk of lung cancer:results from The Netherlands cohort study[J]. Occupational & Environmental Medicine, 54(11):817-824 |
| [74] | Vrijheid M, Slama R, Robinson O, et al. 2014. The human early-life exposome (HELIX):project rationale and design[J]. Environmental Health Perspectives, 122(6):535-544 |
| [75] | Waidyanatha S, Rothman N, Fustinoni S, et al. 2001. Urinary benzene as a biomarker of exposure among occupationally exposed and unexposed subjects[J]. Carcinogenesis, 22(2):279-286 |
| [76] | Ward M H, Nuckols J R, Riggs P, et al. 2007. Using geographic information systems (GIS) for exposure assessment in environmental epidemiology studies of cancer[J]. American Journal of Epidemiology, 165(11):S137-S137 |
| [77] | Wild C P. 2005. Complementing the genome with an "exposome":The outstanding challenge of environmental exposure measurement in molecular epidemiology[J]. Cancer Epidemiology Biomarkers & Prevention, 14(8):1847-1850 |
| [78] | Wild C P. 2012. The exposome:from concept to utility[J]. International Journal of Epidemiology, 41(1):24-32 |
| [79] | Xing G H, Liang Y, Chen L X, et al. 2011. Exposure to PCBs, through inhalation, dermal contact and dust ingestion at Taizhou, China-A major site for recycling transformers[J]. Chemosphere, 83(4):605-611 |
| [80] | 杨汉策,王永伟,杨跃林,等. 2014.累积铅暴露工人ALAD基因多态性与肾损害的相关分析[J].预防医学情报杂志, 30(5):381-385 |
| [81] | 于军. 2013. "人类基因组计划"回顾与展望:从基因组生物学到精准医学[J].自然杂志, 35(5):326-331 |
| [82] | 郑国巧,夏昭林. 2014.暴露组与暴露组学研究进展[J].中华劳动卫生职业病杂志, 32(12):945-948 |
 2016, Vol. 36
2016, Vol. 36


