2. 江苏省水处理技术与材料协同创新中心, 苏州 215000
2. Jiangsu Coorperative Innovation Center of Water Treatment Technology and Materials, Suzhou 215000
水体富营养化导致藻类等水生浮游植物异常繁殖并形成水华,蓝藻水华最为常见,水华发生后水体变色、散发异味并产生有害气体,还释放藻毒素,严重威胁到其他水生生物生态功能的正常发挥,甚至影响人类的健康(Zhang et al., 2003; Codd,2000; Codd et al., 2005).虽然已经有物理、化学、生态等许多技术方法来控制或抑制蓝藻水华,但仍缺乏高效、安全、低成本的蓝藻控制方法(Veldhuis and Wassmann, 2005).
化感作用是一种植物通过向环境中释放化学物质影响其他生物生长的现象(彭海清等,2002; Gross et al., 2003; Nakai et al., 2000).目前已发现多种水生植物对水华藻类具有一定的化感抑制作用,如张薛等(2007)发现未过滤的大麦(Hordeum vulgare)秆提取液对铜绿微囊藻的生长有显著的抑制效果,各实验组6 d后的抑制率均在95%以上;何连生等(2013)研究了活体荷(Nelumbo nucifera)不同部位(茎和叶)提取液对铜绿微囊藻强烈的抑制作用,且荷叶浸出液对藻类的抑制效果优于荷茎浸出液;Mulderij等(2005)认为水剑叶(Stratiotes aloides)释放化感物质的原因是为了竞争光,其化感抑藻机理为延迟浮游藻类进入对数生长期的时间; Żak等(2012)发现波罗的海的多变鱼腥藻(Anabaena variabilis)种植水抽滤液以及经藻酸钠固定后显著的抑制了小球藻(Chlorella vulgaris)的生长和叶绿素a的含量,并认为利用固定化技术可能是一种解释化感作用机理的好方法.利用水生植物化感抑藻具有生态危险性低、副作用小和抑制效果明显等优点,因此成为实现藻类安全控制的新方法(Vyvyan,2002).
铜绿微囊藻(Microcystis aeruginosa)是淡水水华的主要藻类之一,而且能释放藻毒素,对生态环境和人体健康产生威胁,因此选用铜绿微囊藻作为本实验的研究藻种.豆瓣菜(Nasturtium officinale),别名西洋菜,为十字花科豆瓣菜属多年生水生草本植物,利用旱地种植或无土栽培,在我国已较大面积开发利用.笔者在之前的研究中,发现豆瓣菜有机提取物较之凤眼莲、苦草等经典的化感抑藻植物有更强的抑藻能力,然而,目前却尚未见豆瓣菜对蓝藻的化感作用的系统研究报道.本实验选用豆瓣菜为研究对象,就豆瓣菜的有机提取物对铜绿微囊藻的化感作用和作用机制进行了研究并对化感成分进行了初步分离.
2 材料与方法(Materials and methods) 2.1 实验材料水生植物豆瓣菜均采自太湖流域.铜绿微囊藻由中国科学院水生生物研究所提供.铜绿微囊藻用BG-11培养基进行培养.将样品保存于光照培养箱中,培养条件为温度(25±1)℃,光照度2000 lx,光暗比12 h ∶ 12 h,每天摇动3~4次.经多次扩大培养使其处于对数生长期(孙颖颖等,2012).
2.2 实验设计 2.2.1 豆瓣菜有机浸提物的制备将新鲜豆瓣菜用超纯水清洗干净,晾干后用研钵将其研磨粉碎至浆,转移至烧杯中,加入甲醇常温提取48 h.提取结束后,用滤纸滤去提取液中的残渣,并通过0.22 μm有机系滤膜除去颗粒物干扰,然后通过旋转蒸发(100 r · min-1,45 ℃)除去溶剂,得到浸膏,用二甲基亚砜(DMSO)定容,最终得到200 g · L-1提取母液(用植物的鲜重浓度表示提取液的当量浓度).浓缩液在无菌条件下,通过0.22 μm无菌有机系滤膜除去微生物,于4 ℃冰箱备用(洪喻等,2008).前期实验已发现DMSO投加比例不超过1%对受试铜绿微囊藻的生长无影响,后续投加比例均控制在此范围内.
2.2.2 豆瓣菜有机浸提物对铜绿微囊藻的抑制实验实验时将有机浸提液母液依次稀释后得到浓度梯度为200、100、50和25 g · L-1,各取1 mL(对照组加入相同体积的DMSO溶液)和一定体积的BG11培养液及70 mL(初始浓度为106 cells · mL-1)藻液分别置于250 mL锥形瓶中,定容至100 mL,则相应的浓度梯度为0、0.25、0.5、1和2 g · L-1,每组设置3个平行样.
2.2.3 豆瓣菜有机浸提物中化感组分的萃取分离及其抑藻实验称取一定量的新鲜豆瓣菜用超纯水清洗干净,晾干后用研钵将其研磨粉碎至浆,转移至烧杯中,加入80%甲醇常温提取48 h.减压抽滤后,用旋转蒸发仪在45 ℃下减压蒸发浓缩,得到浸膏,浸膏按别聪聪等(2011)所示步骤进行液液萃取分离,得到五个豆瓣菜的分离组分A(正己烷相)、B(乙酸乙酯相)、C(正丁醇相)、D(丁酮相)和E(水相).各个组分通过旋转蒸发除去溶剂,得到浸膏,用二甲基亚砜(DMSO)定容,得到200 g · L-1提取母液,按2.2.2节所述方法进行抑藻实验.
2.3 研究指标和方法 2.3.1 藻细胞数的测定以培养液光密度(OD680)表示培养液中铜绿微囊藻生物量(沈萍萍等,2001),实验开始每48 h测定1次.在进行测定微囊藻生物量之前,绘制了一条微囊藻吸光度与其生物量的线性曲线,如图 1所示.
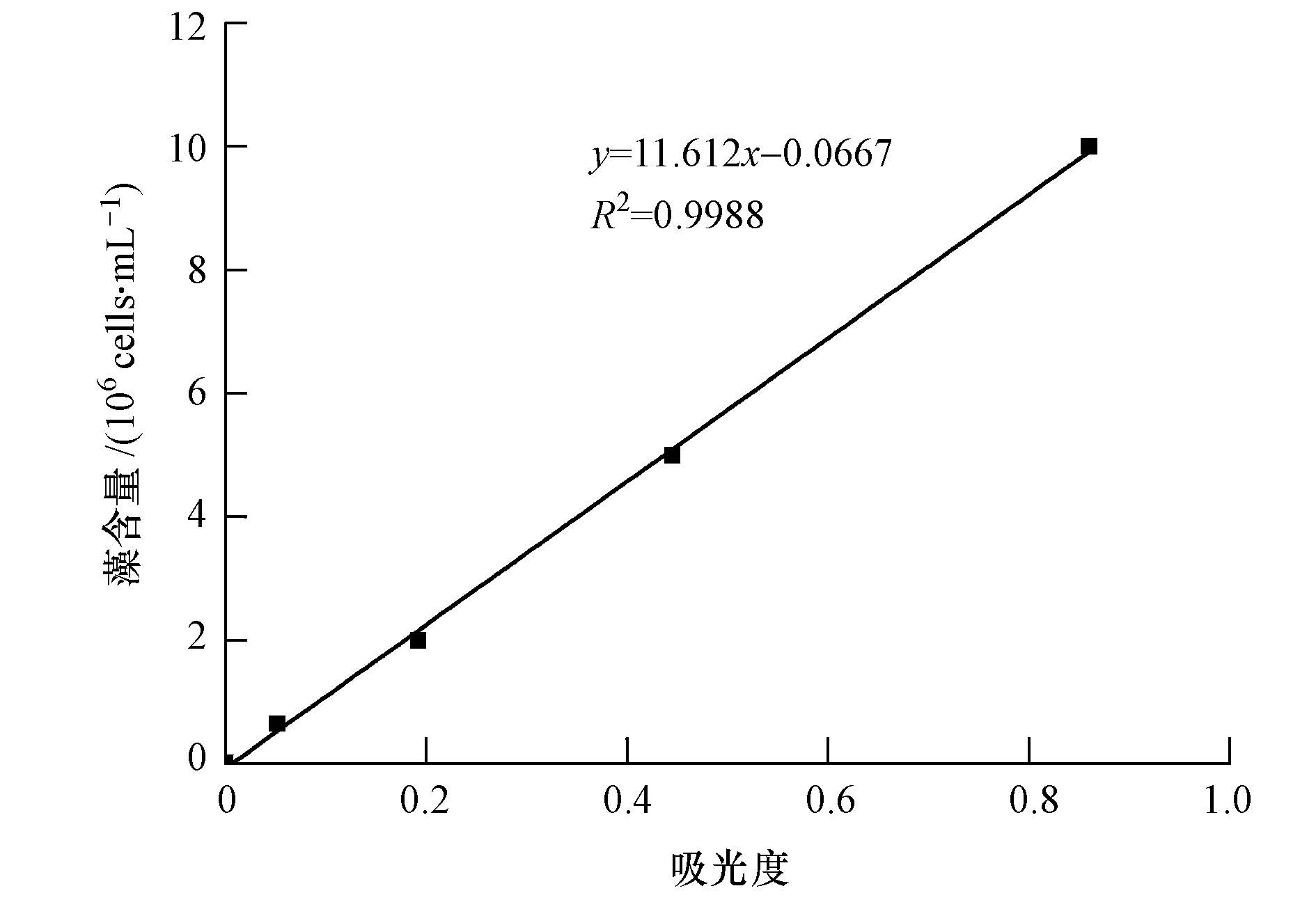 |
| 图1 藻生物量线性曲线 Fig.1 Linear curve of the algal content |
参照(崔莉凤等,2010)的方法:取10 mL藻液,3500 r · min-1下离心3 min,根据其浓度大小取适量上清液,采用碱性过硫酸钾消解紫外分光光度法和过硫酸钾消解铝酸按分光光度法测培养液中的总氮和总磷.
2.3.3 铜绿微囊藻中藻胆蛋白的测定参照(Padgett and Krogmann, 1987)的方法:取5 mL藻液,10000 r · min-1 离心10 min,弃上清液,加入5 mL磷酸缓冲液(0.05 mol · L-1,pH值为7.0).将样品放入超低温冰箱,8 h后取出,室温避光溶解,反复冻溶3~4 次,12000 r · min-1离心10 min.取上清液,测定650 nm、620 nm和565 nm的吸光度,根据以下公式计算藻蓝蛋白(PC)、别藻蓝蛋白(APC)和藻红蛋白(PE)的含量(mg · L-1)以及相对含量:

参照(孙颖颖等,2010)的方法:15 mL藻液2000 r · min-1 转速下离心10 min,弃去上清液. 藻泥于-20 ℃冻融破碎3次后,加入5 mL PBS(磷酸氢二钠和磷酸二氢钠的混合溶液)并充分振荡,离心10 min.上清液用于测定蛋白质和多糖,方法如下:1 mL上清液加入5 mL考马斯亮蓝溶液,测定595 nm处的吸光度,根据标准蛋白质曲线,确定蛋白质的含量;1 mL上清液加入0.1 mL硫酸锌,沸水浴5 min,立即加入亚铁氰化钾0.1 mL,离心10 min,取上清液1 mL加到5 mL蒽酮中,沸水浴10 min,用冷水迅速冷却至室温,稳定后测定620 nm波长处的吸光度,根据标准葡萄糖曲线确定多糖含量.
2.3.5 培养基中溶解氧的测定利用便携式溶氧仪测定溶解氧的含量,实验开始每24 h测定1次.
2.3.6 铜绿微囊藻中叶绿素a和类胡萝卜素的测定参照(Wang et al., 2013)的方法:取10 mL藻液8000 r · min-1,离心5 min,得到沉淀,加入等体积95%乙醇,4 ℃下,经过8 h的提取,取上清测OD665,OD649,OD470.
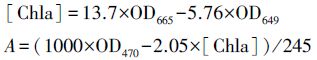
测定参照(陈芝兰,2005)的方法:取15 mL藻液在4000 r · min-1下离心15 min 后收集藻细胞.加入5 mL预冷的0.05 mol · L-1 磷酸缓冲液(pH 7.2).冰浴下超声波破碎(超声5 s,间隔5 s,工作次数为2 次,功率600 W,重复3次),4 ℃下12000 r · min-1离心15 min,收集上清液即为酶液,参照试剂盒(购自南京建成生物工程研究所)通过酶标仪测定,实验开始每48 h测定1次.
2.3.8 铜绿微囊藻中MDA含量的测定测定参照(陈芝兰,2005)的方法:取15 mL藻液4000 r · min-1离心15 min收集藻细胞.加入5 mL预冷的0.05 mol · L-1磷酸缓冲液(pH 7.2),冰浴下超声波破碎(超声5 s,间隔5 s,工作次数为24次,功率600 W,重复3次),4 ℃下12000 r · min-1离心15 min,收集上清液即为酶液,-20 ℃保存备用.参照(Heath and Packer, 1968)的硫代巴比妥酸法测定藻细胞中MDA含量.
2.4 数据分析抑制率计算公式(白羽等,2012)为:
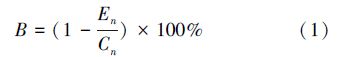
藻细胞相对生长率公式(白羽等,2012):

表数据采用SPSS软件包进行统计分析,应用独立样本t检验进行差异比较,p<0.05表示差异显著,p<0.01表示差异极显著.
3 结果(Results) 3.1 豆瓣菜有机提取物对铜绿微囊藻生长的影响由图 2可知,清水对照组与DMSO对照组无明显差异(p>0.05).当豆瓣菜有机提取物浓度为0.25 g · L-1时,对铜绿微囊藻的生长没有显著影响(p>0.05);当有机提取物浓度大于或等于0.5 g · L-1时,实验后期铜绿微囊藻的生长受到显著的抑制作用(p<0.05).观察0.5~2 g · L-1实验组可知,在实验周期内,其抑制率(抑制率为与DMSO对照组相比)随着时间逐渐增大,特别是2 g · L-1实验组在2 d后,藻体就开始黄化.第10 d,0.5 g · L-1实验组、1 g · L-1实验组和2 g · L-1实验组的抑制率分别为20.65%、45.08%和67.62%,相对生长率为分别为0.129、0.091和0.038,说明3个实验组中的铜绿微囊藻仍可耐受增长,生物量呈正增长.
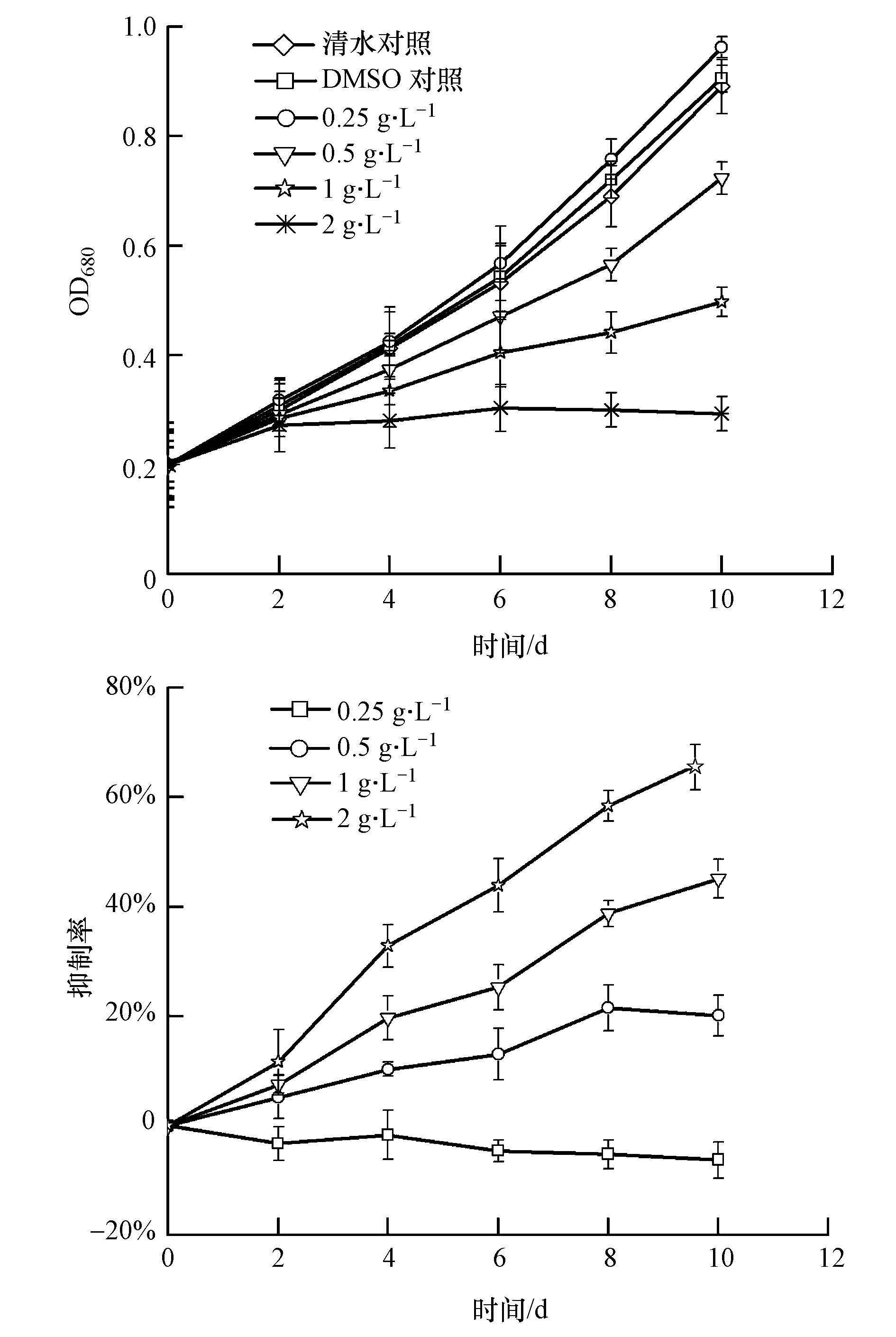 |
| 图2 豆瓣菜有机提取物对铜绿微囊藻生长影响 Fig.2 Effect of organic solvent extracts from N. officinale on the growth of M. aeruginosa |
豆瓣菜有机提取物对培养液中总氮和总磷含量的影响如图 3所示.图 3显示对照组和实验组培养液中的总氮和总磷含量一直保持下降的趋势,而且实验组中的营养盐浓度反而比对照组要高,第10 d,对照组中总氮和总磷含量分别为实验组的47.52%和40.09%(p<0.01).由此可见,铜绿微囊藻的生长受到抑制并不是因为营养盐的缺失,而是植物化感物质的抑制作用.这与张维昊等(2006)的观点类似,其发现在富营养条件下,菖蒲依旧对铜绿微囊藻有抑制作用.
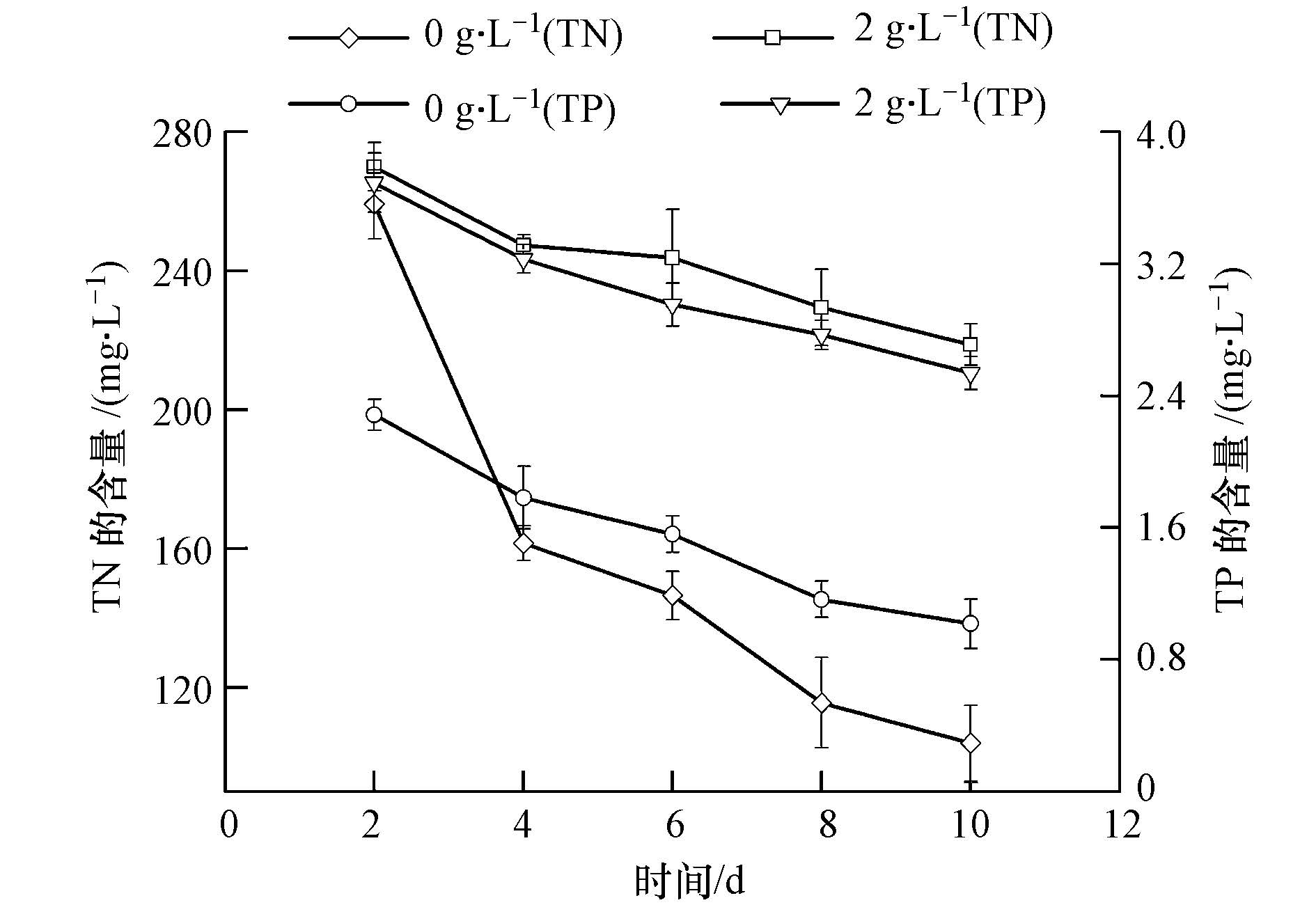 |
| 图3 豆瓣菜有机提取物对培养基中TN和TP含量的影响 Fig.3 Effect of organic solvent extracts from N. officinale on TN and TP in the medium |
由图 4可以看出豆瓣菜有机提取物对藻细胞中叶绿素a和类胡萝卜素含量的影响,自第2 d起,实验组中的叶绿素a和类胡萝卜素含量便持续降低,第10 d,实验组中叶绿素a和类胡萝卜素含量仅为对照组的1.14%和4.9%(p<0.01),这与实验过程中培养液颜色变黄及OD值结果基本相符;实验组中DO的含量在第1 d开始就低于对照组,在1~10 d 内对照组中的DO含量稳定上升,而实验组中的DO含量却一直维持在7.35~8.06之间,变化幅度不明显(p>0.05).
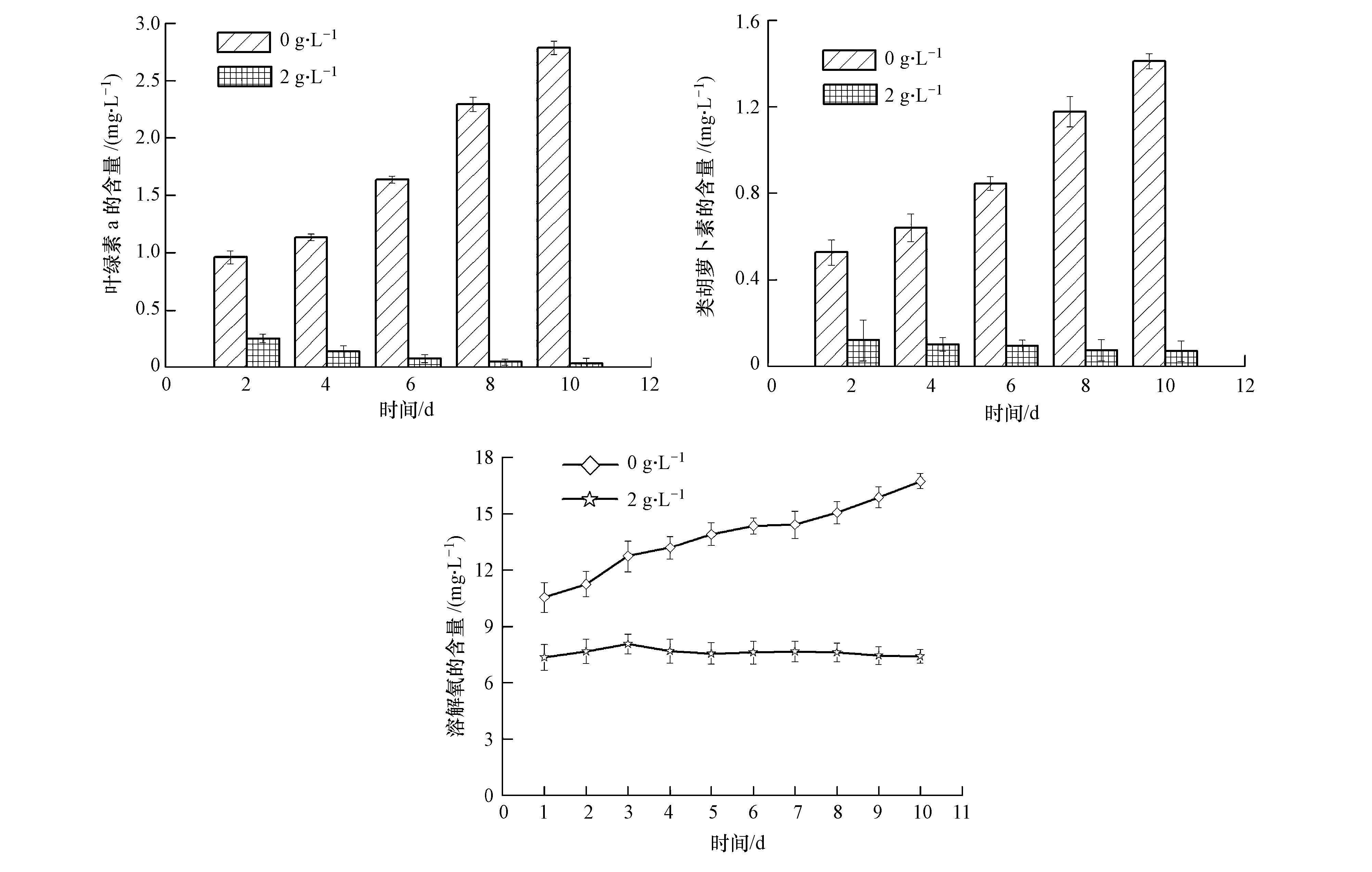 |
| 图4 豆瓣菜有机提取物对叶绿素a、类胡萝卜素和溶解氧的影响 Fig.4 Effect of organic solvent extracts on chlorophyll a,carotinoid and dissolved oxygen |
图 5为藻液中加入有机提取物后铜绿微囊藻体中可溶性蛋白、多糖和藻胆蛋白含量的变化情况.由 图 5可以看出,与对照相比,加入有机提取物后,铜绿微囊藻的可溶性蛋白含量在第2 d开始就逐渐下降,到第10 d时其含量为对照值的42.67%(p<0.01),与藻细胞的生长状态变化情况基本一致,而同期对照组的可溶性蛋白含量在培养过程中保持了稳定的增长;实验组中的多糖的含量变化与可溶性蛋白含量变化类似,在第2 d开始就逐渐下降,到第10 d时其含量仅相当于对照值的0.26%(p<0.01),同期对照组的多糖含量稳定上升;在3种藻胆蛋白中,藻蓝蛋白(PC)的相对含量减少最多,别藻蓝蛋白(APC)次之,藻红蛋白(PE)最少.藻蓝蛋白和别藻蓝蛋相对含量的变化趋势为随着时间迅速降低,到第10 d时已经检测不出两种蛋白的含量.而藻红蛋白的相对含量从2 d的25.76%增至4 d的26.73%,随后迅速降低,最终到10 d的2.41%.
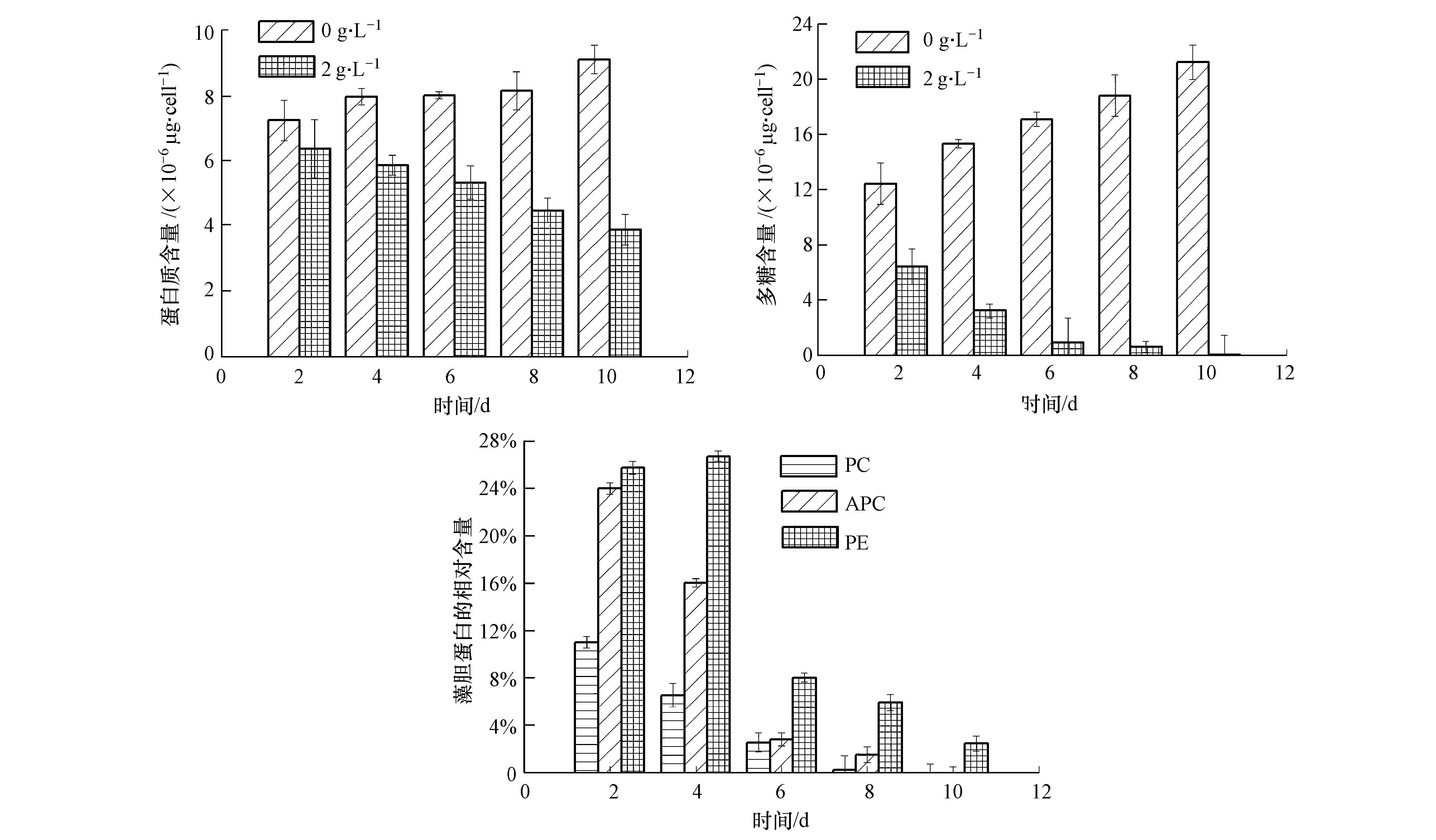 |
| 图5 豆瓣菜有机提取物对可溶性蛋白、多糖和藻胆蛋白的影响 Fig.5 Effect of organic solvent extracts on the protein,polysaccharide and phycobiliprotein |
如图 6、图 7所示,处理初期,相比于对照组,实验组的SOD、CAT、POD的活性都呈显著的上升趋势(p<0.05),都是在第4 d以后有不同趋势的下降.通常,在机体受到胁迫和损伤条件下,SOD、CAT和POD的活性表现为先升高,使细胞内自由基的形成和清除尽快建立新的平衡,若胁迫强度超过细胞所能耐受的范围,胁迫就会伤害细胞表现为SOD、CAT和POD的活性明显降低(何梅等,2008);丙二醛MDA是膜脂过氧化的产物,测定MDA的积累可以反映机体胁迫损伤程度,特别是膜结构破坏的程度(何梅等,2008).实验组的MDA含量的变化与SOD、CAT和POD的活性变化趋势略有不同.前2 d,实验组MDA的含量明显大于对照组MDA含量(p<0.05),说明豆瓣菜的有机提取物在初期就造成了铜绿微囊藻膜脂过氧化加剧,引起MDA的积累.2 d后,MDA的含量均逐渐下降,这可能是此时膜已解体,细胞已死亡;谷氨酰胺合成酶(GS)和酸性磷酸酶(ACP)则能反应豆瓣菜有机提取物对铜绿微囊藻吸收转化氮和磷的影响(Cheng,2012; García et al., 2004),实验后期GS和ACP的低活性表明,豆瓣菜有机提取物抑制了铜绿微囊藻对氮和磷的吸收转化,也解释了3.2节中实验组TN和TP较高含量的原因.
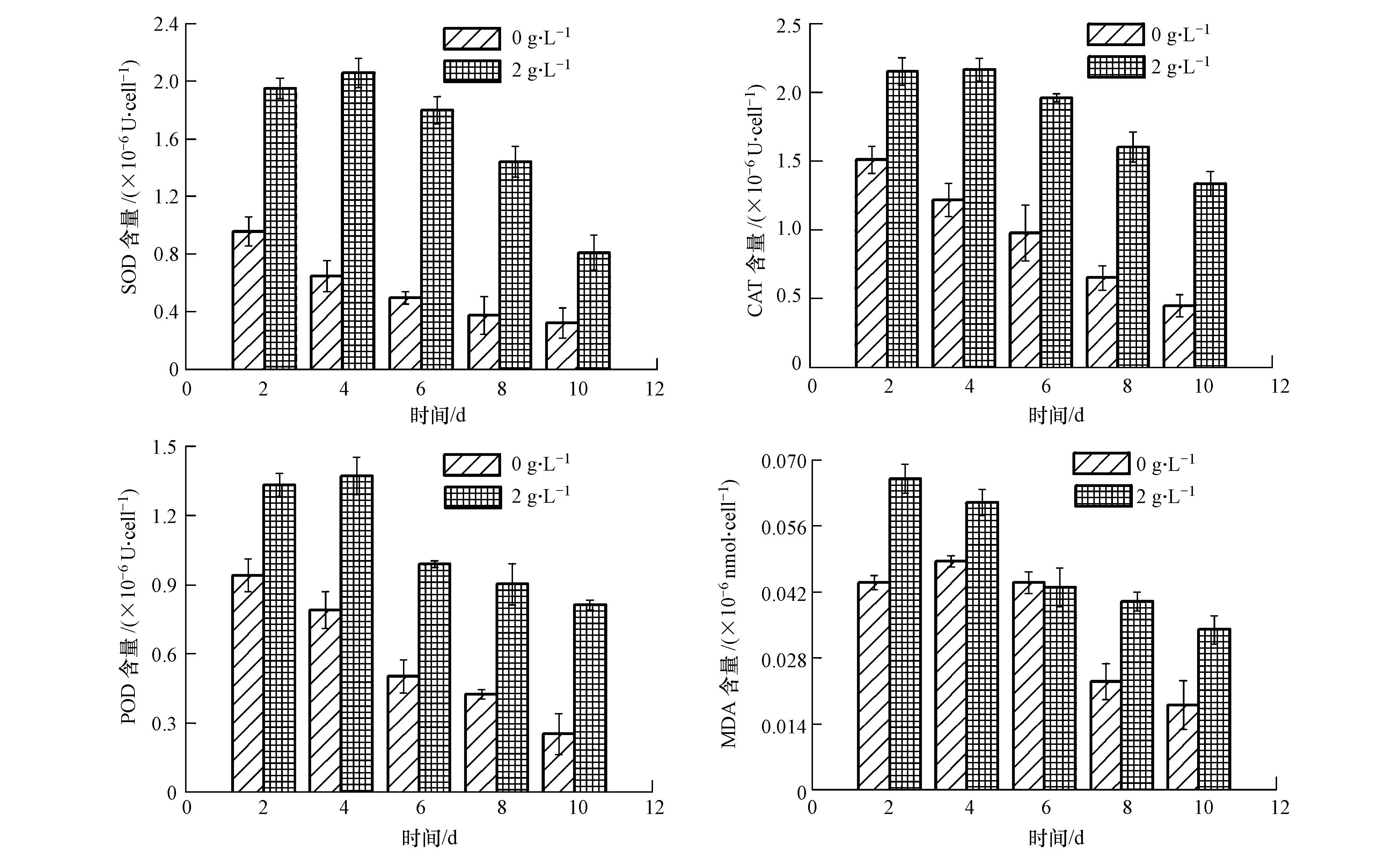 |
| 图6 豆瓣菜有机提取物对抗氧化活性酶和MDA的影响 Fig.6 Effect of organic solvent extracts on antioxidant enzyme and MDA |
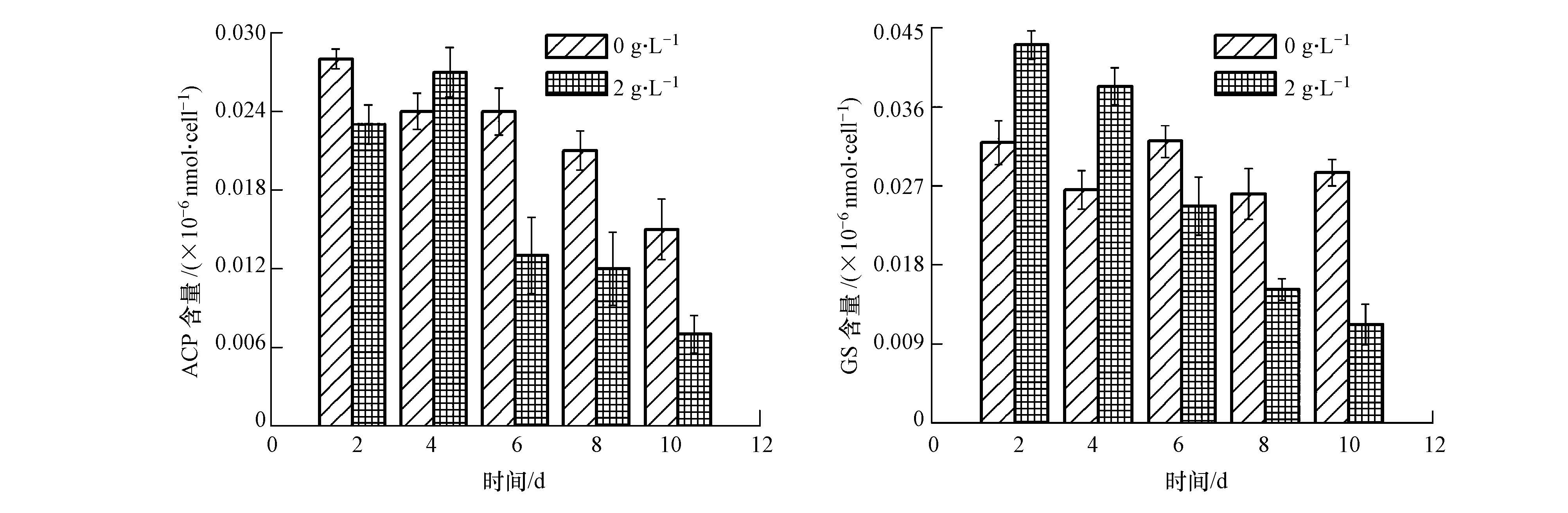 |
| 图7 豆瓣菜有机提取物对GS和ACP的影响 Fig.7 Effect of organic solvent extracts on GS and ACP |
豆瓣菜有机粗提液经液液萃取分离后得到5个组分A、B、C、D和E,其对铜绿微囊藻的生长影响如图 8所示.随着培养时间的延长,各组分的抑藻效果随投加物浓度增加而增强.组分A浓度为2 g · L-1(植物的鲜重浓度表示组分的当量浓度)时,其抑制率随着时间的延长而逐渐增大,在第10 d抑制率达到了94.8%,瓶中藻细胞稀少,后续藻细胞生长无恢复,藻细胞几乎被完全杀死,表明组分A在高浓度下有强烈的抑藻效果.在第10 d,其1、0.5和0.25 g · L-1浓度处理组的抑制率分别为36.31%、17.41%和4.78%.组分B、C、D和E在10 d培养中最大抑制率均没超过40%,特别是组分D和E在低浓度下反而对铜绿微囊藻的生长有促进作用.显而易见,组分A即正己烷相中的化感成分在豆瓣菜的抑藻过程中起着关键性的作用.
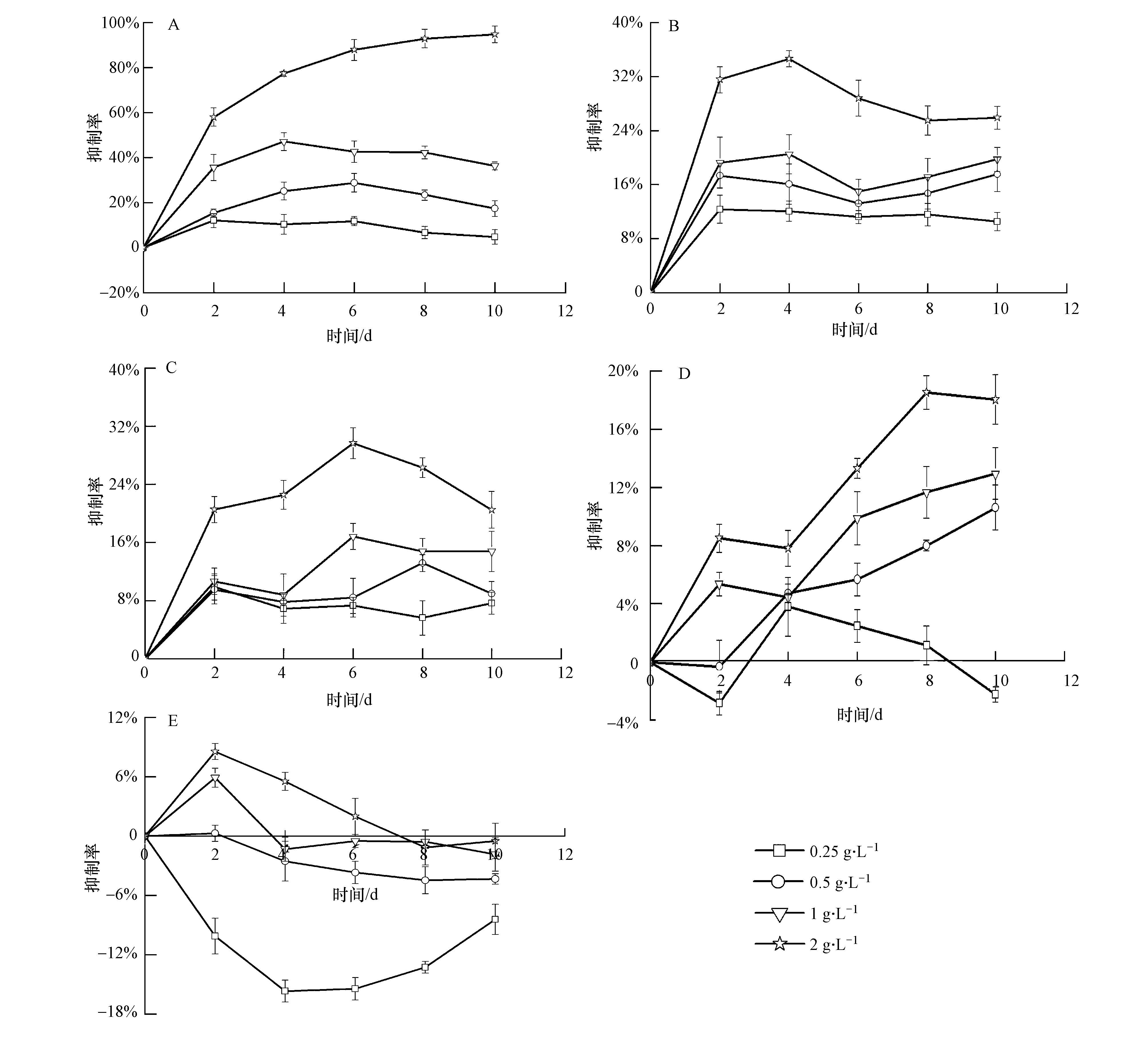 |
| 图8 5个液液萃取组分对铜绿微囊藻生长影响 Fig.8 Effect of five extractive parts on the growth of M. aeruginosa |
利用水生植物的化感作用对藻类爆发进行控制是一种重要的控藻生态学方法,但也存在局限性,若向富营养化严重的水体中移栽活体水生植物,活体植物会受到各种浮游藻类带来的营养、光照以及空间竞争的巨大冲击,导致植株存活率低,无法有效控制有害藻类的过量增殖;且栽种活体植株适应待治理水体环境和发挥抑藻功效的周期较长,从而限制了其应用(李锋民和胡洪营,2004).因此,可以对水生植物中的化感物质进行适当的提取浓缩或投加干体,通过投加提取浓缩物或干体实现对藻类爆发的治理,这样可以不受水域局限,施工简便,且能短期见效.
实验中高浓度的豆瓣菜有机提取物表现出强烈的抑藻效应,这与孙颖颖等(2010)研究结果类似,其比较了5种浒苔(Enteromorpha prolifera)的有机提取物对4种赤潮微藻(microalgae)生长的抑制作用,发现甲醇提取物的抑制作用最强,并利用甲醇在后续分离纯化中进行抑藻物质的初步提取.Park等(2006)也发现不同浓度的稻杆甲醇提取物在2 d后均表现出较强的抑藻作用,第8 d的抑制率均超过了50%.Nakai等(2005)在穗花狐尾藻的甲醇提取物中检测到多种脂肪酸,如壬酸、豆蔻酸、棕榈酸、硬脂酸、油酸等,毒性实验结果显示,壬酸,顺-6-烯酸,顺-9-烯酸明显地抑制铜绿微囊藻的生长.本实验也对豆瓣菜有机提取物中的化感成分进行了初步分离,结果显示正己烷相的抑藻效果最为显著,推测豆瓣菜有机提取物中的活性抑藻成分为弱极性的物质,此结果也与刘文桃(2009)和张迪(2009)的研究相类似,Waride等(2004)和DellaGreca等(2000)都在弱极性溶剂的提取物中检测出具有明显抑藻效果的成分.
叶绿素是植物进行光合作用的主要色素,易受环境胁迫的影响,如干旱、重金属、除草剂等都可能降低植物中叶绿素的含量(Geoffroy et al., 2004).某些化感物质对植物叶绿素的破坏也有报道,例如在化感物质肉桂酸乙酯胁迫下,藻细胞内的叶绿素a发生分解,导致叶绿素含量下降,影响光能的捕获,造成藻细胞的光合活性降低,能降低杂草的叶绿素含量(Bornman and Vogelmann, 1991).从菊花中分离得到的化感物质木犀草素-7-O-葡萄糖醛酸甙能显著降低浮萍叶片中的叶绿素含量(Beninger and Hall, 2005).从西藏裸大麦中分离的化感物质,能有效降低铜绿微囊藻的叶绿素含量(Xiao et al., 2010).在豆瓣菜中活性抑藻物质的胁迫下,藻细胞内的叶绿素a发生分解,导致叶绿素a含量下降,影响光能的捕获,造成藻细胞的光合活性降低;类胡萝卜素具有吸收和传递光能(周聪,2013),保护叶绿素的功能而DO往往是水产动物生存的限制因子,本实验中实验组中类胡萝卜素和DO的较低含量也从侧面反映了藻细胞的光合活性降低.
细胞原生质膜的稳定性为物质运转、能量交换和信息传递等一系列功能的实现,以及维持细胞内外离子的浓度差和物质的主动运输起着重要作用(郜红建等,2004).细胞质膜是许多杀藻剂的靶位点,丙二醛是膜脂过氧化的产物,其含量能反映细胞膜结构损伤程度(Panda et al., 2003).本实验中发现,实验组中MDA含量在2 d里显著增大,且大于对照组,2 d后MDA的含量逐渐下降,这可能是此时膜已解体,细胞已死亡.豆瓣菜有机提取物中的化感物质应是首先对膜产生伤害,通过细胞膜上的靶位点(张庭廷等,2008),将化感物质传送到细胞内,从而对蛋白质、多糖、藻胆蛋白等的合成产生影响(DeLorenzo et al., 2001),进而引起藻细胞分裂、光合作用等的变化(Alaiz et al., 1999),从而对植物的生长产生抑制作用.
藻细胞膜受到的损害可能主要是氧化损伤,在正常情况下,植物可以通过自身保护机制,使细胞内活性氧的产生和消除处于平衡状态,不易导致氧化损伤.抗氧化酶系就是是机体内防御氧化损伤的重要酶系.本实验中,实验组的SOD、CAT和POD酶活性前期都明显升高,后期明显降低,这可能是由于在化感物质胁迫下藻细胞内活性氧(ROS)大量积累,为了清除过多的ROS,藻细胞通过提高抗氧化系酶的活性来保护其免受氧化损伤,然而,当化感物质浓度较高时,细胞内ROS浓度超出一定的阈值时,细胞不能及时将其清除,导致细胞损伤不能被及时修复,引起酶活性降低(Dat et al., 2000).张庭廷等(2007)认为对羟基苯甲酸等酚酸类物质可引起藻细胞氧自由基产生明显增加,而O· -2是以氧为中心的自由基,可以转变成羟基自由基,同时在氢过氧基、过氧化氢、氧有机自由基等形成中也起着重要的作用.刘洁生等(2006)则认为N-苯基-2-萘胺可能通过光分解产生自由基,在藻细胞膜上发生一系列脂膜过氧化反应,产生大量的H ·和C10H7 ·等自由基以及MDA、乙烷等.后续实验将进一步论证发挥作用的自由基的形式.
5 结论(Conclusions)1)豆瓣菜有机提取物对铜绿微囊藻的生长具有一定的抑制作用,当提取物浓度为0.25 g · L-1时,对铜绿微囊藻生长无显著影响(p>0.05),当提取物浓度高于0.5 g · L-1时,对铜绿微囊藻产生抑制作用,且抑制率随时间的延长而逐渐增大,第10 d实验组4的抑制率为67.62%.
2)豆瓣菜有机提取物中的化感物质应是首先对膜产生伤害,通过细胞膜上的靶位点,将化感物质传送到细胞内,从而对蛋白质、多糖、藻胆蛋白等的合成产生影响,进而引起藻细胞分裂、光合作用等的变化,从而对植物的生长产生抑制作用.
3)豆瓣菜有机提取物中的化感物质引起铜绿微囊藻细胞内MDA的含量显著增加,造成藻细胞膜系统和功能紊乱,从而导致细胞代谢生长缓慢.面对氧化胁迫,细胞通过提高抗氧化系酶(SOD、CAT和POD)的活性来保护其免受氧化损伤.
4)正己烷相的抑藻效果最为显著,推测豆瓣菜有机提取物中的化感成分为弱极性的物质. 责任作者简介: 成小英(1977—),博士,副教授,硕士生导师.2003年在英国伦敦大学学院(UCL)攻读硕士学位,2002年至2005年在中国科学院南京地理与湖泊研究所攻读博士学位.
| [1] | Alaiz M, Hidalgo F J, Zamora R. 1999. Effect of pH and temperature on comparative antioxidant activity of nonenzymatically browned proteins produced by reaction with oxidized lipids and carbohydrates[J]. Journal of Agricultural and Food Chemistry, 47(2):748-752 |
| [2] | 白羽,黄莹莹,孔海南,等. 2012.加拿大一枝黄花化感抑藻效应的初步研究[J].生态环境学报, 21(7):1296-1303 |
| [3] | Beninger C W, Hall J C. 2005. Allelopathic activity of luteolin 7-O-β-glucuronide isolated from Chrysanthemum morifolium L.[J]. Biochemical Systematics and Ecology, 33(2):103-111 |
| [4] | 别聪聪,李锋民,李媛媛,等. 2011.六种大型藻浸提液对中肋骨条藻的抑制及活性成分分离[J].中国海洋大学学报, 41(7/8):107-112. |
| [5] | 005 Bornman J F, Vogelmann T C. 1991. Effect of UV-B radiation on leaf optical properties measured with fibre optics[J]. Journal of Experimental Botany, 42(4):547-554 |
| [6] | 陈芝兰. 2005.凤眼莲根对赤潮藻生长的抑制作用及其机理研究[D].广州:暨南大学 |
| [7] | Cheng T S. 2012. The toxic effects of diethyl phthalate on the activity of glutamine synthetase in greater duckweed (Spirodela polyrhiza L.)[J]. Aquatic Toxicology, 124-125:171-178 |
| [8] | Codd G A. 2000. Cyanobacterial toxins, the perception of water quality, and the prioritisation of eutrophication control[J]. Ecological Engineering, 16(1):51-60 |
| [9] | Codd G A, Morrison L F, Metcalf J S. 2005. Cyanobacterial toxins:risk management for health protection[J]. Toxicology and Applied Pharmacology, 203(3):264-272 |
| [10] | 崔莉凤,赵硕,吴溶,等. 2010.穗花狐尾藻浸出液对铜绿微囊藻生长和产毒的影响[J].环境科学与技术, 33(S2):50-54 |
| [11] | Dat J, Vandenabeele S, Vranová E, et al. 2000. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Science, 57(5):779-795 |
| [12] | DellaGreca M, Fiorentino A, Isidori M, et al. 2000. Antialgal ent-labdane diterpenes from Ruppia maritima[J]. Phytochemistry, 55(8):909-913 |
| [13] | DeLorenzo M E, Scott G I, Ross P E. 2001. Toxicity of pesticides to aquatic microorganisms:A review[J]. Environmental Toxicology and Chemistry, 20(1):84-98 |
| [14] | García N A. T, Olivera M, Iribarne C, et al. 2004. Partial purification and characterization of a non-specific acid phosphatase in leaves and root nodules of Phaseolus vulgaris[J]. Plant Physiology and Biochemistry, 42(7/8):585-591 |
| [15] | Geoffroy L, Frankart C, Eullaffroy P. 2004. Comparison of different physiological parameter responses in Lemna minor and Scenedesmus obliquus exposed to herbicide flumioxazin[J]. Environmental Pollution, 131(2):233-241 |
| [16] | Gross E M, Erhard D, Enikö I. 2003. Allelopathic activity of Ceratophyllum demersum L. and Najas marina ssp. intermedia (Wolfgang) Casper[J]. Hydrobiologia, 506-509(1/3):583-589 |
| [17] | 何连生,孟繁丽,刁晓君,等. 2013.白洋淀荷茎叶提取液对铜绿微囊藻及四尾栅藻化感效应[J].环境科学, 34(7):2637-2641 |
| [18] | 何梅,张庭廷,吴安平,等. 2008.肉桂酸对铜绿微囊藻和斜生栅藻的抑制作用[J].应用与环境生物学报, 14(6):774-778 |
| [19] | Heath R L, Packer L. 1968. Photoperoxidation in isolated chloroplasts:Ⅰ. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics, 125(1):189-198 |
| [20] | 洪喻,胡洪营,黄晶晶,等. 2008.不同溶剂提取芦竹化感物质对铜绿微囊藻生长的影响[J].环境科学, 29(11):3143-3147 |
| [21] | 李锋民,胡洪营. 2004.芦苇抑藻化感物质的分离及其抑制蛋白核小球藻效果研究[J].环境科学, 25(5):89-92 |
| [22] | 刘洁生,陈芝兰,杨维东,等. 2006.凤眼莲根系丙酮提取物抑制赤潮藻类生长的机制研究[J].环境科学学报, 26(5):815-820 |
| [23] | 刘文桃. 2009.韭菜提取物对铜绿微囊藻化感抑制的研究[D].扬州:扬州大学 |
| [24] | Mulderij G, Mooij W M, Smolders A J P, et al. 2005. Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides[J]. Aquatic Botany, 82(4):284-296 |
| [25] | Nakai S, Inoue Y, Hosomi M, et al. 2000. Myriophyllum spicatum-released allelopathic polyphenols inhibiting growth of blue-green algae Microcystis aeruginosa[J]. Water Research, 34(11):3026-3032 |
| [26] | Nakai S, Yamada S, Hosomi M. 2005. Anti-cyanobacterial fatty acids released from Myriophyllum spicatum[J]. Hydrobiologia, 543(1):71-78 |
| [27] | Padgett M P, Krogmann D W. 1987. Large scale preparation of pure phycobiliproteins[J]. Photosynthesis Research, 11(1):225-235 |
| [28] | Panda S K, Singha L B, Khan M H. 2003. Does aluminum phytotoxicity induce oxidative stress in greengram (Vigna radiata)?[J]. Bulgaria Journal Plant Physiology, 29(1/2):77-86 |
| [29] | Park M H, Han M S, Ahn C Y, et al. 2006. Growth inhibition of bloom-forming cyanobacterium Microcystis aeruginosa by rice straw extract[J]. Letters in Applied Microbiology, 43(3):307-312 |
| [30] | 彭海清,谭章荣,高乃云,等. 2002.给水处理中藻类的去除[J].中国给水排水, 18(2):29-31 |
| [31] | 沈萍萍,王朝晖,齐雨藻,等. 2001.光密度法测定微藻生物量[J].暨南大学学报(自然科学与医学版), 22(3):115-119 |
| [32] | 孙颖颖,刘筱潇,王长海. 2010.浒苔提取物对4种赤潮微藻生长的抑制作用[J].环境科学, 31(6):1662-1669 |
| [33] | 孙颖颖,徐深圳,张静,等. 2012.金鱼藻对5种水华微藻生长的抑制作用[J].环境科学与技术, 35(7):1-7 |
| [34] | Veldhuis M J W, Wassmann P. 2005. Bloom dynamics and biological control of a high biomass HAB species in European coastal waters:A Phaeocystis case study[J]. Harmful Algae, 4(5):805-809 |
| [35] | Vyvyan J R. 2002. Allelochemicals as leads for new herbicides and agrochemicals[J]. Tetrahedron, 58(9):1631-1646 |
| [36] | Wang J, Zhao F, Chen B H, et al. 2013. Small water clusters stimulate microcystin biosynthesis in cyanobacterial Microcystis aeruginosa[J]. Journal of Applied Phycology, 25(1):329-336 |
| [37] | Waridel P, Wolfender J -L, Lachavanne J -B, et al. 2004. ent-Labdane glycosides from the aquatic plant Potamogeton lucens and analytical evaluation of the lipophilic extract constituents of various Potamogeton species[J]. Phytochemistry, 65(7):945-954 |
| [38] | Xiao X, Chen Y X, Liang X Q, et al. 2010. Effects of Tibetan hulless barley on bloom-forming cyanobacterium (Microcystis aeruginosa) measured by different physiological and morphologic parameters[J]. Chemosphere, 81(9):1118-1123 |
| [39] | Żak A, Musiewicz K, Kosakowska A. 2012. Allelopathic activity of the Baltic cyanobacteria against microalgae[J]. Estuarine, Coastal and Shelf Science, 112:4-10 |
| [40] | 张迪. 2009.铁钉菜(Ishige okamurae)抗菌和抑藻活性物质的研究[D].福州:福建师范大学 |
| [41] | 张庭廷,吴安平,何梅,等. 2007.酚酸类物质对水华藻类的化感作用及其机理[J].中国环境科学, 27(4):472-476 |
| [42] | 张庭廷,何梅,吴安平,等. 2008.对羟基苯甲酸对铜绿微囊藻的化感效应以及对鲤鱼的毒性作用[J].环境科学学报, 28(9):1887-1893 |
| [43] | Zhang W H, Zhang X H, Zhang G M, et al. 2003. Variation of microcystins in a lake for water supply[J]. Environmental Science and Health (Part A), 38(12):2857-2865 |
| [44] | 张维昊,周连凤,吴小刚,等. 2006.菖蒲对铜绿微囊藻的化感作用[J].中国环境科学, 26(3):355-358 |
| [45] | 张薛,胡洪营,门玉洁. 2007.大麦秆提取液对铜绿微囊藻生长的影响研究[J].环境科学学报, 27(12):1984-1987 |
| [46] | 周聪. 2013.两种灭生性除草剂暴露对铜绿微藻藻毒素产生和分泌影响的机制研究[D].杭州:浙江工业大学 |
| [47] | 郜红建,常江,张自立,等. 2004.镧对水稻根质膜透性和根分泌物中几种营养离子含量的影响[J].应用生态学报, 15(4):651-654 |
 2015, Vol. 35
2015, Vol. 35


