2. 环境与市政工程学院, 西安 710055
2. School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055
N2O致温效应为CO2的300多倍、CH4的4~21倍,估计地球上N2O排放对全球温室效应的贡献约占5%~6%(IPCC,1996).污水处理厂氮去除过程会产生大量N2O(Tallec et al., 2006; Kampschreur et al., 2008),占水处理全过程释放的温室气体(包括CO2,CH4和N2O)总量的26%(Kampschreur et al., 2009).我国城镇污水处理厂2011年N2O释放总量估计约为1.26×109 g(以N计)(王亚宜等,2014).因此,污水生物脱氮过程中N2O产生及控制是目前研究的热点之一.
污水生物脱氮过程中硝化及反硝化过程均能产生N2O(Kampschreur et al., 2009;Wunderlin et al., 2011;刘秀红等,2006),自养硝化过程N2O通过AOB硝化菌反硝化或羟胺氧化(化学和生物)产生,其N2O的产生涉及多种酶参与(见图 1),羟氨氧化还原酶(Hydroxylamine oxidoreductase,HAO)是在硝化阶段将羟胺转化成亚硝酸盐的氧化还原酶,位于细胞膜外周质中.有研究表明,羟胺在好氧和厌氧条件下均能被HAO氧化(Yamanaka and Sakano et al.,1980),而N2O是羟胺氧化的副产物(Otte et al., 1999).可见HAO对N2O产生起着关键调控作用.
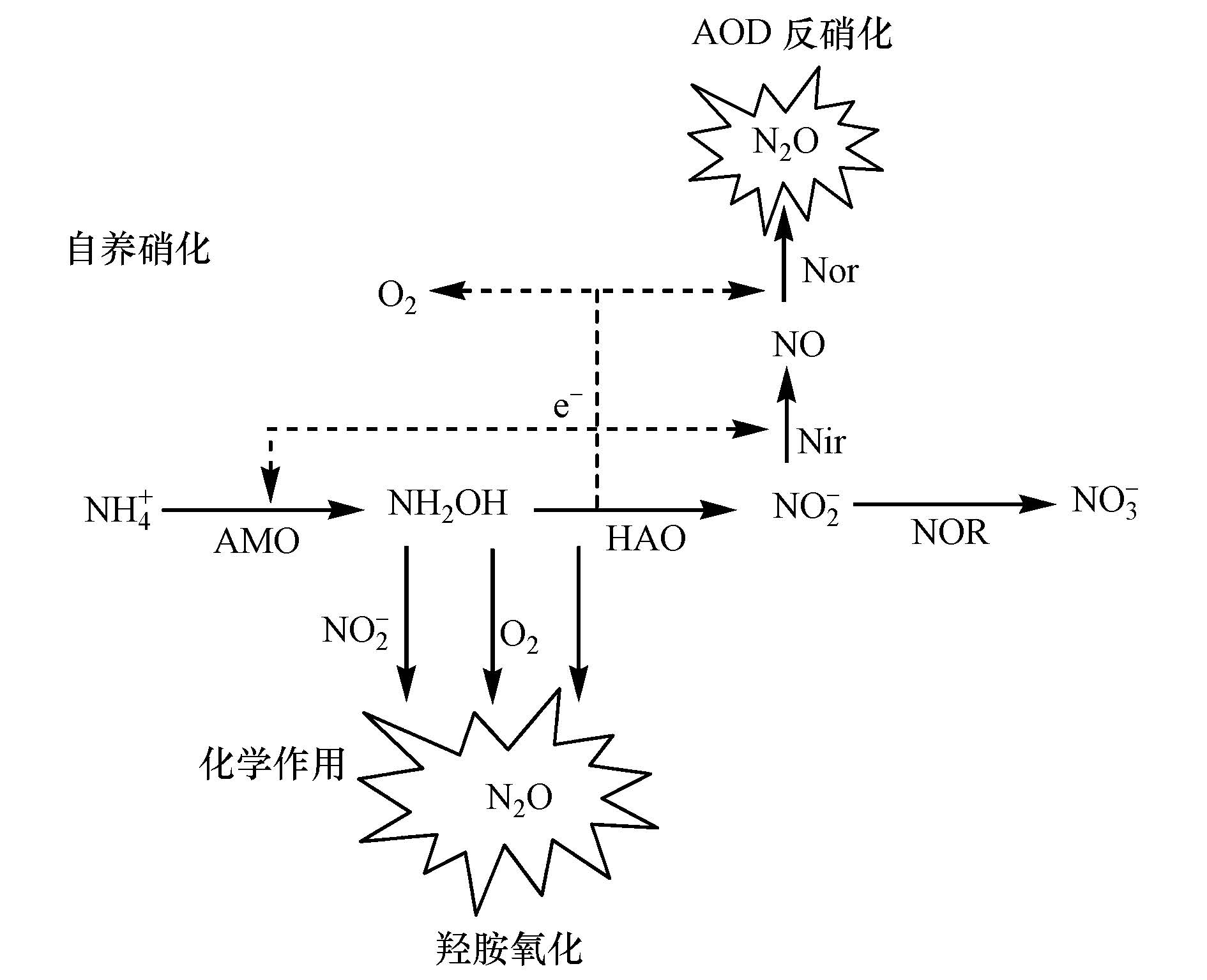 |
| 图1 污水处理硝化过程N2O产生的可能途径及相关酶 (其中:AOB(氨氧化菌,Ammonia-oxidizing bacteria); AMO(氨单加氧酶,Ammonia mono-oxygenase):HAO(羟胺氧化还原酶,Hydroxylamine oxidoreductase);NOR(亚硝酸氧化还原酶,Nitrite oxidoreductase)) Fig.1 Postulated pathway of N2O production and enzymes in nitrification of wastewater treatment |
污水生物处理过程中,酶是控制N2O释放的关键所在(Richardson et al., 2009).目前,一些纯种自养和异养硝化菌的HAO已经分离提纯(Wehrfritz et al., 1993,1996; Kurokawa et al., 1985;Hoppert et al., 1995; Zahn et al., 1994;Ono et al., 1996),这些HAO分子量和结构有所不同(Arciero and Hooper, 1993;Moir et al., 1996;Jetten et al., 1997a;Shimamura et al., 2008).但目前尚无污水生物处理活性污泥HAO的研究报道,一个原因可能是脱氮污泥中硝化菌种类复杂多样,不利于分离提纯HAO而制约了这方面的研究.
不同研究报道的HAO提取和活性测定方法有所不同,破碎细菌细胞的方法有超声法(Jetten et al., 1997b)、压力破碎法(Otte et al., 1999),有研究使用高渗裂解液(Zhang et al., 2014)辅助细胞破碎;酶活性测定时以铁氰化钾作为电子受体,但是所使用的电子受供比也有差异,Otte等(Otte et al., 1999)在测定发酵罐中粪产杆菌的HAO时选用电子受供配比1 : 2,而Tateo Yamanaka等(Yamanaka and Sakano et al.,1980)从Nitrosomonas europaea菌提取纯化HAO时表明,电子受体超过4倍的供体羟胺后,羟胺能迅速被氧化成NO2-.Mike等(Jetten et al., 1997b)在研究羟胺代谢时采用电子受供配比为5 : 2的反应试液.由此可见,目前尚无确定可行的活性污泥HAO酶提取和活性测定方法.
基于此,本文在前期研究(南亚萍等,2012;刘婧晶等,2014)的基础上,从破碎方法、裂解液的使用、酶活测定液电子受供比、反应终止剂等方面对污水生物处理活性污泥中HAO酶的粗提取及酶活测定方法进行了探索研究,旨在为进一步探索污水生物处理中N2O产生和控制的酶水平研究奠定基础.
2 材料与方法(Material and methods) 2.1 材料来源活性污泥取自实验室处理模拟城市生活污水的SBR反应器.该反应器的有效容积为6 L,每天运行3个周期,每周期8 h,包括进水10 min(充水比为1/2),厌氧搅拌120 min,好氧240 min,沉淀40 min,出水10 min,闲置60 min.人工废水由葡萄糖、乙酸钠、氯化铵、磷酸氢二钾、氯化钙、硫酸镁和氯化铁配制而成,加入碳酸氢钠调节pH值为6.8~7.8(FE-20型酸度计,梅特勒-托利多(上海)有限公司).COD约为400 mg · L-1,氨氮约为60 mg · L-1,总磷约为5 mg · L-1.
反应器温度维持在25 ℃;污泥浓度维持在MLSS 3255 mg · L-1(MLVSS/MLSS值在0.80左右).控制曝气强度在0.6 L · min-1,好氧段DO浓度维持在0.3~0.6 mg · L-1.
当氨氮去除率达到90%以上并稳定运行时取样.取样时间点选择在每周期曝气开始后0.5 h.
2.2 HAO粗酶的提取取25 mL泥水混合液,在4000 r · min-1离心3 min(J-26XP贝克曼高速冷冻离心机,美国贝克曼库尔特有限公司生产),倾去上清液,沉淀用缓冲液(50 mmol · L-1 Tris-HCl,pH 7.8,5 mmol · L-1 MgCl2)定容到25 mL,再次离心3 min,倾去上清液,此步骤重复一次.沉淀备用定容至25 mL后,破碎细胞.4 ℃条件下,40000×g 冷冻离心30 min,上清液于4 ℃条件下贮存备用.
2.3 细胞破碎方法超声法:用BILON92-II超声波细胞粉碎机(上海比朗仪器有限公司)于0 ℃的冰-水混合水浴中破碎细胞,调节输出功率200 W,工作3 s,间歇3 s,破碎次数分别设定为30次、60次、99次.
压力细胞破碎法:在4 ℃条件下用JN-02低温超高压连续细胞破碎仪(广州聚能生物科技有限公司)破碎,设定压力50、110、160 MPa,分别破碎1、2、3次.
超声与裂解液结合法:洗涤后的沉淀加细胞裂解液(50 mmol · L-1Tris-HCl(pH 7.5),10%蔗糖,300 mmol · L-1 NaCl,90 mmol · L-1 EDTA)2 mL、5 mL、10 mL,10 min后,缓冲液定容至25 mL后进行破碎,方法同超声法.
压力与裂解液结合法:洗涤后的沉淀加细胞裂解液2 mL、5 mL、10 mL,10 min后,缓冲液定容至25 mL后进行破碎,方法同压力细胞破碎法.
2.4 破碎效果评价用ND-2000微量分光光度计(美国Nanodrop科技有限责任公司)测定破碎后混合液中的DNA含量,将DNA含量高低作为衡量细胞破碎的程度的指标.
2.5 HAO酶活性测定(1)酶活力测定原理:根据HAO酶的氧化还原特性,本实验以铁氰化钾为电子受体,以羟胺为电子供体.羟氨氧化还原酶的活性在400 nm处以铁氰化钾的还原量来计算酶活性.
(2)酶活性单位定义:25 ℃,pH 8.0条件下每分钟还原1 μmol K3Fe(CN)6的酶量为一个酶单位.按下式计算HAO酶的活性(U · mL-1),摩尔吸光系数ε为1 L · mol-1 · cm-1.
酶活性:A =400/[ε·b×t]×VL/V×B 式中,t为时间(min),VL为测定液体积(mL),V为酶液体积(mL),B为稀释倍数,b为比色血宽度(1 cm).
(3)酶活力测定步骤:取4 mL反应混合液放入试管中,加入适量酶提取液,立即混匀并计时,25 ℃恒温水浴仪(北京市永光明医疗仪器有限公司)中准确保温一定时间;反应完成后立即加入2 mL终止剂终止酶反应.室温放置5 min后,UV-2600A分光光度计(龙尼柯(上海)仪器有限公司)于400 nm处测定吸光度;空白对照管先加入2 mL反应终止剂,再加酶液.
2.6 测定方法粗酶液中总蛋白质含量测定:Bradford法(Bradford,1976); DNA含量:微量分光光度法;酶活性测定:分光光度法.
2.7 酶活力测定方法的优化(1)酶反应液电子受体与供体比的选定:选择电子受供比1 : 4、1 : 2、1 : 1、2 : 1、4 : 1,分别取5组平行样.
(2)反应终止剂的选择:选用20%三氯乙酸及2 mol · L-1 HCl,分别取5组平行样.
2.8 实验数据处理多组平行试验结果均以平均值±标准差(±SD)来表示,组间比较采用SPSS13.0 软件进行单因素或多因素方差分析.
3 结果与分析(Result and analysis) 3.1 不同方法的破壁效果HAO为细胞膜外周质酶,能否完全将菌体细胞壁破碎是该酶提取的首要因素.本研究探讨了五种不同的破壁方法,用微量分光光度计测定DNA含量确定破壁效果,同时测定酶活力.
首先对超声法同一功率下超声破碎次数对破碎效果影响进行实验,结果见表 1所示.
| 表1 超声处理次数对污泥破壁的效果 Table 1 Effect of ultrasonic treatment times on cell disruption |
从表 1可知,超声破碎次数增加,DNA含量增加,提取的粗蛋白含量增加,HAO酶活增大,说明细胞破碎程度提高.单因素方差分析表明,破碎30次DNA及蛋白质量均明显小于60次和99次(p<0.05),但是酶活与60次无明显差异,与99次相比明显偏小(p<0.05),为了缩短实验时间及更好的保存酶活性,选择破碎30次进行后续实验.
表 2 是化学渗透对细菌细胞破碎效果的影响.从表 2可知,添加细胞裂解液后,酶活性及DNA比未加的条件下(表 1所示)增加近5倍及多至十几倍.从DNA结果来看,加5 mL和10 mL裂解液没有差异(p>0.05);酶活和蛋白质5 mL条件均显著小于10 mL及25 mL条件(p<0.05).但研究过程发现添加10 mL及更多裂解液时,用Br and ford法测定蛋白质容易产生沉淀,在此种情况下,用分光光度计测定蛋白质比较耗时,读数不稳定.
| 表2 化学渗透处理对污泥破壁的效果 Table 2 Effect of chemical lysis on cell disruption |
基于上述超声次数和裂解液用量对细胞破碎效果的影响,研究进一步探讨超声、压力及裂解液相互结合对破碎效果的影响,以便找出耗时短、破碎效果好的破碎方法.图 2是不同破碎条件下,破碎次数和裂解液对细胞破碎效果的影响.
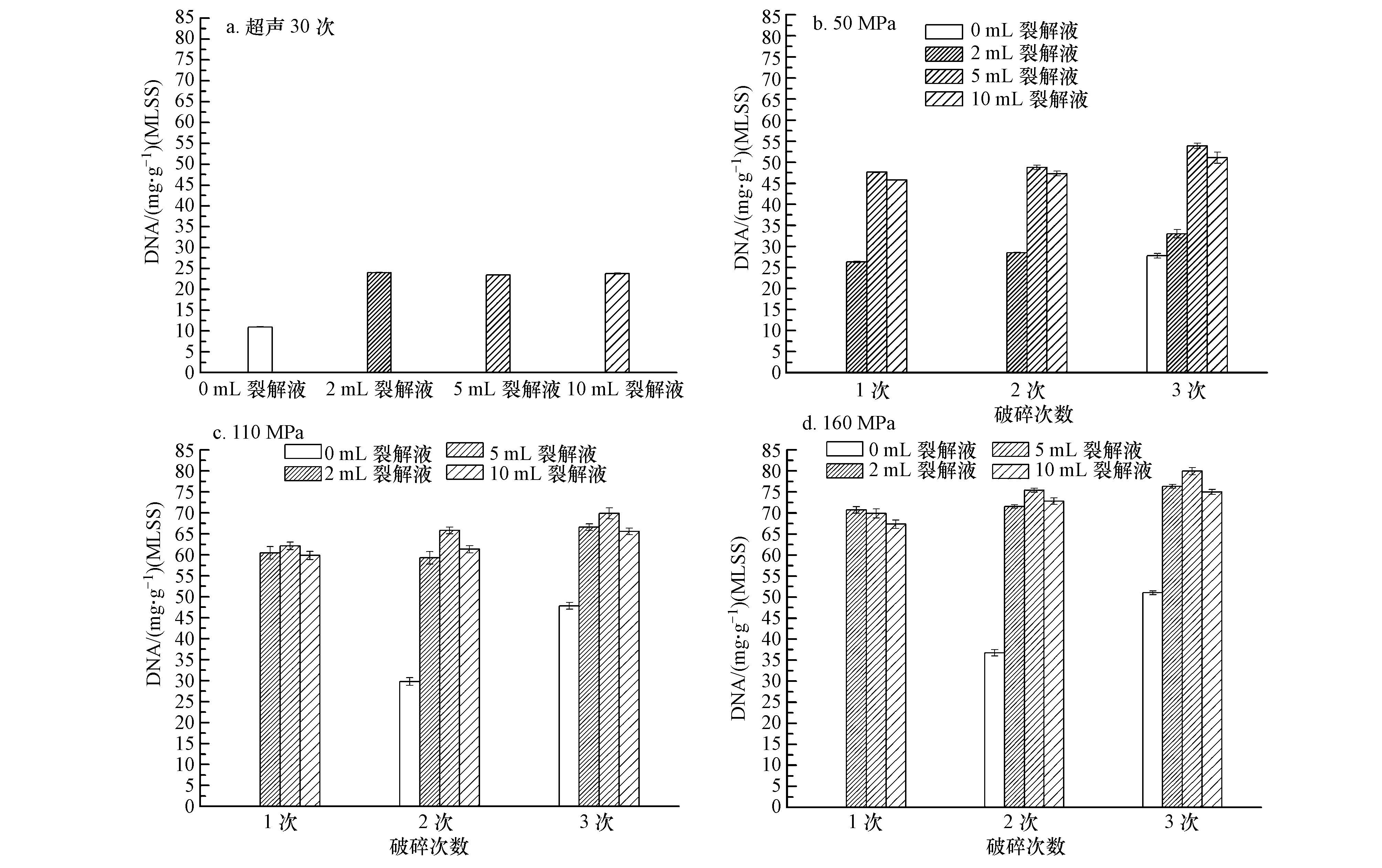 |
| 图2 不同破壁条件下,处理次数和裂解液对污泥破碎效果的影响(污泥以mL计) Fig.2 Effects of treating times and lysate on cell disruption using different methods |
从图 2可以看出,用细胞破碎仪破碎细胞效果明显比超声破碎细胞效果要好;无论是超声还是细胞破碎仪,加裂解液细胞破碎效果较不加的要好.
对3种压力下的DNA结果经多因素方差分析(0 mL未参与分析),F(8,26)=7.281(p<0.01),说明压力、破碎次数及裂解液用量均对破碎效果有极其显著的影响.随着细胞破碎仪破碎压力、次数增大,破碎效果增强;2 mL与5 mL裂解液之间破碎效果有显著差异(p<0.05),而2 mL与10 mL、5 mL与10 mL裂解液之间之间破碎效果没有显著差异(p>0.05).从图中能看出,160 MPa条件下,加5 mL裂解液破碎3次效果是最好的.
3.2 酶活测定方法优化结果在HAO酶活测定过程中,电子受供比和终止剂的选择对酶活力测定影响较大,因此,本研究进行了电子受供比和终止剂对酶活测定影响的研究.结果如下.
3.2.1 酶反应液电子受体与供体比的选定不同微生物菌种、不同的生长环境,HAO的活性高低不尽相同,在以往HAO研究电子受供比1 : 2(Otte et al., 1999)、≥4(Yamanaka and Sakano et al.,1980)、5 : 2(Jetten et al., 1997b)等的基础上,做了表 3所示的电子受供比实验.以确定适合污水脱氮处理工艺HAO酶活研究的配比.取5组试样进行测定.结果见表 3.
| 表3 不同电子受体与供体比下测定的HAO酶活性 Table 3 HAO activities determined under different ratios of electron donor to receptor |
在一定条件下,底物浓度饱和时,酶反应速度与酶浓度呈正比,当底物(不论K3[Fe(CN)6]还是NH2OH)浓度受限时,均会影响酶活性的测定结果.
表 3的结果表明,受供比1 : 4、1 : 2的酶反应液中由于受体K3[Fe(CN)6]不足,在短时间内吸光值减小的幅度很大.对测试样品数目较多的过程不适用.而受供比2 : 1、4 : 1条件下,同样反应时间内,受体K3[Fe(CN)6]剩余量较多.这4种受供比反应后不太适宜用分光光度计测定,因此宜选用电子受供比1 : 1的酶反应液做酶活性测试,本研究用这一受供比也获得了较其他条件下的最大酶活性(0.368±0.012 U · mL-1).
当然,这一配比适用于HAO粗酶测定,若是经过纯化后的HAO,适合的受供比需要进行实验来进一步确定.
3.2.2 反应终止剂与加热酶失活方法相比,用酸碱让酶失活更易操作和节省时间,本研究中受体K3Fe(CN)6在碱性条件下不稳定,因此实验选取20%三氯乙酸和2 mol · L-1 HCl作为HAO酶活性反应的终止剂,选用电子受供比1 : 1的酶反应液.取5组试样进行测定.结果见表 4.
| 表4 反应终止剂对HAO活性测定的影响 Table 4 The effects of different reaction termination reagent on HAO activity |
从表 4数据可知,20%三氯乙酸与2 mol · L-1 HCl作为HAO酶反应终止的试剂,酶活测定值经单因素方差分析,无显著性差异(p>0.05).通过测试两者的pH,20%三氯乙酸(pH 1.8)溶液酸性极强,文献(Yamanaka and Sakano et al.,1980; Jetten et al., 1997b; Otte et al., 1999)中采用它作为HAO酶反应终止剂.铁氰化钾遇强酸时产生剧毒的氰化物,从减少环境污染和操作安全的角度,宜选用酸性较弱的2 mol · L-1 HCl溶液作为反应终止剂.
3.3 不同破碎条件下,裂解液和破碎次数对测定HAO酶活性的影响从图 3可以看出,在不同压力条件下,用细胞破碎仪破碎细胞2次、3次的HAO酶活明显比超声条件下酶活要高;加裂解液破碎后HAO酶活要比不加裂解液的HAO酶活高.
 |
| 图3 不同破碎条件下,破碎次数和裂解液对获得的HAO酶测定活性的影响 Fig.3 Effects of treating times and lysate on the activity of crude HAO obtained using different cell disruption methods |
对3种压力下的酶活结果经多因素方差分析(0 mL未参与分析),F(8,26)=2.718(p<0.01),说明压力、破碎次数及裂解液用量均对酶活有极其显著的影响.只看压力变化时,两两压力之间酶活无差异(p>0.05);破碎2次与1次之间酶活有极其显著差异(p<0.01),而破碎2次与3次之间酶活无差异(p>0.05).
在不同的压力条件下,均是加5 mL裂解液的HAO酶活性要高(与10 mL比无差异(p>0.05)),加10 mL裂解液后酶活反而降低,原因可能是细胞裂解液中含有EDTA,而HAO的活性位点由c型亚铁血红素和血红素P460构成(Hooper et al., 1997),较多的裂解液加入影响了HAO的活性.
从图中看出,160 MPa条件下,加5 mL裂解液破碎细胞2次有最高的HAO酶活力.
3.4 破碎方法、裂解液和破碎次数对HAO酶比活力的影响酶的比活力(specific activity)也就是酶含量的大小,即每毫克蛋白所具有的酶活力.酶的比活力在酶学研究中用来衡量酶的纯度,对于同一种酶来说,比活力越大,酶的纯度越高
从图 4可以看出,超声条件下,酶的比活力比细胞破碎仪破碎细胞酶比活要高;超声条件下,随着裂解液增多,酶比活力有所增大,但是增加幅度很小.
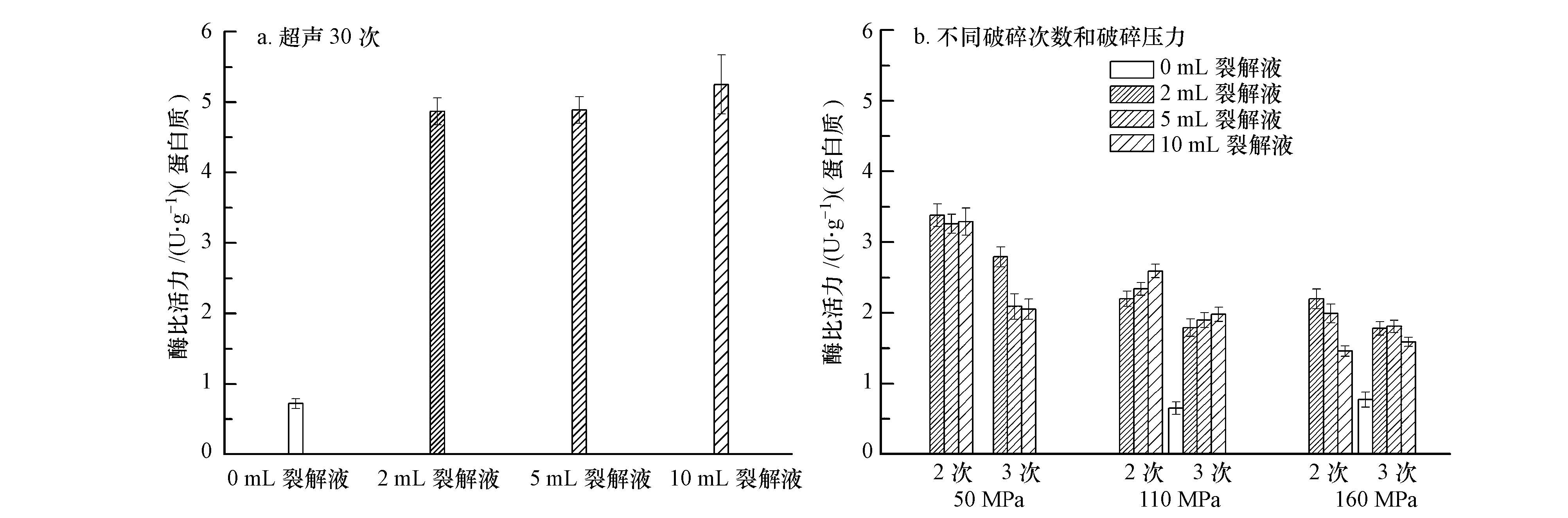 |
| 图4 不同破碎条件下,破碎次数和裂解液对获得的HAO酶的比活力的影响 Fig.4 Effects of treating times and lysate on the specific activity of crude HAO obtained using different cell broken methods |
对3种压力下破碎2次、3次的酶比活力结果经多因素方差分析(0 mL未参与分析),F(4,17)=16.262(p<0.01),说明压力、破碎次数及裂解液用量均对酶比活力有极其显著的影响.不同压力下酶比活力有极其显著差异(p<0.01);破碎2次与3次之间酶比活力有极其显著差异(p<0.01),压力与次数相同的条件下,不同裂解液用量组间酶比活力无差异(p>0.05).
随着细胞破碎仪破碎压力增大,HAO酶比活力减小,说明压力增大后,细胞破碎效果增强,有更多的蛋白从细胞中溶出,而HAO酶的量则没有随之增加,分析原因可能是瞬间高压产生热量破坏了HAO及其活性.
综上所述,160 MPa条件下,加5 mL裂解液破碎3次效果是最好的,该条件下破碎细胞2次有最高的HAO酶活力,但是从酶比活力看,该条件下破碎2次和3次的酶比活力均比110 MPa加裂解液5 mL破碎2次要低(p<0.01),因此综合DNA、酶活力和酶比活力考虑,110 MPa加裂解液5 mL破碎2次更适合污水生物处理中HAO的研究,既节省时间,又能较好的保持酶活性.
4 结论(Conclusions)1)压力、破碎次数及裂解液用量对脱氮活性污泥粗提液中DNA、HAO酶活力及酶比活力均有极其显著的影响(p<0.01).
2)无论是超声还是细胞破碎仪破碎细胞,加裂解液破碎效果比不加要好(DNA含量高),有较高的酶活力(超3~7倍).随着细胞破碎仪破碎压力增大,破碎效果增强,160 MPa条件下,加5 mL裂解液破碎3次效果是最好的.
3)对相同提取条件下提取的粗酶液,酶活反应液电子受体供体之比为1 : 1时,分光光度法可获得较高的酶活力.
4)酶反应终止剂宜选用2 mol · L-1 HCl溶液.
5)综合DNA含量、酶活力及酶比活力考虑,110 MPa加裂解液5 mL破碎2次更适合污水生物处理中HAO的研究,既节省时间,又能较好的保持酶活性.
| [1] | Arciero D M, Hooper A B. 1993. Hydroxylamine oxidoreductase from Nitrosomonas europaea is a multimer of an Octa-heme subunit[J]. The Journal of Biological Chemistry, 268(20):14645-14654 |
| [2] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72(1/2):248-254 |
| [3] | Hooper A B, Vannelli T, Bergmann D J, et al. 1997. Enzymology of the oxidation of ammonia to nitrite by bacteria[J]. Antonie van Leeuwenhoek, 71(1/2):59-67 |
| [4] | Hoppert M, Mahony T J, Mayer F, et al. 1995. Quaternary structure of the hydroxylamine oxidoreductase from Nitrosomonas europaea[J]. Archives of Microbiology, 163(4):300-306 |
| [5] | IPCC. 1996. Climate Change 1995:the Science of Climate Change:Contribution of Working Group I to the Second Assessment Report of the Intergovernmental Panel on Climate Change[M]. Cambridge:Cambridge University Press. 21-24 |
| [6] | Jetten M S M, Logemann S, Muyzer G, et al. 1997a. Novel principles in the microbial conversion of nitrogen compounds[J]. Anthonie van Leeuwenhoek, 71(1/2):75-93 |
| [7] | Jetten M S M, De Bruijn P, Kuenen J G. 1997b. Hydroxylamine metabolism in Pseudomonas PB16:involvement of a novel hydroxylamine oxidoreductase[J]. Antonie van Leeuwenhoek, 71(1/2):69-74 |
| [8] | Kampschreur M J, Van Der Star W R L, Wielders H A, et al. 2008. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment[J]. Water Research, 42(3):812-826 |
| [9] | Kampschreur M J, Temmink H, Kleerebezem R, et al. 2009. Nitrous oxide emission during wastewater treatment[J]. Water Research, 43(17):4093-4103 |
| [10] | Kurokawa M, Fukumori Y, Yamanaka T. 1985. A hydroxylamine-cytochrome C reductase occurs in the heterotrophic nitrifier Arthrobacter globiformis[J]. Plant and Cell Physiology, 26(7):1439-1442 |
| [11] | 刘婧晶,袁林江,何志仙. 2014. A/O-SBR中羟胺氧化酶活性变化与N2O的产生[J].中国给水排水, 30(9):27-31 |
| [12] | 刘秀红,杨庆,吴昌永,等. 2006.不同污水生物脱氮工艺中N2O释放量及影响因素[J].环境科学学报, 26(12):1940-1947 |
| [13] | Moir J W B, Wherfritz J M, Spiro S, et al. 1996. The biochemical characterization of a novel non-haem-iron hydroxylamine oxidase from Paracoccus denitrificans GB17[J]. The Biochemical Journal, 19(Pt 3):823-827 |
| [14] | 南亚萍,袁林江,何志仙,等. 2012.生物除磷过程中活性污泥聚磷酶活性的变化[J].中国给水排水, 28(9):26-29 |
| [15] | Ono Y, Makino N, Hoshino Y, et al. 1996. An iron dioxygenase from Alcaligenes faecalis catalyzing the oxidation of pyruvic oxime to nitrite[J]. FEMS Microbiology Letters, 139(2/3):103-108 |
| [16] | Otte S, Schalk J, Kuenen J G, et al. 1999. Hydroxylamine oxidation and subsequent nitrous oxide production by the heterotrophic ammonia oxidizer Alcaligenes faecalis[J]. Applied Microbiology and Biotechnology, 51(2):255-261 |
| [17] | Richardson D, Felgate H, Watmough N, et al. 2009. Mitigating release of the potent greenhouse gas N2O from the nitrogen cycle-could enzymic regulation hold the key[J]. Trends in Biotechnology, 27(7):388-397 |
| [18] | Shimamura M, Nishiyama T, Shinya K, et al. 2008. Another multiheme protein, hydroxylamine oxidoreductase, abundantly produced in an anammox bacterium besides the hydrazine-oxidizing enzyme[J]. Journal of Bioscience and Bioengineering, 105(3):243-248 |
| [19] | Tallec G, Garnier J, Billen G, et al. 2006. Nitrous oxide emissions from secondary activated sludge in nitrifying conditions of urban wastewater treatment plants:Effect of oxygenation level[J]. Water Research, 40(15):2972-2980 |
| [20] | 王亚宜,周东,赵伟,等. 2014.污水生物处理实际工艺中氧化亚氮的释放:现状与挑战[J].环境科学学报, 34(5):1079-1088 |
| [21] | Wehrfritz J M, Reilly A, Spiro S, et al. 1993. Purification of hydroxylamine oxidase from Thiosphaera pantotropha:Identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification[J]. FEBS Letters, 335(2):246-250 |
| [22] | Wehrfritz J -M, Carter J P, Spiro S, et al. 1996. Hydroxylamine oxidation in heterotrophic nitrate-reducing soil bacteria and purification of a hydroxylamine-cytochrome C oxidoreductase from a Pseudomonas species[J]. Archives of Microbiology, 166(6):421-424 |
| [23] | Wunderlin P, Mohn J, Joss A, et al. 2012. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions[J]. Water Research, 46(4):1027-1037 |
| [24] | Yamanaka T, Sakano Y. 1980. Oxidation of hydroxylamine to nitrite catalyzed by hydroxylamine oxidoreductase purified from Nitrosomonas europaea[J]. Current Microbiology, 4(4):239-244 |
| [25] | Zahn J A, Duncant C, Dispirito A A. 1994. Oxidation of hydroxylamine by cytochrome p-460 of the obligate methylotroph methylococcus capsulatus Bath[J]. Journal of Bacteriology, 176(19):5879-5887 |
| [26] | Zhang S M, Li W G, Zhang D Y, et al. 2014. Purification and characterization of a low-temperature hydroxylamine oxidase from heterotrophic nitrifier Acinetobacter sp. Y16[J]. Biomedical and Environmental Sciences, 27(7):515-522 |
 2015, Vol. 35
2015, Vol. 35


