磺胺类药物最早用于人类疾病的治疗,目前大部分磺胺类药物作为兽药用于动物疾病的治疗,或以低剂量作为生长促进剂添加到动物饲料中(McArdell et al., 2003).磺胺嘧啶(Sulfadiazine,SD)和磺胺甲恶唑(Sulfamethoxazole,SMZ)是2种使用量较大的磺胺类药物,在水产养殖、动物饲养等方面广泛使用.由于磺胺类药物不能被完全代谢,常以母体或代谢物形式通过动物粪便和尿液排出并进入土壤,造成在土壤中的残留(Kümmerer,2009).土壤中有机物污染物残留形态可分为2种,一种是可提取态,包括水溶态和有机溶剂提取态,这一部分形态的生物活性比较高,可直接对生物和环境产生影响;另一部分是结合态,则难以被利用.结合态大大增强了污染物在土壤中的持久性(Fuhr and Mittelstaedt, 1980; Dec et al., 1997).磺胺类药物在土壤中的残留形态不同,其环境效应也不同.研究表明,当环境条件改变或由于微生物作用时,污染物结合态会转化为可提取态重新释放到环境中,造成迟发性威胁(Khan and Ivarson, 1981).
根系分泌物(Artificial Root Exudates,ARE)包括糖类、氨基酸、有机酸等化合物,可增加土壤中有机质含量,影响土壤理化性质和微生物数量及活性,促进微生物对土壤污染物的分解和转化.研究表明,在土壤中添加有机物可促进结合态的形成(Doyle et al., 1998).本试验以磺胺嘧啶(SD)和磺胺甲恶唑(SMZ)为代表,通过添加模拟根系分泌物(ARE)营造根系环境,研究其在土壤中的残留形态及相互转化规律,掌握磺胺类药物在根际环境中的化学行为,以期为土壤中磺胺类药物污染的风险评价和制定污染土壤生态修复措施提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 供试土壤土壤采自河南师范大学生物园表层土(0~20 cm),属于未受任何化学品污染的洁净土壤,15~20 ℃风干,过1 mm筛后备用.土壤样品的基本性质如下:pH 6.31;阳离子交换量12.26 cmol · kg-1;TP(总磷)0.04 mg · kg-1;TK(总钾)0.18 mg · kg-1;有机质1.65%;粘粒13.4%;粉粒24.2%. 2.1.2 药品与试剂 磺胺嘧啶(SD)和磺胺甲恶唑(SMZ)原药(白色结晶,纯度为99.0%,美国Sigma公司);荧光胺(纯度>99.0%,Alfa Aesar公司);甲醇、乙腈、丙酮(色谱纯,美国Fisher公司);冰乙酸、二氯甲烷、盐酸(优级纯);氯化钙、氢氧化钠、无水硫酸钠(分析纯);实验用水为高纯水.
2.1.3 仪器Waters高效液相色谱仪;Waters 2475荧光检测器(Waters,Singapore);Waters 1525 Binary溶剂输送泵(Waters,Singapore);Anke TDl-60B离心机;PHS-3C型pH计;ZD-85型气浴恒温振荡器;CX-100型超声波清洗器;SE812型氮吹仪;RE-2000A旋转蒸发仪.
2.2 土壤处理方法土壤中药物的初始浓度设为0、2、5、10mg · kg-1.在自然光照下土样置于培养皿内培养,每天浇5 mL模拟根系分泌物储备液(T-ARE)或去离子水使土壤水分维持在田间最大含水量的60%.分别于试验第7、14、28、42、63 d取样测定SD和SMZ各形态浓度,同时设置不添加ARE的对照处理(T-CK),每组试验均设3次重复.ARE储备液由葡萄糖(20 mmol · L-1)、果糖(20 mmol · L-1)、蔗糖(20 mmol · L-1)、丁二酸(10 mmol · L-1)、苹果酸(10 mmol · L-1)、丝氨酸(5 mmol · L-1)、精氨酸(5 mmol · L-1)和半胱氨酸(5 mmol · L-1)组成(Joner et al., 2002).
2.3 样品提取方法形态分为水溶态、有机溶剂提取态和结合态,参照Mordaunt等(2005)采用的连续振荡提取法提取.
2.4 色谱分析方法与质量控制SunFire C18分析柱(150 mm×4.6 mm,5 μm),保护柱(C18,4.6 mm×20 mm,5 μm);流动相:0.5%冰乙酸-乙腈(体积比为60 ∶ 40);激发波长:405 nm,检测波长:495 nm;进样量20 μL;流速:1 mL · min-1;柱温:35 ℃.配制浓度范围为0.05~5 mg · L-1混合标准溶液,样品衍生化后供HPLC测定,并绘制标准曲线,可决系数R2均大于0.999.采用加标法测定回收率和检测限,在0.5~10 mg · kg-1添加浓度下回收率为86.5%~94.6%,变异系数小于6.4%,检测限为1.0~2.3 μg · kg-1.
3 结果与分析(Result and analysis) 3.1 磺胺类药物在土壤中的形态转化 3.1.1 土壤中的磺胺类药物形态随时间的变化土壤中磺胺类药物的形态可分为3种:水溶态、有机溶剂提取态和结合态.由图 1可知,在T-CK和T-ARE中,2种磺胺类药物水溶态所占比例均较低,仅为0.6%~7.3%.SD水溶态所占比例随培养时间延长呈减小趋势(10 mg · kg-1浓度除外).例如,在浓度为5 mg · kg-1T-CK中,SD水溶态在7、14、28、42 d和63 d时所占比例分别为4.6%、4.8%、2.2%、1.0%和1.7%;在同一浓度T-ARE中则分别为2.9%、2.7%、3.2%、2.3%和1.9%.一方面可能由于水溶态较易被微生物所利用,在土壤中降解速率快,另一方面可能由于水溶态被土壤粘土矿物吸附或与有机质通过螯合作用等发生形态转化(Lertpaitoonpan et al., 2009),因此,水溶态所占比例呈下降趋势.SMZ水溶态所占比例随培养时间变化趋势不明显.
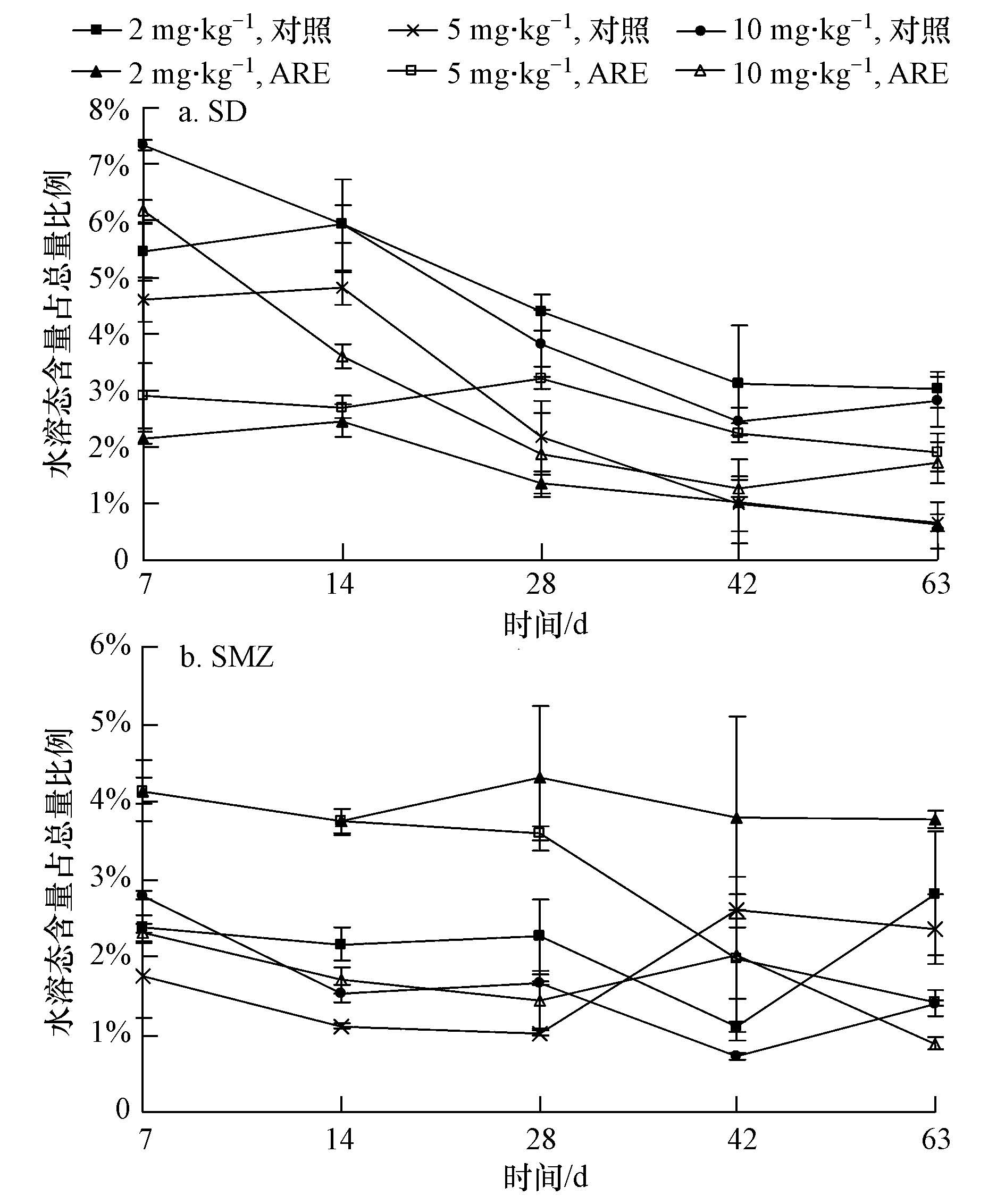 |
| 图1 不同土壤中水溶态所占比例随时间的变化 Fig.1 Proportion of water soluble residues in different soils with the time |
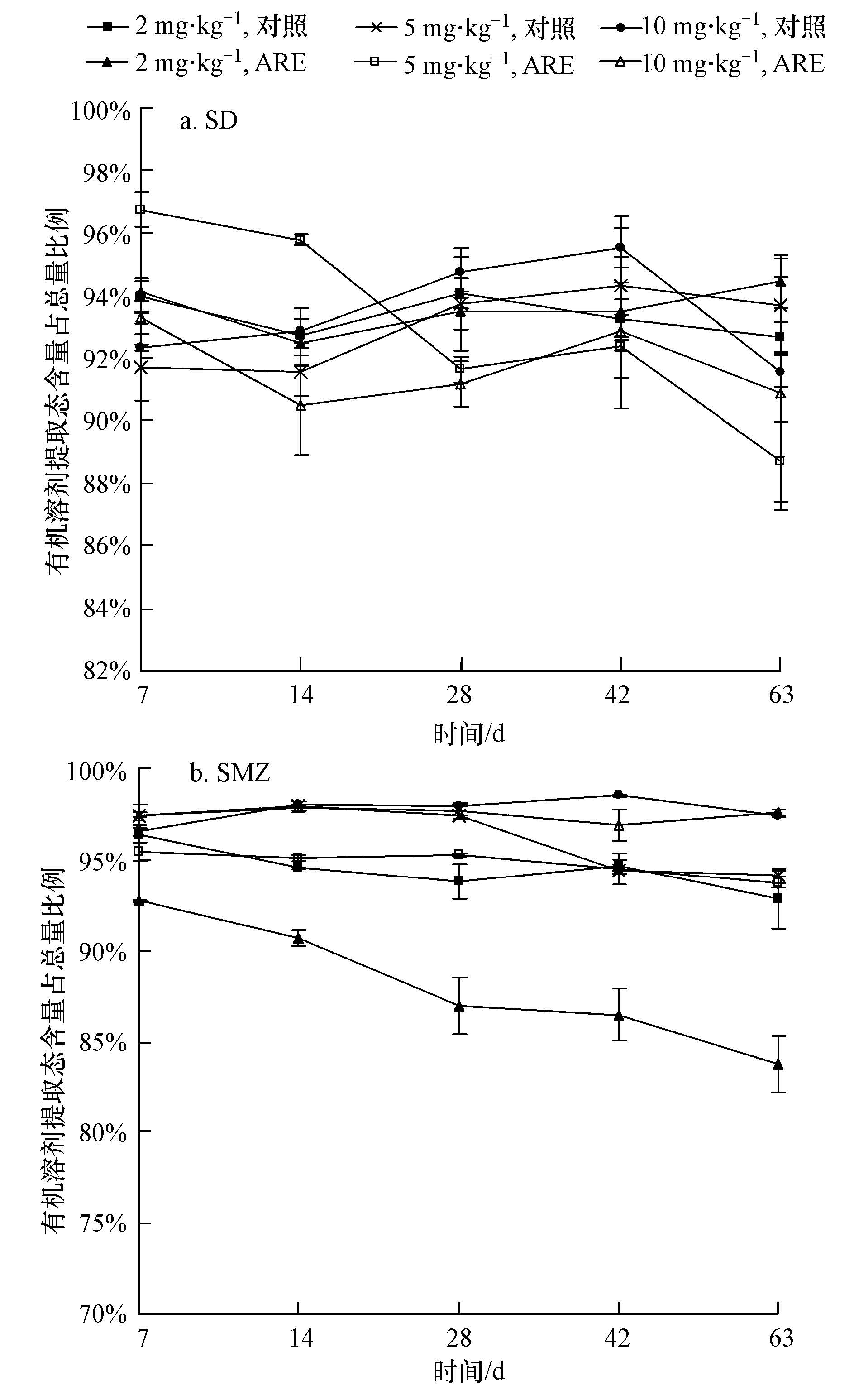 |
| 图2 不同土壤中有机溶剂提取态所占比例随时间的变化 Fig.2 Proportion of organic solvent extractable residues in different soils with the time |
由图 2可知,有机溶剂提取态所占比例较大,在86.5%~98.5%之间,是SD和SMZ在土壤中的主要存在形态.由于SD和SMZ是极性疏水性物质,在甲醇等有机溶剂中的溶解度较大,这可能是其含量占总量比例较大的原因之一.SMZ有机溶剂提取态所占比例随培养时间延长呈下降趋势(10 mg · kg-1浓度除外).例如,在浓度为2 mg · kg-1 T-CK中,SMZ有机溶剂提取态在7、14、28、42 d和63 d所占比例分别为96.4%、94.5%、93.8%、94.7%和91.2%;在同一浓度T-ARE中则分别为92.7%、90.7%、86.9%、86.5%和91.2%.这可能是由于随着降解的发生,SMZ有机溶剂提取态转化为其它形态,或直接被降解,因此,其比例随培养时间延长呈下降趋势.SD有机溶剂提取态所占比例随培养时间变化趋势不明显.
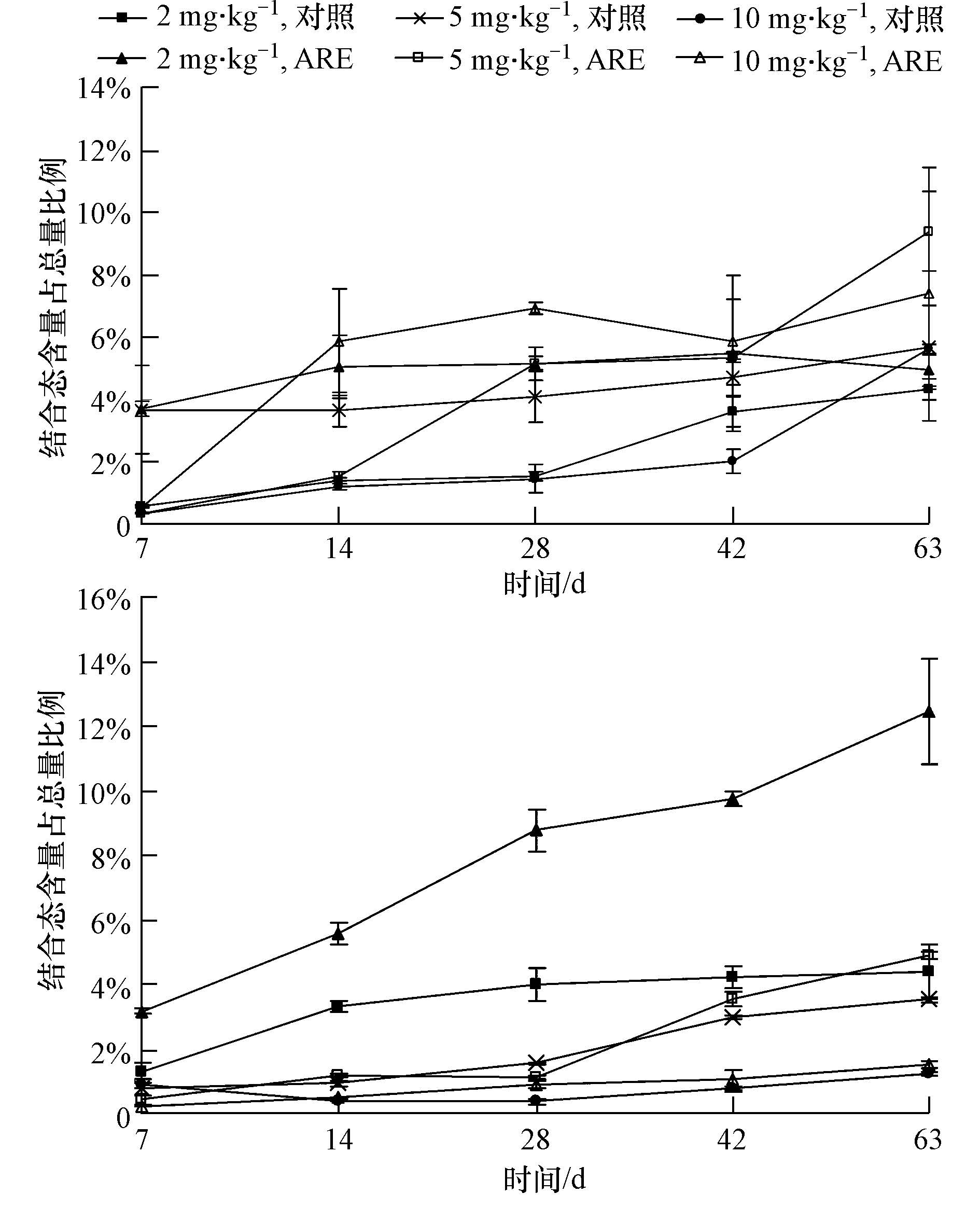 |
| 图3 不同土壤中结合态所占比例随时间的变化 Fig.3 Proportion of bound residues in different soils with the time |
由图 3可知,结合态所占比例较小,在0.1%~12.5%之间,且随培养时间延长呈增加趋势.例如,在SD浓度为10 mg · kg-1T-CK中,在各取样期其结合态含量分别占总量的0.3%、1.2%、1.6%、2.0%和5.6%.这可能是由于磺胺类药物与土壤组分间作用力随时间增加而增强,从而降低了污染物的生物有效性,增加了土壤中结合态的量.结合态的形成一方面是由于污染物吸附在土壤粘土矿物颗粒上,继而扩散至土壤空间结构(如微孔)中或被土壤矿物晶格所捕获(Nam et al., 1998);另一方面由于土壤有机质主要结构单元包括芳香杂环、氨基酸、多糖、蛋白质等,含有大量官能团包括羧酸、酚类和酯类等(Gevao et al., 2000),吸附在土壤中的污染物与有机质通过共价键、表面配位螯合等作用形成结合态(曾跃春等,2009).在中性或pH较高的条件下,磺胺类药物会以阴离子形式出现,如在中性条件下,超过50% 的SD(pKa2=6.5)去质子化以阴离子形式存在,通过离子键等作用与腐殖质中的羧基、酚羟基发生作用形成结合态(Gevao et al., 2000).另外,微生物也可能是导致结合态形成的原因之一.张连仲(1986)研究溴氰菊酯在土壤中结合残留态形成的过程中发现,好气条件下,溴氰菊酯结合态量随时间增加而增加,土壤中细菌和放线菌总量增加了3倍,而对照中细菌和放线菌总量基本保持不变,说明某些细菌和放线菌在有机物结合态形成的过程中起了积极作用.
另外,在T-ARE中,SD结合态形成量大于SMZ(p<0.05).例如,在10 mg · kg-1浓度作用下,63 d时SMZ结合态含量为0.025 mg · kg-1,SD结合态含量为0.146 mg · kg-1,约是SMZ结合态含量的5.8倍.这可能是因为SD与土壤中有机质或粘土矿物的结合能力较SMZ强.结合表 1,由于结合态不易被降解,SD结合态形成量高于SMZ,这可能也是SMZ比SD降解快的原因之一.
3.1.2 ARE对土壤中磺胺类药物形态转化的影响由图 3可知,2种磺胺类药物在T-ARE中结合态所占比例总体上要高于T-CK.例如,在10 mg · kg-1浓度作用下,28 d时SD和SMZ在T-CK中结合态所占比例分别为1.5%和0.4%,而在T-ARE中结合态所占比例分别为6.9%和0.9%.T-ARE中SD和SMZ结合态所占比例约是T-CK的1~7倍.大量研究表明,化合物易吸附于土壤有机质中,土壤有机质含量增加可以增大化合物在土壤中的吸附量,有利于结合态的形成(郭欣妍等,2013; 孔晶晶等,2008).ARE包含多种糖类和氨基酸等物质,在土壤中添加ARE,增加了土壤中有机质含量,导致土壤理化性质发生变化,化合物吸附在土壤颗粒或有机质中的作用力增强,有利于结合态的形成.外源有机物的重复施用也会增加土壤中结合态的形成(Samuel and Pillai, 1991),由于ARE的添加是每天进行的,这也可能是污染物在T-ARE中形成结合态较多的原因之一.
ARE的添加也会影响SD和SMZ水溶态及有机溶剂提取态的转化.由图 1可知,T-CK SD水溶态所占比例总体上大于T-ARE.在2 mg · kg-1浓度作用下,63 d时T-CK SD水溶态所占比例为4.5%,而T-ARE仅为0.6%.这可能是由于土壤微生物对磺胺类药物的降解首先利用的是易于降解的水溶态,ARE的添加提高了土壤中微生物的活性,增强了对磺胺类药物的降解能力.因此,T-ARE微生物对水溶态的利用率要高于T-CK,从而导致T-CK水溶态所占比例较T-ARE高.同时也可能是由于土壤中水溶态磺胺类药物易于被ARE吸附向其他形态发生转化.SD和SMZ有机溶剂提取态的含量较高,性质也相对稳定,受ARE的影响较小.
3.2 磺胺类药物在土壤中的降解性3.2.1磺胺类药物在土壤中残留量随时间的变化 T-ARE和T-CK SD和SMZ的降解情况如图 4所示.由图 4可知,在试验条件下,2种磺胺类药物在T-ARE和T-CK中的降解均较明显,且规律相似,其残留浓度均随时间的增加而降低.在同一时间和浓度下,SD和SMZ在T-ARE中的残留量低于T-CK.浓度为2 mg · kg-1T-CK,SD在63 d时的浓度仅为0.347 mg · kg-1,降解率可达83.2%;而浓度为2 mg · kg-1 T-ARE,SD在63d时的浓度仅为0.211 mg · kg-1,降解率达到89.4%.这可能是由于进入土壤中的磺胺类药物发生可逆转化如乙酰化作用或生物降解等造成在土壤中的残留量减少.
3.2.2 磺胺类药物在土壤中的降解动力学采用一级动力学方程(李松林等,2009)描述磺胺类药物在不同土壤中的降解,即:

由表 1可知,2种磺胺类药物在土壤中的降解速率常数为0.0218~0.0495d-1,半衰期为14.0~31.8 d,可决系数为0.9273~0.9963,这与先前相关文献报道结果一致(10~30 d)(Wang et al.,2006; Kay et al., 2004).在同一浓度下,SD和SMZ在T-ARE中降解速率大于T-CK.2mg · kg-1浓度下,在T-ARE 中SD降解速率常数为0.0343 d-1;而在T-CK中仅为0.0277 d-1.这可能是由于ARE富含葡萄糖、蔗糖等多种有机物,ARE的添加增加了土壤中有机质含量,改变了土壤的理化性质,创造出更适宜微生物生存的土壤条件,从而进一步促进了微生物的生长繁殖活动,提高了微生物的降解能力.
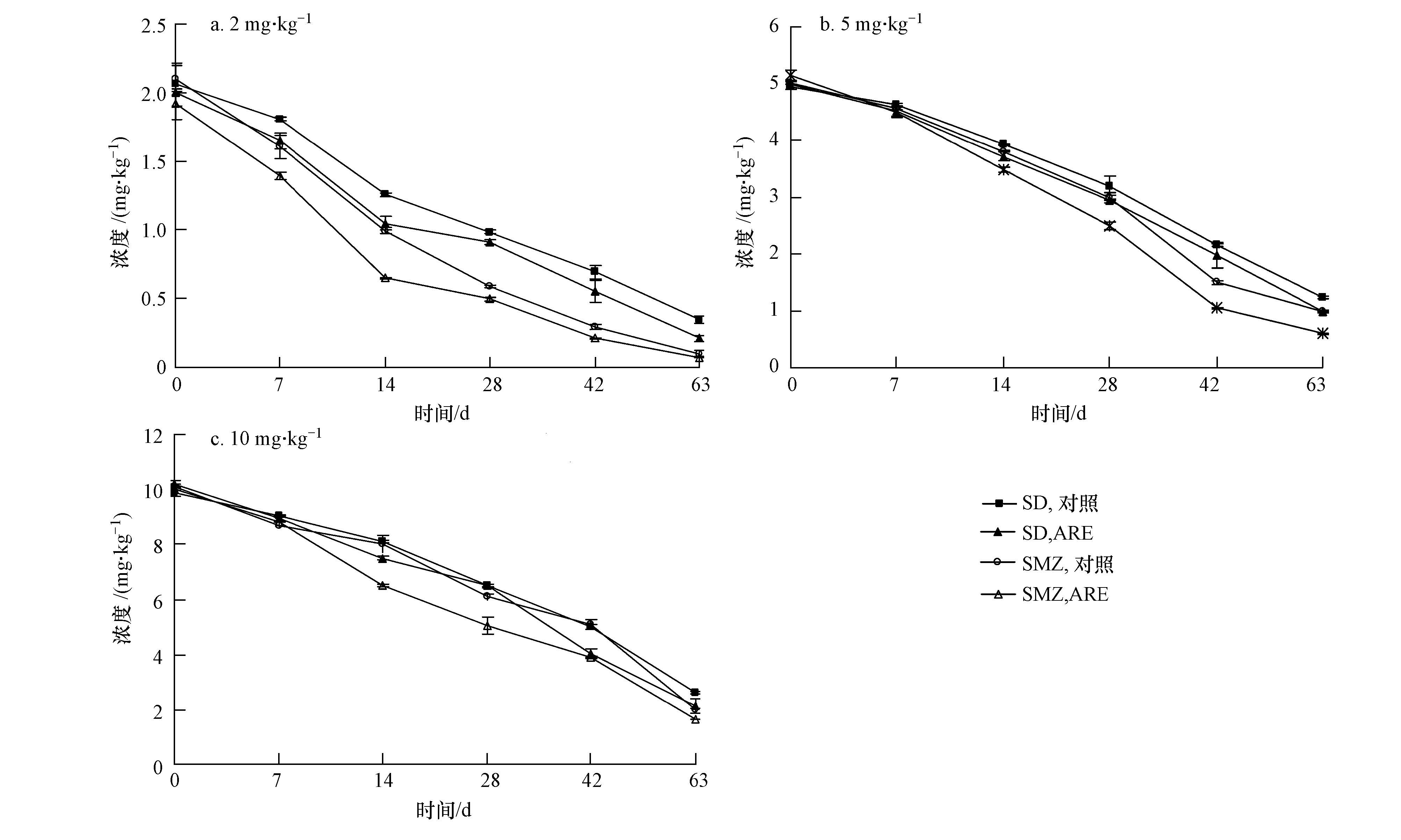 |
| 图4 SD和SMZ在土壤中残留量随时间的变化 Fig.4 Temporal variation of residual concentration of SD and SMZ in soils |
| 表1 一级动力学方程的拟合特性参数 Table 1 Degradation parameters fitted by first-order kinetics |
由表 1还可以看出,低浓度作用下的降解速率大于高浓度.T-CK SD浓度为2、5、10 mg · kg-1时的降解速率常数分别为 0.0277、0.0234、0.0218 d-1;T-ARE亦表现出相同趋势,这与Hallingsen等(2003)的研究结果一致,说明初始浓度会影响有机污染物的降解,初始浓度越高,降解速率越小,半衰期越长.这可能是由于磺胺类药物本身就是一类杀菌剂,在高浓度作用下,对土壤中降解性微生物有强烈地抑制或致死作用,能显著改变环境中微生物活性和呼吸作用等群落功能,进而降低了土壤中微生物对污染物的固化或降解能力,导致高浓度下磺胺类药物的降解率降低(王燕等,2012).
通过比较2种磺胺类药物的降解速率常数可知,其在土壤中的降解速率大小顺序为:SMZ>SD.这可能与药物抑菌强弱有关,SD的抑菌作用较强(Jesús García-Galán and Silvia Díaz-Cruz,2008),对土壤中降解性微生物产生的毒害作用大,微生物降解作用较弱.此外,有研究表明,SMZ在有自然光敏剂存在的条件下可由自然光照引发光化学降解,这也可能是SMZ降解速率较大的原因之一(Baran et al., 2011).
由图 4和表 1可以看出,磺胺类药物的降解呈先快后慢两个阶段,这与Beulke和Brown(2001)和Boxall等(2003)等描述的降解趋势相似.第一个阶段是快速吸附降解阶段,吸附是化合物在土壤环境中迁移和转化的重要过程,大部分磺胺类药物被土壤中有机质或矿物质所吸附,发生微生物或光降解作用,因而降解速率较快(Lertpaitoonpan et al., 2009).第二个阶段缓慢低速降解阶段,由于磺胺类药物发挥其抑菌作用造成微生物数量的减少和活性的降低,导致其降解能力下降.此外,在磺胺类药物长时间作用下,土壤微生物对污染物可能产生一定的抗性,因此,降解后期的降解速率维持在一定的水平.从形态方面考虑,由于结合态的形成进入成熟阶段,水溶态、有机溶剂提取态和结合态之间的转化达到平衡状态,导致后期降解速率较缓慢.
4 结论(Conclusions)1)SD和SMZ在土壤中水溶态和结合态所占比例较小,有机溶剂提取态是其主要的存在形态.
2)ARE的添加有利于土壤中SD和SMZ结合态形成,对水溶态和有机溶剂提取态影响较小.
3)SD在土壤中的降解速率小于SMZ,而结合态形成量高于SMZ.
4)SD和SMZ在土壤中的降解遵循相似规律,降解过程先快后慢,且在T-ARE中的降解速率大于T-CK.
| [1] | Baran W, Adamek E, Ziemiańska J, et al. 2011. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 196:1-15 |
| [2] | Beulke S, Brown C D. 2001. Evaluation of methods to derive pesticide degradation parameters for regulatory modelling[J]. Biology and Fertility of Soils, 33(6):558-564 |
| [3] | Boxall A B A, Kolpin D W, Halling-Sørensen B, et al. 2003. Peer reviewed:Are veterinary medicines causing environmental risks?[J]. Environmental Science & Technology, 37(15):286A-294A |
| [4] | Dec J, Haider K, Rangaswamy V, et al. 1997. Formation of soil-bound residues of cyprodinil and their plant uptake[J]. Journal of Agricultural and Food Chemistry, 45(2):514-520 |
| [5] | Doyle R C, Kaufman D D, Burt G W. 1978. Effect of dairy manure and sludge on 14C-pesticide degradation in soil[J]. Journal of Agricultural and Food Chemistry, 26(4):987-989 |
| [6] | Fuhr F, Mittelstaedt W. 1980. Plant experiments on the bioavailability of unextracted[carbonyl-14C] methabenzthiazuron residues from soil[J]. Journal of Agricultural and Food Chemistry, 28(1):122-125 |
| [7] | Gevao B, Semple K T, Jones K C. 2000. Bound pesticide residues in soils:a review[J]. Environmental Pollution, 108(1):3-14 |
| [8] | 郭欣妍,王娜,许静,等. 2013. 5种磺胺类抗生素在土壤中的吸附和淋溶特性[J].环境科学学报, 33(11):3083-3091 |
| [9] | Jesús García-Galán M, Silvia Díaz-Cruz M. 2008. Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J]. TrAC Trends in Analytical Chemistry, 27(11):1008-1022 |
| [10] | Joner E J, Corgié S C, Amellal N, et al. 2002. Nutritional constraints to degradation of polycyclic aromatic hydrocarbons in a simulated rhizosphere[J]. Soil Biology and Biochemistry, 34(6):859-864 |
| [11] | Kay P, Blackwell P A, Boxall A B A. 2004. Fate of veterinary antibiotics in a macroporous tile drained clay soil[J]. Environmental Toxicology and Chemistry, 23(5):1136-1144 |
| [12] | Kümmerer K. 2009. Antibiotics in the aquatic environment-a review-Part I[J]. Chemosphere, 75(4):417-434 |
| [13] | Khan S U, Ivarson K C. 1981. Microbiological release of unextracted (bound) residues from an organic soil treated with prometryn[J]. Journal of Agricultural and Food Chemistry, 29(6):1301-1303 |
| [14] | 孔晶晶,裴志国,温蓓,等. 2008.磺胺嘧啶和磺胺噻唑在土壤中的吸附行为[J].环境化学, 27(6):736-740 |
| [15] | Lertpaitoonpan W, Ong S K, Moorman T B. 2009. Effect of organic carbon and pH on soil sorption of sulfamethazine[J]. Chemosphere, 76(4):558-564 |
| [16] | 李松林,周亚平,刘俊吉. 2009.物理化学(第5版)[M].北京:高等教育出版社. 516-518 |
| [17] | McArdell C S, Molnar E, Suter M J F, et al. 2003. Occurrence and fate of macrolide antibiotics in wastewater treatment plants and in the Glatt Valley Watershed, Switzerland[J]. Environmental Science & Technology, 37(24):5479-5486 |
| [18] | Mordaunt C J, Gevao B, Jones K C, et al. 2005. Formation of non-extractable pesticide residues:observations on compound differences, measurement and regulatory issues[J]. Environmental Pollution, 133(1):25-34 |
| [19] | Nam K, Chung N, Alexander M. 1998. Relationship between organic matter content of soil and the sequestration of phenanthrene[J]. Environmental Science & Technology, 32(23):3785-3788 |
| [20] | Samuel T, Pillai M K K. 1991. Impact of repeated application on the binding and persistence of 14C-DDT and 14C-HCH in a tropical soil[J]. Environmental Pollution, 74(3):205-216 |
| [21] | Sorensenb H, Sengelev G, Ingerslev F, et al. 2003. Reduced antimicrobial potencies of oxytetracycline, tylosin, sulfadiazin, streptomycin, ciprofloxacin, and olaquindox due to environmental processes[J]. Archives of Environmental Contamination and Toxicology, 44(1):7-16 |
| [22] | Wang Q Q, Guo M X, Yates S R. 2006. Degradation kinetics of manure-derived sulfadimethoxine in amended soil[J]. Journal of Agricultural and Food Chemistry, 54(1):157-163 |
| [23] | 王燕,宋剑,李芳柏. 2012.磺胺嘧啶对土壤氮矿化及相关微生物参数的影响[J].土壤, 44(5):782-787 |
| [24] | 曾跃春,高彦征,凌婉婷,等. 2009.土壤中有机污染物的形态及植物可利用性[J].土壤通报, 40(6):1479-1484 |
| [25] | 张连仲. 1986.溴氰菊酯的结合残留[J].环境化学, 5(4):19-27 |
 2015, Vol. 35
2015, Vol. 35


