我国纺织印染行业日产3×106~4×106 m3印染废水,占整个工业废水的35%,但印染废水回用率不足10%(张斌等,2011).大量未经处理的印染废水直接排放到环境中,导致系列严重的环境污染问题.印染废水较高的COD值和BOD值将大量消耗水体中的溶解氧,影响水环境中生物的生存;对水体动物具有直接的致死、致畸毒性作用;此外,还会导致水体浊度升高,影响水生植物的光合作用,继而改变局部水体生态系统的食物链(Wang et al., 2011;原居林等,2012).
印染废水的处理工艺,从传统的理化处理工艺,逐渐发展出物理-生物处理工艺或化学-生物处理工艺,生物法处理工艺和酶法处理工艺.基于白腐菌及其产生的漆酶开发出的脱色工艺,是当今生物法或酶法处理印染废水的主流工艺(张晓昱等,2006;詹琪等,2014).然而,漆酶的催化活性高度依赖某些氧化还原介质(如1-hydroxybenzotriazole,HBT等)(D'Acunzo et al., 2002; Andreu and Vidal, 2011),因此在实际应用过程中,漆酶介导的脱色工艺,常常须向反应体系中加入各种氧化还原介质,以提高漆酶的脱色效果(Roriz et al., 2009; Moya et al., 2010).上述介质的加入,在增加企业生产成本的同时,还导致对环境的二次污染.
强氧化剂过氧乙酸,在降解环境污染物方面,具有良好的使用效果(Mukhopadhyay and Daswat, 2013; Sharma at al.,2014),但过氧乙酸作为一种易爆的危险化学品,大规模制备、贮存及运输条件苛刻,对一般企业而言,存在较高的难度.以乙酸乙酯和过氧化氢为底物,利用过水解酶(Perhydrolase)催化合成过氧乙酸(图 1),具有较好的安全性和易操控性(Gamenara et al., 2012; Carboni-Oerlemans et al., 2006).酶法催化合成过氧乙酸耦合过氧乙酸(原位)氧化各类底物的酶法-化学联合催化工艺,已在医疗废水的处理、环氧化合物的合成、油脂深加工、木质素降解等领域展现出良好的应用效果和前景(Grover et al., 2013a; Yin et al., 2011; Dinu et al., 2010).本文报道本实验室自主制备的过水解酶酶法催化合成过氧乙酸及其原位氧化活性艳蓝KN-R(Remazol Brilliant Blue KN-R,RBBR)的脱色工艺.
 |
| 图 1 过水解酶催化合成过氧乙酸的方程式 Fig.1 The formulation of peracetic acid synthesis catalyzed by the perhydrolase |
活性艳蓝KN-R购自天津希恩思生化科技有限公司;2-氯-5,5-二乙基-1,3-环己二酮(Monochlorodimedone,MCD)购自Alfa Aesar-A Johnson Matthey Company;乙酸乙酯、溴化钠和过氧化氢均购自国药集团化学试剂有限公司;HisTrap HP(5 mL)购自GE Healthcare公司;标准分子量的蛋白质Marker购自宝生物工程(大连)有限公司.其他试剂均为市售分析纯.
携带过水解酶编码基因的重组Escherichia coli BL21(DE3)菌株由本实验室构建并保存,卡那霉素抗性.
2.2 过水解酶的制备取E. coli BL21(DE3)重组菌株甘油管保藏菌液接种于5 mL液体LB培养基中(含50 μg · mL-1卡那霉素),37 ℃过夜培养,活化菌种.将活化后的菌种转接到200 mL LB液体培养基中(含50 μg · mL-1卡那霉素,1 L三角瓶),30 ℃培养至 OD600达到0.6~0.9.向培养基中加入IPTG至终浓度为1 mmol · L-1,诱导过水解酶基因的表达.16 h后离心收集菌体.菌体重悬于pH 7.4,20 mmol · L-1 NaH2PO4-Na2HPO4,20 mmol · L-1咪唑,500 mmol · L-1 NaCl的缓冲溶液中,超声裂解细胞.细胞裂解液10625 × g离心10 min,收集上清,用0.22 μm超滤膜过滤后作为粗酶液进行纯化.
以0.5 mL · min-1的上样速度将粗酶液样品加到HisTrap HP层析柱中,先用上样缓冲溶液(pH 7.4,含20 mmol · L-1 Na2HPO4-NaH2PO4,20 mmol · L-1 咪唑,500 mmol · L-1氯化钠)洗脱10个柱体积,再用洗脱液(pH 7.4,含20 mmol · L-1 Na2HPO4-NaH2PO4,500 mmol · L-1咪唑,500 mmol · L-1氯化钠)以1 mL · min-1的流速线性梯度洗脱层析柱60 min.以3 mL · 试管-1分部收集洗脱液,分别通过酶活测定和SDS-PAGE电泳检测洗脱液,收集具有过水解酶酶活的洗脱液,合并,再用pH 7.4,50 mmol · L-1 Na2HPO4-NaH2PO4的缓冲溶液平衡.
2.3 蛋白质浓度的测定及酶活性的测定过水解酶的纯度及相对分子量采用SDS-PAGE检测,分离胶浓度为12%.纯化后的蛋白质浓度的测定采用Bradford法进行测定,以牛血清白蛋白为标准蛋白.
过水解酶酶活的测定参照Yin和Kazlauskas(2012)的方法进行,具体反应体系如下:pH7.4,20 mmol · L-1 NaH2PO4-Na2HPO4缓冲溶液中,依次加入终浓度为817.16 mmol · L-1的乙酸乙酯,149 mmol · L-1的溴化钠,适量的酶液,0.047 mmol · L-1 MCD和0.01 mol · L-1过氧化氢,40 ℃下反应5 min.在上述条件下,每min减少1 μmol MCD所需要的酶量,定义为1个酶活单位(U)(在此条件下,ε290= 2.03×104 L · mol-1 · cm-1).
2.4 活性艳蓝KN-R最大吸收光谱的测定用 UV-2600 型紫外可见分光光度计对70 mg · L-1的RBBR在可见光波段(400~800 nm)范围内进行光谱扫描,检测RBBR的最大吸收波长λmax.在最大吸收波长λmax下测定并绘制RBBR浓度对吸光度Abs的标准曲线(RBBR浓度范围:10~180 mg · L-1).
2.5 活性艳蓝KN-R的脱色试验和脱色率的计算脱色基准反应体系总体积为5 mL,反应时间为6 h,反应体系的缓冲溶液为20 mmol · L-1的磷酸氢二钠-柠檬酸,反应温度为室温(26~28 ℃).基准反应体系为:20 mmol · L-1的磷酸氢二钠-柠檬酸缓冲溶液,80 mg · L-1的RBBR,3.0 U · 反应-1的过水解酶添加量、0.8 mol · L-1的乙酸乙酯、0.01 mol · L-1的过氧化氢.
在单因子实验中,分别改变体系中的某一因子,而其他因子不变,以此考察pH、过水解酶添加量、染料浓度、乙酸乙酯与过氧化氢的摩尔比率等对脱色效果的影响.
RBBR脱色率的计算公式:脱色率(%)=(C0-Ct)/C0×100%,C0、Ct分别表示初始时刻和反应终止后,反应体系中的RBBR浓度.采用高温灭活后的过水解酶作为对照组.实验组脱色率数据均为减去对照组脱色率后的数值,对照组和实验组实验均重复3次,并计算均方差.
2.6 正交优化试验根据上述单因子试验获得的初步结果,进行四因子三水平的正交实验,优化过水解酶对RBBR的脱色工艺.
2.7 活性艳蓝脱色动力学及放大实验在正交实验获得的最优脱色条件下,分别测定不同处理时间对染料脱色效果的影响,测定过水解酶催化RBBR脱色的动力学曲线.
在最优脱色条件下,将脱色体系放大到250 mL(50倍放大),检测过水解酶催化的脱色效果.
3 结果与讨论(Results and discussion) 3.1 过水解酶的纯化及比活力测定经过HisTrap HP层析柱纯化后的过水解酶SDS-PAGE电泳结果如图 2所示.电泳结果显示为单一条带,分子量大小为28 kDa,与预期大小一致.酶活测定表明,该过水解酶比活力为7.53 U · mg-1,高于已报道的其他过水解酶的比活力(Mathew et al.,2007;Lee et al., 2010).
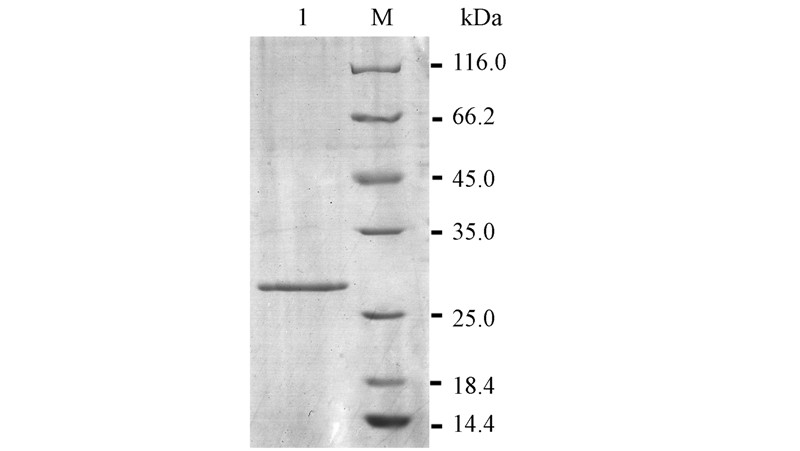 |
| 图 2 过水解酶的SDS-PAGE电泳分析 Fig.2 SDS-PAGE analysis of the purified perhydrolase(M: Marker; 1: the purified perhydrolase) |
RBBR的最大吸收波长测定结果如图 3所示.在595 nm处,染料RBBR有最大吸收峰,与Enayatzamir 等(2009)报道的最大吸收波长一致.在后续实验过程中,均以595 nm作为检测波长.RBBR的浓度在10~180 mg · L-1范围内,吸光度Abs与RBBR浓度呈良好的线性关系.
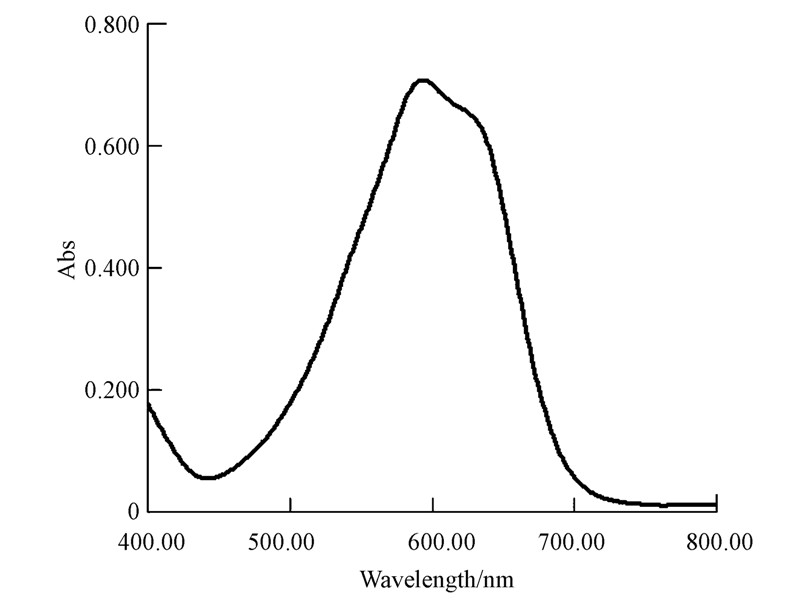 |
| 图 3 染料RBBR的吸收波长扫描图 Fig.3 The absorption spectrum scanning of Remazol Brilliant Blue KN-R in the range of 400~800 nm |
本实验使用的比色皿体积为5 mL,为方便后续检测,确定了5 mL反应体积的基准反应体系.为使实验结果在后续实际应用过程中具有指导价值,本实验的反应温度选择室温(福州地区常平均温度在25℃左右).参照过水解酶酶活测定体系中的底物浓度设定基准反应体系中的乙酸乙酯和过氧化氢的初始浓度(Yin and Kazlauskas, 2012).在活性艳兰KN-R标准曲线范围内(中间浓度区段),作为基准反应体系中活性艳兰KN-R的初始浓度.为方便实验操作和比较实验结果,以在一个工作日(8 h)的反应时间内,脱色率在80%~90%之间,确定基准反应体系中的初始加酶量(在前期调研其他酶制剂介导的染料脱色效果时,我们注意到大多数文献报道的脱色率在80%~90%之间).
在5 mL基准反应体系中,缓冲溶液的pH、添加的酶剂量、乙酸乙酯与过氧化氢的摩尔比、RBBR浓度等因子对过水解酶脱色效果的影响如图 4所示.
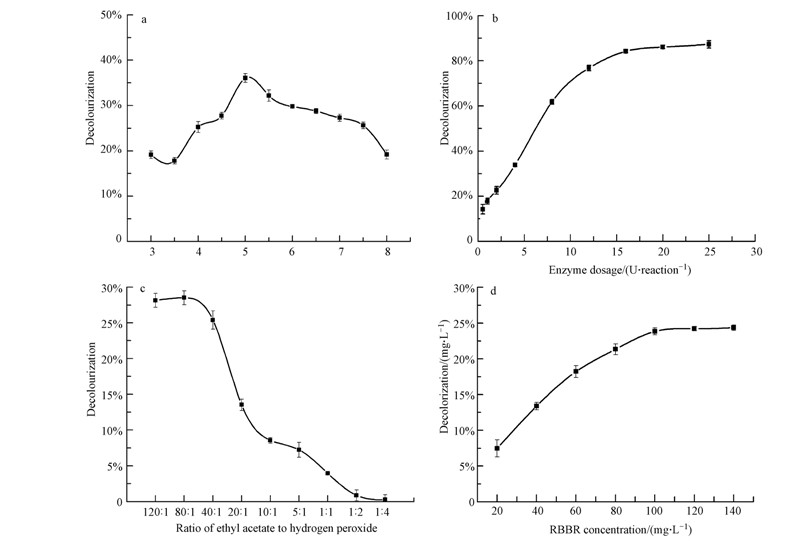 |
| 图 4 各种单一因子对RBBR脱色效果的影响(a. pH对脱色效果的影响;b. 过水解酶剂量对脱色效果的影响;c. 乙酸乙酯与过氧化氢摩尔比率对脱色效果的影响;d. RBBR浓度对脱色效果的影响) Fig.4 The single factor test for the decolorization of RBBR(a. the effect of pH on the decolorization of RBBR; b. the effect of perhydrolase doseage on the decolorization of RBBR; c. the effect of the molar ratio of ethyl acetate to hydrogen peroxide on the decolorization of RBBR; d. the effect of the RBBR concentration on the decolorization of RBBR) |
在pH 3~5的范围内,随着pH的升高,脱色效果逐渐增强;在pH=5时脱色率最高.随着pH的进一步提高,脱色效果逐渐降低(图 4a).pH对过水解酶脱色效果的影响,是多重效应共同作用的结果:①pH对过水解酶活性的影响.过水解酶的最适pH为6.0(实验室尚未发表数据),在pH 3~6的范围内,过水解酶的活性随着pH的升高而升高;②pH对过氧化氢稳定性的影响.过氧化氢在pH 3.5~4.5时最稳定.作为过水解酶底物之一的过氧化氢的稳定性,将直接影响到产物过氧乙酸的生成,从而间接影响到过水解酶的脱色效果;③pH对RBBR稳定性的影响.在酸性或碱性pH条件下,中性的RBBR转化为带上正电荷或负电荷的离子型化合物,有助于RBBR的分解(Mahmoud et al., 2007).
在5 mL基准反应体系中,在0.5~25 U · 反应-1的浓度范围内,随着反应体系中酶剂量的增大,脱色效果逐渐增强.在0.5~8 U · 反应-1的浓度范围内,酶剂量与脱色率呈线性关系;当酶剂量高于16 U · 反应-1的范围后,脱色率增高值极为有限,呈零级反应(图 4b).
在5 mL基准反应体系中,乙酸乙酯对过氧化氢的摩尔比率对RBBR的分解有较大的影响.当摩尔比率低于40 ∶ 1时,RBBR的脱色率显著降低(图 4c).实验结果表明:(1)过水解酶对过氧化氢的亲和力大于对乙酸乙酯的亲和力.过氧化氢作为一种强氧化剂,容易导致蛋白质变性失活(Matsuo,1953;Törnvall et al., 2010).因此,在后续实验中,利用蛋白质工程技术,构建能耐受高浓度过氧化氢的过水解酶(Irani et al., 2013; Vojcic et al., 2013),有助于更好地大规模推广过水解酶在印染废水处理中的应用.(2)反应过程中,维持高浓度的乙酸乙酯是必要的.因此,在后续实验过程中,可考虑选用三酰甘油酯或二酰甘油酯替换乙酸乙酯(Barnett and Sala, 2010;Grover et al., 2013b),既可降低羧酸酯对过氧化氢的摩尔比,又有助于提高过水解酶在反应体系中的稳定性(在乙酸乙酯工艺中,产物中有乙醇生成;而三酰甘油酯或二酰甘油酯工艺中,产物为甘油).
在5 mL基准反应体系中,RBBR浓度在20~100 mg · L-1的浓度范围内,被分解掉的RBBR浓度随初始浓度的增加而增加.RBBR浓度超过100 mg · L-1后,被分解掉的RBBR浓度增速减缓,呈零级反应态势(图 4d).
3.4 正交实验优化过水解酶脱色工艺对反应体系的pH、加酶量、乙酸乙酯与过氧化氢的摩尔比率和RBBR浓度4个因子进行正交试验优化.实验结果(表 1)表明:①对RBBR脱色率影响大小依次为B>D>C>A,即过水解酶剂量>RBBR浓度>乙酸乙酯与过氧化氢的摩尔比率>反应体系的pH;②最优组合为A2B3C2D1,即反应体系的pH 5.0,加酶量为20 U · 反应-1,乙酸乙酯对过氧化氢的摩尔比率为40 ∶ 1和RBBR浓度为80 mg · L-1.在最优条件下,在5 mL反应体系中进行验证性试验,RBBR脱色率为81.11%.
| 表 1 RBBR脱色的正交试验设计、试验结果及分析 Table 1 L9(3)4 orthogonal test design,test results and analysis of test results for decolourization of RBBR |
在5 mL反应体系中,过水解酶脱色动力学结果如图 5所示.在反应的初始阶段,具有极快的脱色速度(在反应的初始30 min,体系中超过67%的RBBR被降解);随着反应时间的延长,乙酸乙酯、过氧化氢及RBBR浓度逐渐降低,导致脱色率增速逐渐减缓.24 h后脱色率达到91.96%.RBBR的氧化脱色动力学符合两相指数衰减(Two phase exponential decay)模型(Graphpad Prism统计软件Nonlinear Regression拟合结果),脱色动力学方程为:Y=12.32+65.82e(-9.61X)+21.86e(-0.2127X)(Y为脱色率,X为处理时间,R2=0.9986).
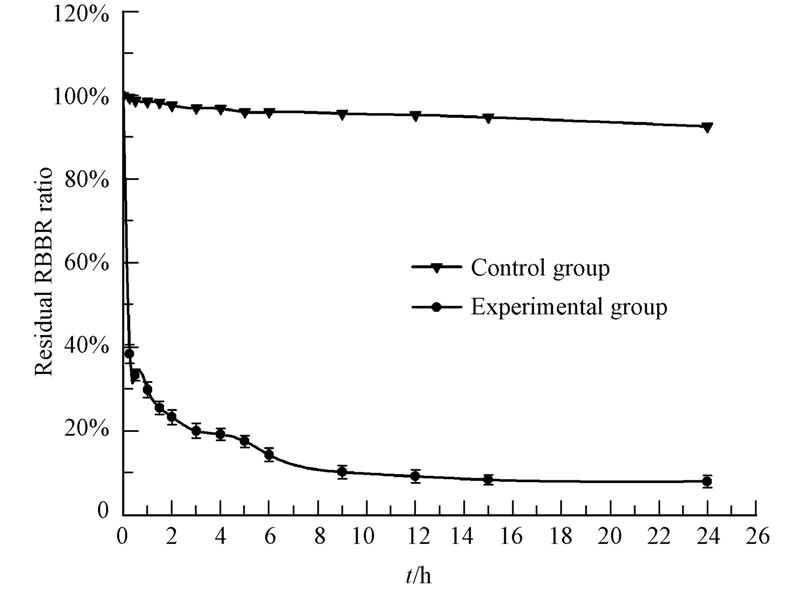 |
| 图 5 过水解酶原位合成过氧乙酸氧化RBBR脱色动力学分析 Fig.5 The decolorization dynamics analysis of RBBR by peracetic acid genetated in situ by perhydrolase in the 5 mL reaction system |
在最优工艺条件下,将反应体系放大50倍(250 mL)后,进行脱色试验.以灭活的过水解酶作为对照组试验;反应24 h,测定RBBR的脱色率.放大体系试验的RBBR脱色效果如图 6所示.和对照组相比,实验组具有非常明显的脱色效果:溶液浊度(颜色)变浅,瓶底出现明显的絮状沉淀;24 h后RBBR的脱色率为84.55%,较5 mL反应体系,略有下降,具体原因及机制还有待深入调查.
 |
| 图 6 过水解酶在最适条件下在250 mL反应系统中催化PBBR氧化脱色的效果 Fig.6 The oxidative decolorization of RBBR by peracetic acid genetated in situ by perhydrolase in the 250 mL reaction system |
由于酶制剂的过水解活性(Perhydrolysis activity)属于酶的催化混乱性活性(Promiscuous activity),因此,常常需要加入过量的底物,以推动反应向正反应反向进行(Yin and Kazlauskas, 2012).按照优化后的脱色体系,处理每吨污水需要加入274 mL的过氧化氢,而乙酸乙酯的量则达到反应体系体积的4%(V/V).因此单就一个批次的污水处理而言,成本高于现有污水处理方法的运行成本.但在实际操作过程中,处理后的污水,形成大量的絮状沉淀物(图 6).经过简单沉淀滤过后,只需向上清液中补加极少量的过氧化氢和乙酸乙酯,即可进行下一批次的污水处理,脱色效果基本维持不变.在实验室阶段,通过酶制剂的固定化技术,已实现6个批次的重复实验(实验室未发表数据,后续论文将发表).事实上,利用三乙酸甘油酯(Glyceryl triacetate,GTA)替换乙酸乙酯,底物浓度可以进一步降低到现有浓度的1/3(Grover et al., 2013b).通过进一步优化工艺和酶制剂的固定化技术等措施,可实现底物的多批次循环利用,从而实现本技术路线的低成本运行.
4 结论(Conclusions)1)利用过水解酶原位制备过氧乙酸进行印染废水(RBBR模型)处理,是完全可行的.通过酶促反应(过氧乙酸的合成)和化学氧化反应(过氧乙酸氧化RBBR脱色)耦合的两阶段反应工艺,获得了较好的脱色效果.在5 mL反应体系中,6 h脱色率为81.11%;24 h脱色率为91.96%(由于对照组具有3%~5%的数值,因此实际脱色率已超过95%).
2)该工艺中,不同单一因子对RBBR脱色率的影响依次为:过水解酶剂量>RBBR浓度>乙酸乙酯与过氧化氢的摩尔比率>反应体系的pH;最优组合为:反应体系的pH=5.0,加酶量为20 U · 反应-1,乙酸乙酯对过氧化氢的摩尔比率为40 ∶ 1和RBBR浓度为80 mg · L-1.
3)在最优条件下,250 mL反应体系中,24 h后RBBR脱色率为84.55%;较5 mL反应体系中的脱色率略有下降,具体原因及机制还有待深入调查.
致谢(Acknowledgement): 感谢国家留学基金管理委员会的资助;感谢瑞典皇家理工学院生物技术学院工业生物技术系的Hult Karl教授、Martinelle Mats博士及Hendil-Forssell Peter博士在过水解酶研究方面的指导.| [1] | Andr eu G, Vidal T. 2011. Effects of laccase-natural mediator systems on kenaf pulp [J]. Bioresource Technology, 102(10): 5932-5937 |
| [2] | Barnett C C, Sala R F. 2010. Oxidative decolorization of dyes with enzymatically generated peracid method, composition and kit of parts. US, PCT/US2010/025846. 2010-03-02 |
| [3] | Carboni-Oerlemans C, Domínguez de María P, Tuin B, et al. 2006. Hydrolase-catalysed synthesis of peroxycarboxylic acids: biocatalytic promiscuity for practical applications [J]. Journal of Biotechnology, 126(2): 140-151 |
| [4] | D'Acunzo F, Galli C, Masci B. 2002. Oxidation of phenols by laccase and laccase-mediator systems [J]. European Journal of Biochemistry, 269(21): 5330-5335 |
| [5] | Dinu C Z, Zhu G Y, Bale S S, et al. 2010. Enzyme-based nanoscale composites for use as active decontamination surfaces [J]. Advanced Functional Materials, 20(3): 392-398 |
| [6] | Enayatzamir K, Tabandeh F, Yakhchali B, et al. 2009. Assessment of the joint effect of laccase and cellobiose dehydrogenase on the decolouration of different synthetic dyes [J]. Journal of Hazardous Materials, 169(1/3): 176-181 |
| [7] | Gamenara D, Seoane G A, Saenz-Méndez P, et al. 2012. Hydrolase-mediated oxidations//Redox Biocatalysis: Fundamentals and Applications[M]. New Jersey, USA: John Wiley & Sons, Inc. 433-452 |
| [8] | Grover N, Dinu C Z, Kane R S, et al. 2013a. Enzyme-based formulations for decontamination: current state and perspectives [J]. Applied Microbiology and Biotechnology, 97(8): 3293-3300 |
| [9] | Grover N, Douaisi M P, Borkar I V, et al. 2013b. Perhydrolase-nanotube paint composites with sporicidal and antiviral activity [J]. Applied Microbiology and Biotechnology, 97(19): 8813-8821 |
| [10] | Irani M, Törnvall U, Genheden S, et al. 2013. Amino acid oxidation of Candida antarctica lipase B studied by molecular dynamics simulations and site-directed mutagenesis [J]. Biochemistry, 52(7): 1280-1289 |
| [11] | Lee W, Vojcic L, Despotovic D, et al.2010. Rationalizing perhydrolase activity of aryl-esterase and subtilisin Carlsberg mutants by molecular dynamics simulations of the second tetrahedral intermediate state [J]. Theoretical Chemistry Accounts, 125(3/6): 375-386 |
| [12] | Mahmoud A S, Ghaly A E, Brooks S L. 2007. Influence of temperature and pH on the stability and colorimetric measurement of textile dyes [J]. American Journal of Biochemistry and Biotechnology, 3(1): 33-41 |
| [13] | Mathews I, Soltis M, Saldajeno M, et al. 2007. Structure of a novel enzyme that catalyzes acyl transfer to alcohols in aqueous conditions [J]. Biochemistry, 46(31): 8969-8979 |
| [14] | Matsuo Y. 1953. Degradation of methionine by hydrogen peroxide [J]. Nature, 171(4362): 1021-1022 |
| [15] | Moya R, Hernández M, García-Martín A B, et al. 2010. Contributions to a better comprehension of redox-mediated decolouration and detoxification of azo dyes by a laccase produced by Streptomyces cyaneus CECT 3335 [J]. Bioresource Technology, 101(7): 2224-2229 |
| [16] | Mukhopadhyay M, Daswat D P. 2013. Photochemical degradation of 4-chlorophenol in the aqueous phase using peroxyacetic acid (PAA) [J]. Water Science & Technology, 67(2): 440-445 |
| [17] | Roriz M S, Osma J F, Teixeira J A, et al. 2009. Application of response surface methodological approach to optimise reactive black 5 decolouration by crude laccase from Trametes pubescens [J]. Journal of Hazardous Materials, 169(1/3): 691-696 |
| [18] | Sharma S, Mukhopadhyay M, Murthy Z V P. 2014. Photolytic degradation of chlorophenols from industrial wastewaters by organic oxidants peroxy acetic acid, para nitro benzoic acid and methyl ethyl ketone peroxide: identification of reaction products [J]. Water Science & Technology, 69(6): 1259-1266 |
| [19] | Törnvall U, Hedström M, Schillén K, et al. 2010. Structural, functional and chemical changes in Pseudozyma antarctica lipase B on exposure to hydrogen peroxide [J]. Biochimie, 92(12): 1867-1875 |
| [20] | Vojcic L, Despotovic D, Maurer K H, et al. 2013. Reengineering of subtilisin Carlsberg for oxidative resistance [J]. Biological Chemistry, 394(1): 79-87 |
| [21] | Wang Z P, Xue M M, Huang K, et al. 2011. Textile dyeing wastewater treatment//Hauser P J. Advances in Treating Textile Effluent [M]. Croatia: InTech. 91-116 |
| [22] | Yin D T, Jing Q, AlDajani W W, et al. 2011. Improved pretreatment of lignocellulosic biomass using enzymatically-generated peracetic acid [J]. Bioresource Technology, 102(8): 5183-5192 |
| [23] | Yin D T, Kazlauskas R J. 2012. Revised molecular basis of the promiscuous carboxylic acid perhydrolase activity in serine hydrolases [J]. Chemistry-A European Journal, 18(26): 8130-8139 |
| [24] | 原居林, 顾志敏, 叶金云, 等. 2012. 纺织印染废水及其底泥对太湖花早期发育的毒性研究 [J]. 环境科学学报, 32(3): 762-768 |
| [25] | 詹琪, 廖红福, 张敏, 等. 2014. 漆酶催化复合染料酸性黑ATT脱色的研究 [J]. 环境科学学报, 34(5): 1236-1241 |
| [26] | 张斌, 刘金海, 冯晓辉. 2011. 印染废水污染现状及其处理技术的发展 [J]. 科技信息, (5): 376-377 |
| [27] | 张晓昱, 颜克亮, 王宏勋, 等. 2006. 稻草基质中白腐菌降解三苯甲烷类染料机制探讨 [J]. 环境科学学报, 26(8): 1284-1289 |
 2015, Vol. 35
2015, Vol. 35


