水生生物暴露在含有众多胁迫物(如重金属)的水体中后会对水产资源的开发产生不利影响(Cresswell, et al., 2014; Angeletti et al., 2014).据Mason(1991)报道,镉(Cd)是导致水环境问题的主要有毒污染物之一,水体镉污染可对水生动物产生毒性作用(胡蓉等,2011),并导致一些组织的病理改变(Kavitha et al., 2013).组织病理变化是指示污染物暴露程度的一项重要生理指标.Thophon(2003)研究表明,急性和慢性镉处理均可直接导致水生动物主要组织形态结构的损伤.
在自然状态下,由于水体周围环境的不断改变,生物体不可能持续不变地在急性或慢性的毒性环境中暴露,且急性和慢性镉中毒对水生动物的毒性作用不同(Pablos et al., 2015).然而,有关两种方式镉胁迫对生物体毒性比较的研究较少.截至目前,本课题组对于镉暴露下河南华溪蟹(Sinopotamon henanense)主要组织器官(如鳃、心脏、精巢等)的形态结构损伤进行了较为系统的研究(轩瑞晶,2013; Lei et al., 2011; Wang et al., 2011),但对其消化系统病理学的相关研究工作却鲜有报道(吴昊等,2014).
河南华溪蟹的消化系统包括肝胰腺和消化管(口、食道、中肠、后肠等),是机体消化食物和吸收营养物质的主要部位.生物的生命过程中离不开消化和吸收,这两个生理过程的正常进行对于完成新陈代谢、满足机体生长发育和从事各种生命活动的物质和能量需求,都有着非常重要的意义,是动物赖以生存的基本生理功能(王民生等,2011).消化道是镉进入机体的重要途径之一(Rainbow et al.,1989),镉可以通过溪蟹的摄食进入其消化系统,并在溪蟹消化食物、吸收营养的过程中,对其消化系统的各部位造成一定的损伤,而受损的消化系统无法行使正常的消化功能,必会引起机体的生理紊乱.
我们前期对急性和亚慢性镉胁迫下河南华溪蟹消化酶活性的变化进行了检测,结果表明,不同的暴露方式对消化酶活性的抑制程度不同(Wu et al., 2013;2014).为了探明镉对消化系统影响的机制,本实验观察了急、亚慢性镉处理后河南华溪蟹食道、中肠、后肠和肝胰腺4种消化器官细胞亚显微结构的病理学变化,以明确急、亚慢性镉处理对河南华溪蟹消化系统胁迫程度的差异性,填补对甲壳动物消化系统细胞病理学研究的不足,为生态环境的保护、环境污染的检测、水产品的健康养殖和防治镉中毒等多项工作提供重要科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料河南华溪蟹(以下简称“溪蟹”),购自太原市五龙口东安水产批发市场,在实验室条件下暂养2周以上备用.暂养用水为自来水,曝气48 h以上,温度16~22 ℃,pH值6.8,溶氧量6 mg · L-1以上.水族缸外遮蔽黑色塑料袋以避免光线刺激.每周喂食2次鱼粮(喂食量占体重的1%).主要试剂为分析纯氯化镉(CdCl2 · 2.5H2O),主要仪器为透射电镜(JEOL JEM-1400,日本).
2.2 实验方法 2.2.1 实验设计镉(Cd)急性攻毒溪蟹,首先用概率法求得96 h LC50为232.00 mg · L-1(Wang et al., 2011).根据 LC50,设置Cd 浓度为29.0 mg · L-1(1/8 LC50)急性染毒4 d和2.90 mg · L-1(1/80 LC50)亚慢性染毒21 d.同时设立一个对照组.
选取个体大小基本一致(平均湿重为(20.1±3.2)g)、健康的个体,随机放入处理缸中,每缸12只,分别加入不同浓度的Cd溶液,对照组中加入曝气的自来水,每个处理组设3个重复.急性Cd处理期间不喂食,每24 h换溶液1次;亚慢性Cd处理期间每周喂食2次,每48 h换溶液1次.
2.2.2 透射电镜超微结构观察分别在急性和亚慢性处理组中,随机挑取5只溪蟹,活体解剖.迅速取出食道、中肠、后肠和肝胰腺组织,切割成1 mm3左右的小块,置于2.5%戊二醛固定液中固定2 h,磷酸缓冲液冲洗,用1%锇酸后固定2 h.经丙酮梯度脱水,Epon 812环氧树脂定向包埋,超薄切片,厚度60 nm,醋酸铀-柠檬酸铅双重染色,透射电镜下观察并拍照.
3 结果(Results) 3.1 镉染毒对河南华溪蟹食道组织亚细胞结构的影响图 1显示,对照组食道上皮细胞核膜完整,常染色质分布均匀,异染色质聚集在核膜下,核仁清晰可见(图 1 A1);线粒体双层膜完整,基质均匀分布,为中等电子密度,嵴完整(图 1 A2);肌原纤维分布均匀,排列整齐规则(图 1 A3).
 |
| 图 1 镉暴露对河南华溪蟹食道组织超微结构的影响 (A1~A3,对照组:A1. 10000×,细胞核;A2. 25000×,线粒体;A3. 30000×,肌纤维束及肌原纤维;B1~B3,急性处理组:B1. 15000×,细胞核扭曲变形,核膜断裂、消失(↑);B2. 30000×,损伤的线粒体(↑);B3. 30000×,肌原纤维排列紊乱;C1~C3,亚慢性处理组:C1. 12000×,核变形(↑);C2. 25000×,结构异常的线粒体(↑);C3. 20000×,肌原纤维排列不规则;N:细胞核;Nu:核仁;M:线粒体;My:肌纤维) Fig.1 Effects of Cd on ultrastructure of esophagus in S. henanense.(A1~A3, control group: A1. 10000×, the nucleus; A2. 25000×, the mitochondria; A3. 30000×, the muscle fibers. B1~B3, treated with acute group: B1. 15000×, the nuclei is deformed and nuclear envelope disruption (↑); B2. 30000×, shows the dissolution of cristae and vacuolation of mitochondria (↑); B3. 30000×, shows disordered arrangement of muscle fibers. C1~C3, treated with subchronic group: C1. 12000×, the nuclear membrane is distorted (↑); C2. 25000×, space between inner membrane is larged (↑); C3. 20000×, the arrangement of muscle fibers is irregular. N: nucleus; Nu: nucleolus; M: mitochondria; My: myofiber) |
急性Cd处理后,可见上皮细胞核严重扭曲变形,染色质浓缩边集,核膜部分断裂、结构模糊消失(图 1 B1,↑);线粒体破裂、基质电子密度降低、嵴变短消失,出现空泡区域(图 1 B2,↑);肌原纤维排列紊乱(图 1 B3).
亚慢性处理组细胞损伤程度较急性处理组的轻.但可见细胞核变形,染色质边集和浓缩(图 1 C1,↑);线粒体嵴肿胀,部分线粒体嵴融解、消失(图 1 C2,↑);肌原纤维排列不规则(图 1 C3).
3.2 镉染毒对河南华溪蟹中肠组织亚细胞结构的影响对照组溪蟹中肠上皮细胞微绒毛形态结构正常、排列整齐(图 2 A1);细胞核呈圆形或椭圆形,染色质均匀分布,可见核仁,核膜完整连续(图 2 A2);线粒体膜、嵴结构明显,粗面内质网为扁平囊状,附着核糖体清晰可见,高尔基复合体形态正常(图 2 A3).
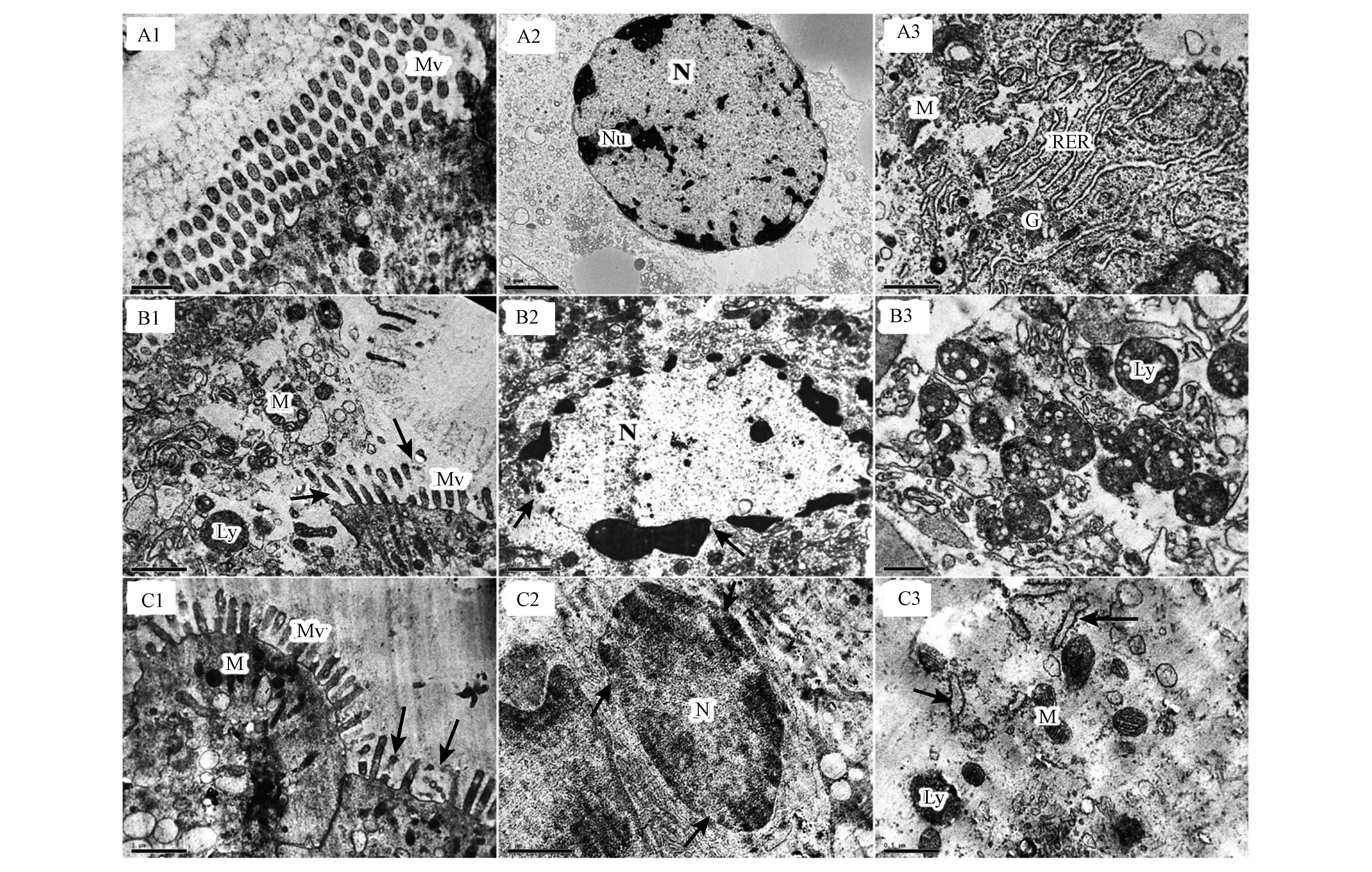 |
| 图 2 镉暴露对河南华溪蟹中肠组织超微结构的影响 (A1~A3,对照组:A1.30000×,微绒毛;A2.10000×,细胞核;A3.20000×,各细胞器形态结构正常;B1~B3,急性处理组:B1. 20000×,微绒毛融解、消失(↑),细胞膜破裂;B2. 8000×,染色质边集化,核膜融解(↑);B3. 30000×,大量溶酶体;C1~C3,亚慢性处理组:C1. 20000×,部分微绒毛融解、消失;C2. 12000×,膜结构模糊(↑);C3. 40000×,内质网明显扩张(↑),线粒体膜结构异常,溶酶体数量增多;Mv:微绒毛;M:线粒体;N:细胞核;Nu:核仁;RER:粗面内质网;G:高尔基复合体;Ly:溶酶体) Fig.2 Effects of Cd on ultrastructure of midgut in S. henanense(A1~A3, control group: A1.30000×, the apical microvilli; A2.10000×, shows the nucleus and nucleolus; A3.20000×,the normalrough endoplasmic reticulum, Golgi complex and mitochondria. B1~B3, treated with acute group: B1. 20000×, the apical microvilli are deformed and disruption (↑), and cell membranes is bursting; B2. 8000×, shows chromatin condensation and nuclear membrane disruption (↑); B3. 30000×, shows a large area of lysosomes.C1~C3, treated with subchronicgroup: C1. 20000×, the parts of apical microvilli are dissolved (↑); C2. 12000×, the membrane structure is faint; C3. 40000×, the rough endoplasmic reticulum cisternae are dilated (↑); the damaged mitochondria and increased lysosome are observed;Mv: microvilli; M: mitochondria; N: nucleus; Nu: nucleolus; RER: rough endoplasmic reticulum; G: Golgi complex; Ly: lysosome) |
急性处理组溪蟹中肠上皮细胞微绒毛大量脱落、融解、消失,细胞膜破裂,胞质外溢,细胞器散落(图 2 B1,↑);细胞核中染色质严重浓缩边集,核膜结构模糊(图 2 B2,↑);可见大量溶酶体(图 2 B3).
亚慢性处理组微绒毛部分融解、破裂(图 2 C1,↑);核膜结构不明显,膜边缘出现空泡(图 2 C2,↑);细胞中细胞器结构受损,线粒体肿胀变形,膜结构不完整,嵴消失;溶酶体增多;粗面内质网扩张、扭曲、核糖体脱落(图 2 C3,↑).
3.3 镉染毒对河南华溪蟹后肠组织亚细胞结构的影响从图 3 A1可见,溪蟹后肠上皮细胞核膜完整,染色质分布均匀,肌原纤维排列规则;线粒体结构正常,嵴清晰可见(图 3 A2);溶酶体数量较少,偶见髓样体结构(图 3 A3).
 |
| 图 3 镉暴露对河南华溪蟹后肠组织超微结构的影响 (A1~A3,对照组:A1. 10000×,细胞核和肌纤维;A2. 30000×,正常线粒体;A3. 30000×,偶见髓样体结构(↑);B1~B3,急性处理组:B1. 20000×,染色质浓缩,核膜模糊不完整(↑);B2. 30000×,线粒体肿胀变形(↑);B3. 40000×,大量髓样体结构;C1~C3,亚慢性处理组:C1. 10000×,染色质浓缩、边集;C2. 25000×,损伤的线粒体,外膜消失,嵴不明显(↑);C3. 30000×,髓样体增多;My:肌纤维;N:细胞核;Nu:核仁;Ly:溶酶体;MB:髓样体) Fig.3 Effects of Cd on ultrastructure of hindgut in S. henanense(A1~A3,control group: A1.10000×, the nucleusand the muscle; A2.30000×, the mitochondria; A3.30000×, a few of primary lysosome and myeloid bodies (↑).B1~B3, treated with acute group: B1. 20000×, the nuclear matrices are condensed with vacuoles around the nucleus (↑), and the membrane structure is faint (↑); B2. 30000×, severely damaged mitochondria (↑); B3. 40000×, shows a large area of myeloid bodies.C1~C3, treated with subchronicgroup: C1. 10000×, the chromatin is condensed and marginated; C2. 25000×, mitochondrial cristae and membrane aredissolution and disappearance (↑); C3. 30000×, the number of myeloid bodies is increased.My: myofiber; N: nucleus; Nu: nucleolus; M: mitochondria; Ly: lysosome; MB: myeloid bodies) |
急性处理后,后肠上皮细胞异染色质增多,核膜模糊、断裂、不完整(图 3 B1,↑);线粒体肿胀,基质电子密度不规则降低,嵴结构消失(图 3 B2,↑);且出现大量髓样体(图 3 B3).
亚慢性处理后,后肠组织上皮细胞可见染色质边集和浓缩(图 3 C1);线粒体结构破坏、膜破裂、局部水肿,嵴融解、消失(图 3 C2,↑);髓样体数量增多(图 3 C3);肌原纤维不明显.
3.4 镉染毒对河南华溪蟹肝胰腺组织亚细胞结构的影响正常的肝胰腺上皮细胞顶端密布排列整齐的微绒毛结构(图 4A1);核圆形,核膜完整光滑,染色质均匀分布,可见核仁(图 4 A2);核周分布有大量粗面内质网,呈层状排列(图 4 A3);线粒体丰富,呈圆形、长椭圆形或杆状,双层膜结构清晰可见,嵴结构完整(图 4 A4).
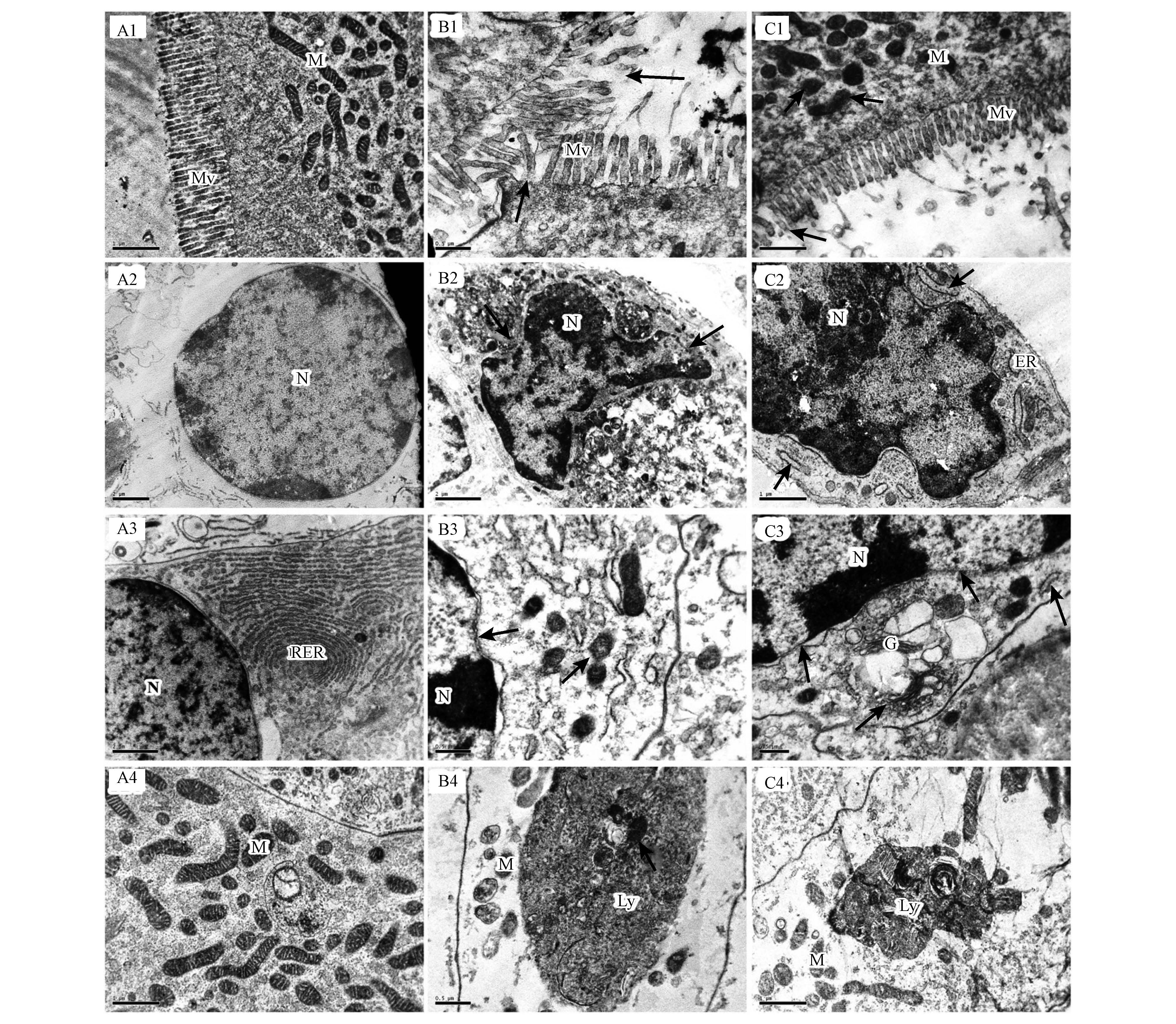 |
| 图 4 镉暴露对河南华溪蟹肝胰腺组织超微结构的影响 (A1~A4,对照组:A1. 20000×,微绒毛;A2. 8000×,细胞核;A3. 10000×,各细胞器形态;A4. 20000×,线粒体;B1~B4,急性处理组:B1. 30000×,微绒毛排列紊乱,部分脱落、融解、消失(↑);B2. 10000×,染色质边集,核膜融解(↑);B3. 30000×,核变形,线粒体损伤,基质局部电子密度降低,嵴结构不清(↑);B4. 30000×,自噬体,似吞有线粒体结构的物质(↑);C1~C4,亚慢性处理组:C1. 20000×,少数微绒毛脱落,线粒体结构模糊(↑);C2. 20000×,细胞核变形,核染色质浓缩,内质网肿胀;C3. 25000×,核膜模糊,内质网扩张,核糖体脱落(↑),高尔基体异常(↑);C4. 20000×,自噬体;Mv:微绒毛;M:线粒体;N:细胞核;Nu:核仁;RER:粗面内质网;ER:内质网;Ly:溶酶体;G:高尔基体) Fig.4 Effects of Cd on ultrastructure of hepatopancreas in S. henanense(A1~A4, control group: A1. 20000×, the microvilli; A2. 8000×, the nucleus; A3. 10000×, the rough endoplasmic reticulum and cytomembrane are normal; A4. 20000×, the normal mitochondria.B1~B4, treated with acute group: B1. 30000×, the partial microvilli are deformed and disruption (↑); B2. 10000×, shows chromatin condensation and nuclear membrane disruption (↑); B3. 30000×, shows the nuclear membrane deformation, and the membrane structure of mitochondria is faint (↑); B4. 30000×, shows abundant of autophagosome, and it seems that one mitochondrion is phagocytized (↑).C1~C4, treated with subchronicgroup: C1. 20000×, the changes of the apical microvilli are not obvious, and the membrane structure of mitochondria is faint (↑); C2. 20000×, chromatin is condensed and the cytomembrane is distorted, the rough endoplasmic reticulum cisternae are dilated (↑); C3. 25000×, shows nuclear membrane ruptures (↑), rough endoplasmic reticulum cisternaes are dilated (↑), and the Golgi complex is abnormal; C4. 20000×, shows the area of autophagosome. Mv: microvilli; M: mitochondria; N: nucleus; Nu: nucleolus; RER: rough endoplasmic reticulum; ER: endoplasmic reticulum; Ly: lysosome) |
急性Cd染毒组的肝胰腺上皮细胞损伤严重:部分微绒毛脱落、融解、消失(图 4 B1,↑);细胞核变形严重,异染色质严重浓缩边集,核膜内凹,断裂(图 4 B2,↑);核膜不光滑,细胞器减少,线粒体膜结构消失(图 4 B3,↑);自噬溶酶体大量出现,其内可见多种结构,如空泡、某些膜结构、脂褐素等,其中一个自噬体内似吞有线粒体(图 4 B4,↑).
亚慢性处理组的微绒毛结构损伤不明显,但可见多数线粒体肿胀(图 4 C1,↑);核变形,染色质浓缩(图 4 C2、C3);内质网扩张、扭曲、核糖体脱落,高尔基体的形态结构异常(图 4 C3,↑);可见体积巨大的自噬溶酶体(图 4 C4).
4 讨论(Discussion)本实验中,两种方式的镉暴露浓度均远远高于实际水环境中的镉含量,然而在一些极端的污染地区,如矿山、冶炼工厂排放的废水中,镉浓度高达26.5 mg · L-1(赵传冬等,2008).根据本课题组之前的调查结果显示:在溪蟹的广布流域之一——山西省第二大河流沁河的表层沉积物中,镉含量可达到(12.46±1.88)mg · kg-1,这具有很高的生态风险(韩托等,2008).河流沉积物是水环境重金属的主要蓄积库,在一定的物理和化学条件下,如水环境中pH降低、水体流速改变等,可使镉再次溶出而造成水体再次污染(魏俊峰等,2003;马叶等,2009).
当水生动物处于被镉污染的水体中时,可通过消化系统将镉吸收进入体内.研究表明,镉暴露下,动物主要通过3种应答机制来防御镉对机体造成的损伤:①启动应激反应,如超氧化物歧化酶(SOD)、 过氧化氢酶(CAT)等其他抗氧化防御系统(Souid et al., 2013);②合成更多的可螯合镉的蛋白质(如金属硫蛋白)以消除多余的镉(Mao et al., 2012);③降低自身的代谢速率,减少与外界物质的交换,以避免对镉更多的吸收(Xuan et al., 2013).一旦体内镉的积累速度超出机体自身的解毒和代谢能力时,就会产生毒性作用,如诱导活性氧(ROS)的产生,此物质可与体内多种生物大分子物质(如酶、核酸、脂类等)发生氧化反应,进而引起细胞损伤,甚至可导致器官病变(Cuypers et al., 2010).
基于不同的胁迫方式对生物体所造成的损伤程度不同,因此,本研究采用了两种不同的暴露方法,以检测镉染毒对溪蟹消化系统形态结构所产生的毒害作用.
4.1 镉对河南华溪蟹消化系统亚细胞结构损伤的分析溪蟹消化系统各组织细胞的超微结构显示,染毒组的细胞核均失去正常形态,出现染色质凝聚、固缩且边集化,核膜不完整的现象.镉具有遗传毒性,可直接作用于核酸分子,并通过抑制DNA修复过程中关键酶的活性而抑制DNA损伤的修复,使得DNA链断裂,甚至可影响细胞的分裂,细胞核结构受损(赵伟等,2005).
研究表明,镉可引起氧化损伤而对线粒体产生毒性作用(Zamzami et al., 1995).镉可与线粒体表面的含巯基蛋白结合,引起线粒体膜的通透性增加(Dorta et al., 2003);另外,镉诱导产生大量ROS会损伤线粒体膜,在膜上形成PT孔,即“渗透性临时孔道”,导致线粒体基质膨胀、膜电位下降,破坏线粒体膜的完整性(Gobe et al., 2010).因此,出现实验结果中各消化系统组织的线粒体嵴数量减少、消失,外膜不全的现象.
中肠和肝胰腺组织细胞中粗面内质网和高尔基复合体在镉暴露后都出现了明显的损伤.这两种细胞器主要参与各种蛋白的合成、组装、转运、修饰等过程,细胞器结构的改变必会影响这些正常功能(Schuwerak et al., 2003).中肠和肝胰腺是甲壳动物重要的消化和分泌器官,镉的毒性将影响其对蛋白的合成、酶的分泌、营养物质和能量的储存等多种生理功能(Liu et al., 2013).
两种方式的镉胁迫后还观察到中肠、后肠和肝胰腺组织中的溶酶体数量增多,且自噬溶酶体和髓样体结构大量出现.这是典型细胞中金属离子过量的自我保护现象,可以此方式来清除异物,维持体内的平衡机制(Wu et al., 2009).然而,如果大量自身成分被消耗会导致细胞坏死(Rubinstein et al., 2011):当溶酶体在吞噬的时候发生溶酶体酶漏出,从而引起细胞自溶,这表明镉暴露会对消化系统各组织细胞造成严重损伤.
中肠与肝胰腺上皮细胞微绒毛结构在两种方式的镉胁迫后均受到不同程度的损伤,这会减弱这两种组织对食物中营养物质的吸收(吴波等,2011),引起消化功能障碍,进而更多的损伤发生、细胞坏死,导致恶性循环.最终,溪蟹消化系统受到严重破坏.
由于镉会对聚集在肌原纤维周围的线粒体产生损伤,造成线粒体结构破坏,其提供能量的功能丧失,使肌原纤维处于饥饿状态,收缩失去动力,导致肌原纤维断裂(Kruatrachue et al., 2003).本实验中,两种方式的镉处理溪蟹后,食道和后肠组织中肌原纤维发生的明显改变将造成溪蟹消化功能紊乱.
4.2 镉胁迫对河南华溪蟹消化系统损伤程度的比较两种方式的镉胁迫后,溪蟹中肠和肝胰腺组织的损伤程度较食道和后肠组织严重.溪蟹的食道是一条肌性管道,是消化系统中最初级的消化器官,没有主要的消化吸收功能(姜永华等,2009).而中肠可有效地对食物进行消化,并吸收营养,是甲壳动物最重要的消化器官之一(Sousa et al., 2006),吸收作用可将更多的镉积累在此,导致结构受损严重,这必然会影响其正常的生理功能(Bishak et al., 2015).后肠上皮中发达的肌层可促使粪便从肛门排出,为蟹类消化过程中的最后一个器官.肝胰腺是甲壳类动物重要的解毒器官,其对外界环境的改变非常敏感,可以减轻甚至消除外来有毒物质对机体的毒害作用,所以也极易受到有害物质的损伤(Johnston et al.,1998).两种方式的镉胁迫后,溪蟹主要消化系统组织的形态结构均受到了不同程度的损伤,其消化、吸收、分泌和解毒等重要生理功能必然受到影响,引起自身代谢机能降低,甚至会导致溪蟹活动力减弱,直至死亡(楼哲丰等,2013).
在急性处理组,溪蟹在短期内难以适应周围高浓度镉的生存环境,水体中的镉通过消化、呼吸等作用方式迅速进入溪蟹体内,而镉的积累量也大大超过了体内所能合成的蛋白对其的螯合能力,未被结合的镉可诱导活性氧物质的生成,引起脂质过氧化反应,导致细胞氧化损伤(Sevcikova et al., 2011),进而造成了对组织器官的毒害作用,因此,对溪蟹产生的毒害作用较大.而亚慢性处理组为溪蟹提供了一个低浓度长时间的染毒过程,肠道或鳃等器官吸收的镉逐渐转移至解毒器官肝胰腺和其他组织中,机体自身的解毒机制也慢慢适应了这种毒性环境,有人假设这种适应性是一种金属抗性机制(Annabi et al., 2011).所以,本实验中急性镉处理组中溪蟹消化系统各部位组织的形态结构损伤程度都较亚慢性处理组的严重.此结果提示,水环境中急性高浓度镉暴露对于水生动物的毒害作用更大,但该推论还有待进一步的验证.
该研究揭示了溪蟹消化系统对急性和亚慢性镉处理的应激反应存在差异性,可以为进一步利用水生动物鉴定水体的突发性高浓度污染和长期低浓度污染提供实验依据.
5 结论(Conclusions)1)在所研究的溪蟹消化系统的4种器官中,中肠和肝胰腺的损伤情况较为严重,甚至出现大量细胞坏死,提示镉暴露会对溪蟹的消化功能产生一定影响.
2)两种方式的镉胁迫均可对溪蟹消化系统产生毒害作用,且急性高浓度的镉暴露可导致溪蟹消化系统形态结构严重损伤.
| [1] | Angeletti R,Binato G,Guidotti M,et al.2014.Cadmium bioaccumulation in Mediterranean spider crab (Maya squinado): Human consumption and health implications for exposure in Italian population[J].Chemosphere,100: 83-88 |
| [2] | Annabi A,Messaoudi I,Kerkeni A,et al.2011.Cadmium accumulation and histological lesion in mosquitofish (Gambusia affinis) tissues following acute and chronic exposure[J].International Journal of Environment Research,5(3): 745-756 |
| [3] | Bishak Y K,Payahoo L,Osatdrahimi A,et al.2015.Mechanisms of cadmium carcinogenicity in the gastrointestinal tract[J].Asian Pacific Journal of Cancer Prevention,16(1): 9-21 |
| [4] | Cresswell T,Simpson S L,Smith R E W,et al.2014.Bioaccumulation and retention kinetics of cadmium in the freshwater decapod Macrobrachium australiense[J].Aquatic Toxicology,148: 174-183 |
| [5] | Cuypers A,Plusquin M,Remans T,et al.2010.Cadmium stress: an oxidative challenge[J].BioMetals,23(5): 927-940 |
| [6] | Dorta D J,Leite S,DeMarco K C,et al.2003.A proposed sequence of events for cadmium-induced mitochondrial impairment[J].Journal of Inorganic Biochemistry,97(3): 251-257 |
| [7] | Gobe G,Crane D.2010.Mitochondria,reactive oxygen species and cadmium toxicity in the kidney[J].Toxicology Letters,198(1): 49-55 |
| [8] | 韩托,王茜,王兰.2008.山西沁河流域溪蟹生态调查及河流污染现状[J].四川动物,27(5): 804-806 |
| [9] | 胡蓉,唐正义.2011.镉对鲫鱼肝胰脏CAT和SOD活性的影响[J].西南大学学报 (自然科学版),33(8): 94-98 |
| [10] | 姜永华,颜素芬.2009.中国龙虾消化道的组织学与组织化学研究[J].集美大学学报 (自然科学版),14(3): 211-223 |
| [11] | Johnston D J,Alexander C G,Yellowlees D.1998.Epithelial cytology and function in the digestive gland of Thenus orientalis (Decapoda: Scyllaridae)[J].Journal of Crustacean Biology,18(2): 271-278 |
| [12] | Kavitha R,Deepa Rani S,Sivagnanam S,et al.2013.Cadmium nanoparticle induced histological and biochemical changes in hepatopancreas of mud crab Scylla olivacea (Herbst,1796)[J].Journal of Academic Industrial and Research,2(3): 205-209 |
| [13] | Kruatrachue M,Rangsayatorn N,Pokethitiyook P,et al.2003.Histopathological changes in the gastrointestinal tract of fish,Puntius gonionotus,fed on dietary cadmium[J].Bulletin of Environmental Contamination and Toxicology,71(3): 561-569 |
| [14] | Lei W W,Wang L,Liu D M,et al.2011.Histopathological and biochemical alternations of the heart induced by acute cadmium exposure in the freshwater crab Sinopotamon yangtsekiense[J].Chemosphere,84(5): 689-694 |
| [15] | Liu D M,Yang J,Li Y J,et al.2013.Cd-induced apoptosis through the mitochondrial pathway in the hepatopancreas of the freshwater crab Sinopotamon henanense[J].PLoS One,8(7): e68770 |
| [16] | 楼哲丰,曹琼洁,冯钰淇,等.2013.镉对果蝇肠道上皮细胞损伤和调控中肠干细胞增殖、分化机制的研究[J].中国细胞生物学学报,35(5): 602-608 |
| [17] | 马叶,贝荣塔,孙丽菲.2009.河流中污染底质镉解吸规律的研究[J].环境研究与监测,22(4): 4-8 |
| [18] | Mao H,Wang D H,Yang W X.2012.The involvement of metallothionein in the development of aquatic invertebrate[J].Aquatic Toxicology,110-111: 208-213 |
| [19] | Mason C F.1991.Biology of freshwater pollution (2nd ed.)[M].New York: Long-Man.351 |
| [20] | Pablos M V,García-Hortigüela P,Fernández C.2015.Acute and chronic toxicity of emerging contaminants,alone or in combination,in Chlorella vulgaris and Daphnia magna[J].Environmental Science and Pollution Research,22(7): 5417-5424,doi: 10.1007/s11356-015-4119-1 |
| [21] | Rainbow P S,White S L.1989.Comparative strategies of heavy metal accumulation by crustaceans: zinc,copper and cadmium in a decapod,an amphipod and a barnacle[J].Hydrobiologia,174(3): 245-262 |
| [22] | Rubinstein A D,Eisenstein M,Ber Y,et al.2011.The autophagy protein atg12 associates with antiapoptotic Bcl-2 family members to promote mitochondrial apoptosis[J].Molecular Cell,44(5): 698-709 |
| [23] | Schuwerak P M M,Lewis J W.2003.The mode of action of acute and chronic concentrations of waterborne Cd in the digestive gland of the acclimated infested freshwater crab (Potamonautes warreni)[J].Cell and Tissue Research,312(2): 249-263 |
| [24] | Sevcikova M,Modra H,Slaninova A,et al.2011.Metals as a cause of oxidative stress in fish: a review[J].Veterinarni Medicina,56(11): 537-546 |
| [25] | Souid G,Souayed N,Yaktiti F,et al.2013.Effect of acute cadmium exposure on metal accumulation and oxidative stress biomarkers of Sparus aurata[J].Ecotoxicology and Environmental Safety,89: 1-7 |
| [26] | Sousa L,Petriella A M.2006.Morphology and histology of P.argentinus (Crustacea,Decapoda,Caridea) digestive tract[J].Biocell,30(2): 287-294 |
| [27] | Thophon S,Kruatrachue M,Upatham E S,et al.2003.Histopathological alterations of white seabass,Lates calcarifer,in acute and subchronic cadmium exposure[J].Environment Pollution,121(3): 307-320 |
| [28] | Wang L,Xu T,Lei W W,et al.2011.Cadmium-induced oxidative stress and apoptotic changes in the testis of freshwater crab,Sinopotamon henanense[J].PLoS One,6(11): e27853 |
| [29] | 王民生,马文军.2011.消化系统毒理学[M].北京: 北京大学医学出版社 |
| [30] | 魏俊峰,吴大清,彭金莲,等.2003.污染沉积物中重金属的释放及其动力学[J].生态环境,12(2): 127-130 |
| [31] | 吴波,李薇,付玉梅,等.2011.重金属镉对参环毛蚓胃肠道上皮细胞超微结构损伤的研究[J].中药材,34(12): 1832-1837 |
| [32] | Wu G X,Gao X,Ye G Y,et al.2009.Ultrastructural alterations in midgut and Malpighian tubules of Boettcherisca peregrina exposure to cadmium and copper[J].Ecotoxicology and Environmental Safety,72(4): 1137-1147 |
| [33] | Wu H,Xuan R J,Li Y J,et al.2013.Effects of cadmium exposure on digestive enzymes,antioxidant enzymes,and lipid peroxidation in the freshwater crab Sinopotamon henanense[J].Environmental Science and Pollution Research,20(6): 4085-4092 |
| [34] | Wu H,Xuan R J,Li Y J,et al.2014.Biochemical,histological and ultrastructural alterations of the alimentary system in the freshwater crab Sinopotamon henanense subchronically exposed to cadmium[J].Ecotoxicology,23(1): 65-75 |
| [35] | 吴昊,张小民,轩瑞晶,等.2014.河南华溪蟹消化系统的形态结构观察和组织学研究[J].水产学报,38(7): 956-964 |
| [36] | Xuan R J,Wu H,Lin C D,et al.2013.Oxygen consumption and metabolic responses of freshwater crab Sinopotamon henanense to acute and sub-chronic cadmium exposure[J].Ecotoxicology and Environmental Safety,89: 29-35 |
| [37] | 轩瑞晶.2013.镉对华溪蟹糖和蛋白质分解代谢的影响机制研究[D].太原:山西大学 |
| [38] | Zamzami N,Marchetti P,Castedo M,et al.1995.Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death[J].The Journal of Experimental Medicine,182(2): 367-377 |
| [39] | 赵传冬,陈富荣,陈兴仁,等.2008.长江流域沿江镉异常源追踪与定量评估的方法技术研究: 以长江流域安徽段为例[J].地学前缘(中国地质大学(北京); 北京大学),15(5): 179-193 |
| [40] | 赵伟,王强.2005.镉的遗传毒性及其机制和解毒[J].环境与职业医学,22(4): 371-372 |
 2015, Vol. 35
2015, Vol. 35


