2. 环境保护部华南环境科学研究所, 广州 510655
2. South China Institute of Environmental Sciences, MEP, Guangzhou 510655
目前农业生产中广泛使用地膜、农药、化肥等农用化学品,造成多种有机物对农田土壤的复合污染.邻苯二甲酸酯(PAEs)是一类环境内分泌物质,作为地膜增塑剂,易从地膜中释出而造成土壤污染.邻苯二甲酸二丁酯(DBP)是最常见的PAEs之一,在各类环境中广泛存在,为优先控制污染物(高军和陈伯清,2008).氰戊菊酯是一种常见的拟除虫菊酯类农药,在农业生产中广泛使用,造成其在土壤中大量残留.据研究,氰戊菊酯在蔬菜中的检出率较高(李雪飞等,2006),对水生生物的危害也比较大(赵玉琴等,2008).因此,如何修复复合污染农田土壤,以减少污染物对环境的危害和提高农产品品质和安全,是当前研究的热点.
DBP和氰戊菊酯都是农田土壤中典型的常见有机污染物,其光解和自然化学降解都非常缓慢,生物降解是其在环境中降解的主要途径.近年来,关于细菌降解DBP和氰戊菊酯的报道比较多(Chen,2011; 陈少华等,2011a; 段星春等,2007; 李俊等,2005; Liao et al., 2010; Lu et al., 2009; 汤鸣强等,2010),但关于真菌降解的报道较少.有研究表明,白腐真菌可以高效降解DBP(Lee et al., 2004);黑曲霉、芽枝霉属可以降解氰戊菊酯(Liang et al., 2005; Chen et al., 2011).上述这些研究,主要针对DBP或氰戊菊酯单独研究,关于真菌同时降解两者的研究尚未见报道.实际农田土壤中往往是DBP、氰戊菊酯同时存在,它们共存时产生的相互作用使得生物降解过程更加复杂.本研究筛选到1株可同时降解DBP和氰戊菊酯的真菌菌株并研究其降解特性,以期为同类污染土壤的修复提供种质资源和理论依据.
2 材料与方法(Materials and methods) 2.1 试验材料培养基:富集培养基(马丁氏真菌培养基),葡萄糖10 g,蛋白胨5 g,KH2PO4 1.0 g,MgSO4 · 7H2O 0.5 g,H2O 1000 mL,调节pH 7.0,115 ℃高压蒸汽灭菌20 min后冷却至55~60 ℃,加入0.02%的氯霉素,固体培养基需加琼脂1.5%~2.0%;基础培养基:(NH4)2SO4 1.0 g,KH2PO4 1.0 g,MgSO4 · 7H2O 0.2 g,CaCl2 0.1 g,FeCl3 0.01 g,H2O 1000 mL,调节pH 7.0,121 ℃高压蒸汽灭菌20 min.
主要试剂:DBP和氰戊菊酯标准品(纯品),购自上海安谱科学仪器有限公司;丙酮、石油醚(30~60 ℃),正己烷均为色谱纯,购自北京迪科马试剂有限公司;其余试剂为国产分析纯,购自广州市东征化玻有限公司.
主要仪器:HYQ-180型生物摇床(武汉汇城科技仪器有限公司)、RE-5299旋转蒸发器(河南巩义予华仪器有限责任公司)、Spectrumlab 752SP紫外可见光分光光度计(上海棱光技术有限公司)、Pulverisette 2土壤臼式研磨机(广州予康科学仪器有限公司)、Centrifuge 5804R离心机(Eppendorf,德国)、GC-17A气相色谱仪(Shimadzu,日本).
2.2 试验方法 2.2.1 降解真菌的富集筛选供试土壤样品采自广东省西部某市水稻田的耕作层,土样各项指标如下:有机质23.8 g · kg-1,总氮1300 mg · kg-1,有效磷193 mg · kg-1,速效钾126.3 mg · kg-1,pH 5.06.取土样10 g,装入有90 mL富集培养基、4~5粒玻璃珠的250 mL三角瓶,28 ℃,180 r · min-1振荡30 min,静置30 min.取10 mL上清液加入140 mL含DBP和氰戊菊酯的基础培养基中进行3次梯度驯化.每个梯度DBP和氰戊菊酯的浓度分别为100、200和400 mg · L-1,每次取10 mL菌液转入140 mL新鲜培养基中,28 ℃,120 r · min-1培养7 d,加入0.02%氯霉素抑制细菌生长.最后取1 mL菌液平板涂布到真菌培养基,28 ℃培养7 d,将不同形态的菌落分别平板划线得到单菌落,斜面保存.以上操作均在无菌条件下进行.
2.2.2 分离菌株对DBP和氰戊菊酯的降解能力测定将分离纯化后的不同菌种以菌量D660 nm=0.5(约为0.16 g · L-1)分别接种到含50 mg · L-1 DBP、氰戊菊酯及DBP和氰戊菊酯复合的100 mL无菌液体基础培养基,28 ℃,120 r · min-1培养7 d,以不接种基础培养基为非生物降解对照,检测DBP和氰戊菊酯的降解率和菌丝体干重,确定最佳降解菌种.DBP和氰戊菊酯的提取与分析参考文献(韩蕊等,2013),采用正己烷和石油醚1 ∶ 1萃取3次,有机滤液并入梨形瓶,38 ℃下旋蒸近干,用正己烷定容到色谱瓶中至1 mL,GC检测分析.检测条件如下:毛细管色谱柱,DB-5(30 m×0.32 mm);载气,氮气(纯度≥99.999%);进样口温度240 ℃,检测器(ECD)温度320 ℃;分流进样,分流比为10 ∶ 1,进样量1 μL;升温程序,起始温度150 ℃,保持2 min,以6 ℃ · min-1升温至270 ℃,保持20 min.
2.2.3 菌种鉴定形态学鉴定主要通过培养特征观察和电镜扫描技术观察生长期的个体形态及菌落特征等方法进行,生理生化特性鉴定参考真菌鉴定手册(魏景超,1979),菌种的26S rDNA序列测定及系统发育分析委托广东省微生物分析检测中心鉴定.
2.2.4 菌株降解条件优化对2.2.2节确定的菌株,考察外加碳源(葡萄糖)、有机物浓度和pH值对降解效果的影响.按照正交试验(表 1)进行,采用基础培养基,每瓶100 mL,接菌量OD660 nm=0.5,表中浓度为2种有机物分别的浓度值,通过添加1 mol · L-1的NaOH调节pH值,28 ℃,120 r · min-1培养7 d,用未接种的基础培养基为对照.测定DBP、氰戊菊酯含量和菌液pH值,计算降解率,确定最优降解条件.
| 表 1 正交试验的因子水平表 Table 1 Factor levels for orthogonal experiment |
配制DBP和氰戊菊酯的浓度梯度分别为0、25、50、75、100 mg · L-1基础培养基,1 mol · L-1 NaOH调节pH值至7.0~7.5左右.对2.2.2节确定菌株,扩大培养制成试验菌液.吸取10 mL 菌液(OD660 nm=0.5),加入90 mL含不同浓度梯度DBP和氰戊菊酯的基础培养基中,28 ℃,120 r · min-1培养7 d,对照组加入10 mL灭菌水作为自然降解对照,研究DBP和氰戊菊酯的降解效果.另外,采用同样的培养方法,将菌液加入到含50 mg · L-1的DBP和氰戊菊酯的基础培养基中,培养10 d,分别在0、2、4、6、8和10 d时取样,分析DBP和氰戊菊酯的残留量,对DBP和氰戊菊酯的降解动力学进行线性拟合.DBP和氰戊菊酯的检测分析参照2.2.2节.
3 结果与分析(Results and analysis) 3.1 降解真菌的分离和筛选通过富集培养、分离、纯化,共得到4株降解效果较好的真菌,分别命名为:DY1,DY2,DY3和DY4.由表 2可以看出,对DBP和氰戊菊酯降解率最高且生物量最大的菌种为DY4,其对50 mg · L-1的DBP和氰戊菊酯的降解率分别为84.13%和37.07%.4种真菌对DBP的降解率一般较氰戊菊酯的高,DBP和氰戊菊酯共存时,DBP的降解率大大降低(由84.13%降为47.97%),说明氰戊菊酯的加入会对DY4产生一定的毒害作用,进而影响到DY4对DBP的降解,这可能是由于氰戊菊酯化学结构中所含的氯苯基和氰基会对微生物产生较大的毒害作用,降低微生物的活性,使其降解能力下降.
| 表 2 4株真菌对DBP和氰戊菊酯的降解率 Table 2 Degradation rate of DBP and fenvalerate by four fungi |
菌株DY4的液体培养基中培养液混浊,形成絮状物,表面形成膜.固体平板上菌落形态观察,菌落成平板扩散,生长快,乳白色,绒毛状并带粉状,中心突起,有放射线纹(图 1).高倍显微镜及电镜观察,具有真菌隔菌丝和节孢子,无出芽细胞,电镜下观察菌丝裂殖为圆柱形或圆筒形的节孢子.形成有隔膜真菌丝,有的有二叉分枝,无子囊孢子(图 2).
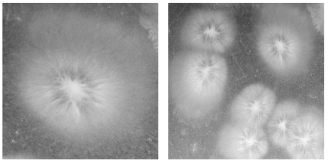 |
| 图 1 DY4菌落形态 Fig.1 Colonial morphology of DY4 |
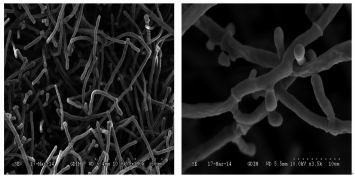 |
| 图 2 DY4电镜照片 Fig.2 Electron microscopy images of DY4 |
DY4的26S rDNA序列与地霉属(Geotrichum sp.)的同源性达99.8%,将菌株的26S rDNA 基因序列与GenBank中的已知序列进行了分析比对,从GenBank 中取得相关序列作为参考菌株序列,首先使用 Clustal X将序列进行完全比对,然后使用程序Mega的Neighbor-joining法对其作系统进化树(图 3).数据自展重抽样次数 1000 次.
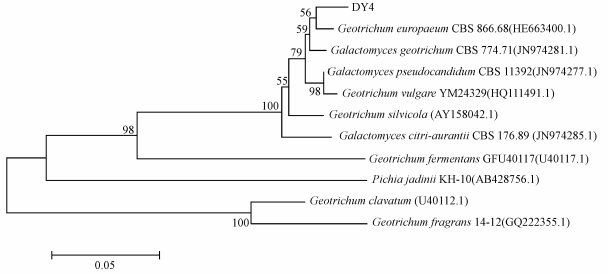 |
| 图 3 根据菌株DY4及相关菌株的26S rDNA构建的系统发育树 Fig.3 Phylogenetic tree based on the 26S rDNA sequences of strain DY4 and the related strains |
葡萄糖发酵试验杜氏管中无气体产生,硝酸盐试验中硝酸钾含量几乎没有下降,尿素分解试验中培养基不呈红色,说明没有脲酶产生;以上试验DY4均呈阴性,结合抗放线菌酮测试、碳源利用试验等生理生化试验,可知菌株DY4与地霉属(Geotrichum sp.)最相似.
3.3 菌株DY4降解条件优化正交试验的降解结果见表 3.考虑外加碳源(葡萄糖)浓度、有机物浓度和pH值对降解率的影响,用正交试验极差分析,根据试验获得的DBP和氰戊菊酯降解率计算K、k和R值(表 4).其中,K为同一因素各水平的试验结果相加之和,k为K的平均值,R为极差值,即同一因素中k最大值减k最小值.R值越大说明该因素对试验的影响越大,反之越小;K值越大说明在同一因素中该水平对试验的影响越大,反之越小.
| 表 3 正交试验设计及试验结果 Table 3 Orthogonal experiment design and results |
结合表 4,比较R值,可以看出pH值对DBP和氰戊菊酯的降解试验结果影响最大,外加碳源(葡萄糖)浓度对降解试验结果影响最小;比较K值,可以得出正交试验的最优降解条件是葡萄糖浓度为0 g · L-1,有机物浓度为25 mg · L-1,pH值为7.5.当葡萄糖浓度为0.5%和1%时,试验终止时的pH值下降至3~3.5(表 3),可能是因为降解过程中葡萄糖的加入,使得微生物优先降解葡萄糖,产生小分子有机酸,酸性物质积累,对微生物造成危害,打破了降解平衡,不利于真菌的生长和有机物的降解.
| 表 4 不同因素不同水平计算得出的K、k和R值 Table 4 K, k and R value calculated by different levels of factors |
如图 4所示,在不同浓度条件下,DBP的降解率均大于氰戊菊酯的,可能与分子的大小和结构复杂程度有关.氰戊菊酯分子量大于DBP,分子结构中含有氰基、苯氧基及氯苯基等,较DBP复杂,且氰戊菊酯的辛醇-水分配系数(KOW =6.20)大于DBP(KOW =4.45)的(Fan et al., 1997; 隆兴兴等,2006),疏水性较强,较难被微生物利用.DBP和氰戊菊酯的降解规律一致,均是25 mg · L-1 > 75 mg · L-1 > 50 mg · L-1 > 100 mg · L-1,在25 mg · L-1时的降解率最高,分别达到65.36%和55.77%,此处理组的菌液OD值也最高,说明真菌生长状态也最好.随着处理浓度的增加,DBP和氰戊菊酯降解率下降,菌液OD值也呈下降趋势,但两者没有相关关系;DBP和氰戊菊酯在100 mg · L-1时的降解率最低,分别为36.83%和34.89%,但此时菌液的OD值并不是最低,说明菌株DY4可以耐受较高浓度的DBP和氰戊菊酯.
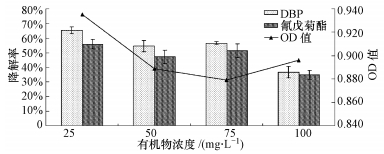 |
| 图 4 DBP和氰戊菊酯在液体培养基中的降解效果及菌液OD值 Fig.4 Degradation rate of DBP and fenvalerate and OD value in culture medium |
为了解菌株DY4在DBP和氰戊菊酯共存时的降解行为,采用一级动力学模型,对0、2、4、6、8和10 d的农药残留量(c)和时间(t)进行拟合,降解动力学方程为Ct=C0×e-kt,其中Ct代表降解后某时间点有机污染物的浓度,C0代表有机污染物的初始浓度,k代表降解速率常数,t代表降解时间,半衰期t1/2= ln2/k,方程的拟合度由可决系数(R2)进行评价.拟合的结果见表 5,从中可知,菌株DY4对50 mg · L-1 DBP和氰戊菊酯的同时降解反应符合一级动力学方程,可决系数(R2)分别为0.9878和0.9947,拟合相关度较好.在最优降解条件下,DBP和氰戊菊酯的半衰期分别为4.46和6.88 d.
| 表 5 DBP和氰戊菊酯降解的一级动力学拟合结果 Table 5 The curve fitting results of the first-order kinetic model for DBP and fenvalerate degradation |
微生物降解是去除农田土壤中复合有机污染物的主要途径,筛选出可以同时高效降解PAEs和农药的土著微生物是开展典型有机物复合污染农田土壤生物修复工作的重要前提.本研究从长期受PAEs和农药污染的农田土壤中筛选出1株高效并同时降解DBP和氰戊菊酯的真菌DY4,经鉴定为地霉属(Geotrichum sp.)种,该菌株能够分别以DBP和氰戊菊酯为唯一碳源,7 d内对50 mg · L-1的DBP和氰戊菊酯的降解率分别为84.13%和37.07%,将DBP和氰戊菊酯复合在一起,降解率分别为47.97%和42.12%,说明农药较难降解且影响微生物的降解功能.农药分子结构中所含的卤素、氮、氢等原子,会影响到生物降解,再加上苯环、类苯环的出现,生物降解会更加困难(王乃亮和杜斌,2010),农药中的个别基团或其代谢中间产物对微生物具有毒害作用,有的中间产物甚至毒性更大,比如毒死蜱,降解中间产物3,5,6-三氯-2-吡啶(TCP)的毒性就远远大于毒死蜱(Sardar et al., 2005).
正交设计是研究多因素多水平的一种试验设计方法,被广泛应用于微生物降解试验.有正交试验研究得出微杆菌(Microbacterium sp.)对氯氰菊酯降解的最适培养温度、加菌量、培养基、底物浓度和装液量(杨娜,2007);爪哇正青霉(Eupenicillum javanicun)对PAEs的最优降解条件是C ∶ N为20 ∶ 1,pH为7.0,PAEs初始浓度为50 mg · L-1(韩蕊等,2013);本试验得出菌株DY4的最优降解条件为有机物浓度25 mg · L-1、pH 7.5和无外加碳源.当培养液中外加碳源(葡萄糖)浓度较高时,由于可利用的碳源十分充足,真菌能够充分生长,但作为碳源,葡萄糖比DBP和氰戊菊酯更易于被真菌利用从而减少了真菌对DBP和氰戊菊酯的降解,使降解率降低(秦坤,2010),这与陈莉等(2008)的研究结果相反,他们认为适量外加碳源葡萄糖的加入对氰戊菊酯的降解有刺激作用.
有研究表明,假单胞菌属(Pseudomonas sp.)在以100 mg · L-1氰戊菊酯农药为唯一碳源的基础培养基中培养5 d,对氰戊菊酯的降解率达64.32%,对氰戊菊酯的耐受度最高可达1500 mg · L-1(田盼,2009),戴尔福特菌(Delftia tsuruhatensis)对100 mg · L-1氰戊菊酯、溴氰菊酯、高效氯氟氰菊酯的降解率分别为30.87%、33.90%和45.69%,且戴尔福特菌能够耐受600 mg · L-1的联苯菊酯浓度(景岳龙,2010),说明假单胞菌和戴尔福特菌对农药的降解率不高,但均属于高浓度耐受农药菌种.本试验筛菌过程中,有机污染物的最高浓度达到800 mg · L-1,DY4仍能存活且能降解DBP和氰戊菊酯;在菌株的降解特性试验中,DY4对100 mg · L-1的DBP和氰戊菊酯降解率最低,但菌量并不是最低,说明菌株DY4也可以耐受较高浓度的DBP和氰戊菊酯.
目前国内外在有关PAEs和农药的研究中,很多学者认为可用一级动力学方程来描述其降解过程.据报道,5种PAEs(DMP、DEP、DBP、DAP和DOP)的生物降解反应符合一级降解动力学方程,最终降解的半衰期为0.5~18 d(叶常明和田康,1989);苍白杆菌(Ochrobactrum sp.)对高效氯氰菊酯、高效氯氟氰菊酯和氰戊菊酯的降解反应也均符合一级降解动力学模型方程,且R2值在0.9481~0.9650之间,其降解半衰期为30~40 h(陈少华等,2011b);假单胞菌属(Pseudomonas sp.)和肠杆菌属(Enterobacter sp.)对土壤中甲基对硫磷和毒死蜱的降解也均符合一级动力学方程(元文静,2010).本试验中菌株DY4对50 mg · L-1 DBP和氰戊菊酯的降解反应符合一级动力学方程,且R2拟合相关度较好.有报道称,PAEs在土壤中的半衰期在数小时到数月之间,拟除虫菊酯类农药在土壤中降解的半衰期一般在几天到几十天之间(汪军等,2013; 张婷,2013),而本试验中菌株DY4对DBP和氰戊菊酯的降解半衰期分别为4.46和6.88 d,说明菌株DY4在控制土壤中PAEs和菊酯类农药残留方面具有一定应用潜力.
5 结论(Conclusions)1)通过富集培养法,从长期受PAEs和农药污染的农田土壤中筛选出一真菌菌株DY4,属于地霉属(Geotrichum sp.),能利用DBP和氰戊菊酯作为唯一碳源,对DBP和氰戊菊酯具有较强的耐性,可同时降解DBP和氰戊菊酯.
2)通过正交试验确定菌株DY4的最优降解条件为无外加碳源、DBP和氰戊菊酯初始浓度为25 mg · L-1、pH值为7.5.
3)在最优降解条件下,菌株DY4在7 d内对25 mg · L-1的DBP和氰戊菊酯降解率分别达到65.36%和55.77%,对DBP和氰戊菊酯的降解反应符合一级动力学方程,两者的半衰期分别为4.46 d和6.88 d.
| [1] | 陈莉, 章钢娅, 胡锋. 2008. 氰戊菊酯在土壤中的降解及其影响因子研究[J]. 土壤学报, 45(1): 90-97 |
| [2] | Chen S H, Hu Q B, Hu M Y, et al. 2011. Isolation and characterization of a fungus able to degrade pyrethroids and 3-phenoxybenzaldehyde [J]. Bioresource Technology, 102(17): 8110-8116 |
| [3] | 陈少华, 罗建军, 胡美英, 等. 2011a. 一株拟除虫菊酯农药降解菌的分离鉴定及其降解特性与途径[J]. 环境科学学报, 31(8): 1616-1626 |
| [4] | 陈少华, 李亚楠, 赖开平, 等. 2011b. 降解菌株 DG-S-01对菜薹和土壤中3种拟除虫菊酯类农药降解动力学的影响[J]. 农药学学报, 13(4): 381-386 |
| [5] | 段星春, 易筱筠, 杨晓为, 等. 2007. 两株邻苯二甲酸二丁酯降解菌的分离鉴定及降解特性的研究[J]. 农业环境科学学报, 26(5): 1937-1941 |
| [6] | Fan G T, Burnision B K, Solomon K R. 1997. The partitioning of fenvalerate to natural dissolved organic matter [J]. Water Research, 31(10): 2429-2434 |
| [7] | 高军, 陈伯清. 2008. 酞酸酯污染土壤微生物效应与过氧化氢酶活性的变化特征[J]. 水土保持学报, 22(6): 166-169 |
| [8] | 韩蕊, 王冬莹, 芮洋, 等. 2013. 一株降解邻苯二甲酸酯真菌的筛选及其降解特性研究[J]. 环境科学学报, 33(11): 2941-2946 |
| [9] | 景岳龙. 2010. 拟除虫菊酯降解菌的筛选、鉴定及降解性能研究[D]. 杨凌: 西北农林科技大学. 28-30 |
| [10] | Lee S M, Koo B W, Lee S S, et al. 2004. Biodegradation of dibutylphthalate by white rot fungi and evaluation on its estrogenic activity [J]. Enzyme and Microbial Technology, 35(5): 417-423 |
| [11] | 李俊, 舒为群, 陈济安, 等. 2005. 降解DBP菌株CQ0302的分离鉴定及其降解特性[J]. 中国环境科学, 25(1): 47-51 |
| [12] | 李雪飞, 杨艳刚, 孙胜龙, 等. 2006. 蔬菜中有机磷、拟除虫菊酯类农药残留调查[J]. 环境与健康杂志, 23(5): 418-420 |
| [13] | Liang W Q, Wang Z Y, Li H, et al. 2005. Purification and characterization of a novel pyrethroid hydrolase from Aspergillus niger ZD11 [J]. Journal of Agricultural and Food Chemistry, 53(19): 7415-7420 |
| [14] | Liao C S, Chen L C, Chen B S, et al. 2010. Bioremediation of endocrine disrupter di-n-butyl phthalate ester by Deinococcus radiodurans and Pseudomonas stutzeri[J]. Chemosphere, 78(3): 342-346 |
| [15] | Lu Y, Tang F, Wang Y, et al. 2009. Biodegradation of dimethyl phthalate, diethyl phthalate and di-n-butyl phthalate by Rhodococcus sp. L4 isolated from activated sludge [J]. Journal of Hazardous Materials, 168(2/3): 938-943 |
| [16] | 秦坤. 2010. 氯氰菊酯降解真菌的筛选及其降解特性研究[D]. 泰安: 山东农业大学.35-37 |
| [17] | Sardar D, Kole R K. 2005. Metabolism of chlorpyrifos in relation to its effect on the availability of some plant nutrients in soil [J]. Chemosphere, 61(9): 1273-1280 |
| [18] | 汤鸣强, 田盼, 尤民生. 2010. 氰戊菊酯降解菌FDB的分离鉴定及其生长特性[J]. 微生物学通报, 37(5): 682-688 |
| [19] | 田盼. 2009. 氰戊菊酯降解菌的筛选及其降解酶的初步纯化[D]. 福州: 福建农林大学. 42-45 |
| [20] | 汪军, 骆永明, 马文亭, 等. 2013. 典型设施农业土壤酞酸酯污染特征及其健康风险[J]. 中国环境科学, 33(12): 2235-2242 |
| [21] | 王乃亮, 杜斌. 2010. 微生物对环境中农药的降解作用[J]. 甘肃科技, 26(21): 93-95 |
| [22] | 魏景超. 1979. 真菌鉴定手册[M]. 上海: 上海科学技术出版社 |
| [23] | 杨娜. 2007. 氯氰菊酯降解菌的分离筛选鉴定与特性研究[D]. 杨凌: 西北农林科技大学. 21-24 |
| [24] | 叶常明, 田康. 1989. 邻苯二甲酸酯类化合物生物降解动力学[J]. 环境科学学报, 9(1): 37-41 |
| [25] | 元文静. 2010. 有机磷农药降解菌的筛选、分离鉴定及其降解动力学特性研究[D]. 兰州: 兰州理工大学. 18-24 |
| [26] | 张婷. 2013. 甲氰菊酯对鲤鳃、肝、肾组织损伤的研究[D]. 武汉: 华中农业大学. 3-6 |
| [27] | 赵玉琴, 李丽娜, 李建华. 2008. 常见拟除虫菊酯和有机磷农药对鱼类的急性及其联合毒性研究[J]. 环境污染与防治, 30(11): 53-57 |
 2015, Vol. 35
2015, Vol. 35


