多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是一类在环境中广泛分布的芳香族化合物,主要来源于石油、煤、塑料等有机物的不完全燃烧,因其较长的半衰期和致癌、致畸、致突变性质而受到广泛关注(Tervahauta et al., 2009).其中,高分子量多环芳烃(High Molecular Weight PAHs,HMW PAHs)是指四环及四环以上的多环芳烃,随着芳香环数和分子量的增加,其疏水性和稳定性相应提高,降解难度远大于低分子量PAHs(Yuliani et al., 2012),因而HMW PAHs污染已成为一个亟待解决的环境问题,严重影响着人类生存环境的质量(Kanaly et al., 2010).因此,寻找快速高效地去除HMW PAHs的方法,减少HMW PAHs对环境的污染问题已成为当今环境研究中的热点.在20世纪90年代发展起来的微生物治理PAHs污染是众多途径中效率最高、研究最多的,因其具有成本低、操作简单且无二次污染等特点而越来越受到关注(Lu et al., 2011).
荧蒽(Fluoranthene)是一种典型的高分子量多环芳烃,广泛存在于石油污染土壤中(Lee et al., 2007),以荧蒽为对象研究微生物对HMW PAHs的降解作用,具有一定的代表性.2009年Wu等(2009)从海洋沉物中筛得一株Ochrobactrum sp.BAP5,鉴定其可利用苯并〖α〗芘为唯一碳源生长,同时也可降解荧蒽等PAHs.周惠娟等(2013)从PAHs污染土壤中分离得到一株能够良好降解荧蒽的Achromobacter xylosoxidans,结果表明,生物降解过程中多种蛋白的表达有显著变化.据研究报道,微生物通过4条途径对荧蒽开环:分别在C-1,2位、C-2,3位,C-7,8位和C-8,9位开裂,最终氧化成邻苯二甲酸(张银萍等,2010);此外,还有水杨酸途径和龙胆酸途径等(赵渝,2007).细菌氧化PAHs主要依靠双加氧酶,这类酶属于非血红素类铁氧化-还原蛋白,其中,邻苯二酚-1,2-双加氧酶(catechol-1,2-dioxygenase,C12O)催化生成内二元醇,邻苯二酚-2,3-双加氧酶(catechol-1,2-dioxygenase,C23O)催化生成外二元醇,促使芳香环彻底开裂,是关键的限速酶(周鑫淼等,2007).2013年,陈志丹从石油污染土壤中筛选到一株降解芘的假单胞菌Pseudomonas sp.B2,优化培养条件并对其C23O进行活性测定和序列分析,进而构建了表达质粒(陈志丹,2013).然而,荧蒽因其分子结构含有4个苯环而极难溶于水,在一些研究中通过直接添加表面活性剂以降低溶液表面张力,促进HMW PAHs的乳化,进而促进其生物降解.如Xu等(2011)从泥浆中分离得到一株可降解荧蒽的Herbaspirillum chlorophenolicum,发现在适当浓度范围内吐温-80可显著增强菌株对荧蒽的降解.其他研究显示,生物表面活性剂鼠李糖脂可以显著促进HMW PAHs的生物降解(Nie et al,2010),并能促进原油的乳化和降解(汤晓等,2008).
基于此,本研究以一株从石油污染的土壤中分离得到的能够以荧蒽为唯一碳源而生长良好的菌株DN1为对象,通过生理生化特性及16S rRNA gene保守序列分析初步确定其为铜绿假单胞菌(Pseudomonas aeruginosa),并探究该菌株产鼠李糖脂的能力、荧蒽的生物降解特性和在荧蒽降解过程中关键酶邻苯二酚1,2-双加氧酶和邻苯二酚2,3双加氧酶的活性变化,为进一步研究荧蒽的微生物降解提供理论基础.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 土壤样品的采集供试土壤采集于陕西延长油田下寺湾采油厂(36°27′36″N,108°55′12″E)内石油污染程度不同的土壤,分别于3个地点收集地表下2 cm深的土壤样品各约100 g,各平行收集3份混合后置于冰盒中保存.新鲜土壤样品过2 mm筛,于暗处4 ℃保存,以供筛选PAHs降解菌用.
2.1.2 培养基实验用培养基有LB培养基、M9无机盐培养基、BPLM培养基、各种鉴定实验所需培养基和反应体系等,配制方法见文献(东秀珠等,2001;沈萍等,2007;周德庆,2006).除特殊说明外,配置时均用蒸馏水定容至1000 mL,121 ℃灭菌30 min,需要用固体培养基时,在此配方基础上加14.00 g · L-1琼脂.
LB培养基:每1000 mL中含蛋白胨10.00 g,酵母提取物5.00 g,氯化钠10.00 g,pH 7.0~7.2.
M9无机盐培养基:每1000 mL中含NH4Cl 1.00 g,Na2HPO4 6.00 g,KH2PO4 3.00 g,NaCl 0. 50 g,MgSO4 0.24 g,pH 7.0.
BPLM培养基:每1000 mL中含5 mL磷酸盐缓冲液(K2HPO4 · 3H2O 25.82 g · L-1,KH2PO4 8.70 g · L-1,Na2HPO4 · 12H2O 33.40 g · L-1,NH4Cl 5.00 g · L-1),3 mL MgSO4 溶液(22.50 g · L-1),1 mL CaCl2溶液(36.40 g · L-1),1.0 mL FeCl3溶液(0.25 g · L-1),1 mL微量元素溶液(MnSO4 39.90 mg · L-1,ZnSO4 · H2O 42.80 mg · L-1,(NH4)7MoO24 · 4H2O 34.70 mg · L-1),添加2%总体积的棕榈油为碳源,5.00 g NaNO3为氮源,pH=7.0.
2.2 实验方法 2.2.1 荧蒽降解菌株的分离与筛选称取10.00 g新鲜土壤,加入到装有100 mL M9无机盐液体培养基(荧蒽浓度为0.50 g · L-1)的三角瓶中,30 ℃、200 r · min-1下振荡培养1周.按10%接种量转接到新鲜的荧蒽无机盐培养基中,继续培养1周,反复5次.最后吸取0.1 mL培养液稀释不同梯度涂布于LB培养基平板上,挑取单菌落,将平板划线纯化后的单菌落再接种到荧蒽无机盐液体培养基中,选取总生物量最大的菌株DN1作为研究菌株.
2.2.2 形态及生理生化鉴定将充分活化的菌株DN1接至LB 液体培养基,30 ℃下振荡培养24 h,挑取一环菌液进行革兰氏染色,显微观察菌体形态并以测微尺测量大小.同时在 LB 固体培养基上划线接种,30 ℃培养箱中倒置培养48 h,观察菌落形态并测量大小.
生理生化特征测定方法见参考文献(沈萍等,2007;东秀珠等,2001; 周德庆,2006),根据《常见细菌系统鉴定手册》进行形态和生理生化鉴定.
2.2.3 16S rRNA gene的PCR扩增、测序及系统发育分析以菌DN1热裂解液为粗模板,以细菌的16S rRNA gene通用引物27F、1492R(Hanano et al., 2014)为引物,扩增其16S rRNA gene片段.PCR条件为:95 ℃预变性5 min;94 ℃变性40 s,55 ℃延伸40 s,72 ℃退火90 s,30个循环;72 ℃延伸8 min.PCR产物经0.8%琼脂糖凝胶电泳检测产量及大小,以试剂盒回收纯化,送上海生工测序部测序.16S rRNA gene的测序结果经Blast程序与GenBank中已有的核酸序列进行比对,用软件MEGA 5.0构建系统发育树,分析方法采用邻接法(Neighbor Joining),其GenBank登录号为KP119458.
2.2.4 最适生长温度、pH及其生长曲线的测定将活化过夜的DN1菌液分别接入同体积LB液体培养基,测定DN1在不同温度和pH下的生长情况,定时取菌液稀释3倍,测量600 nm处的吸光值,每组3个平行.绘制DN1在以荧蒽(0.50 g · L-1)为唯一碳源的M9液体中的生长曲线,定时取菌液稀释涂布,计量菌落数(以CFU表示).
2.2.5 鼠李糖脂的产生及荧蒽的生物降解将LB活化过夜的DN1菌液按2%总体积的接种量接入含有200 mL BPLM培养基的三角瓶中,并添加5.00 g · L-1 NaNO3为氮源,2%棕榈油为碳源,摇瓶培养7 d,每日取定量培养液以硫酸-蒽酮法(Abidi et al., 2010)测定鼠李糖脂浓度,绘制鼠李糖脂的产生曲线.菌株生物量结合浊度法,所得结果以菌体浓度表示.
将菌株DN1接种于BPLM(2%棕榈油,5.00 g · L-1 NaNO3)液体培养基,在30 ℃、200 r · min-1的条件下培养48 h获得种子培养液.将种子液按照1%总体积的接种量接种于以荧蒽(0.50 g · L-1)为唯一碳源的M9液体培养基中,在30 ℃、200 r · min-1的条件下培养.每24 h 取样,用等体积环己烷萃取3次,取上层有机相旋转蒸发,用甲醇定容后过0.22 μm孔径滤膜后,在232 nm处测其紫外吸收值,与荧蒽标准曲线进行比对得到残余浓度,测量荧蒽的降解能力.
荧蒽降解组分的分析采用气相色谱测定:取降解后的溶液1 mL,12000 r · min-1下离心5 min,吸取上清液100 μL,用甲醇萃取,12000 r · min-1下再次离心5 min,取上清液过0.22 μm滤膜后加入进样瓶中,以0.50 g · L-1 荧蒽溶液为对照,C14、C15、C6为标品,用Agilent 6890气相色谱分析.色谱条件:色谱柱HP-5(0.32 mm×0.25 μm×30 m);进样口温度250 ℃,不分流进样,检测器为 FID 氢火焰离子检测器;检测器温度300 ℃,程序升温,从75 ℃升温至280 ℃,保持3 mim,载气N2,燃气H2.
2.2.6 降解酶活性测定将LB活化过夜的DN1菌液按10%总体积的接种量接入BPLM培养基,添加荧蒽为唯一碳源,使终浓度达到0.20 g · L-1,最适条件下振荡培养,定时取菌液测定邻苯二酚-1,2-双加氧酶和邻苯二酚-2,3-双加氧酶的活性,方法见参考文献(Kojima et al., 1961)并加以改进.将每分钟吸光值增加0.01定义为一个酶活力单位,蛋白质浓度用Bradford法(Bradford,1976)蛋白质定量试剂盒进行定量.
3 结果(Results) 3.1 菌株形态特征及生理生化特性经荧蒽选择培养基反复筛选,从多株降解菌中选出生长状态最好的菌株DN1作为研究菌株.菌株DN1肉眼可看到清晰的单菌落,菌落呈不规则圆型,表面不光滑,边缘不整齐,直径约为2.0~3.0 mm(图 1).显微镜下观察该菌菌体为直或稍弯、两端钝圆的杆菌,长1.5~3.0 μm,宽0.5~0.8 μm,为革兰氏阴性菌.实验显示的DN1部分生理生化特性见表 1.
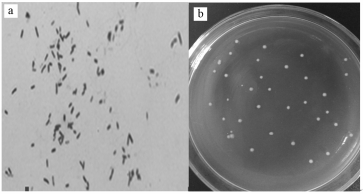 |
| 图 1 DN1 菌株形态 (a.革兰氏染色,b.平板培养) Fig.1 Morphological observation of strain DN1 (a. Gram stain, b. Plate cultivation) |
| 表 1 菌株 DN1部分生理生化特征 Table 1 Physiological and biochemical characteristics of strain DN1 |
用16S rRNA gene 通用引物进行 PCR 扩增得到目的 DNA 片段,最终得到约1.4 kb的16S rRNA gene 部分保守序列,测序结果利用 GenBank Blast 软件进行序列同源性比较,显示菌株 DN1 的 16S rRNA gene 序列与多种铜绿假单胞菌(Pseudomonas aeruginosa)具有高度同源性.从GenBank基因数据库中下载与菌株DN1序列相似性大于97%的16S rRNA gene序列,通过 ClustalX 软件进行聚类分析后,利用MEGA5. 0 软件以Neighbor-Joining 计算方式生成系统发育树(图 2).从图 2可以看出,DN1与铜绿假单胞菌属具有高度的同源性.
 |
| 图 2 基于菌株 DN1 的16S rRNA gene片段序列构建的系统发育树 Fig.2 Phylogenetic tree of l6S rRNA gene sequences from strain DN1 |
菌株DN1接种于pH 7的LB液体培养基中,于温度分别为25、28、31、34、37、42 ℃的条件下摇床培养42 h.每隔一定时间取样,于600 nm处测其吸光值.为保证实验结果,做3组平行实验,结果如图 3所示,DN1从28 ℃到42 ℃均可良好生长,且在34~37 ℃时生长最好,当温度低于28 ℃时生长较为缓慢,延滞期增长.
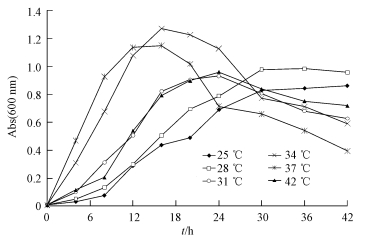 |
| 图 3 不同温度对菌株DN1生长的影响 Fig.3 Effect of different temperatures on the growth of strain DN1 |
将菌株DN1接种于初始pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0的LB液体培养基中,置于34 ℃条件下摇床培养42 h.每隔一定时间取样,于600 nm处测其吸光值.为保证实验结果,做3组平行实验,结果如图 4所示,该菌对pH的适应范围较广,pH为5~8的条件下均能生长,且在pH为 5.5~7.5时生长最好,但在碱性的环境中较为受到抑制,适宜在酸性环境中生长.
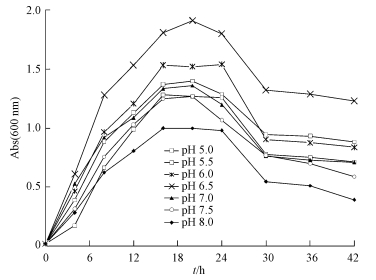 |
| 图 4 不同初始pH对菌株DN1生长的影响 Fig.4 Effect of different initial pH on the growth of strain DN1 |
在最适条件下,将DN1的活化菌液接入以荧蒽(0.50 g · L-1)为唯一碳源的M9液体培养基,相同时间间隔取样测定CFU,绘制生长曲线.由图 5可知,菌株在培养6 d后进入对数生长期,在第8 d时生长总量达到最大,11 d之后进入衰亡期.
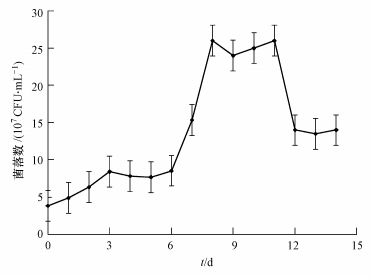 |
| 图 5 菌株DN1以荧蒽为唯一碳源的生长曲线 Fig.5 Growth curve of strain DN1 with fluoranthene as the sole carbon source |
将菌株DN1接种于含有200 mL BPLM(5.00 g · L-1 NaNO3为氮源,2%棕榈油为碳源)液体培养基中,在30 ℃、200 r · min-1条件下培养7 d,按相应的测定方法分别测定其产生鼠李糖脂的量及菌体浓度,结果如图 6所示.由图 6可知,培养的前4 d鼠李糖脂含量呈累积上升趋势,鼠李糖脂产量在第4 d达到峰值,最高可达22.90 g · L-1;之后含量开始下降并保持在14 g · L-1 左右的中等水平.同时,菌体浓度测定结果显示,发酵至第2 d进入对数生长期并在第5 d达到最大生长总量,随后开始衰亡.
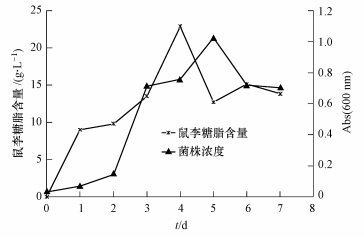 |
| 图 6 最适条件下DN1的生长曲线与鼠李糖脂产量 Fig.6 Growth and rhamnolipid concentration profiles of strain DN1 during cultivation at optimum conditions |
在以荧蒽为唯一碳源时,菌株DN1表现出良好的降解能力(图 7),48 h内对荧蒽的降解速率最大,降解率达到38.5%,在培养至第8 d后降解速率趋于平缓,14 d内总降解率达到90.2%.对降解结果进行气相色谱鉴定,结果如图 8所示.对照中荧蒽(0.50 g · L-1)在11.445 min出峰,峰高为86.82685 mAu,
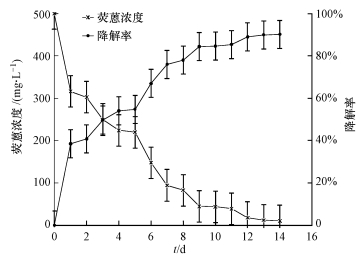 |
| 图 7 菌株DN1对荧蒽的降解 Fig.7 Biodegradation of fluoranthene by strain DN1 |
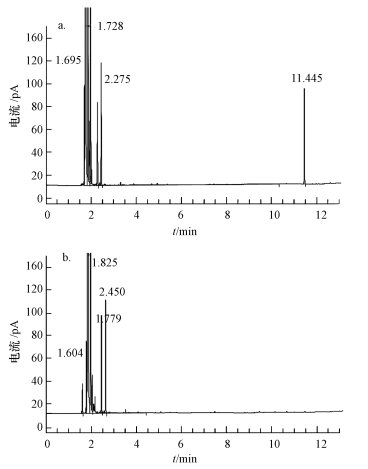 |
| 图 8 降解初始荧蒽(a)及降解后残余荧蒽(b)的气相色谱图谱 Fig.8 Gas chromatography analysis of initial(a)and residual(b)fluoranthene after inoculation with strain DN1 |
峰面积为 110.74163 mAu·s,降解后的样品因荧蒽浓度过低无法检测出具体数值,这表明培养液中的绝大多数荧蒽都几乎被完全降解.
3.6 降解酶活性测定在0.20 g · L-1 的荧蒽诱导下,菌株DN1中邻苯二酚-1,2-双加氧酶(C12O)与邻苯二酚-2,3-双加氧酶(C23O)的活性随时间变化情况如图 9所示.C12O和C23O是诱导酶,其活性与污染物的去除效率呈正相关性.单个样本T检验结果表明,两种酶活性均在诱导至后显著升高,且在48 h后显著降低(以*表示差异显著(0.01≤p<0.5),以**表示差异极显著(p<0.01)).对两种酶的活性进行独立样本T检验,方差齐性检验显示两样本差异极显著,不接受方差相等假设,而接受方差不相等假设,该假设下两种酶活性差异极显著.整个培养过程中C12O活性明显比C23O活性高,尤其是在24~48 h内C12O活性是C23O活性的2倍以上,表明在降解过程中C12O起着主导作用.
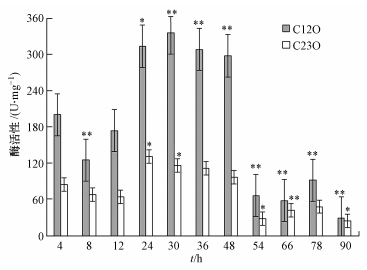 |
| 图 9 荧蒽降解过程中C12O和C23O的活性变化 Fig.9 Enzymatic activity of C12O and C23O in the presence of strain DN1during the fluoranthene degradation |
荧蒽是石油污染土壤中主要存在的一种高分子量多环芳烃(Lee et al., 2007),利用微生物降解土壤中的荧蒽,是一种高效率低成本的治理方式.然而,对于高分子量的PAHs,即4环以上的,由于其化学结构的复杂性及在水环境中的低溶解度,难以被微生物直接降解.研究表明,大多数微生物对4环以上的高分子量PAHs的降解是以共代谢(co-metabolism)的方式进行的(许光素等,2013).铜绿假单胞菌是常见的烃类降解菌,通常从废水、石油污染土壤及油田中分离得到,也有报道该菌与其他混合菌群共培养来提高HMW PAHs的生物降解能力(Kweon et al,2010).铜绿假单胞菌能够降解烃类化合物的原因,与其分泌鼠李糖脂的能力相关.鼠李糖脂可有效降低油水界面张力,使烃类乳化甚至增溶,因而可促进HMW PAHs的生物降解.
本研究从石油污染土壤中分离得到一株铜绿假单胞菌,能单独以荧蒽为唯一碳源生长,且可以产生生物表面活性剂鼠李糖脂作为乳化剂增强其对荧蒽的生物降解能力.综合DN1的生长特性、鼠李糖脂的产生与降解特性及酶活性变化规律,推测菌株DN1在荧蒽(0.50 g · L-1)生物降解中持续大量分泌鼠李糖脂至稳定期,促进了荧蒽的乳化,使其易于被菌体利用降解,降解速率维持在较高水平,与毛健等(2008)降解率为84.5%的副球菌相比有一定的提高.
一般认为双加氧酶是微生物降解多环芳烃的关键酶之一(Jakoncic et al., 2007).常见的双加氧酶有邻苯二酚-1,2-双加氧酶(C12O)、邻苯二酚-2,3-双加氧酶(C23O)等,是一种诱导酶.双加氧酶可将PAHs的苯环裂解,将2个氧原子作用于底物形成双氧乙烷,然后氧化为顺式二氢乙醇,最终进入三羧酸循环.在荧蒽的生物降解过程中,C12O和C23O两种酶的活性与降解效率呈正相关性,且C12O活性显著高于C23O,推测菌株DN1可能主要经C12O催化进行最终的开环作用,倾向于经内二元醇途径开环.
5 结论(Conclusions)研究表明,菌株DN1生长条件宽松,易于培养,具有较强的产鼠李糖脂能力,能够以荧蒽为唯一碳源和能源而良好生长并将其高效地降解,且降解方式有鲜明的特征,可应用于多环芳烃污染土壤的生物修复.后续的实验将对荧蒽的具体降解机制进行探索,对于其主要的代谢途径和代谢中间物进行深入探究.
| [1] | Abidi N, Hequet E, Cabrales L.2010.Changes in sugar composition and cellulose content during the secondary cell wall biogenesis in cotton fibers[J].Cellulose, 17(1): 153-160 |
| [2] | Bradford M M.1976.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 72(1/2): 248-254 |
| [3] | 陈志丹.2013.多环芳烃芘降解菌的筛选、鉴定及邻苯二酚-2, 3-双加氧酶基因克隆与表达[D].乌鲁木齐:新疆大学.1-66 |
| [4] | 东秀珠,蔡妙英.2001.常见细菌系统鉴定手册[M].北京:科学出版社 |
| [5] | Hanano A, Ammouneh H, Almousally I, et al.2014.Traceability of polychlorinated dibenzo-dioxins/furans pollutants in soil and their ecotoxicological effects on genetics, functions and composition of bacterial community[J].Chemosphere, 108: 326-333 |
| [6] | Jakoncic J, Jouanneau Y, Meyer C, et al.2007.The catalytic pocket of the ring-hydroxylating dioxygenase from Sphingomonas CHY-1[J].Biochemical and Biophysical Research Communications, 352(4): 861-866 |
| [7] | Kanaly R A, Harayama S.2010.Advances in the field of high-molecular-weight polycyclic aromatic hydrocarbon biodegradation by bacteria[J].Microbial Biotechnology, 3(2): 136-164 |
| [8] | Kojima Y, Itada N, Hayaishi O, et al.1961.Metapyrocatechase: a new catechol-cleaving enzyme[J].Journal of Biological Chemistry, 236(8): 2223-2228 |
| [9] | Kweon O, Kim S -J, Freeman J P, et al.2010.Substrate specificity and structural characteristics of the novel rieske nonheme Iron aromatic Rinğ-Hydroxylatinğoxyğenases nidAB and NidA3B3 from Mycobacterium vanbaalenii PYR-1[J].mBio, 1(2): e00135-10 |
| [10] | Lee S E, Seo J S, Keum Y S, et al.2007.Fluoranthene metabolism and associated proteins in Mycobacterium sp.JS14[J].Proteomics, 7(12): 2059-2069 |
| [11] | Lu X Y, Zhang T, Fang H H P.2011.Bacteria-mediated PAH degradation in soil and sediment[J].Applied Microbiology and Biotechnology, 89(5): 1357-1371 |
| [12] | 毛健,骆永明,滕应,等.2008.一株高分子量多环芳烃降解菌的筛选、鉴定及降解特性研究[J].微生物学通报,35(7): 1011-1015 |
| [13] | Nie M Q,Yin X H,Ren C Y,et al.2010.Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3[J].Biotechnology Advances,28(5): 635-643 |
| [14] | 沈萍,陈向东.2007.微生物学实验(第4版)[M].北京: 高等教育出版社 |
| [15] | 汤晓,张国亮,孟琴.2008.铜绿假单胞菌分泌鼠李糖脂能力对原油降解影响的研究[J].高校化学工程学报,22(1): 88-93 |
| [16] | Tervahauta A I,Fortelius C,Tuomainen M,et al.2009.Effect of birch (Betula spp.) and associated rhizoidal bacteria on the degradation of soil polyaromatic hydrocarbons,PAH-induced changes in birch proteome and bacterial community[J].Environmental Pollution,157(1): 341-346 |
| [17] | Wu Y R,He T T,Zhong M Q,et al.2009.Isolation of Marine benzo pyrene-degrading Ochrobactrum sp.BAP5 and proteins characterization[J].Journal of Environmental Sciences,21(10): 1446-1451 |
| [18] | 许光素,崔志松,郑立,等.2013.高分子量多环芳烃降解过程中菌种间的相互作用[J].应用与环境生物学报,19(4): 677-682 |
| [19] | Xu H X,Wu H Y,Qiu Y P,et al.2011.Degradation of fluoranthene by a newly isolated strain of Herbaspirillum chlorophenolicum from activated sludge[J].Biodegradation,22(2): 335-345 |
| [20] | Yuliani H,Hermansyah H,Sahlan M,et al.2012.Dioxygenase gene of PAHs degrading a Bacillus strain isolated from marine indonesian environment and its biosurfactant production ability[J].International Journal of Pharma and Bio Sciences,3(4): (B)380-(B)390 |
| [21] | 张银萍,王芳,杨兴伦,等.2010.土壤中高环多环芳烃微生物降解的研究进展[J].微生物学通报,37(2): 280-288 |
| [22] | 赵渝.2007.芳香烃生物降解途径蛋白质组学研究[D].上海:华东师范大学.1-134 |
| [23] | 周德庆.2006.微生物学实验教程(第2版)[M].北京:高等教育出版社 |
| [24] | 周惠娟,马艳玲.2013.一株荧蒽降解菌的筛选鉴定及降解特性[J].环境工程学报,7(5): 1984-1988 |
| [25] | 周鑫淼,陈洁君,耿立召,等.2007.邻苯二酚2,3-双加氧酶的结构和功能研究进展[J].生物技术通报,(4): 51-54 |
 2015, Vol. 35
2015, Vol. 35


