2. 北京城建设计发展集团股份有限公司, 北京 100037;
3. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085
2. Beijing Urban Construction Design & Development Group CO., LTD, Beijing 100037;
3. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
腐殖酸(HA)作为分布最为广泛的天然有机物,占天然水体中可溶性有机质(DOM)的50%以上(Liu et al., 1999),占土壤有机质的70%~80%.同时,由于HA含有大量羧基和酚羟基等官能团,与水体及土壤中的重金属具有较高的反应活性,可通过配位作用等方式吸附重金属(Sposoto et al., 1986),影响重金属离子在自然界中的存在形态和迁移转化途径.因此,研究水中HA、重金属离子和悬浮颗粒物等物质间相互作用机制(Smolyakov et al.,2010),探讨矿物颗粒对HA和重金属离子去除的影响(白庆中等,2000;Tokuyama et al., 2010;Hirose,2007),是水质净化领域的研究热点之一.许多研究表明,水中存在的铅、镉、锌等金属都是以一种有机络合形态存在的.O′Reilly Wiese等(1997)研究发现,Cr(Ⅲ)、Cd(Ⅱ)和Pb(Ⅱ)主要以有机结合态存在于河口沉积物中.Fytianos等(2004)发现,希腊湖泊的表层沉积物中Cr(Ⅲ)、Cd(Ⅱ)和Pb(Ⅱ)以碳酸盐结合态、有机质结合态和残渣态为主要赋存形态.刘保峰等(2005)采用离子交换平衡法,对胡敏酸与Zn(Ⅱ)、Cd(Ⅱ)单独及复合体系形成的络合物的稳定性进行了研究,发现Zn(Ⅱ)、Cd(Ⅱ)单独体系中,随着pH值增大,络合反应的配位数及稳定常数增大,而在Zn(Ⅱ)、Cd(Ⅱ)符合体系中pH值的影响不显著.白领玉等(2000)测定了胡敏酸及富里酸与Cd(Ⅱ)、Zn(Ⅱ)络合反应的稳定常数及配位数,发现随着腐殖酸芳构化程度的提高,其与Cd(Ⅱ)、Zn(Ⅱ)的络合物的配位数及稳定常数也逐渐提高.环境中Cd(Ⅱ)能够与HA的活性官能团作用而产生稳定的络合物(Abate et al.,2000),从而改变Cd(Ⅱ)的溶解度,影响Cd(Ⅱ)向上覆水体或沉积物中迁移(余贵芬等,2002).因此,研究Cd(Ⅱ)与HA的作用关系及影响因素,进而研究其对水体中颗粒物的生长、絮凝、凝结和溶解等表面反应过程的影响具有重要意义.
同时,水合二氧化锰(HMO)作为水体沉积物悬浮颗粒物的重要组成之一(Bernard,1997),在HA和重金属离子的迁移转化中发挥着重要作用.在HA和重金属离子共存条件下,针对HMO对复合污染物的去除效果研究较少,且HA和重金属离子的络合关系及其影响因素,特别是HA和重金属离子及其复合污染物在HMO表面的分配关系尚未明确.因此,本文采用离子交换平衡法系统测定HA和Cd(Ⅱ)的配位数和络合稳定常数,以明确主要影响因素.同时,考察二者在HMO表面的反应动力学过程,并进一步探讨温度对HA和Cd(Ⅱ)在HMO表面分配关系的影响.
2 材料与方法(Materials and methods) 2.1 实验材料实验所用阳离子交换树脂(732型)购自广东汕头市西陇化工厂;氯化镉(分析纯)购自天津市津科精细化工研究所;腐殖酸(1415-93-6)购自SIGMA公司;其它化学品,如盐酸、氢氧化钠、高锰酸钾、过氧化氢、氯化钠等均为分析纯,购自北京试剂公司.实验中除特别强调外,试剂均未进行进一步处理.
HA的预处理:称取2.50 g商品HA置于1000 mL烧杯,加入0.40 g NaOH,加去离子水500 mL,在磁力搅拌器上充分搅拌溶解,然后静置24 h,样品通过孔径0.45 μm滤膜过滤,采用TOC-VCPH型总有机碳分析仪测定TOC浓度,TOC标准曲线方程为Y=142.4X+0.758(R2=0.993).HA的浓度以TOC值计,使用时将高TOC浓度的溶解态HA用蒸馏水稀释至所需TOC值.
钠型阳离子树脂的预处理:取一定量732型强酸性阳离子交换树脂,首先使用饱和氯化钠溶液,其量约为被处理树脂体积的2倍,将树脂置于饱和氯化钠溶液中浸泡18~20 h;然后放尽氯化钠溶液,用蒸馏水漂洗至排出水不带黄色;随后用NaOH溶液(2.0%~4.0%)浸泡2~4 h(或小流量清洗),用量与饱和氯化钠溶液相同;放尽碱液后,用蒸馏水冲洗树脂直至排出水接近中性;最后用HCl溶液(5.0%)浸泡4~8 h,用量与上述相同,放尽酸液,用蒸馏水漂洗后待用.
2.2 实验方法pH值对络合稳定常数(K)和配位数(x)的影响:吸取已知浓度的溶解态HA溶液0、4.00、8.00、12.00、16.00、20.00 mL分别置于50 mL锥形瓶中,加入去离水至总体积约为30.00 mL,用0.10 mol · L-1的NaOH或HCl(分析纯)调节pH值分别至3、4、5、6、7、8、9、10,实验中每隔1 h微调pH值,使pH值保持在±0.2误差范围内.然后各加入0.10 mol · L-1 NaCl溶液5.00 mL和10.00 mg · mL-1的CdCl2溶液5.00 mL,此时溶液总体积约为40.00 mL;用0.10 mol · L-1的NaOH和HCI(分析纯)微调pH值,加去离子水至刻度;然后分别加入1.30 mL Na型阳离子交换树脂,在温度为(298±1)K,转速为180 r · min-1的恒温摇床中振荡反应1 h.静置24 h后,用3号砂芯漏斗过滤,滤液于100 mL容量瓶中定容,将过滤后的树脂先用1~2 mL 2.00 mol · L-1 HCl(优级纯)洗涤2次,然后用2~3 mL 0.10 mol · L-1 HCl洗涤数次,于25 mL容量瓶中定容,用原子吸收分光光度计测定滤液及原液中金属离子的浓度.
离子强度对络合稳定常数(K)和配位数(x)的影响:吸取HA溶液0、4.00、8.00、12.00、16.00、20.00 mL分别置于50 mL锥形瓶中,然后各加入0.010、0.05、0.1、0.2 mol · L-1 NaCl溶液5.00 mL和10.00 mg · mL-1的CdCl2溶液5.00 mL;用0.10 mol · L-1的NaOH和HCI(分析纯)调节pH值为5、6、7的系列溶液,后续步骤与pH影响实验方法相同.
本文采用离子交换平衡法(文启孝,1984),通过测定阳离子交换树脂加入前后溶液中的离子浓度及树脂上吸附的离子浓度,从而求得相应的络合稳定常数及配位数,计算公式如式(1).

分配系数(Kd)的测定:HA和Cd(Ⅱ)在HMO表面的分配系数用吸附前后各组分在固相中浓度与液相中浓度的比值来表示,计算公式如式(2).

反应动力学实验:在1000 mL的锥形瓶中,分别加入浓度为10 mg · L-1的Cd(Ⅱ)溶液、浓度为700.00 mg · L-1的HA溶液、Cd(Ⅱ)含量为10 mg · L-1的HA-Cd(Ⅱ)络合溶液500 mL,然后分别加入12.50 mL HMO悬浊液,使得吸附剂含量均为100.00 mg · L-1,离子强度取0.01 mol · L-1 NaCl,调节溶液的pH值为7.0±0.2,反应温度为288、298、308 K,在恒温振荡箱中振荡,转速为180 r · min-1,分别在0.1、0.2、0.3、0.5、0.7、0.9、1.2、1.5、2、2.5、3、4、5、6、9和24 h时间隔取样.取样后,经0.45 μm滤膜过滤后,使用原子吸收分光光度计测定溶液中重金属元素Cd的含量.
3 结果与讨论(Results and discussion) 3.1 pH值对HA与Cd(Ⅱ)络合关系的影响溶液pH值是影响有机物与重金属离子络合稳定常数的重要因素之一,它不仅对HA酸性官能团的解离有很大的影响,而且可以改变金属离子在溶液中的存在形态.研究溶液pH值对HA与Cd(Ⅱ)的络合性能的影响,有助于更好地确定HA与镉离子的最佳络合条件.pH值对HA与Cd(Ⅱ)配位数及稳定常数的影响如图 1所示.在pH=3~10的范围内,在HA浓度、溶液离子强度、投加Cd(Ⅱ)浓度相同条件下,HA-Cd(Ⅱ)的络合稳定常数logK的变化范围为1.652~3.548,且logK随溶液pH值的升高呈现出先增大后减小的趋势,当pH=8时logK达到最大值.这与王强等(2006)通过离子交换法研究胡敏酸与Fe(Ⅲ)的络合特性一致.而当pH=10时,络合稳定常数明显降低,可见pH值对HA和Cd(Ⅱ)的络合稳定常数有重要影响.与胡敏酸与Cd(Ⅱ)所形成络合物配位数随着pH值增大而增大的结果不同(刘保峰等,2005),本实验中HA和Cd(Ⅱ)的配位数x虽呈下降趋,但变化范围在1.752~1.651之间,表明HA和Cd(Ⅱ)的配位数受溶液pH值影响较小.
 |
| 图 1 pH值对腐殖酸与Cd(Ⅱ)配位数及稳定常数的影响(Cd(Ⅱ)10.00 mg · L-1,HA 700.00 mg · L-1,离子强度0.01 mol · L-1,pH 3~10) Fig.1 The effect of pH on the complex stability constant(K) and co-ordination number(x)of HA and cadmium ions(Cd(Ⅱ)) |
溶液pH值能够影响HA的羧基和酚羟基中H+的解离程度,进而影响HA与金属离子的络合稳定常数(Stark et al., 2007).当溶液中H+浓度较大时能改变络合基的络合势.HA表面胺基及羧基的质子化作用易使HA分子发生一定程度的凝聚,使HA胶体的比表面积减少,导致HA与金属离子的络合能力有所降低(Österberg et al., 1997).随着pH值的逐渐增高,酸性官能团的活性增强,增加了其对金属离子的络合能力,使与每摩尔金属离子络合的有机质的摩尔数增加(即形成络合物的配位数增大).在高pH值条件下,更有利于金属离子与有机质的络合反应.然而,随着pH值的升高,平衡体系中OH-的浓度随之增加,OH-与HA竞争Cd(Ⅱ)的能力增强,使Cd(Ⅱ)与HA的络合能力下降,导致络合物稳定性降低.
3.2 离子强度对HA与Cd(Ⅱ)络合关系的影响离子强度对HA与Cd(Ⅱ)的配位数和络合稳定常数的影响如图 2所示.在HA浓度、溶液pH值、投加总Cd(Ⅱ)浓度相同的条件下,HA与Cd(Ⅱ)的配位数随溶液离子强度的增加而提高;同时,随着离子强度增加,pH值对HA与Cd(Ⅱ)的配位数的影响呈明显下降趋势.可见,离子强度对HA与Cd(Ⅱ)的配位数具有重要影响.Robertson等(1997)的实验结果也表明,在pH相同的条件下,离子强度为0.10 mol · L-1时Cu(Ⅱ)在矿物质表面的络合量比离子强度为0.01 mol · L-1时的络合量小,即离子强度降低,络合量增加.原因可归结于当HA溶液中投加较多的Na+时,Na+可与-OH及-COOH发生反应(Senesi,1990),占据了Cd(Ⅱ)与HA发生络合反应的结合点,故溶液中离子强度的增加会使络合量降低.
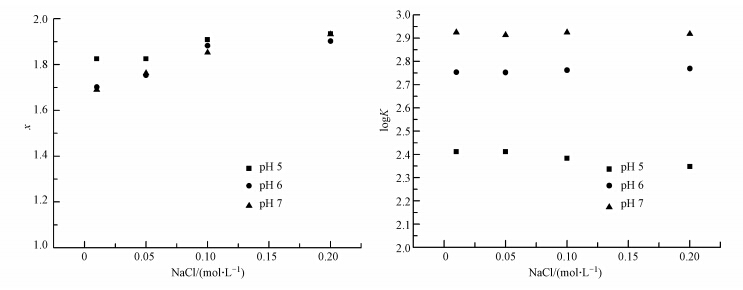 |
| 图 2 离子强度对HA与Cd(Ⅱ)配位数和络合稳定常数的影响(Cd(Ⅱ)10.00 mg · L-1,HA 700.00 mg · L-1) Fig.2 The effect of ionic strength on the values of x and K |
进一步观察到,尽管在相同的离子强度下,pH值对HA和Cd(Ⅱ)的络合稳定常数影响显著(logK=2.41~2.94),但在相同pH值条件下,离子强度对HA和Cd(Ⅱ)的络合稳定常数(logK=2.41,离子强度0.01mol · L-1,pH=7.0)影响较小.这与Ravat等(2000)针对离子强度对麦麸中提取的NOM与Cu(Ⅱ)的络合有轻微影响的研究结果一致.
3.3 HA和Cd(Ⅱ)在HMO表面的反应动力学实验进一步考察了HA、Cd(Ⅱ)及二者共存时,污染物在HMO表面的反应动力学过程.鉴于在高pH值和低离子强度时,Cd(Ⅱ)与HA的络合稳定常数最大,络合效果最好,同时为避免pH值在8以上时Cd(Ⅱ)沉淀,动力学实验在pH=7和离子强度为0.01 mol · L-1的条件下进行.
在288、298、308 K下,HA、Cd(Ⅱ)和HA-Cd(Ⅱ)在HMO表面的反应动力学结果分别如图 3和4所示.HA与HMO在反应前9 h呈明显波动,在9 h时,HMO对HA的去除率达到最大值,随后逐渐降低,在反应24 h后趋于平衡.在本实验中,比较288、298、308 K 条件下HA的去除率,在308 K时HMO对HA的去除率最低、Kd-HA值最小.此外,从图 4中可以看出,HA和Cd(Ⅱ)二元体系中,HMO对HA的去除过程与HA单独存在时相似,随反应温度升高,HMO对HA的去除率呈下降趋势;在HA和Cd(Ⅱ)共存条件下,HA的去除率较单独HA体系均有所下降,表明Cd(Ⅱ)与HA的络合作用降低了HA与HMO的反应活性,导致HA去除率下降.
 |
| 图 3 HA和HA-Cd(Ⅱ)在HMO表面的反应动力学曲线(HMO 100.00 mg · L-1,Cd(Ⅱ)10.00 mg · L-1,HA 700.00 mg · L-1,pH=7.0,NaCl 0.01 mol · L-1) Fig.3 Reaction kinetics of HA and HA-Cd(Ⅱ) |
 |
| 图 4 Cd(Ⅱ)和HA-Cd(Ⅱ)在HMO表面的反应动力学曲线(HMO 100.00 mg · L-1,Cd(Ⅱ)10.00 mg · L-1,HA 700.00 mg · L-1,pH=7.0,NaCl 0.01 mol · L-1) Fig.4 Reaction kinetics of Cd(Ⅱ) and HA-Cd(Ⅱ) |
从图 4中可以看出,与单独Cd(Ⅱ)相比,反应平衡时HMO对HA-Cd(Ⅱ)络合体系中Cd(Ⅱ)的去除率显著降低.在HA存在条件下,反应初期HMO对Cd(Ⅱ)的去除率较高,而后随着反应时间的延长而减小,并在反应9 h后达到最小值;随后,去除率又逐渐增大,并在反应24 h后趋于平衡.Cd(Ⅱ)去除率的变化归因于HA与HMO的表面反应过程,从而导致HMO表面吸附Cd(Ⅱ)的活性位点被HA消耗或占据(Ng et al., 2001).同时,Cd(Ⅱ)通过扩散作用进入腐殖酸分子内部后,较自由Cd(Ⅱ)和HA表面束缚的Cd(Ⅱ)更难与HMO作用,导致去除率下降(Tripathy et al., 2006).9 h后,HA与HMO的反应趋于平衡,HMO对Cd(Ⅱ)的去除率又逐渐增加;但24 h后,HMO对HA-Cd(Ⅱ)络合体系中Cd(Ⅱ)的去除率较单独Cd(Ⅱ)明显偏低.
3.4 HA和Cd(Ⅱ)在HMO表面的分配关系在pH=7、离子强度0.01 mg · L-1(NaCl)、温度分别为288、298、308 K的条件下,分别测定了反应平衡时HA和Cd(Ⅱ)在HMO表面的分配系数Kd-Cd和Kd-HA,并进一步研究了HA和Cd(Ⅱ)共存条件下,二者的络合作用对HA和Cd(Ⅱ)各自在HMO表面的分配系数Kd-HA(Cd)(以HA计)和Kd-Cd(HA)(以Cd(Ⅱ)计)的影响,计算结果如表 1所示.
| 表 1 不同温度下HA和Cd(Ⅱ)在HMO表面的分配系数 Table 1 The values of Kd at different temperatures |
温度显著影响各污染物在HMO表面的分配系数.表 1数据显示,随着温度升高,Kd-Cd呈上升趋势,说明Cd(Ⅱ)从溶液中迁移至HMO表面的比例增加,可见升温利于HMO对Cd(Ⅱ)的去除;Kd-HA则随温度上升呈下降趋势,在308 K时Kd-HA值最小,说明此时HMO对HA的去除效果最差;值得注意的是,当Cd(Ⅱ)与HA共存时,络合体系中Cd(Ⅱ)或HA在HMO表面的分配系数均较Cd(Ⅱ)或HA单独存在时明显下降.总体上,HA和Cd(Ⅱ)络合体系的存在抑制了HMO对二者的去除作用,且HA的引入对Cd(Ⅱ)去除的抑制作用更显著.
4 结论(Conductions)本文系统考察了pH值和离子强度对腐殖酸(HA)与镉离子(Cd(Ⅱ))络合作用的影响,进一步明确了HA、Cd(Ⅱ)及二者络合物在水合二氧化锰(HMO)表面的分配关系.水中腐殖酸(HA)和镉离子(Cd(Ⅱ))可以形成较为稳定的络合物;在pH值 3~10范围内,HA和Cd(Ⅱ)的配位数(x)变化较小,但络合稳定常数(K)随溶液pH值的升高呈现出先增大后减小的趋势,并在pH=7时达到最大值;在不同pH值条件下,离子强度对HA和Cd(Ⅱ)的络合稳定常数影响均较小,但其配位数均随溶液离子强度的增加而提高.升温Cd(Ⅱ)在HMO表面的分配系数上升,有利于HMO对Cd(Ⅱ)的去除;但导致HA在HMO表面的分配系数下降,不利于HMO对HA的去除;当络合体系存在时,HA和Cd(Ⅱ)络合体系的存在抑制了HMO对二者的去除作用,且HA对Cd(Ⅱ)去除的抑制作用更显著.上述结果对于研究溶解性有机污染物、重金属离子和水体悬浮颗粒物的界面反应过程具有重要意义.
| [1] | Abate G,Masini J C.2000.Influence of pH,ionic strength and humic acid on adsorption of Cd(Ⅱ) and Pb(Ⅱ) onto vermiculite[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,262(1/3):33-39 |
| [2] | 白领玉,陈世宝,华珞,等.2000.腐殖酸与Cd、Zn的络合特性研究[J].核农学报,14(1):44-48 |
| [3] | Bernard S,Chazal Ph,Mazet M.1997.Removal of organic compounds by adsorption on pyrolusite (β-MnO2)[J].Water Research,31(5):1216-1222 |
| [4] | 白庆中,宋燕光,王晖.2000.有机物对重金属在粘土中吸附行为的影响[J].环境科学,21(5):64-67 |
| [5] | Fytianos K,Lourantou A.2004.Speciation of elements in sediment samples collected at Lakes Volvi and Koronia,N.Greece[J].Environment International,30(1):11-17 |
| [6] | Hirose K.2007.Metal-organic matter interaction:Ecological roles of ligands in oceanic DOM[J].Applied Geochemistry,22(8):1636-1645 |
| [7] | Liu A G,Gonzalez R D.1999.Adsorption/desorption in a system consisting of humic acid,heavy metals,and clay minerals[J].Journal of Colloid and Interface Science,218(1):225-232 |
| [8] | 刘保峰,王强,孟威,等.2005.酸度对胡敏酸与镉和锌离子络合反应的影响[J].西南农业大学学报(自然科学版),27(4):451-455 |
| [9] | Ng W J,Ong S L,Hu J Y.2001.Denitrifying phosphorus removal by anaerobic/anoxic sequencing batch reactor[J].Water Science & Technology,43(3):139-146 |
| [10] | O'Reilly Wiese S B,Macleod C L,Lester J N.1997.A recent history of metal accumulation in the sediments of the Thames Estuary,United Kingdom[J].Estuaries,20(3):483-493 |
| [11] | Österberg R,Shirshova L.1997.Oscillating,nonequilibrium redox properties of humic acids[J].Geochimica et Cosmochimica Acta,61(21):4599-4604 |
| [12] | Ravat C,Dumonceau J,Monteil-Rivera F.2000.Acid base and Cu(Ⅱ) binding properties of natural organic matter extracted from wheat bran:modeling by the surface complexation model[J].Water Research,34(4):1327-1339 |
| [13] | Robertson A P,Leckie J O.1997.Cation binding predictions of surface complexation models:effects of PH,ionic strength,cation loading,surface complex,and model fit[J].Journal of Colloid and Interface Science,188(2):444-472 |
| [14] | Senesi N.1990.Molecular and quantitative aspects of the chemistry of fulvic acid and its interactions with metal ions and organic chemicals.Part Ⅱ.The fluorescence spectroscopy approach[J].Analytica Chimica Acta,232:77-106 |
| [15] | Smolyakov B S,Ryzhikh A P,Bortnikova S B,et al.2010.Behavior of metals (Cu,Zn and Cd) in the initial stage of water system contamination:Effect of pH and suspended particles[J].Applied Geochemistry,25(8):1153-1161 |
| [16] | Sposoto G,Weber J H.1986.Sorption of trace metals by humic materials in soils and natural waters[J].Critical Reviews in Environmental Control,16(2):193-229 |
| [17] | Stark P C,Rayson G D.2007.Competitive metal binding to a silicate-immobilized humic material[J].Journal of Hazardous Materials,145(1/2):203-209 |
| [18] | Tokuyama H,Hisaeda J,Nii S,et al.2010.Removal of heavy metal ions and humic acid from aqueous solutions by co-adsorption onto thermosensitive polymers[J].Separation and Purification Technology,71(1):83-88 |
| [19] | Tripathy S S,Bersillon J L,Gopal K.2006.Adsorption of Cd2+ on hydrous manganese dioxide from aqueous solutions[J].Desalination,194(1/3):11-21 |
| [20] | 王强,魏世强.2006.胡敏酸与Fe3+络合反应稳定性及热力学特征研究[J].环境科学学报,26(1):118-123 |
| [21] | 文启孝.1984.土壤有机质研究法[M].北京:农业出版社 |
| [22] | 余贵芬,蒋新,吴泓涛,等.2002.镉铅在粘土上的吸附及受腐殖酸的影响[J].环境科学,23(5):109-112 |
 2015, Vol. 35
2015, Vol. 35


