2. 河北科技大学环境科学与工程学院, 河北省污染防治生物技术实验室, 石家庄 050018
2. Pollution Prevention Biotechnology Laboratory of Hebei Province, School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018
目前,偶氮染料废水的危害的严重性被越来越多的人所重视,偶氮染料大量的排放到水环境中会造成严重的污染,因此对偶氮染料的处理研究越来越广泛(延利军,2013;范彬等,2000;毕晶晶等,2010).
目前处理偶氮染料的处理方法有物化法和生物法,而生物法是有良好应用前景的处理方法(梅翔等,2001;朱杰和付永胜,2006;张建美和郝会玲,2014).但生物法也存在着一些问题,比如:反应速率慢,处理周期长等问题,因而提高偶氮染料的降解效率成为研究的热点.
近年来的研究显示,含有醌基的氧化还原介体能够有效地加速一些难降解污染物的生物转化过程,醌基结构是加速生物转化过程的活性官能团(郭延凯等,2013;Hernández-Montoya et al., 2012;方连峰等,2007),许多醌类化合物能够作为氧化还原介体加速电子供体与电子受体之间的电子传递速率,加速污染物的氧化还原速率,从而加速难降解污染物生物降解速率,缩短生物转化时间(Cervantes et al., 2010;Aran da-Tamaura et al., 2007;Dos Santos et al., 2004;Zee et al., 2003).
氧化还原介体分为天然介体与人工介体,天然介体有分子量小、醌基少的劣势,而人工介体中的水溶性介体有易流失造成二次污染和连续投加成本高的缺点,所以选择非水溶性氧化还原介体进行加速作用.介体固定化技术是指利用物理或化学的手段将氧化还原介体限制或定位于特定的空间区域,使其具有水不溶性、达到一定密集程度,并保持其生物催化功能可反复利用的技术(陈延明等,2013).有学者利用聚氨酯物理吸附蒽醌(司伟磊等,2010)和AQS(Lu et al., 2010)来进行染料的厌氧脱色,固定的醌型介体可以使偶氮染料生物脱色率提高8.8倍.聚乙烯醇具有优良的反应性和无毒无味,国内外研究者对各种类型的PVA接枝共聚物进行深入研究,然后对PVA及其聚酯等进行物理或者化学改性,然后再提高其机械强度及化学稳定性(Lozinsky and Plieva, 1998).为了开发出对难降解污染物具有催化活性的非水溶性氧化还原介体,以PVA海绵为载体,将醌基基团用化学反应的方法将其接枝到PVA海绵载体上,合成出含有醌基的氧化还原介体高分子材料,并通过元素分析与扫描电镜进行表征,以实验室模拟废水为目标污染物,探索研究醌基PVA海绵对偶氮染料废水处理方面的应用,考察其降解效果并对制备参数进行优化.
2 材料与方法(Materials and methods) 2.1 主要试剂与仪器二氯甲烷,天津市大茂化学试剂厂;蒽醌-2-磺酸钠,重庆跨越(集团)股份有限公司;水合茚三酮,天津市永大化学试剂有限公司;二乙烯三胺,天津市光复精细化工研究所;其他实验试剂均采用分析纯.
2.2 醌基PVA海绵的制备醌基PVA海绵制备主要分为3个步骤:蒽醌-2-磺酰氯(ASC)的制备、PVA海绵的胺化、胺化PVA海绵合成为醌基PVA海绵.
2.2.1 蒽醌-2-磺酰氯(ASC)的制备取5 g 9,10-蒽醌-2-磺酸钠(AQS)与50 mL二氯甲烷到四口瓶中,将四口瓶放入水浴锅中,设定水浴温度为40 ℃,磁力搅拌,保持回流状态.当出现第一滴回流液时从四口瓶侧颈加入8 mL氯磺酸,继续搅拌,反应回流6 h,停止加热并静置至室温.将反应液倒入蒸馏水中,体系呈分层状态,用蒸馏水洗涤有机层5~6次,用分液漏斗分离有机层与水层,保留有机层,真空减压抽滤,风干除去其中的二氯甲烷,得到产物9,10-蒽醌-2-磺酰氯(ASC)黄色结晶体(Feng et al., 2002).
 |
| 图 1 蒽醌-2-磺酰氯(ASC)的制备 Fig.1 The preparation of ASC |
量取50 mL的2 mmol·L-1的NaOH溶液和50 mL二乙烯三胺放入到四口瓶中,二乙烯三胺在溶解过程中放出大量热量,需等待其体系降至所设定温度后,称取PVA海绵0.88 g放入四口瓶中,并开始计时.反应实验设定时间后停止反应,将瓶中的液体倒出,将产物胺化PVA海绵(R-NH2)用自来水与蒸馏水各洗涤3次,洗去其中的NaOH溶液与二乙烯三胺,并放置在烘箱中在40 ℃下烘干.
2.2.3 将胺化PVA海绵合成为醌基PVA海绵胺化PVA海绵在碱性条件下与蒽醌-2-磺酰氯(ASC)溶液反应生成醌基PVA海绵,反应如图 2所示.
 |
| 图 2 接醌PVA海绵的制备 (R-NH2代表胺化PVA海绵) Fig.2 The preparation of the functional PVA grafted with quinone (R-NH2 represents the amination of PVA) |
量取50 mL 2 mol·L-1氢氧化钠放入四口瓶中,向其中加入0.88 g胺化聚乙烯醇海绵.取0.1 g蒽醌-2-磺酰氯溶解在20 mL二氯甲烷中,当反应体系达到设定温度后,用恒压漏斗将二氯甲烷溶液缓慢滴加到四口瓶中,滴加完毕后反应一定时间,然后用二氯甲烷、N,N-二甲基甲酰胺和蒸馏水先后分别洗涤3次,放入40 ℃烘箱中烘干,备用.
2.3 醌基PVA海绵的表征 2.3.1 元素分析本实验通过元素分析方法定量测量S的摩尔质量再转换成醌基的摩尔质量,通过与空白载体S的摩尔量相比,进而确定醌基的含量.
2.3.2 扫描电镜扫描电镜应用主要体现在材料形貌观察分析上.对材料形貌的观察分析、直接观察纳米材料的形貌、观察材料表面、切面进行分析.本实验通过扫描电镜可以分析放大后的载体结构图,定性分析接醌前后载体结构的变化以及接醌情况.
2.4 醌基修饰PVA海绵加速偶氮染料生物降解偶氮染料降解:偶氮染料的生物降解过程中,一般在LB培养基中转接菌种GYZ,实验所用降解偶氮染料的菌种为本实验室分离驯化好的耐盐菌株Staphylococcus sp.GYZ(16S rDNA在GenBank登陆序列号:EF188282),在35 ℃、120 r·min-1的恒温摇床中好氧培养4 h左右,待细菌生长至660 nm波长下吸光度为0.3左右,菌液混合.
在加入醌基修饰PVA海绵加速偶氮染料降解的过程中,配制好降解培养基和扩大培养基,调节pH为7,分装到锥形瓶,放入高温灭菌锅中,冷却后,扩大培养基中接入细菌,恒温摇床摇8 h.然后再把扩大培养基接入降解培养液中,恒温摇床摇8 h后,加入5块PVA海绵.取培养液离心后(12000 r·min-1,5 min)的上清液,以去离子水为参比,利用可见分光光度计,调节分光光度计的波长为514 nm,每隔1 h测1次样,测量其吸光度,记录实验数据.根据标准曲线测定样品吸光度,计算出偶氮染料浓度.
2.5 分析方法采用茚三酮显色法定量的检测氨基的含量.偶氮染料浓度的测定是通过分光光度计在514 nm下测量吸光度,然后运用标准曲线公式计算染料的浓度.脱色率按以下公式进行计算: η=(1-At/A0)×100% 式中,A0为降解前染料废水最大吸附峰处的吸光度; At为降解t时刻染料废水最大吸收峰处的吸光度.
3 结果与讨论(Result and discussion) 3.1 醌基PVA海绵的表征 3.1.1 元素分析对PVA海绵进行元素分析来表征出其接醌含量,其元素分析如表 1所示.
| 表 1 元素分析 Table 1 Element analysis |
如表 1所示,通过观察接醌前后S元素的摩尔比的不同,得出接醌PVA海绵的S元素是0.256%,通过计算可得PVA的接醌含量是0.08 mmol·g-1.
3.1.2 扫描电镜对PVA海绵进行了扫描电镜分析来表征其微观结构,对其接醌前后进行对比(图 3).
 |
| 图 3 扫描电镜图 Fig.3 Scanning electron microscopy (SEM) |
图 3中a图表明PVA海绵具有表面疏松多孔的结构和比表面积大的特点,这种结构更容易使得细菌在其表面附着.而图b和图c对接醌前后表面扫描电镜图进行对比,在图b中其接醌前表面呈现光滑的结构,而图c中其接醌后表面呈现出粗糙的结构,并有颗粒在其表面富集,这表明醌基已经接枝到了PVA海绵载体上了.
3.2 探究不同胺化时间合成的醌基PVA海绵对生物降解的影响聚乙烯醇海绵胺化时间、胺化温度、接醌时间、接醌温度对接醌PVA海绵的制备影响较大.实验采用单一变量法考察其影响.微生物对偶氮染料进行降解作用,而醌基修饰PVA海绵是含有醌基的高分子材料,其在降解过程中起到了氧化还原介体的作用,可以大大加速微生物厌氧过程中的电子传递,进而促进微生物降解有机污染物.
3.2.1 茚三酮显色法测量不同胺化时间的PVA海绵氨基含量设定胺化温度为30 ℃,接醌时间为6 h,接醌温度为30 ℃,胺化时间作为单一变量,用茚三酮显色法检测氨基含量,检测结果如图 4a所示.
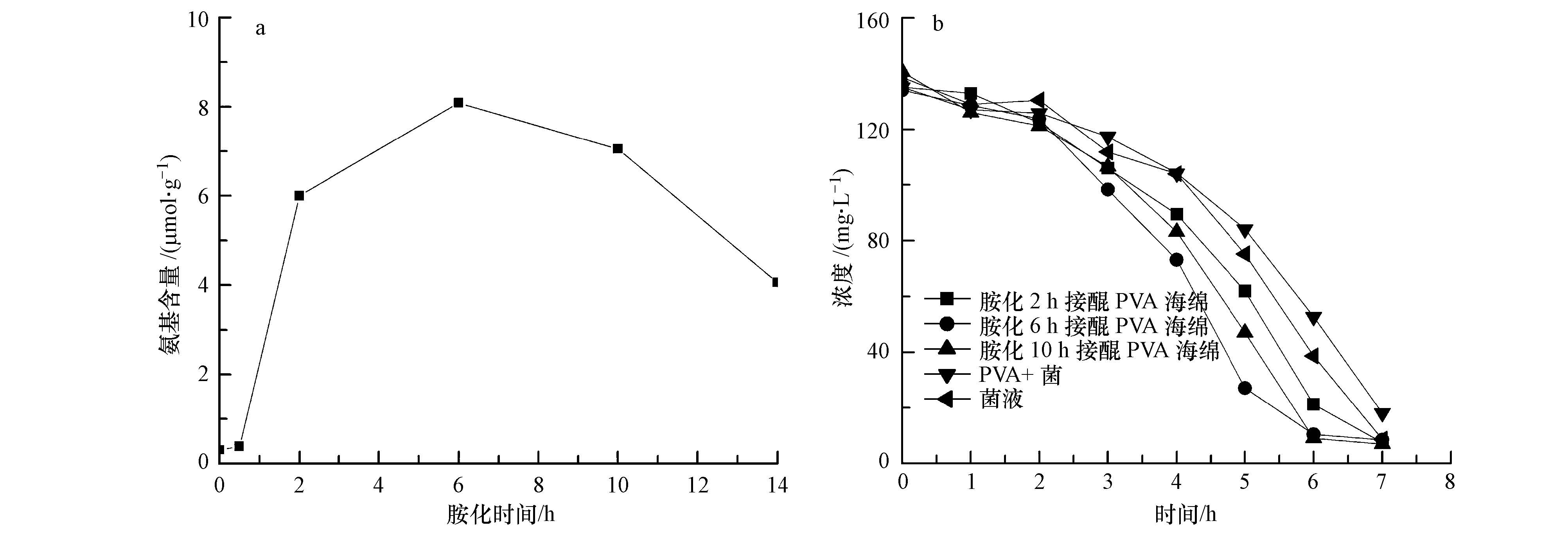 |
| 图 4 不同胺化时间对海绵氨基含量的影响与其对偶氮染料降解加速的影响 Fig.4 The influence of different ammoniation time on the content of amination PVA and the effect of the PVA on the degradation of azo dyes |
如图 4a所示,随着胺化时间的增加,其单位质量的摩尔量呈现先上升后下降的趋势,当胺化反应6 h时,单位质量胺基摩尔量达到最大值,原因可能是胺化时间达到6 h后胺解反应迅速.从图 4a中可以看出胺化时间为6 h时氨基含量达到最大值,所以我们选择胺化6 h为最佳反应温度.
3.2.2 胺化时间对偶氮染料的加速生物降解的影响将合成过程的胺化温度定为30 ℃,接醌温度为30 ℃,接醌时间为6 h,单一改变胺化时间来进行合成接醌海绵,将其用于加速酸性红B生物降解的试验中,其生物降解试验图如图 4b所示.
从图 4b中可以看出,接醌PVA海绵的加入能够影响偶氮染料的加速降解作用,合成过程中不同的胺化时间影响偶氮染料的降解速度,胺化时间6 h的PVA海绵比2 h的降解偶氮染料的速率快而比10h的慢,这是由于在其他条件不变的条件下接醌量随胺化量的增加而增加,其对偶氮染料的降解速率也随之增加,而6 h后胺化海绵不稳定而氨基含量减少,接醌量也随之减少,从而偶氮染料的降解速率减慢.这一结果与其在茚三酮显色反应的结果相同.胺化时间为6 h时的PVA海绵的对偶氮染料的降解速率最快.
综上所述,通过不同的方法得到胺化时间为6 h的PVA海绵具有较高的氨基含量,从而具有较好的对偶氮染料的降解速率,所以其将胺化时间定为6 h.
3.3 探究不同胺化温度合成的醌基PVA海绵对生物降解的影响设定PVA海绵的胺化温度作为变量,胺化时间为6 h,接醌时间4 h和接醌温度30 ℃保持不变,来探索其对偶氮染料的加速降解过程.
3.3.1 茚三酮显色反应测定不同胺化温度的PVA海绵氨基含量PVA海绵在不同胺化温度下的合成对茚三酮显色反应的影响如图 5a所示.
 |
| 图 5 不同胺化温度合成的醌基PVA海绵对氨基含量的影响与其对偶氮染料的加速降解的影响 Fig.5 The influence of different amination temperature on the content of amination PVA and the effect of the PVA on the degradation of azo dyes |
如图 5a所示,温度在30 ℃以下时,聚乙烯醇海绵的氨基含量随着胺化温度的增加而增加.当胺化温度达到30 ℃以上时,其氨基含量并没有随其胺化温度的增长而持续增加,而是保持30 ℃时氨基含量的值不变,其氨基含量保持稳定并达到最大.因此可以将30 ℃定为较优的胺化温度.
3.3.2 不同胺化温度合成的醌基PVA海绵对偶氮染料的加速降解的影响将合成PVA海绵的胺化时间设定为6 h,接醌反应的温度是30 ℃,接醌时间为6 h不变.单一地改变胺化温度一个变量来合成的PVA海绵进行加速酸性红B的生物降解实验,结果如图 5b所示.
从图 5b中能够得出胺化海绵能够有效地加速偶氮染料的降解,胺化温度为20 ℃的海绵的加速降解能力较差,但随着温度的提升,20 ℃到30 ℃的PVA海绵的降解能力呈现逐渐加强的趋势,说明随着温度的提高氨基含量增加.但胺化温度到了30 ℃及其以上时,PVA海绵的氨基含量达到最大且接醌量也达到最大稳定值,其对偶氮染料降解速率不会再随胺化温度的升高而加快.加速偶氮染料降解速率较好的胺化温度30 ℃与茚三酮显色反应中的结果保持一致,所以选择30 ℃为聚乙烯醇海绵的较优胺化温度.
3.4 探究不同接醌时间合成的醌基PVA海绵对生物降解的影响本实验设定PVA海绵的接醌时间为单一变量,其胺化时间6 h,胺化温度30℃和接醌温度为30 ℃不变,探索其对偶氮染料的加速降解的影响,结果如图 6所示.
 |
| 图 6 接醌时间合成的醌基PVA海绵对偶氮染料加速降解的影响 Fig.6 Effect of different synthesis time for functional PVA grafted with quinone on the degradation of azo dyes |
如图 6所示,接醌PVA海绵都具有加速偶氮染料的生物降解的作用,而在其他条件不变的条件下,接醌时间为2 h时对偶氮染料的加速效果最好,接醌时间在4~8 h时,其加速降解的效果比较接近,当接醌时间为10h时,其加速降解的效果较差.接醌时间为10h效果较慢的原因可能是蒽醌磺酰氯较易水解,随着时间的增加水解较严重,导致接醌量减少,从而使得加速偶氮染料的降解作用降低.
3.5 探究不同接醌温度合成的醌基PVA海绵对生物降解的影响本次设定PVA海绵的接醌温度为单一变量,其胺化时间6 h,胺化温度30 ℃,接醌时间4 h保持不变,探索接醌温度对偶氮染料的加速降解的影响,结果如图 7所示.
 |
| 图 7 接醌温度合成的醌基PVA海绵对偶氮染料加速降解的影响 Fig.7 Effect of different synthesis temperature of the functional PVA grafted with quinone on the degradation of azo dyes |
如图 7所示,不同温度的接醌PVA海绵都具有加速偶氮染料生物降解的作用.在接醌温度在20~40 ℃时随着接醌温度的增加,其对偶氮染料的加速降解作用也越来越好,这表明随着温度的增加PVA海绵的接醌量也越来越大,从而使其的催化降解活性也越来越强.但当温度达到50~60 ℃时,其催化降解活性并没有进一步增强,而是有所减弱,这说明PVA海绵的接醌量有所减少.导致这种结果的原因可能是:二氯甲烷的沸点为40 ℃,当接醌温度高于40 ℃时,二氯甲烷的挥发程度逐渐加大,使得溶解在其中的蒽醌磺酰氯快速析出,遇到水环境时大部分发生水解,这导致在接醌过程中接醌量大大减少,从而其对偶氮染料的催化加速活性降低.
3.6 偶氮染料生物降解过程中ORP的变化在初始酸性红B浓度为200 mg·L-1的条件下,来探索聚乙烯醇海绵对酸性红B的生物脱色过程的脱色率和ORP变化的关系,如图 8所示.
 |
| 图 8 醌基PVA海绵与空白体系对酸性红B的脱色率与ORP值 Fig.8 The decolorization rate of acid red B and ORP of the PVA and the blank system |
如图 8所示,降解2.5 h时含有醌基的PVA海绵脱色率达到了90.2%,与同时刻的空白相比是其脱色率的1.3倍.因此含有醌基的PVA海绵能够显著地提高酸性红B的脱色速率;在空白和含有醌基PVA海绵的两个体系中,随着酸性红B的脱色率不断增加,其ORP的值也均随之降低.在生物脱色过程中,含有醌基的PVA海绵的ORP值与空白体系的相比其值较低.因此我们可以推测出醌基PVA海绵对酸性红B的脱色速率比空白体系明显增加,其原因可能是通过加速ORP的降低来进行实现的.
3.7 醌基PVA海绵的循环使用将制备的醌基PVA海绵进行酸性红B的生物脱色试验,实验进行4 h后将其从培养基中取出,随即将其加入到另一个相同的反应体系中,逐次重复实验,探索醌基PVA海绵的脱色率与循环使用次数之间的关系.醌基PVA海绵对偶氮染料的生物脱色实验的循环使用图如图 9所示.降解反应4 h时,醌基PVA海绵在连续使用11次后其脱色率仍能保持在90%以上,能一直保持较高的脱色率.这表明醌基PVA海绵在循环使用多次的情况下仍能保持良好的生物脱色性能,并且固定的醌基基团并没有损失,这说明醌基PVA海绵具有良好的实际应用价值.
 |
| 图 9 醌基PVA海绵的循环使用次数 Fig.9 The cyclic use of the functional PVA grafted with quinone |
1)聚乙烯醇的最佳胺化反应时间为6 h,最佳胺化温度是30 ℃,最佳接醌反应时间是2 h,最佳接醌温度为40 ℃.元素分析可得PVA的接醌含量是0.08 mmol·g-1,扫描电镜表明醌基基团已经成功接枝到了PVA海绵表面上.
2)醌基的PVA海绵对酸性红B的脱色率明显高于空白体系的脱色率,降解2.5h时含有醌基的PVA海绵脱色率达到了90.2%,是空白体系脱色率的1.3倍.随着酸性红B的脱色率不断增加,其ORP的值也均随之降低,醌基PVA海绵的ORP值比空白体系的较低,这可以推测出醌基PVA海绵对酸性红B具有良好的生物催化作用,这可能是由于ORP值降低来实现的.
3)醌基PVA海绵在循环使用11次后脱色率仍能保持90%以上,这表明醌基PVA海绵在循环使用多次后仍能在微生物的作用下保持良好的介体加速脱色性能.
| [1] | Aran da-Tamaura C, Estrada-Alvarado M I, Texier A C, et al. 2007. Effects of different quinoid redox mediators on the removal of sulphide and nitrate via denitrification[J]. Chemosphere, 69(11): 1722-1727 |
| [2] | 毕晶晶, 彭昌盛, 胥慧真. 2010. 地下水硝酸盐污染与治理研究进展综述[J]. 地下水, 32(1): 97-103 |
| [3] | Cervantes F J, Garcia-Espinosa A, Antonieta Moreno-Reynosa M, et al. 2010. Immobilized Redox mediators on anion exchange resins and their role on the reductive decolorization of azo dyes[J]. Environmental Science & Technology, 44(5): 1747-1753 |
| [4] | 陈延明, 张华雨, 赵丽君, 等. 2013. 氧化还原介体在环境治理中应用研究进展[J]. 河北工业科技, 30(4): 266-271 |
| [5] | Dos Santos A B, Bisschops I A E, Cervantes F J, et al. 2004. Effect of different redox mediators during thermophilic azo dye reduction by anaerobic granular sludge and comparative study between mesophilic (30 ℃) and thermophilic (55 ℃) treatments for decolourisation of textile wastewaters[J]. Chemosphere, 55(9): 1149-1157 |
| [6] | 范彬, 曲久辉, 刘锁祥, 等. 2000. 饮用水中硝酸盐的脱除[J]. 环境污染治理技术与设备, 1(3): 44-50 |
| [7] | 方连峰, 王竞, 周集体, 等. 2007. 醌化合物强化偶氮染料的生物脱色[J]. 中国环境科学, 27(2): 174-178 |
| [8] | Feng F, Uno B, Goto M, et al. 2002. Anthraquinone-2-sulfonyl chloride: a new versatile derivatization reagent-synthesis mechanism and application for analysis of amines[J]. Talanta, 57(3): 481-490 |
| [9] | 郭延凯, 马志远, 郭建博, 等. 2013. 醌介体催化强化酸性红B 生物脱色[J]. 环境工程学报, 7(5): 1739-1744 |
| [10] | Hernández-Montoya V, Alvarez L H, Montes-Morán M A, et al. 2012. Reduction of quinone and non-quinone redox functional groups in different humic acid samples by Geobacter sulfurreducens[J]. Geoderma, 183-184: 25-31 |
| [11] | Lozinsky V I, Plieva F M. 1998. Poly (vinyl alcohol) cryogels employed as matrices for cell immobilization. 3. Overview of recent research and developments[J]. Enzyme and Microbial Technology, 23(3/4): 227-242 |
| [12] | Lu H, Zhou J T, Wang J, et al. 2010. Enhanced biodecolorization of azo dyes by Anthraquinone-2 -Sulfonate immobilized covalently in polyurethane foam[J]. Bioresource Technology, 101(18): 7185-7188 |
| [13] | 梅翔, 陈洪斌, 张全兴, 等. 2001. 微污染水源水生物处理中硝酸盐氮的变化[J]. 环境科学与技术, 24(6): 11-15 |
| [14] | 司伟磊, 吕红, 周集体, 等. 2010. 聚氨酯泡沫固定化蒽醌强化偶氮染料生物脱色的研究[J]. 高校化学工程学报, 24(3): 498-502 |
| [15] | Van der Zee F P, Bisschops I A E, Lettinga G, et al. 2003. Activated carbon as an electron acceptor and redox mediator during the anaerobic biotransformation of azo dyes[J]. Environmental Science & Technology, 37(2): 402-408 |
| [16] | 延利军. 2013. 水中硝酸盐污染现状、危害及脱除技术[J]. 能源环境保护, 27(3): 39-43 |
| [17] | 张建美, 郝会玲. 2014. 地下水硝酸盐生物处理技术研究进展[J]. 长江大学学报(自科版), 11(1): 24-29 |
| [18] | 朱杰, 付永胜. 2006. 生物脱氮处理过程中氮素转化规律的研究[J]. 环境化学, 25(5): 624-629 |
 2015, Vol. 35
2015, Vol. 35


