碳酸酐酶(Carbonic Anhydrase,CA)能够将CO2快速催化转换成为HCO3-,是至今发现的最有效的CO2水合酶催化剂(Gilmour and Perry, 2009).将烟气中的CO2利用CA酶催化吸收分离出来,有效促进了CO2的吸收,加快了CO2的捕集速率,是具有前景的CO2捕集应用技术(Wanjari et al., 2011;Favre et al., 2009).
酶在高温、强酸碱、有机溶剂等条件下易失活,限制了其被广泛应用.固定化技术不仅可使酶易于分离,也利于酶稳定性的提高,且固定化酶具有一定形状和机械强度,可装填于反应器中,便于连续生产,且过程易控制(金杰等,2010;黄磊和陈振民,2006).
近年来,利用固定化CA模拟生物法捕获CO2的技术得到重视,国内外学者在固定化CA的制备方法和对CO2的吸收特性上展开了研究,为固定化酶在工业上的应用提供了更有潜力的方法(潘富军和周作明,2014).Sharma和Bhattacharya(2010)将CA固定在铁屑颗粒上,显示了很高的固定化效率,但固定化材料中酶损耗比较大.Ozdenir等(2009)将CA固定在聚氨酯泡沫上,固定化酶非常稳定,在60 ℃时,固定化酶会失活.Fradette和Ceperkovic(2010)以MEA为溶剂利用CA捕获燃烧物中的CO2,并申请了专利.Zhang等(2011)将CA酶固定在玻璃材料和活性炭上,固定化酶对温度以及硫酸盐和氯化物等杂质的耐受性明显提高,促进了K2CO3溶液对CO2的吸收,贮存稳定性也得到了改善.Zhang等(2009)用纳米复合水凝胶固定CA,将固定化酶布置在PVDF真空纤维膜上吸收低浓度CO2,取得了较好的效果,这给固定化酶的应用提供了更有潜力的方法.高伟芳等(2010)采用不同的固定方法研究CA的固定,制备的固定化酶有较好的耐酸性和稳定性,对固定化酶的应用没有进一步的研究.
目前,在反应釜利用固定化CA催化吸收CO2的研究比较少,为减小固定化酶的流失率,本实验以海藻酸钠为固定材料,采用包埋-交联法制备固定化CA,用量热法测定酶活力,考察了固定化酶的特性和催化吸收CO2的效果,为固定化CA在工业中的应用提供基础.
2 材料与方法(Materials and methods) 2.1 材料碳酸酐酶是从牛血细胞中提取的CAⅡ,白色粉末状,保存温度2~10 ℃;海藻酸钠(AR),生化级,用于固定酶;戊二醛(AR),浓度为25%,一种双官能团交联剂,与酶分子交联形成三维网状结构物质,对酶分子的固定效果好.CO2气体,纯度为99.9%.实验用水为超纯水设备产生的双重去离子水,其它试剂都为分析纯.
2.2 固定化CA制备将3 mL浓度为3.5%的海藻酸钠和1 mL载酶量为0.5 mg · mL-1的CA酶溶液在30 ℃水浴中充分混匀,混合后海藻酸钠的浓度是2.5%,用5 mL注射器(5号针头)吸取混合液,以50 mm的高度逐滴注入浓度为2%的CaCl2溶液中,立即形成光滑的凝胶颗粒.滤出凝胶颗粒,放入2%的CaCl2溶液中,4 ℃条件下静置硬化45 min.再次滤出凝胶颗粒,用蒸馏水充分洗涤至表面无CaCl2溶液后,把凝胶颗粒放在1%的戊二醛溶液里,25 ℃的条件下化学交联1 h.最后滤出凝胶颗粒,用蒸馏水充分洗涤至表面无戊二醛溶液后,用吸水纸吸干表面水分,贮存于4 ℃冰箱中备用.
2.3 酶活力测定碳酸酐酶的酶活力测定方法采用量热法(Zhang et al., 2009),酶活力的计算式如下:
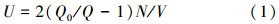
式中,酶活力标准单位μmol(CO2)· s-1 · mg-1用u表示(来琦芳等,2006).N为碳酸酐酶的稀释倍数,V为样品体积,Q0为在烧杯中加入12 mL冰冷的Tris-HCl缓冲液,维持温度于0~4 ℃,用10 mL移液管取8 mL饱和CO2水溶液加入缓冲液,同时按动秒表,记录pH由8.3下降到6.3所需要的时间(s);Q为在烧杯中加入12 mL冰冷的Tris-Hcl缓冲液,维持温度于0~4 ℃,然后加入1 mL浓度为1 mg · mL-1的CA酶溶液或载酶量为1 mg的固定化酶,用10 mL移液管取8 mL饱和CO2水溶液加入缓冲液,同时按动秒表,记录pH由8.3下降到6.3所需要的时间(s).
碳酸酐酶的固定效果可用固定化酶的酶活回收率来表征,其计算公式为:

固定化酶催化吸收CO2实验装置如图 1所示.反应釜是1 L双层玻璃反应釜,内外直径分别为150 mm和180 mm,有小孔与外界相通,釜内加入由缓冲液调解pH为9.4的200 mL去离子水,通过恒温水浴箱的循环水保持反应釜内的温度恒定,载酶量为1 mg的1.30 g固定化酶布置在纱布做成的反应袋中,100 mL · min-1的CO2通入反应袋,梅特勒pH计(S2206)在线监测反应釜内溶液的pH和温度,pH探头距离反应袋水平距离50 mm.
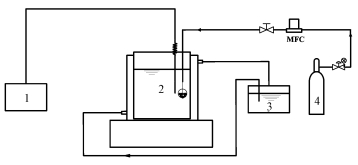 |
| 图 1 固定化酶催化吸收CO2实验装置示意图 (1. pH计; 2. 反应釜; 3. 恒温水浴箱; 4. CO2气瓶) Fig.1 Experimental setup of catalytic absorption of CO2 by immobilized CA (1. pH meter; 2.reactor; 3.incubator; 4.gas cylinder) |
固定化酶的酶活力回收率定义为固定化酶的活力与游离酶活力的比值,载酶量为1 mg的固定化酶由量热法测定酶活力U为1260 u,1 mg游离酶的酶活力测定为2237 u,固定化酶的酶活回收率由式(2)计算为56.3%.
酶的相对酶活力是指单因素条件下测得各组酶活力与该条件下酶的最高活力之比(李桂银等,2009).
将固定化酶和游离酶放在4 ℃冰箱内保存,每5 d测定1次酶活,结果如图 2所示.30 d后,固定化酶的相对酶活力稍有下降,远大于游离酶的61.8%,固定化酶的储存稳定性大幅度提高.
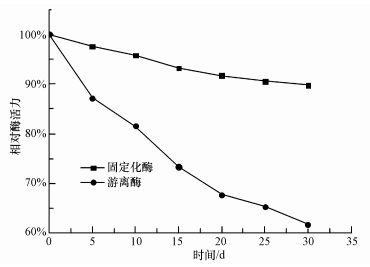 |
| 图 2 固定化酶和游离酶的存储稳定性 Fig.2 stability of immobilized and free CA |
取固定化酶和游离酶各6份,分别置于20~45 ℃条件下温浴20 min,测定固定化酶和游离酶的相对酶活力,结果如图 3所示.相对酶活力随着温度的升高先上升后下降,固定化酶在T=30 ℃时有最高相对酶活力,比游离酶高5 ℃,固定化载体提高了酶的空间结构相对稳定性.再随着温度的上升,固定化酶和游离酶的相对酶活力显著下降,游离酶比固定化酶下降的幅度更大,相比游离酶,固定化酶在30~40 ℃区间,有较高的相对酶活力.相比游离酶,固定化酶在30~40 ℃区间,有较高的相对酶活力.
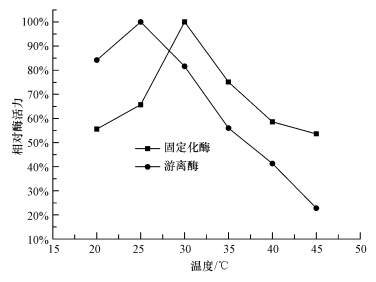 |
| 图 3 固定化酶的最适反应温度 Fig.3 The optimum temperature of immobilized CA |
将固定化酶和游离酶分别加到pH=5~11的缓冲液中,30 ℃温浴20 min后,测定相对酶活力,结果如图 4所示.相对酶活力随着pH的增大先升高再降低,固定化酶在pH=7反应条件下有最高相对酶活力,比游离酶低一个pH单位.固定化酶在pH=6~10范围内,相对酶活力大于80%,比游离酶具有更宽和稳定的反应pH范围.固定化方法和载体材料不同,导致固定化酶在不同的pH下,相对酶活力不同.
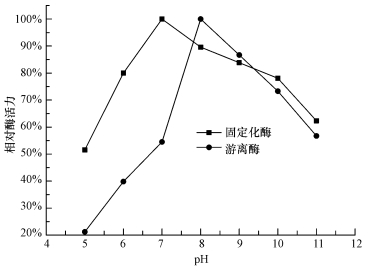 |
| 图 4 固定化酶的最适pH Fig.4 The optimum pH of immobilized CA |
将固定化酶和游离酶分别加到T=20~60 ℃、pH=8.0的缓冲液中,温水浴1 h后,测定相对酶活力,考察固定化酶的热稳定性,如图 5所示.固定化酶在60 ℃温浴1 h后还能保持39.8%的相对酶活力,而游离酶已经基本完全失去活性,可见CA经固定化后,热稳定性显著提高.
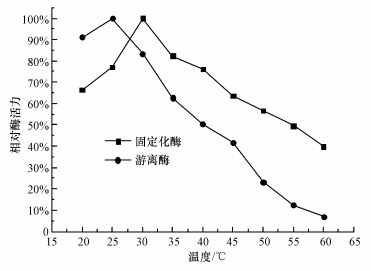 |
| 图 5 固定化酶的热稳定性 Fig.5 Thermal stability of immobilized CA |
将固定化酶和游离酶分别加到pH=5.0~12.0的缓冲液中,30 ℃温水浴1 h后,测定相对酶活力,考察固定化酶的pH稳定性,如图 6所示.固定化酶最高相对酶活力的pH向碱性方向移动,相比游离酶,固定化酶在pH=5.0~11.0范围内有稳定和较高的相对酶活力.
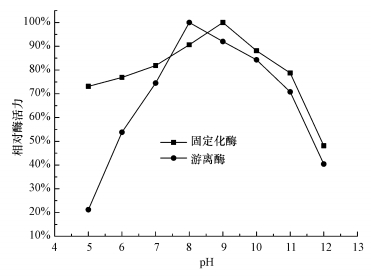 |
| 图 6 固定化酶的pH稳定性 Fig.6 pH stability of immobilized CA |
用图 1所示实验装置研究温 度对固定化酶催化吸收CO2的影响,实验结果如图 7所示.加入固定化酶后,显著加快了水吸收CO2的速度,溶液pH显著下降,固定化酶在T=30 ℃时催化吸收CO2的效果最好.在T=30 ℃时,前90 s内溶液的pH下降了3.27,水吸收CO2的量为4.2×10-6 L.没有酶的空白试验,水吸收CO2的量1.0×10-9 L.固定化酶催化吸收CO2的量是空白试验的4.2×103倍.整个催化反应时间是15 min,溶液pH从9.30下降到5.22,下降了4.08,相当于10%的反应时间完成了80.15%的催化吸收反应.
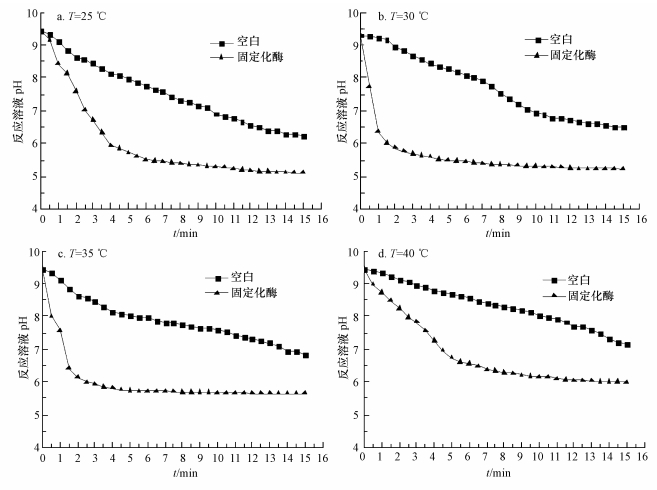 |
| 图 7 温度对固定化酶催化吸收CO2的影响 Fig.7 Effect of temperatures on CO2 absorption by immobilized CA |
将固定化酶放在反应釜中催化吸收CO2,在30 ℃下连续实验6次,每次实验时间为15 min,实验后用缓冲液冲洗,测定酶活力,固定化酶的操作稳定性如图 8所示.经过6次循环后,相对酶活力下降为50.4%,而游离酶于溶液中难以回收,不具有操作稳定性,固定化酶具有较高的操作稳定性.
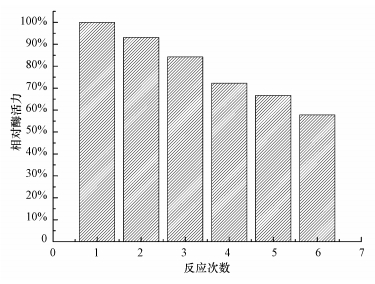 |
| 图 8 固定化酶的操作稳定性 Fig.8 Operation stability of immobilized CA |
固定化酶在50 ℃下烘干后,采用SEM观察微观结构,观察粒径为5μm,结果如图 9所示.无CA酶的凝胶表面紧密,直径小于0.5 μm的孔零星分布;固定化后的凝胶表面粗糙,出现一些隆状突起,小孔尺寸变大;催化吸收CO2后的凝胶表面出现大量形状不规则的小孔,同时一些封闭孔也被打开,空隙结构变得发达,由凝胶固定化酶吸水溶胀和吸收CO2形成.
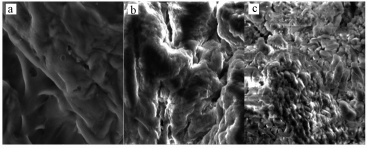 |
| 图 9 凝胶微观结构SEM对比分析 (a.无CA酶, b.固定化后, c.催化吸收CO2后) Fig.9 Comparative analysis of gelatin observed by SEM (a. without CA, b. after immobilization, c. after CO2 catalysis of absorption) |
1)固定化酶的酶活力回收率56.3%,最适反应温度为30 ℃,最适pH为7,在T=30~40 ℃和pH=6~10区间内,固定化酶有稳定和很高的相对酶活力.
2)固定化酶具有较高的操作稳定性和储存稳定性.固定化酶连续实验操作6次,能保持50.4%的相对酶活力,在4 ℃条件下保存30 d后,依然保留89.6%的相对酶活力.
3)固定化酶的热稳定性和pH稳定性显著提高.60 ℃温浴1 h后,固定化酶能保持39.8%的相对酶活力,而游离酶已经基本完全失去活性,固定化酶在pH=5.0~11.0范围内有稳定和较高的相对酶活力.
4)固定化酶催化吸收CO2的效果显著.在T=30 ℃下催化吸收CO2效果显著,10%的反应时间完成了80.2%的催化反应,SEM显示反应后的固定化酶表面出现大量形状不规则的小孔,空隙结构变得发达.
| [1] | Favre N, Christ M L, Pierre A C. 2009. Biocatalytic capture of CO2 with carbonic anhydrase and its transformation to solid carbonate[J]. Journal of Molecular Catalysis B: Enzymatic, 60(3/4): 163-170 |
| [2] | Fradette S, Ceperkovic O. 2010. CO2 absorption solution[P]. US, US7740689. 2010-06-22 |
| [3] | 高伟芳, 肖翔, 张朝晖. 2010. 碳酸酐酶在硅藻土上的固定化及其性质研究[J]. 材料导报, 24(Zl): 405-407 |
| [4] | Gilmour K M, Perry S F. 2009. Carbonic anhydrase and acid-base regulation in fish[J]. Journal of Experimental Biology, 212(11): 1647-1661 |
| [5] | 黄磊, 程振民. 2006. 微孔陶瓷固定化酶载体的合成[J]. 化工学报, 57(4): 912-918 |
| [6] | 金杰, 杨艳红, 吴克, 等. 2010. 中性脂肪酶在凹凸棒石表面固定条件优化及其活性[J]. 太阳能学报, 31(5): 556-560 |
| [7] | 来琦芳, 么宗利, 周凯, 等. 2006. 微量碳酸酐酶活性测定装置[P]. 中国, CN200620042147.8. 2007-11-07 |
| [8] | 李桂银, 杨栋梁, 蒋玉仁, 等. 2009. 交联海藻酸钙凝胶固定化酵母醇脱氢酶研究[J]. 中南大学学报(自然科学版), 40(6): 1510-1516 |
| [9] | Ozdemir E. 2009. Biomimetic CO2 sequestration: 1. immobilization of carbonic anhydrase within polyurethane foam[J]. Energy & Fuels, 23(11): 5725-5730 |
| [10] | 潘富军, 周作明. 2014. 碳酸酐酶固定化技术研究与应用进展[J]. 化学工程, 42(3): 11-17; 58 |
| [11] | Sharma A, Bhattacharya A. 2010. Enhanced biomimetic sequestration of CO2 into CaCO3 using purified carbonic anhydrase from indigenous bacterial strains [J]. Journal of Molecular Catalysis B: Enzymatic, 67(1/2): 122-128 |
| [12] | Wanjari S, Prabhu C, Yadav R, et al. 2011. Immobilization of carbonic anhydrase on chitosan beads for enhanced carbonation reaction[J]. Process Biochemistry, 46(4): 1010-1018 |
| [13] | Zhang S H, Zhang Z H, Lu Y Q, et al. 2011. Activity and stability of immobilized carbonic anhydrase for promoting CO2 absorption into a carbonate solution for post-combustion CO2 capture[J]. Bioresource Technology, 102(22): 10194-10201 |
| [14] | Zhang Y T, Zhi T T, Zhang L, et al. 2009. Immobilization of carbonic anhydrase by embedding and covalent coupling into nanocomposite hydrogel containing hydrotalcite [J]. Polymer, 50(24): 5693-5700 |
 2015, Vol. 35
2015, Vol. 35


