2. 贵州大学动物科学学院, 贵阳 550025;
3. 江南大学, 无锡 214122
2. College of Animal Science, Guizhou University, Guiyang 550025;
3. Jiangnan University, Wuxi 214122
附着藻和沉水植物均为湖泊生态系统中的重要初级生产者(Melzer,1999; Rodusky et al., 2001).在富营养湖泊中,着生于植物表面的附着藻通过竞争光照、二氧化碳等资源,抑制了沉水植物的生长(Jones et al., 2002).螺是水生态系统中常见的大型软体动物,主要以附着藻、有机碎屑等为食(Reavell,1980),通过刮食去除植物表面的附着藻,减弱后者对沉水植物的光限制及其竞争营养盐等的抑制作用,从而有利于沉水植物种群的发展(Jones et al., 2003).因此,螺-附着藻-沉水植物之间的这种生态关系成为维持富营养湖泊沉水植物的重要机制.
对于在氮负荷较高的富营养湖泊中沉水植被较为稀少的现象近年来受到人们的广泛关注(Sagrario et al., 2005;James et al., 2005;Jeppesen et al., 2011),但其机理尚不十分清楚.Li等(2007)发现,较高浓度的氨氮(>0.50 mg · L-1)对沉水植物有毒害作用,影响其生长繁殖,可能导致沉水植物的减少或消失.但这还不能解释那些氨氮浓度较低、而氮负荷或总氮浓度较高的湖泊中沉水植被逐渐消失或难以恢复的现象(Sagrario et al., 2005;James et al., 2005).有研究表明,随着水体氮、磷浓度升高,附着藻的氮、磷含量也会增加,从而改变了以附着藻为食的牧食动物的食物质量(Stelzer et al., 2001).生态计量化学认为,牧食动物在摄食某些元素含量过高的植物后,通过排泄释放过量的营养元素,以维持自身机体元素组成的稳定,如果新陈代谢消耗能量太大,牧食动物的生长就会受到抑制(Anderson et al., 2005;Boersma et al., 2006).那么,氮负荷升高导致的附着藻食物质量改变,是否会影响螺的生长,从而打破或扰乱了螺-附着藻-沉水植物之间生态关系的平衡,成为氮负荷较高湖泊中沉水植物消亡的原因之一?针对此问题,国内外尚未见报道.
本文选取我国内陆水体常见的大型底栖动物铜锈环棱螺(Bellamya aeruginosa)和沉水植物苦草(Vallisneria spiralis),设计双因子(氮负荷升高、有无螺类)受控实验,研究氮负荷升高对螺-附着藻-苦草之间生态关系的影响,进而探讨氮浓度高的富营养湖泊沉水植物消亡的机制,研究结果有利于明确控制氮负荷在浅水湖泊沉水植物的保护及修复中的作用,为富营养湖泊的管理提供依据.
2 材料与方法(Materials and methods)2013年8月4日至10月4日在苏州太湖基地进行了双因子受控实验.双因子(氮负荷升高、有无螺类)实验共4组处理,即正常氮负荷+无螺组、正常氮负荷+有螺组、3倍氮负荷+无螺组、3倍氮负荷+有螺组,每种处理组设4个重复.正常氮负荷是指与太湖平均每天的营养盐负荷(氮130 μg · L-1,磷5 μg · L-1)相同(Kang et al., 2013),3倍氮负荷是指氮负荷每天增加到3倍而磷负荷不变,即氮为390 μg · L-1,磷5 μg · L-1.有螺组中环棱螺密度为150 ind · m-2,该密度在太湖环棱螺分布范围内(蔡永久等,2009).
实验所用容器为16个高强度的聚乙烯塑料桶(桶高70 cm,上、下底直径分别为48 cm和40 cm),桶放置在水深50 cm的室外水泥池中.实验桶内沉积物厚度10 cm,水深40 cm.实验所用沉积物来自东太湖,经60目过筛混匀后使用,沉积物中总氮、总磷和有机质含量分别为(3.86±1.51)mg · g-1、(0.61±0.19)mg · g-1和(75.6±2.2)mg · g-1.实验用水为500目过滤的东太湖湖水,其初始TN、TP和叶绿素a浓度分别为(0.74±0.08)mg · L-1、(34.3±8.4)μg · L-1和(18.2±3.7)μg · L-1.实验所用的苦草、环棱螺从太湖采集.每个实验桶种植8株苦草,其株高约23~25 cm,叶片5~7片,颜色亮绿,初始重量基本一致.为了采集附着生物,每个桶放置4块硬塑料板(8 cm×10 cm),附着板下方用棉绳系一螺帽,利用水的浮力使其保持垂直状态,与苦草叶片方向一致.苦草种植7 d后,在有螺组中放入规格相近的环棱螺30只 · 桶-1(即150 ind · m-2)(表 1),实验正式开始.
| 表 1 环棱螺与苦草初始重量(平均值±标准差) Table 1 Initial wet weight of Bellamya aeruginosa and Vallisneria spiralis (Mean ± SD) |
实验期间,按照实验设计每天加入配置的营养盐溶液(氮为KNO3,磷为KH2PO4),观察螺类活动情况.在两个月的实验期间,水温变化范围为29.5~35.0 ℃,每两周采集一次水样与附着藻,分析水体总氮、溶解性总氮、总磷、溶解性总磷、氨氮和叶绿素a含量,测定单位面积附着生物干重,其方法依据《湖泊生态调查观测与分析》(黄祥飞,1999).实验结束后,测定苦草湿重、叶片数和株高等生长指标,计算苦草的相对生长率,其计算公式为:RGR=ln(Wf/Wi)/D,其中,Wi和Wf分别为植物实验前、后的湿重,D为天数.计算环棱螺的成活率和生长率.
应用办公软件Microsoft Excel 2010对数据进行计算处理,利用Two-way ANOVA分析不同因子对营养盐浓度、附着生物干重、苦草生长指标、环棱螺存活率和生长率的影响,分析软件采用SPSS 21. 0,作图软件GraphPad Prism 5对数据绘制柱状图.
3 结果与分析(Results and analysis) 3.1 水体理化指标氮负荷升高极显著地提高了水体氮浓度(p < 0.001),3倍氮负荷处理组的总氮和溶解性总氮浓 度均远高于正常氮负荷处理组,环棱螺存在对水体氮浓度影响则不显著(p>0.05).氮负荷升高与环棱螺存在对水体总磷、溶解性总磷及氨氮浓度的影响均不显著,且两因素之间不存在交互作用(p>0.05).氮负荷升高对水体叶绿素a含量有显著影响,3倍氮负荷处理组高于正常氮负荷处理组(p=0.048),环棱螺存在对水体叶绿素a含量的影响极显著,无螺组要高于有螺组(p=0.005),但两者之间不存在交互作用(p>0.05).
 |
| 图 1 水体总氮、溶解性总氮、总磷、溶解性总磷、氨氮与叶绿素a含量 (平均值±标准差) Fig.1 The concentration of total nitrogen, total dissolved nitrogen, total phosphorus, total dissolved phosphorus, ammonia nitrogen and Chl a in water (Mean ± SD) |
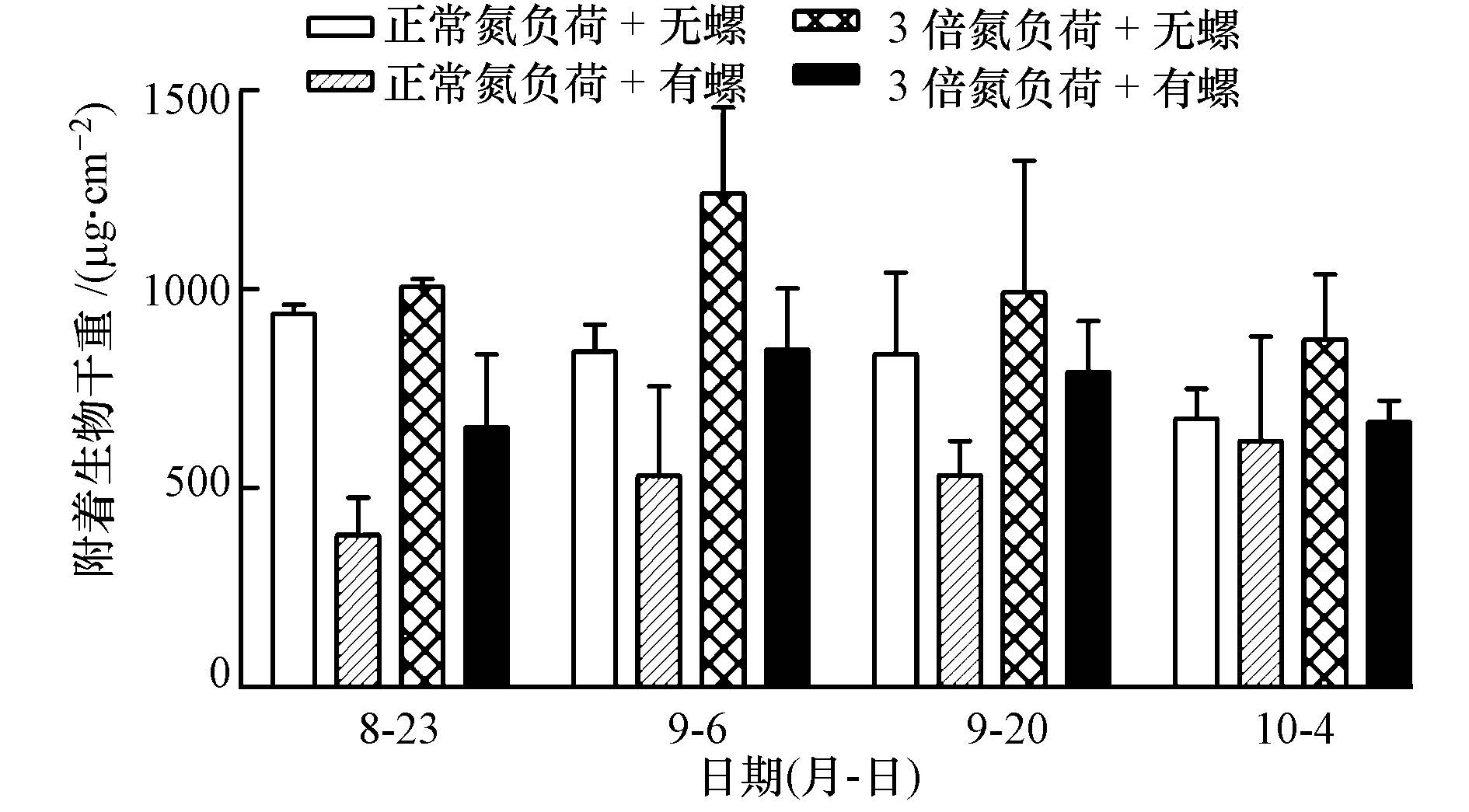 |
| 图 2 附着生物干重(平均值±标准差) Fig.2 Periphyton dry mass on stratum (Mean ± SD) |
氮负荷升高明显增加了附着生物的干重(p=0.02),环棱螺的存在则极显著地降低了附着生物干重(p=0.001),但氮负荷升高与环棱螺存在的交互作用对附着生物干重的影响不显著(p>0.05).
3.3 苦草生长指标氮负荷升高明显抑制了苦草生长(p=0.016),3倍氮负荷处理组的苦草相对生长率、株高和叶片数分别为(17.45±2.80)mg · g-1 · d-1、(22.00±1.90)cm和(92±3)片 · 桶-1,均显著低于正常氮负荷处理组((25.91±2.80)mg · g-1 · d-1、(29.33±1.55)cm和(106±15)片 · 桶-1),降幅分别为33%、25%和13%.环棱螺的存在则促进了苦草生长,有螺组中苦草的相对生长率、株高和叶片数均显著高于其无螺组(p=0.018).然而,氮负荷升高与环棱螺存在对苦草生长无交互作用(p>0.05).
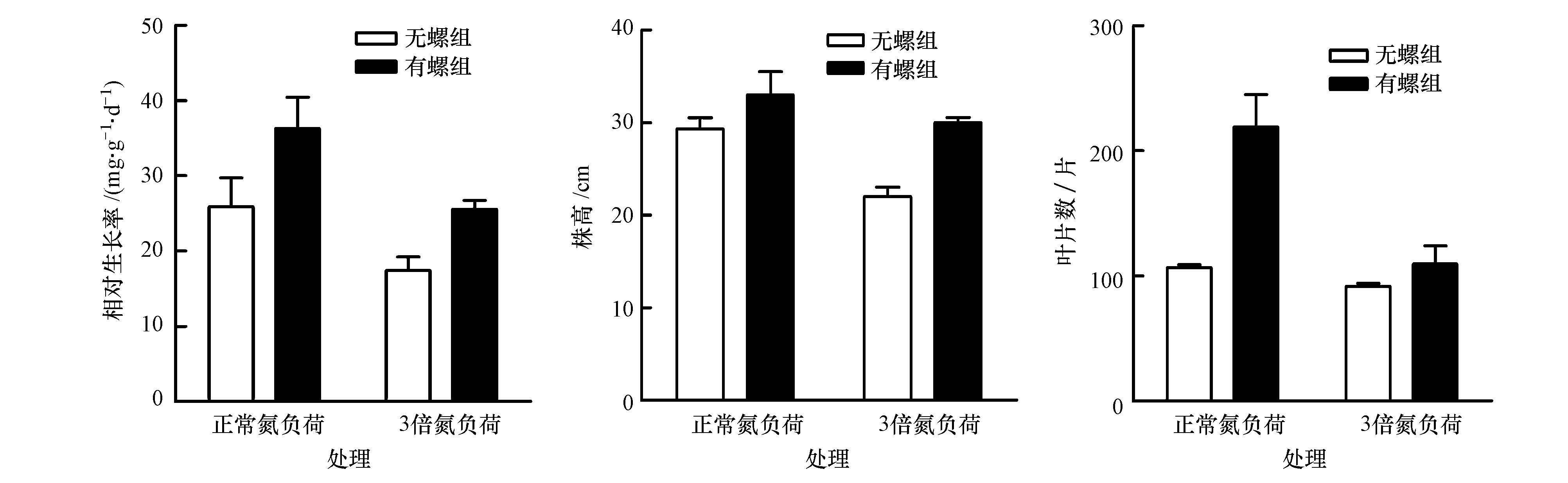 |
| 图 3 苦草的相对生长率、株高和叶片数(平均值±标准差) Fig.3 The relative growth rate, plant height and number of leaves of V. spiralis (Mean ± SD) |
实验结束时,正常氮负荷处理组的环棱螺成活率(82.50%±7.5%)稍高于3倍氮负荷处理组(81.67%±3.33%),差异不显著(p>0.05).氮负荷升高抑制了环棱螺的生长(p=0.001),3倍氮负荷组中环棱螺的生长率((5.10±0.33)mg · d-1)显著低于正常负荷组((9.44±0.20)mg · d-1),降幅达46%.
4 讨论(Discussion)氮浓度较高的湖泊等水体中沉水植物往往极为稀少,对该现象有不同解释.首先是浮游植物因素,Sagrario等(2005)设计了3个浓度梯度的氮负荷(2、4和10 mg · L-1)受控实验,发现氮负荷升高能促进浮游植物特别是蓝藻水华的发展,使水体透明度下降,沉水植物伊乐藻(Elodea canadensis)和眼子菜(Potamogeton)生物量逐渐降低.实验中3倍氮负荷处理的浮游植物生物量(叶绿素a含量)显著高于正常氮负荷处理组,因此,浮游植物的遮光作用可能是抑制苦草生长的原因.其次是附着藻因素,Jones等(2002)发现随富营养化的加剧(实验设定了3种氮浓度梯度:0.2、1和4 mg · L-1),沉水植物(伊乐藻)表面的附着生物量不断升高,有机碳等资源的竞争加剧导致沉水植物(伊乐藻)生物量降低.Phillips等(1978)通过受控实验和英国诺福克湖区(Norfolk Broads)野外调查发现,大茨藻(Najas marina)、狐尾藻(Myriophyllum spicatum)等沉水植物的减少是由于附着生物量的增加,也得出附着藻对沉水植物的光竞争是沉水植物消亡关键因子的结论.本实验结果与上述研究一致,即氮负荷升高使附着生物干重的增加也是抑制苦草生长的主要原因.此外,本实验3倍氮负荷处理组水体中总氮浓度在2~8 mg · L-1之间,高浓度的氮对植物生长是否有不利影响?Barker等(2008)通过受控实验,分析不同浓度梯度的硝态氮(1、2、5和10 mg · L-1)对伊乐藻生长的影响,发现在硝态氮浓度为2 mg · L-1和5 mg · L-1时伊乐藻的生物量要高于其他两组处理.潘琦等(2010)在研究水体硝氮胁迫对不同沉水植物生理生长的影响时也发现,苦草在5 mg · L-1硝态氮浓度处理下生物量积累最大,10 mg · L-1是其能够耐受的最高硝态氮浓度.本实验中3倍氮负荷处理组中营养盐浓度虽然显著高于正常氮负荷组,但实验中氮浓度超过5 mg · L-1的时间较短,且在苦草的耐受浓度范围之内,因此,氮负荷增加应该不是影响苦草生长的主要因素.
环棱螺的存在促进了苦草的生长,可能有两方面的原因.一方面与螺类改善水质有关.Zhu等(2013)研究了不同密度(0、100、200、400 ind · m-2)铜锈环棱螺对浮游植物和水质的影响,发现实验水体中叶绿素a的含量随着螺密度的升高而降低,说明铜锈环棱螺的分泌物质可使水体中颗粒悬浮物迅速絮凝为团状,加快水体悬浮物质的沉降,从而减少了浮游植物的生物量.实验中环棱螺的存在同样显著降低了叶绿素a的含量,减弱了浮游植物对苦草的遮光作用.另一方面与螺牧食去除附着生物有关.研究表明,虽然附着生物过度覆盖会对沉水植物产生不利影响(Liboriussen et al., 2003),但螺通过刮食去除沉水植物表面的附着生物,可减轻后者对沉水植物的抑制,从而有利于沉水植物生长(Jones et al., 2003).实验期间经常观察到环棱螺活动于苦草叶片上,而且实验数据也证实了环棱螺显著降低了附着生物干重,这与李宽意等(2007)的研究有相似结论.
实验中氮负荷升高显著降低了环棱螺的生长率,其原因可能有两个.一是氮浓度升高对螺本身的影响.螺和许多其他水生动物一样,生活的水体中允许的氨氮最高浓度不超过5 mg · L-1(张进凤等,2009),这样的氨氮浓度在自然水体中一般很少存在.环棱螺是太湖中的优势种,其密度分布在东太湖较高,而东太湖的氨氮浓度范围(140~475 μg · L-1)(Qin et al., 2007)与本实验氨氮浓度(100~400 μg · L-1)接近.因此,实验中氨氮浓度不是影响环棱螺生长的原因.Graaf(1964)和Pierce等(1993)认为水生动物在溶氧充足时对硝态氮的耐受浓度可以达到500 mg · L-1. Corrao等(2006)研究也表明福寿螺(Pomacea paludosa)在500 mg · L-1硝态氮浓度下可正常生活,幼螺在504~622 mg · L-1的硝态氮浓度下生长才受到影响.有关长江流域水系的调查也发现,铜锈环棱螺在南河(总氮浓度为2.91~5.50 mg · L-1)、洮滆(总氮浓度为2.36~26 mg · L-1)、黄浦江(总氮浓度为1.11~8.22 mg · L-1)和沿江水系(总氮浓度为3.73~6.77 mg · L-1)均为优势种(吴召仕等,2011).因此,本实验中较高的氮浓度(2~8 mg · L-1)应该不是抑制环棱螺生长的原因.二是氮浓度升高使得附着藻氮磷比偏高,食物质量的改变影响了螺生长.临界元素比率假说认为:牧食动物在摄食某些元素含量过高的植物后会大量消耗能量,以维持自身肌体元素组成的稳定(Boersma et al., 2006;Evans-White et al., 2006;Frost et al., 2006).为了主动维持机体内元素组成的稳定性,必须通过新陈代谢排泄出过量的营养元素,如果排泄耗费能量太大,牧食动物的生长、繁殖速率就会下降(Anderson et al., 2005;Boersma et al., 2006).因此,本实验中氮负荷的升高可能引起附着藻中氮元素含量升高,从而导致环棱螺食物(附着藻)质量下降,这很可能是抑制环棱螺生长的主要原因.Li等(2008)认为附着藻牧食者的数量降低会加快富营养湖泊中沉水植物的减少和消亡.一旦牧食者环棱螺的密度降低,附着藻的牧食压力减小,将间接地提高附着藻生物量,从而抑制苦草生长.当然,这还需要进一步实验来验证.
综上所述,氮负荷升高引起的浮游植物和附着生物生物量的增加是抑制苦草生长的两个主要原因,而环棱螺通过降低浮游植物与附着生物的生物量对苦草生长有促进作用.氮负荷升高还导致环棱螺生长率的下降,可能的原因是附着藻氮磷比升高抑制了螺生长,其生态后果是螺生长与繁殖受抑制后种群数量降低,对附着生物的牧食率也将下降,从而使得附着生物对沉水植物生长的抑制加强,这可能打破或扰乱了螺-附着藻-沉水植物之间生态关系的平衡,成为氮负荷较高湖泊中沉水植物消亡的原因之一.
| [1] | Anderson T R,Hessen D O,Elser J J,et al. 2005. Metabolic stoichiometry and the fate of excess carbon and nutrients in consumers[J]. The American Naturalist,165(1): 1-15 |
| [2] | Barker T,Hatton K,O'Connor M,et al. 2008. Effects of nitrate load on submerged plant biomass and species richness: results of a mesocosm experiment[J]. Fundamental and Applied Limnology,173(2): 89-100 |
| [3] | Boersma M,Elser J J. 2006. Too much of a good thing: on stoichiometrically balanced diets and maximal growth[J]. Ecology,87: 1325-1330 |
| [4] | 蔡永久,龚志军,秦伯强. 2009.太湖软体动物现存量及空间分布格局(2006—2007年)[J].湖泊科学,21(5): 713-719 |
| [5] | Corrao N M,Darby P C,Pomory C M. 2006. Nitrate impacts on the Florida apple snail,Pomacea paludosa[J]. Hydrobiologia,568(1): 135-143 |
| [6] | Evans-White M A,Lamberti G A. 2006. Stoichiometry of consumer-driven nutrient recycling across nutrient regimes in streams[J]. Ecology Letters,9(11): 1186-1197 |
| [7] | Frost P C,Benstead J P,Cross W F,et al. 2006. Threshold elemental ratios of carbon and phosphorus in aquatic consumers[J]. Ecology Letters,9(7): 774-779 |
| [8] | Graaf F D. 1964. Maintenance problems in large public aquaria. Arch[J]. Nearland Zool,16: 142-143 |
| [9] | 黄祥飞. 1999.湖泊生态调查观测与分析[M].北京:中国标准出版社. 72-79 |
| [10] | James C,Fisher J,Russell V,et al.2005.Nitrate availability and hydrophyte species richness in shallow lakes[J].Freshwater Biology,50(6): 1049-1063 |
| [11] | Jeppesen E,Kronvang B,Olesen J E,et al. 2011. Climate change effects on nitrogen loading from cultivated catchments in Europe: implications for nitrogen retention,ecological state of lakes and adaptation[J]. Hydrobiologia,663(1): 1-21 |
| [12] | Jones J I,Young J O,Eaton J W,et al. 2002. The influence of nutrient loading,dissolved inorganic carbon and higher trophic levels on the interaction between submerged plants and periphyton[J]. Journal of Ecology,90(1): 12-24 |
| [13] | Jones J I,Sayer C D. 2003. Does the fish-invertebrate-periphyton cascade precipitate and plant loss in shallow lakes?[J]. Ecology,84(8): 2155-2167 |
| [14] | Kang Y H,Song X L,Liu Z W. 2013. Sediment resuspension dampens the effect of nutrient inputs on the phytoplankton community: a mesocosm experiment study[J]. Hydrobiologia,710(1): 117-127 |
| [15] | Li H J,Cao T,Li H,et al. 2007. Effects of ammonium on growth,nitrogen and carbohydrate metabolism of Potamogeton maackianus A. Benn[J]. Fundamental and Applied Limnology,170(2): 141-148 |
| [16] | 李宽意,文明章,杨宏伟,等. 2007. "螺-草"的互利关系[J].生态学报,27(12): 5427-5432 |
| [17] | Li K Y,Liu Z W,Gu B H. 2008. Persistence of clear water in a nutrient-impacted region of Lake Taihu: The role of periphyton grazing by snails[J]. Fundamental and Applied Limnology,173(1): 15-20 |
| [18] | Liboriussen L,Jeppesen E.2003.Temporal dynamics in epipelic,pelagic and epiphytic algal production in a clear and a turbid shallow lake[J]. Freshwater Biology,48(3): 418-431 |
| [19] | Melzer A. 1999. Aquatic macrophytes as tools for lake management[J]. Hydrobiologia,395-396: 181-190 |
| [20] | 潘琦,邹国燕,宋祥甫. 2010.硝氮胁迫对不同沉水植物生理生长的影响[J].上海环境科学,29(1): 16-20 |
| [21] | Phillips G L,Eminson D,Moss B. 1978. A mechanism to account for macrophyte decline in progressively eutrophicated freshwaters[J]. Aquatic Botany,4: 103-126 |
| [22] | Pierce R H,Weeks J M,Prappas J M. 1993. Nitrate toxicity to five species of marine fish[J]. Journal of the World Aquaculture Society,24(1): 105-107 |
| [23] | Qin B Q,Xu P Z,Wu Q L,et al. 2007. Environmental issues of Lake Taihu,China[J]. Hydrobiologia,581(1): 3-14 |
| [24] | Reavell P E. 1980. A study of the diets of some British freshwater gastropods[J]. Journal of Conchology,30: 253-271 |
| [25] | Rodusky A J,Steinman A D,East T L,et al. 2001. Periphyton nutrient limitation and other potential growth-controlling factors in Lake Okeechobee,U.S.A.[J]. Hydrobiologia,448(1/3): 27-39 |
| [26] | Sagrario M A G,Jeppesen E,Gomà J,et al. 2005. Does high nitrogen loading prevent clear-water conditions in shallow lakes at moderately high phosphorus concentrations?[J]. Freshwater Biology,50(1): 27-41 |
| [27] | Stelzer R S,Lamberti G A. 2001. Effects of N:P ratio and total nutrient concentration on stream periphyton community structure,biomass,and elemental composition[J]. Limnology and Oceanography,46(2): 356-367 |
| [28] | 吴召仕,蔡永久,陈宇炜,等. 2011.太湖流域主要河流大型底栖动物群落结构及水质生物学评价[J]. 湖泊科学,23(5): 686-694 |
| [29] | 张进凤,李瑞伟,刘杰凤,等. 2009.淡水养殖水体氨氮积累危害及生物控制的研究现状[J]. 河北渔业,(6): 41-44 |
| [30] | Zhu J Y,Lu K H,Liu X S. 2013.Can the freshwater snail Bellamya aeruginosa (Mollusca) affect phytoplankton community and water quality?[J]. Hydrobiologia,707(1): 147-157 |
 2015, Vol. 35
2015, Vol. 35


