种间竞争是指两种或两种以上生物共同利用同一资源而产生的相互作用,是生物群落中普遍存在的物种间相互产生负效应的一种作用方式.对其机理的研究有助于进一步了解竞争生物的生长及抑制规律,可以用来调控生物的生长和繁殖,进行有害生物的防治.种间竞争不仅与种群密度、生物个体大小密切相关,而且与温度、盐度、光照和营养盐等环境条件密切相关.研究表明,营养盐是限制藻类光合作用、生长的决定性因素(Peter et al., 2013;赵艳芳等,2009),研究人员普遍认为氮磷营养盐条件不仅决定藻类生长繁殖,而且是微藻种间竞争的关键因子(Edwards et al., 2011;Mellard et al., 2012;Yang et al., 2012;袁美玲等,2008).浮游植物在其生长过程中,氮和磷的作用常常是相互的,Redfield(1958)提出藻类适宜的氮磷比(原子质量比)为16 ∶ 1,然而不同的藻类对氮、磷营养盐有各自不同的需求,其生长适宜的氮磷比也不同,正是这种对资源的不同需求在某种程度上决定了浮游植物不同物种之间的竞争与共存.孟顺龙等(2012)的研究结果表明,微囊藻在中氮磷比(N/P=4.5)下生长最好,而颤藻在低氮磷比(N/P=0.45)下生长最好,氮磷比对藻类的种间竞争抑制参数能够产生明显影响,中、高氮磷比时,微囊藻在竞争中占优势,低氮磷比时,微囊藻和颤藻不稳定共存.因此,研究氮磷比对浮游植物种间竞争的影响具有重要意义.
有关海洋微藻间的相互作用包括赤潮微藻之间(Lim et al., 2014;Gong et al., 2014;董云伟等,2004;蔡恒江等,2005;赵晓玮等,2009),以及大型海藻与赤潮微藻间(Ye et al., 2014;王悠等,2006;曲良等,2007;雷光英等,2010)等的研究已经广泛展开,但关于饵料微藻与赤潮微藻间相互作用及其作用机理的研究仅见少数报道(郝雯瑾等,2008;魏杰等,2012).塔玛亚历山大藻(Alex and rium tamarense)是一种能够产生麻痹性贝毒(PSP)的有害赤潮藻,由其引发的赤潮曾在世界各地海域及养殖区域屡次发生(林元烧,1996;陈月琴等,1999);蛋白核小球藻(Chlorella pyrenoidosa)因其具有蛋白核、生长迅速、易培养且具有较高的经济价值等优点受到极大关注,在国内外被广泛培养用作海产经济动物育苗的开口饵料.因此,本文选取塔玛亚历山大藻和蛋白核小球藻为实验对象,在实验生态条件下,研究氮磷比对两种微藻在单独培养和共培养模式下的生长特征,分析两种微藻生长繁殖与氮磷比的相互关系,初步探讨两种微藻的种间竞争机制.以期为探讨饵料藻和赤潮藻间相互作用的规律和竞争机制提供有价值的参考资料,并为运用种间竞争进行赤潮生物防控提供一些理论依据.
2 材料与方法(Materials and methods) 2.1 藻种来源本实验所用的蛋白核小球藻和塔玛亚历山大藻均来源于辽宁省水生生物学重点实验室.实验前,反复转接藻种并培养3~4个周期,使细胞达到同步生长.
2.2 培养条件培养海水取自大连黑石礁近海,经沉淀、过滤,煮沸消毒后待用.用于微藻培养的500 mL广口锥形瓶均预先用次氯酸刷洗,并于高温高压灭菌30 min后待用.培养液采用f/2营养盐配方,接种的藻种均保证其处于指数生长期.培养温度为(20±1)℃,盐度为31.0±0.5,光照强度2000 lx,光照周期L ∶ D=10 h ∶ 14 h,pH=8.34.每隔4~6 h摇瓶1次,防止藻附壁或下沉.
2.3 试验方法塔玛亚历山大藻室内采用f/2培养基培养,其氮含量为12.35 mg · L-1,磷含量为1.34 mg · L-1.海洋浮游植物在一般情况下对氮、磷营养盐的吸收比率符合经典Redfield比值,即浮游植物对营养盐的吸收基本上按照N/P接近16这个比例进行,因此,本实验以此为依据来设置氮、磷浓度及氮磷比.
实验以NaNO3和KH2PO3为氮源和磷源,氮、磷的初始浓度参照表 1,其余元素均与f/2培养基中相同.处理组:设N固定组与P固定组,每组设5个水平,将处于指数生长期的两种微藻按照等起始生物量(1.661×10-2 g · L-1)共同培养在400 mL上述培养液中.实验以相同条件下单独培养的两种微藻为对照组,处理组与对照组均设3个重复,于光照培养箱中连续培养15 d.
| 表 1 培养基氮、磷初始浓度 Table 1 Initial concentrations of nitrogen and phosphorus in the culture medium |
处理组:将处于对数生长期的蛋白核小球藻藻液经0.45 μm滤膜真空抽滤,再经过0.22 μm滤膜进行二次除菌抽滤,得到蛋白核小球藻的培养滤液,滤液中添加f/2营养盐并接种处于指数生长期的塔玛亚历山大藻,生物量为1.661×10-2 g · L-1.同样方法处理塔玛亚历山大藻的培养滤液,并接种等生物量的蛋白核小球藻.实验以正常海水中单独培养的两种微藻为对照组,处理组与对照组均设3个重复,于光照培养箱中连续培养15 d.
2.5 结果观察每隔1 d取1 mL藻液,取前摇匀,鲁哥氏液固定,观察微藻细胞密度和粒径的变化.在OlympusCX21型双筒显微镜下用血细胞计数板进行细胞计数,每个样品计数3次,取其平均值,计算细胞密度.因蛋白核小球藻和塔玛亚历山大藻细胞形态均似球体,其粒径用直径表示,在OlympusCX21型双筒显微镜下用目镜测微尺进行粒径测量,每种微藻随机测量50个细胞,取其平均值.并将每个细胞体积单独计算,分别得出两种微藻细胞的平均体积.由于微藻细胞的相对密度接近1,因此,其体积值可视为其鲜重值(即平均湿重).在实验中根据微藻细胞密度(ind · L-1)和平均湿重(g · ind -1)来换算生物量(g · L-1).
2.6 计算和统计方法种间竞争优势用相对生长速率判别,其计算公式为(林忠洲等,2013):

式中,K为生长速率常数,Nt为培养t天后的藻密度(ind · L-1),N0为初始藻密度(ind · L-1),K1为单独培养时塔玛亚历山大藻相对于蛋白核小球藻的生长速率,KA、KC分别为单独培养时塔玛亚历山大藻和蛋白核小球藻的生长速率常数,K2为共培养时塔玛亚历山大藻相对于蛋白核小球藻的生长速率,K′A、K′C则为共培养时二者的生长速率常数;KR值大于1表示塔玛亚历山大藻具竞争优势,等于1说明两种藻无竞争,小于1表示蛋白核小球藻具竞争优势.
数据以平均值±标准差表示,绘图和统计分析分别在Excel2007和SPSS17.0中完成,采用T检验、单因素方差分析(ANOVA),p<0.05表示组间差异显著.
3 结果(Results) 3.1 不同氮磷比下蛋白核小球藻和塔玛亚历山大藻的生长特征不同氮磷比下蛋白核小球藻和塔玛亚历山大藻的生长曲线见图 1.各氮磷比中两种微藻的生物量均随培养时间的延长先升后降.蛋白核小球藻在N/P为16时,单养11 d时生物量达到最大值,共养9 d时生物量达到最大值,而其他N/P中蛋白核小球藻在两种培养模式下均在13~15 d时生物量达到最大值;塔玛亚历山大藻在各氮磷比中单养13~15 d时生物量达到最大值,共养11~13 d时生物量达到最大值.可见,两种微藻在共养模式下达到最大生物量所需时间较单养模式有所提前.
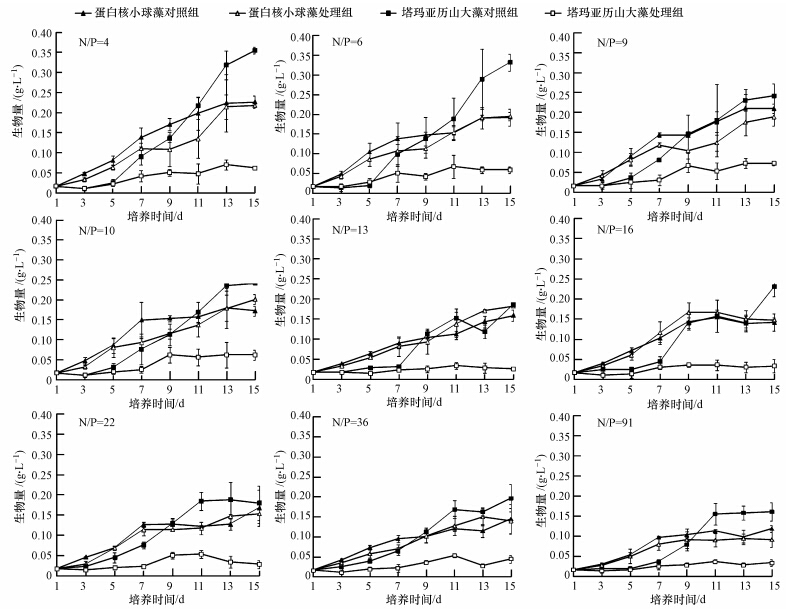 |
| 图 1 不同氮磷比对蛋白核小球藻和塔玛亚历山大藻生长的影响 Fig. 1 Effect of different ratios of nitrogen to phosphorus on the growth of C. pyrenoidosa and A. tamarense |
两种培养模式下蛋白核小球藻的最大生物量比较结果见图 2a.经统计检验分析,氮磷比对两种培养模式下蛋白核小球藻的最大生物量影响显著(p<0.05),单养蛋白核小球藻在N/P为4时最大生物量显著高于N/P为36和91的实验组(p<0.05),而与其他各组差异不显著(p>0.05);共养蛋白核小球藻在N/P为4时最大生物量显著高于N/P为16~91实验组(p<0.05),而与其他各组差异不显著(p>0.05).N/P为6、10、13、16和36时共养蛋白核小球藻的最大生物量均高于单养模式,但差异不显著(p>0.05),共养约为单养的101%~115%.
 |
| 图 2 不同氮磷比对蛋白核小球藻(a)和塔玛亚历山大藻(b)最大生物量的影响 Fig. 2 Effect of different ratios of nitrogen to phosphorus on the maximum biomass of C. pyrenoidosa(a) and A. tamarense(b) |
两种培养模式下塔玛亚历山大藻的最大生物量比较结果见图 2b.经统计检验分析,氮磷比对两种培养模式下塔玛亚历山大藻的最大生物量影响显著(p<0.05),单养塔玛亚历山大藻在N/P为4和6时的最大生物量显著高于其他各组;共养塔玛亚历山大藻在N/P为4和9时的最大生物量显著高于N/P为13、16和91实验组(p<0.05),而与其他各组差异不显著(p>0.05).各组共养塔玛亚历山大藻的最大生物量均显著低于单养(p<0.05),共养仅为单养的15.85%~30.23%.
由此可见,在单养模式下,蛋白核小球藻在N/P为4~22时生长适宜,N/P>22时生长受抑制,塔玛亚历山大藻在N/P为4和6时生长适宜,N/P>6时生长受抑制;在共养模式下,蛋白核小球藻具有竞争优势,而塔玛亚历山大藻生长受抑制.
3.2 蛋白核小球藻和塔玛亚历山大藻的种间竞争关系塔玛亚历山大藻对蛋白核小球藻的相对生长速率如图 3所示.自培养7 d始各氮磷组中KR值均介于0~1之间,且随培养时间的延长呈下降趋势,其中,N/P为13和16时KR值较其他各组低,当培养15 d时KR值可低至0.16~0.22.由此可见,蛋白核小球藻表现出明显的竞争优势,且N/P为13和16时其种群竞争优势最明显.
 |
| 图 3 塔玛亚历山大藻对蛋白核小球藻的相对生长速率 Fig. 3 Relative growth ratio of C.pyrenoidosa to A. tamarense |
两种培养模式下蛋白核小球藻的粒径比较见图 4a.经统计检验分析,氮磷比对两种培养模式下蛋白核小球藻粒径的影响不显著(p>0.05),在共养模式下,N/P为9、13、16、22和91时其粒径低于单养模式,但差异均不显著(p>0.05).
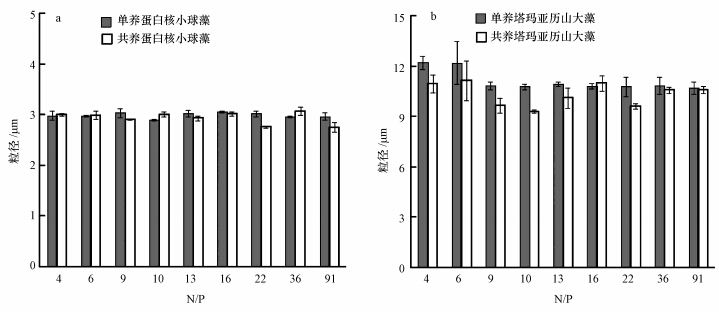 |
| 图 4 不同氮磷比对蛋白核小球藻(a)和塔玛亚历山大藻(b)粒径的影响 Fig. 4 Effect of different ratios of nitrogen to phosphorus on the size of C. pyrenoidosa(a) and A. tamarense(b) |
两种培养模式下塔玛亚历山大藻的粒径比较见图 4b.经统计检验分析,氮磷比对两种培养模式下塔玛亚历山大藻粒径的影响显著(p<0.05),单养模式下塔玛亚历山大藻在N/P为4和6时粒径显著大于其他各组(p<0.05);共养模式下塔玛亚历山大藻除N/P为16时粒径略大于单养模式下外,其他各组粒径均小于单养模式下,其中,在N/P为9和10时较单养模式下差异显著(p<0.05).由此可见,蛋白核小球藻在两种培养模式下粒径受氮磷比影响不明显,而塔玛亚历山大藻在单养模式下粒径随氮磷比的增大有逐渐减小的趋势,种间竞争使其粒径普遍减小.
3.4 一种微藻的培养滤液对另一种微藻生长的影响两种微藻中,一种微藻的培养滤液对另一种微藻的生长影响见图 5.经统计检验分析,生物量均无显著影响(p>0.05),说明在共培养条件下,蛋白核小球藻和塔玛亚历山大藻的培养滤液对彼此生长均未产生抑制作用.
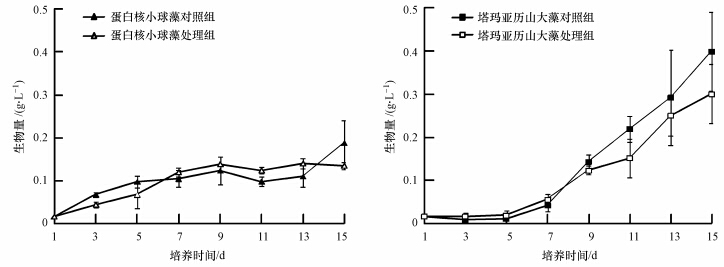 |
| 图 5 一种微藻的培养滤液对另一种微藻生长的影响 Fig. 5 Effect of culture filtrate of one algal species on the growth of the other species |
一般而言,藻类的生长受水体中营养盐含量的影响.研究表明,浮游藻类所需的氮、磷营养盐下限分别为0.08 mg · L-1和0.018 mg · L-1(钱振明等,2008).本实验设计的氮、磷浓度范围分别为6.31~28.14 mg · L-1和0.31~2.21 mg · L-1,远高出所需下限,但随着藻密度的增大和营养盐的消耗,低浓度组也会表现出一定的营养盐限制,这说明每种藻类所需的最适营养盐浓度和下限不同.当水体中营养盐较充足时,不同N/P也会影响藻类的生长.有学者提出N/P为16时最适宜藻类生长,若N/P>16,P则成为限制因子;当N/P<10,N则成为限制因子;当N/P为10~20时,限制因子不确定(Li et al., 2001).每种微藻对氮磷结构比都具有特殊的需求,如林忠洲等(2013)得到青岛大扁藻的最适N/P为14.81,孙育平等(2011)得到亚心形扁藻最适N/P为17,Austin等(1990)、于瑾等(2006)得到牟氏角毛藻的最适N/P分别为23、28.本研究表明,蛋白核小球藻生长适宜的N/P幅度较大(4~22),N/P为36和91(远大于16)时,磷显然已成为限制因子,其生长受到抑制,说明蛋白核小球藻对磷的需求较高(1.29~2.21 mg · L-1),而对氮的适应性强(6.31~28.14 mg · L-1).这与Tilman等(1984)的研究结果基本一致:绿藻对磷的需求比氮高.而塔玛亚历山大藻在N/P为4和6时生长适宜,氮未成为其限制因子,说明塔玛亚历山大藻适宜在低氮(6.31~10.21 mg · L-1)、高磷(1.79 mg · L-1)的营养条件下生长,高氮(28.14 mg · L-1)条件会抑制其生长.这与石岩峻等(2003)的研究结果基本一致:塔玛亚历山大藻在氮浓度为12.25 mg · L-1,磷浓度为3.35 mg · L-1条件下,藻细胞具有最大的生物量,磷浓度在1.12 mg · L-1时藻细胞具有最大的比生长速率;甲藻的生长需要消耗更多的磷,低N/P有利于赤潮藻类的爆长.这一结果可为赤潮预警预报提供一定的科学依据.
4.2 蛋白核小球藻与塔玛亚历山大藻的种间竞争机制藻类在共同培养下,随着藻密度的增加和营养盐的消耗,微藻之间会产生竞争排斥,通常对营养盐吸收能力强的藻类会表现出更强的生长优势,一般情况下最大密度会低于单独培养模式或者与之持平,但也有高于单独培养的现象发生(Rhee,1978;谢志浩等,2008).本研究表明,共养模式下蛋白核小球藻的最大生物量略高于单独培养模式或者与之持平,而塔玛亚历山大藻的生长明显受抑制.从塔玛亚历山大藻对蛋白核小球藻的相对生长速率KR值来看,蛋白核小球藻具有明显的竞争优势,这与魏杰等(2012)的研究结果基本一致.海洋的浮游植物在一般情况下,对氮、磷营养盐的吸收比率符合经典Redfield比值,即浮游植物对营养盐的吸收基本上按照N/P接近16这个比例进行,这可能是造成在N/P为13和16时KR值较低的原因.
生物种间竞争可分为资源利用性竞争和相互干扰性竞争.资源利用性竞争主要特征表现为参与竞争的个体对营养盐、光照等有限环境资源的竞争.浮游生物的大小在海洋浮游生物群落结构组成中起重要作用,藻类的大小、形态和表面积/体积比例的不同会影响其对营养盐的吸收能力(Karp-Boss et al., 1996),Egge(1998)认为营养盐的吸收与细胞表面积显著相关,Armstrong(2003)认为微藻间的相互作用存在明显的大小依赖性,个体较小的微藻具有较大的比表面积,能更多地吸收营养和接收光照,获取生长所需条件.蛋白核小球藻的个体大小约为塔玛亚历山大藻的1/100,因而具有较大的比表面积,这可能是蛋白核小球藻在竞争中占有优势的主要原因.本研究表明,在共养模式下,蛋白核小球藻的粒径在各氮磷比中变化不明显,而塔玛亚历山大藻的粒径较单独培养普遍缩小,按照上述说法其比表面积相对增大,由此推测,种间竞争可能会提高塔玛亚历山大藻对营养盐的相对吸收率.在N/P为13和16时蛋白核小球藻种群竞争优势最明显,此时氮、磷含量都趋于最高,从两种微藻对氮、磷的需求量来看,由于高氮(28.14 mg · L-1)、高磷(1.79~2.21 mg · L-1)条件适宜蛋白核小球藻的生长;而塔玛亚历山大藻对氮有较低的需求(6.31~10.21 mg · L-1),高氮(28.14 mg · L-1)条件会抑制其生长,这可能是蛋白核小球藻在竞争中占有优势的重要原因.
相互干扰性竞争为一个个体以行为上的直接对抗影响另一个个体,竞争的手段可能通过他感作用(即分泌次生物质)和直接接触来实现.很多有毒赤潮藻类在吸收营养盐方面并没有什么优势,但它们可以通过分泌毒素等方式在海洋浮游生物群落中占优势(Chen et al., 2005;Jonsson et al., 2009;Weissbach et al., 2010).对塔玛亚历山大藻的研究表明(Tan et al., 2002;蔡恒江等,2005),其藻细胞和去藻过滤液都有一定的毒性作用.但本研究表明,两种微藻的一种培养滤液对另一种微藻生长的影响均不明显,说明在共培养条件下,两种微藻的培养滤液对彼此生长均未产生抑制作用.由此推测,蛋白核小球藻和塔玛亚历山大藻的种间竞争主要以资源利用性竞争为主.
5 结论(Conclusions)1)蛋白核小球藻的生长对磷的需求较高(1.29~2.21 mg · L-1),对氮的适应性强(6.31~28.14 mg · L-1),适宜的N/P幅度较大(4~22);而塔玛亚历山大藻的生长对氮的需求较低(6.31~10.21 mg · L-1),对磷的需求较高(1.79 mg · L-1),适宜的N/P为4和6.
2)在共同培养的条件下,蛋白核小球藻具有竞争优势,且N/P为13和16时蛋白核小球藻种群竞争优势最明显.蛋白核小球藻在两种培养模式下粒径受氮磷比影响不明显.蛋白核小球藻和塔玛亚历山大藻的培养滤液对彼此生长均未产生抑制作用.
| [1] | Austin A P,Ridley-Thomas C I,Lucey W P,et al.1990.Effects of nutrient enrichment on marine periphyton: Implications for abalone culture[J].Botanica Marina,33(3): 235-240 |
| [2] | Chen B Z,Zhu M Y,Wang Z L,et al.2005.Adaptive and competitive strategies of red tide algae[J].Marine Environmental Science,24(1): 70-75 |
| [3] | 蔡恒江,唐学玺,张培玉,等.2005.不同起始密度对3种赤潮微藻种间竞争的影响[J].生态学报,25(6): 1331-1336 |
| [4] | 陈月琴,邱小忠,屈良鹄,等.1999.南海有毒塔玛亚历山大藻的分子地理标记分析[J].海洋与湖沼,30(1): 45-51 |
| [5] | 董云伟,董双林,刘相义.2004.不同起始浓度对塔玛亚历山大藻和赤潮异弯藻种群竞争的影响[J].中国海洋大学学报(自然科学版),34(6): 964-968 |
| [6] | Edwards K F,Klausmeier C A,Litchman E.2011.Evidence for a three-way trade-off between nitrogen and phosphorus competitive abilities and cell size in phytoplankton[J].Ecology,92(11): 2085-2095 |
| [7] | Egge J K.1998.Are diatoms poor competitors at low phosphate concentrations?[J].Journal of Marine Systems,16(3/4): 191-198 |
| [8] | Gong Y M,Hu H H.2014.Effect of silicate and inorganic carbon availability on the growth and competition of a diatom and two red tide dinoflagellates[J].Phycologia,53(5): 433-442 |
| [9] | 郝雯瑾,王悠,唐学玺.2008.两种海洋微藻—强壮前沟藻与青岛大扁藻之间的相互作用研究[J].中山大学学报:自然科学版,47(S1): 98-105 |
| [10] | Jonsson P R,Pavia H,Toth G.2009.Formation of harmful algal blooms cannot be explained by allelopathic interactions[J].Proceedings of the National Academy of Sciences of the United States of America,106(27): 11177-11182 |
| [11] | Karp-Boss L,Boss E,Jumars P A.1996.Nutrient fluxes to planktonic osmotrophs in the presence of fluid motion[J].Oceanography and Marine Biology: An Annual Review,34: 71-107 |
| [12] | 雷光英,杨宇峰,李宵.2010.龙须菜对赤潮异弯藻和海洋原甲藻的生长抑制效应[J].海洋环境科学,29(1): 27-31 |
| [13] | Li R X,Zhu M Y,Chen S,et al.2001.Responses of phytoplankton on phosphate enrichment in mesocosms[J].Acta Ecologica Sinica,21(4): 603-607 |
| [14] | Lim A S,Jeong H J,Jang T Y,et al.2014.Inhibition of growth rate and swimming speed of the harmful dinoflagellate Cochlodinium polykrikoides by diatoms: Implications for red tide formation[J].Harmful Algae,37: 53-61 |
| [15] | 林元烧.1996.有毒甲藻——塔玛亚历山大藻在厦门地区虾塘引起赤潮[J].台湾海峡,15(1): 16-18 |
| [16] | 林忠洲,徐善良,邵波,等.2013.不同氮磷质量浓度下青岛大扁藻和牟氏角毛藻的种间竞争关系[J].宁波大学学报(理工版),26(1): 12-17 |
| [17] | Mellard J P,Yoshiyama K,Klausmeier C A,et al.2012.Experimental test of phytoplankton competition for nutrients and light in poorly mixed water columns[J].Ecological Monographs,82(2): 239-256 |
| [18] | 孟顺龙,裘丽萍,胡庚东,等.2012.氮磷比对两种蓝藻生长及竞争的影响[J].农业环境科学学报,31(7): 1438-1444 |
| [19] | Peter K H,Sommer U.2013.Phytoplankton cell size reduction in response to warming mediated by nutrient limitation[J].PLoS ONE,8(9): e71528 |
| [20] | 钱振明,邢荣莲,汤宁,等.2008.光照和盐度对8种底栖硅藻生长及其生理生化成分的影响[J].烟台大学学报(自然科学与工程版),21(1): 46-52 |
| [21] | 曲良,肖慧,王仁君,等.2007.鼠尾藻和小珊瑚藻对赤潮异弯藻克生效应的初步研究[J].中国海洋大学学报(自然科学版),37(4): 621-626 |
| [22] | Redfield A C.1958.The biological control of chemical factors in the environment[J].American Scientist,46(3): 205-221 |
| [23] | Rhee G Y.1978.Effects of N:P atomic ratios and nitrate limitation on algal growth,cell composition,and nitrate uptake[J].Limnology and Oceanography,23(1): 10-25 |
| [24] | 石岩峻,胡晗华,马润宇,等.2003.塔玛亚历山大藻对氮和磷的吸收及其生长特性[J].应用生态学报,14(7): 1143-1146 |
| [25] | 孙育平,赵曰水.2011.不同氮、磷浓度下亚心形扁藻的生长及水体中氮、磷变化[J].水产科学,30(4): 197-201 |
| [26] | Tan Z J,Yan T,Zhou M J,et al.2002.The effects of Alexandrium tamarense on survival,growth and reproduction of Neomysis awatschensis[J].Acta Ecologica Sinica,22(10): 1635-1639 |
| [27] | Tilman D,Sterner R W.1984.Invasions of equilibria: tests of resource competition using two species of algae[J].Oecologia,61(2): 197-200 |
| [28] | 王悠,俞志明,宋秀贤,等.2006.大型海藻与赤潮微藻以及赤潮微藻之间相互作用的研究[J].环境科学,27(2): 274-280 |
| [29] | 魏杰,赵文,杨为东,等.2012.起始生物量比对3种海洋微藻种间竞争的影响[J].生态学报,32(4): 1124-1132 |
| [30] | Weissbach A,Tillmann U,Legrand C.2010.Allelopathic potential of the dinoflagellate Alexandrium tamarense on marine microbial communities[J].Harmful Algae,10(1): 9-18 |
| [31] | 谢志浩,肖慧,蔡恒江,等.2008.不同起始数量对赤潮异弯藻和东海原甲藻种间竞争的影响[J].海洋环境科学,27(5): 462-465 |
| [32] | Yang S W,Wang S R,Wang H M,et al.2012.Interspecific competition among Cyanophyta,Chlorophyta and Diatom in response to pulse supply of nitrate[J].International Journal of Environment and Waste Management,10(1): 13-24 |
| [33] | Ye C P,Liao H P,Yang Y F.2014.Allelopathic inhibition of photosynthesis in the red tide-causing marine alga,Scrippsiella trochoidea (Pyrrophyta),by the dried macroalga,Gracilaria lemaneiformis (Rhodophyta)[J].Journal of Sea Research,90: 10-15 |
| [34] | 于瑾,蒋霞敏,梁洪,等.2006.氮、磷、铁对牟氏角毛藻生长速率的影响[J].水产科学,25(3): 121-124 |
| [35] | 袁美玲,王朝晖,李友富.2008.N、P营养盐对海洋卡盾藻(Chattonella marina)生长的影响[J].生态学报,28(1): 430-435 |
| [36] | 赵晓玮,唐学玺,王悠.2009.两种海洋赤潮微藻赤潮异弯藻和米氏凯伦藻之间的相互作用[J].植物生态学报,33(5): 958-965 |
| [37] | 赵艳芳,俞志明,宋秀贤,等.2009.营养盐对长江口2种主要赤潮原因藻光合色素和光合作用影响的比较研究[J].环境科学,30(3): 700-706 s |
 2015, Vol. 35
2015, Vol. 35


