2. 福建省污染控制与资源循环利用重点实验室, 福州 350007
2. Fujian Key Laboratory of Pollution Control and Resource Reuse, Fuzhou 350007
近年来,由于大量含磷废水未经处理或处理不当就排入水体,远远超出了磷的排放标准,导致水体富营养化现象频发且日趋严重,威胁着水生生物的生存和饮用水安全.目前污水处理厂普遍采用的生物处理工艺由于易受污泥质量、温度、pH等因素的影响导致除磷效果不稳定,需要进一步深度处理(向衡等,2013 ; Su et al., 2013 ).吸附法具有操作简单、处理效率高、无二次污染,且可将磷酸盐回收再利用(李敏等,2013 )等优点而倍受青睐.因此,制备一种成本低廉,生物相容性好,吸附容量大,环境友好的新型吸附剂显得尤为重要.
单分散纳米氧化铁由于比表面积大,吸附性能好,有磁性易分离被应用于环境中重金属离子、染料、磷酸根等环境污染物的单独和同步去除(汪婷等,2013 ).已有研究表明,单分散纳米氧化铁作为吸附剂用于去除低浓度含磷废水已成为一种稳定有效且回收率高的方法(李国亮等,2012 ; Yoon et al., 2014 ).常规的单分散纳米氧化铁合成方法如化学沉淀法、水热法、溶胶-凝胶法、微乳液法则存在成本高,使用的化学药品易产生二次污染等弊端(Tang and Lo, 2013 ).因此,迫切需要发展一种绿色经济的制备单分散纳米氧化铁的方法.
目前,利用自然产物如植物提取物,茶叶、咖啡、简单的氨基酸,葡萄酒、蔗糖或葡萄糖等作为还原剂和稳定剂制备纳米金属(Kharissova et al., 2013 )的绿色合成技术由于具有原料易得,操作简单,成本低廉和可大规模使用等优点(Iravani,2011 )备受关注. Njagi等在pH=2~3的条件下用高粱麸皮合成出纳米铁(Njagi et al., 2011 ),但存在酸性废液的处理问题. 高书燕等(Gao et al., 2008 )采用海藻酸钠还原氯化铁制备出纳米氧化铁,但反应需要在180 ℃条件下进行24 h,导致能耗较高,成本增加. 同时,本课题组在前期工作中利用桉叶提取液成功制备零价纳米铁(Wang et al., 2014 ),证实桉树叶提取液中存在的抗氧化剂如多酚,还原糖,氨基酸等能取代常用的有毒化学试剂如硼氢化钠、二甲基甲酰胺等作为还原剂使用,符合绿色化学的目标. 由于氯化铁水解生成的氢氧化铁沉淀物在加热的条件下会转化为氧化铁,通过将氯化铁加到桉树叶提取液并水浴加热一段时间,一方面能利用桉树叶提取液中的还原性物质进一步将氧化铁还原为四氧化三铁(Fe3O4),另一方面也能作为稳定剂降低单分散纳米氧化铁的团聚生长,但由于单分散纳米氧化铁有较高的表面能(Tang and Lo, 2013 ),导致分散性差和易团聚成为制约其应用的关键因素.
表面活性剂不仅可以作为润湿剂和增溶剂,还可以作为分散剂和稳定剂改性合成金属纳米材料,提高纳米材料的多分散性和稳定性(Jin et al., 2012 ;金晓英等,2014 ).然而,对不同的离子型表面活性剂改性绿色合成单分散纳米氧化铁的表面性质和吸附性能的差异却鲜有研究. 基于此,本文在绿色合成单分散纳米氧化铁过程中分别引入阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)和阴离子表面活性剂十二烷基硫酸钠(SDS)对氧化铁进行表面改性;同时,通过SEM、EDS、UV-vis、FTIR和Zeta电位等表征手段及去除磷酸根实验,比较CTAB-IONP,SDS-IONP和IONP在形貌尺寸和表面电荷的变化以及对磷的吸附效果;另外,还进行了动力学研究,探讨不同的离子型表面活性剂对调控绿色合成单分散纳米氧化铁活性的影响.
2 材料与方法(Materials and methods) 2.1 试剂和材料桉树叶摘自福州市闽侯区福建师范大学旗山校区;六水合氯化铁;无水醋酸钠,酒石酸锑氧钾,抗坏血酸和磷酸二氢钾;十六烷基三甲基溴化铵(CTAB)和十二烷基硫酸钠(SDS);钼酸铵;硫酸;无水乙醇. 所有化学试剂均为分析纯.
2.2 仪器SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);DZF-6020型真空干燥箱(上海精宏实验设备有限公司);THZ-320台式恒温振荡器(上海精宏实验设备有限公司);GZX-9070MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);紫外可见分光光度计(UV-1902,上海凤凰光学科仪有限公司).
2.3 改性和未改性纳米氧化铁的制备 2.3.1 桉叶提取液的制备量取30 g洗净晒干的桉树叶剪碎后加到500 mL蒸馏水中,在80 ℃条件下恒温水浴加热1 h(使多酚氧化酶失活)后,用0.45 μm滤膜真空抽滤,所得滤液即桉树叶提取液(EL),贮存于棕色玻璃瓶内留用.
2.3.2 纳米氧化铁 IONP的制备依次称取19.68 g NaAc,6.48 g FeCl3 · 6H2O加到120 mL桉树叶提取液中,在70 ℃条件下搅拌反应2 h,反应后的黑色产物依次用蒸馏水和无水乙醇润洗2~3遍,真空抽滤后置于45 ℃真空干燥箱中干燥过夜,所得黑色固体粉末即纳米氧化铁(IONP).反应过程见方程式(1,2)(Venkateswarlu et al., 2013 ):
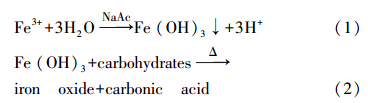
取0.0876 g CTAB(2 mmol · L-1)加到含有19.68 g NaAc,6.48 g FeCl3 · 6H2O的120 mL桉树叶提取液中,其他条件同2.3.2节.
2.3.4 改性SDS-IONP的制备取0.0654 g SDS(2 mmol · L-1)加到含有19.68 g NaAc,6.48 g FeCl3 · 6H2O 的120 mL桉树叶提取液中,其他条件同2.3.2节.
2.4 表征扫描电子显微镜(SEM):采用JSM-7500型扫描电子显微镜观察样品的表面形貌和微观形态; X射线能量色散谱(EDS):利用与SEM联机的X射线能量散射仪分析样品表面的元素种类和含量;紫外可见全波扫描(UV-vis):采用UV1902紫外可见分光光度计获取试样的UV-vis谱图,扫描范围200~800 nm;傅里叶变换红外光谱(FTIR):采用Thermo Nicolet 5700红外光谱仪,获取试样的FTIR谱图,溴化钾压片,扫描范围4000~400 cm-1;Zeta电位:采用MALVERN ZEN3600电位仪,取少量试样的悬浮液加蒸馏水稀释相同倍数后用0.1 mmol · L-1 的HCl或NaOH分别调至不同的pH值,超声分散30 min后,测定试样在不同pH值时的表面电势.
2.5 磷酸根的吸附实验吸附反应在50 mL的玻璃瓶中进行,反应温度为25 ℃,分别量取0.05 g CTAB-IONP,0.05 g SDS-IONP,0.05 g IONP加入到25 mL溶液浓度为20 mg · L-1的磷酸盐溶液中,在振荡速度250 r · min-1的摇床中分别振荡0、2.5、5、15、30、45、60、90 min取样,用0.45 μm滤膜快速过滤后,采用钼锑抗分光光度法测定磷酸根的浓度,以去除率和吸附量来评价吸附剂的性能.所有实验平行3次.
2.6 pH对吸附磷的影响实验取一系列50 mL的玻璃瓶分别加入25 mL浓度为20 mg · L-1的磷酸盐溶液,测得溶液初始pH为1.6,通过逐滴滴加0.1 mmol · L-1 NaOH分别调节溶液pH至3、5、7、9、11、13,分别加入0.05 g 试样在25 ℃,250 r · min-1的恒温摇床中振荡反应2 h后取出,用0.45 μm滤膜快速过滤后,采用钼锑抗分光光度法测定滤液中的磷酸根的浓度. 实验平行3组进行.
3 结果与讨论(Results and Discussion) 3.1 改性和未改性绿色合成氧化铁去除磷酸根的效率为研究表面改性对绿色合成氧化铁反应活性的影响,在温度为25 ℃,磷酸根初始浓度为20 mg · L-1(溶液pH为1.62)的条件下对CTAB-IONP、SDS-IONP和IONP分别进行吸附磷酸根的实验,结果如图 1所示.
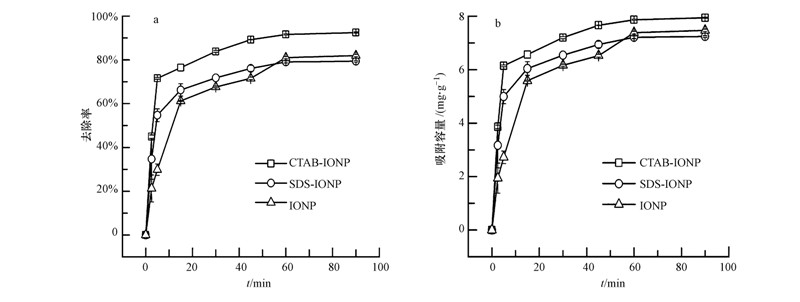 |
| 图 1 CTAB-IONP,SDS-IONP和IONP对磷酸根的去除率(a)和吸附容量(b) Fig.1 Removal efficiency(a) and adsorption capacity(b)of phosphate using CTAB-IONP,SDS-IONP and IONP |
从图 1中可以看出,未改性的IONP吸附磷酸根的反应速率较慢,在反应进行5 min时,去除率仅为29.82%;而CTAB-IONP和SDS-IONP反应速率较快,5 min时去除率分别达到71.57%和54.73%,前期反应速率的提高可能是因为表面改性后的氧化铁分散度明显提高,增加了单位时间吸附剂表面活性位点和磷酸根的接触机会,加快了对磷酸根的吸附. 随着反应的进行,材料表面的活性吸附位点逐渐被磷酸根覆盖,反应速率逐渐变慢,到90 min时基本达到平衡.平衡时CTAB-IONP,SDS-IONP和IONP对磷酸根的去除率依次为92.47%,79.38%和81.94%,平衡吸附量分别达到7.939、7.238、7.472 mg · g-1.其中,CTAB是阳离子表面活性剂,在合成CTAB-IONP的过程中通过头端作用与氧化铁表面羟基发生吸附,并由于疏水作用包覆在氧化铁上使其带正电,在和带负电的磷酸根离子反应时,由于异种电荷间的静电吸引和氧化铁表面羟基与溶液中H2PO-4、HPO2-4、PO3-4的配体交换(Anderson and Rubin, 1989 )的共同作用使得对磷酸根的去除率提高了10.53%,平衡吸附容量增加了0.467 mg · g-1. 相反,SDS是阴离子表面活性剂,能降低氧化铁纳米颗粒的表面能阻碍其团聚,降低氧化铁粒径,增大比表面积,但由于在溶液中电离出带负电的基团C12H25SO2-4取代氧化铁表面的OH-(肖进新和赵振国,2003 ),减少了氧化铁表面进行配体交换的吸附位点,此外,SDS-IONP和磷酸根离子的表面均带负电,增强了静电斥力,导致对磷酸根的去除率和吸附量与未改性氧化铁相比略有下降.
3.2 扫描电子显微镜(SEM)为观察离子型表面活性剂对氧化铁改性后形貌结构上的变化,采用SEM对CTAB-IONP、SDS-IONP和IONP进行表征,如图 2a、2b、2c所示.
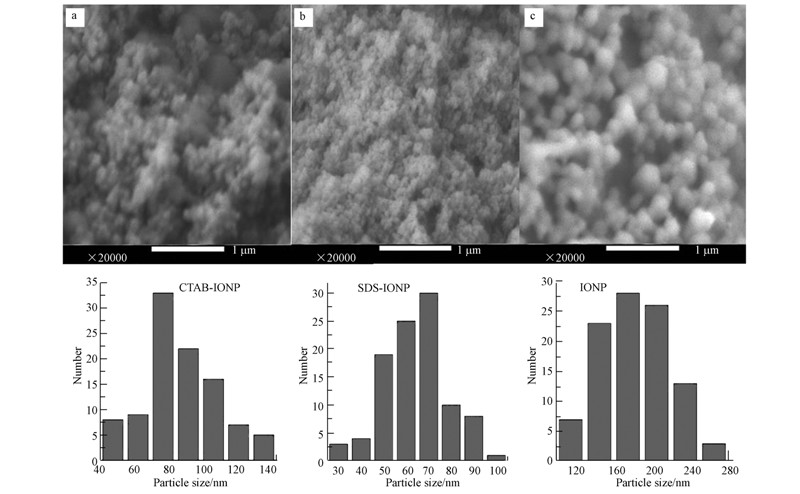 |
| 图 2 扫描电镜图(a. CTAB-IONP; b.SDS-IONP; c. IONP) Fig.2 The SEM images of(a. CTAB-IONP; b.SDS-IONP; c.IONP) |
如图 2所示,改性氧化铁(2a、2b)和未改性氧化铁(2c)整体形貌均呈不规则球形,同时,这些球形的氧化铁纳米粒子因其粒径小、比表面积大,无法独立生长,且存在范德华力和磁性吸引,发生了不同程度的团聚现象(Tang and Lo, 2013 ; 李国亮等,2012 ). 利用Smileview软件进行电镜粒度统计分析,结果表明CTAB-IONP的粒径主要分布在80~90 nm之间,相比粒径范围为130~180 nm的IONP前者粒径更小,粒径分布范围更窄,分散性更好,吸附位点更多,这是由于CTA+带正电,首先通过头端静电作用包覆在氧化铁表面然后在疏水作用下定向排列使得带正电的亲水基团朝外从而改变了氧化铁的表面电荷,同时较长的疏水碳链对应较强的空间位阻,增强了CTAB-IONP颗粒间的立体空间结构. 图 2b中SDS-IONP的粒径最小,平均粒径在60 nm左右,则是因为SDS所带的阴离子取代了氧化铁表面的羟基吸附在氧化铁表面,降低了纳米氧化铁的表面能,增大了粒子之间的距离,阻碍了颗粒的相互接触和进一步团聚,极大地提高了纳米氧化铁的分散度.
3.3 X射线能量色散谱(EDS)通过EDS表征离子型表面活性剂改性纳米氧化铁前后成分和元素含量的变化,结果如图 3所示.
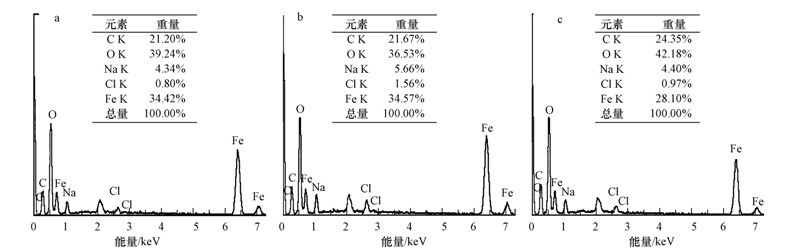 |
| 图 3 X射线能谱图(a. CTAB-IONP; b.SDS-IONP; c. IONP) Fig.3 The X-ray energy spectra of(a.CTAB-IONP; b.SDS-IONP; c. IONP) |
从图 3中可以看出,3种材料中均含有C、O、Fe、Na、Cl,这说明表面改性没有改变氧化铁的成分,只引起元素含量的变化.其中,Fe和O元素的存在证实了制得的是氧化铁纳米复合材料,C既是桉叶萃取液中的多酚,还原糖等抗氧化剂的主要成分(Wang et al., 2014 ),也是CTAB和SDS的主要组成元素. CTAB-IONP(图 3a),SDS-IONP(图 3b)和IONP(图 3c)中Fe元素的含量依次为34.42%、34.57%、28.10%,Fe含量的增加说明了CTAB和SDS改性氧化铁中活性组分的提高,这与SEM中改性氧化铁粒径变小,粒径分布范围变窄及分散度提高的结果相符.
3.4 紫外-可见吸收光谱(UV-vis)图 4是波长200~600 nm范围内分别对绿色合成的CTAB-IONP,SDS-IONP和IONP前驱体胶体溶液紫外可见扫描光谱图.
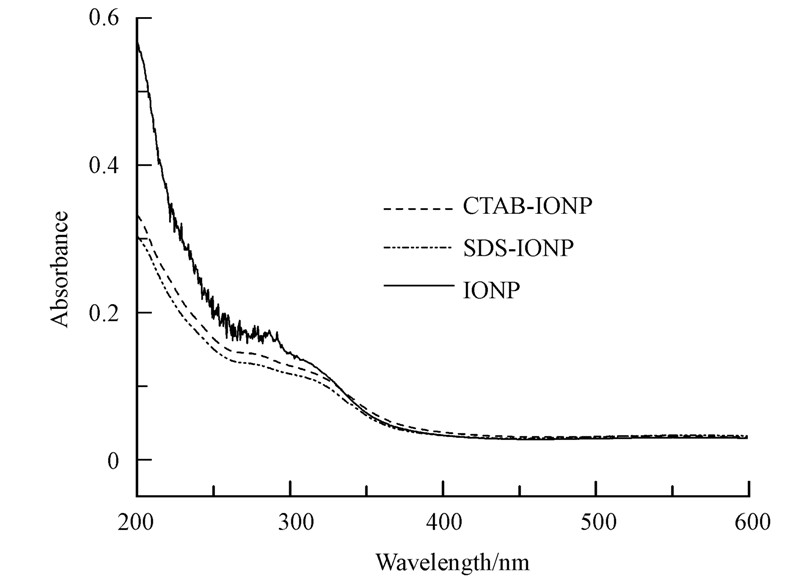 |
| 图 4 紫外-可见光谱图 Fig.4 The UV-vis spectrum of different ionic form of IONPs |
从图 4中可以看到吸收起始位置随粒子尺寸减小,量子尺寸效应导致200~300 nm处吸收峰的蓝移(杨迈之等,1994 ),这与SEM结果相符,也进一步证实了阳离子表面活性剂和阴离子表面活性剂对合成纳米金属的粒径有不同程度的影响.
3.5 傅里叶变换红外光谱(FTIR)图 5a、5b、5c、5d、5e分别为CTAB-IONP、SDS-IONP、IONP、CTAB和SDS的红外光谱图.在未改性IONP的红外光谱图(图 5(c))中,3440 cm-1附近宽的吸收峰是由于羟基自由基的伸缩振动,1553cm-1和1412 cm-1处分别为多酚类物质中芳环上的C C的伸缩振动峰和O—H的弯曲振动峰,545 cm-1和659 cm-1处出现的是Fe3O4和Fe2O3中Fe—O的伸缩振动峰(金晓英等,2014 ),这说明未改性的绿色合成氧化铁表面包裹着部分有机物.
图 5a、5b、5c、5d、5e分别为CTAB-IONP、SDS-IONP、IONP、CTAB和SDS的红外光谱图.在未改性IONP的红外光谱图(图 5(c))中,3440 cm-1附近宽的吸收峰是由于羟基自由基的伸缩振动,1553cm-1和1412 cm-1处分别为多酚类物质中芳环上的C C的伸缩振动峰和O—H的弯曲振动峰,545 cm-1和659 cm-1处出现的是Fe3O4和Fe2O3中Fe—O的伸缩振动峰(金晓英等,2014 ),这说明未改性的绿色合成氧化铁表面包裹着部分有机物.
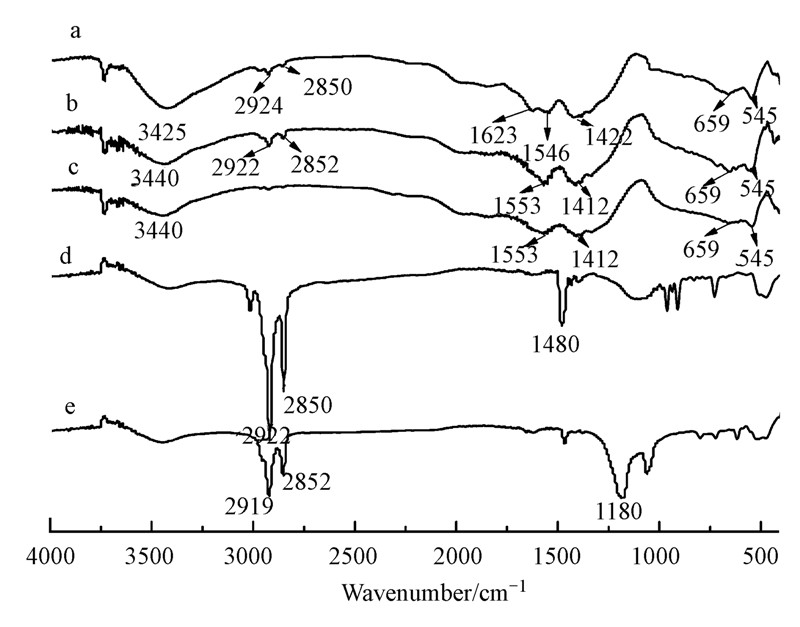 |
| 图 5 红外光谱图(a. CTAB-IONP; b. SDS-IONP; c. IONP; d. CTAB; e. SDS) Fig.5 The FTIR spectrum of(a. CTAB-IONP; b. SDS-IONP; c. IONP; d. CTAB; e. SDS) |
图 5a中,3425 cm-1和1623 cm-1附近出现的较尖的吸收峰分别为脂肪胺类的游离氨基的N—H键伸缩振动峰和弯曲振动峰,覆盖了氧化铁中较弱的O—H吸收峰.2924 cm-1和2850 cm-1处出现了新的吸收峰为季铵盐上有机基团的吸收峰,在1422 cm-1也有CH3-N+分子对称和反对称的C—H剪形振动峰出现(Kavas et al., 2010 ),与单独的CTAB的红外光谱图(图 4d)中特征峰的位置相符,这表明CTAB-IONP的表面确实被CTAB包覆,同时Fe—O的特征吸收峰没有变化说明氧化铁的结构没有被破坏.CTAB通过静电吸附作用和疏水作用改性绿色合成氧化铁,有效地提高其分散度和吸附能力,这与吸附磷酸根实验结果一致.
与IONP的红外光谱图(图 4c)相比,SDS-IONP(图 4b)中除了在2922 cm-1和2852 cm-1处成对出现了与单独的SDS的红外光谱图(图 4e)中一致的吸收峰,该特征峰是由SDS的疏水碳链中—CH2的伸缩振动引起(P and ey et al.,2014),其它各个官能团的吸收峰变化不大,说明阴离子表面活性剂SDS通过离子交换作用吸附在氧化铁固体表面且未改变氧化铁的组成,进一步证实SEM和EDS的结果.
3.6 Zeta电位(Zeta potential)为进一步探究阳离子表面活性剂CTAB和阴离子表面活性剂SDS改性氧化铁表面电荷的不同,通过Zeta电位来测定3种样品在不同pH条件下的电势,结果如图 6所示.
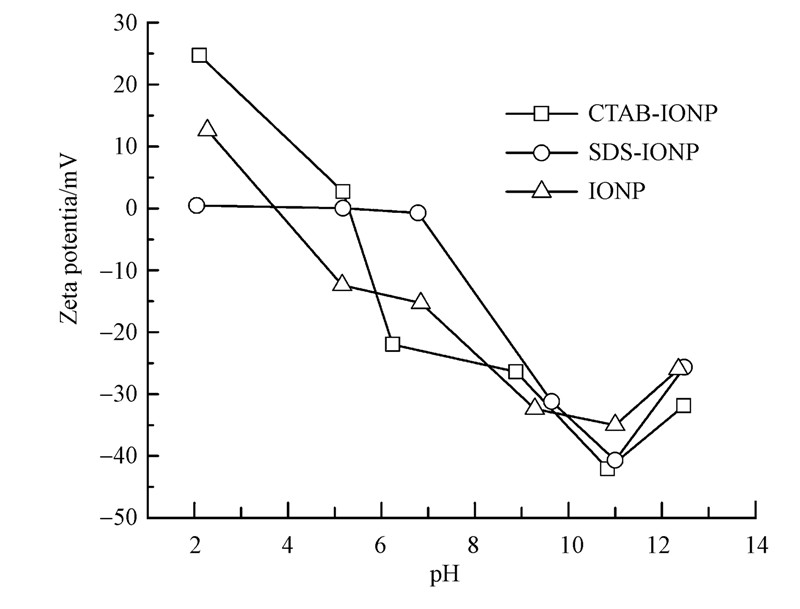 |
| 图 6 Zeta电位 Fig.6 Zeta potential of different ionic form of IONPs |
对比CTAB-IONP、SDS-IONP和IONP的Zeta电位随氧化铁悬浮液pH的变化趋势,可以看出IONP的Zeta电位随pH增加而逐渐减小,到等电点(pH≈4)时为零,继续减小为负值,Zeta电位越小说明吸附层越厚,当pH>11时又增加,拐点出现的原因是pH影响材料表面结构导致颗粒团聚;CTAB-IONP的Zeta电位随pH变化波动较大,拐点较多,表明CTAB-IONP对pH较敏感,等电点也向右漂移到pH=5.6左右(Su et al., 2013 ),同时在pH≈2时,CTAB-IONP电位(正值)大于IONP的电位,当pH大于等电点时,电位(负值)小于IONP的电位,说明CTAB-IONP的分散性比IONP好(Carneiro-da-Cunha et al., 2011 );而SDS-IONP在酸性pH范围内电位基本为零,这可能是因为溶液中的H+被带负电的SDS中和而呈现电中性,在碱性环境中变化趋势与未改性氧化铁IONP类似. 此外,利用pH计测得氧化铁悬浮液初始pH为5.16,此时CTAB-IONP、SDS-IONP和IONP的Zeta电位分别为2.68、0、 -12.4 mV,这表明未改性氧化铁表面带负电,而CTAB-IONP表面带正电,SDS-IONP呈电中性,进一步证实阳离子表面活性剂和阴离子表面活性剂改性氧化铁的表面电荷不同,这与我们对上述实验现象的解释一致.
3.7 pH对吸附磷的影响(Effect of solution pH)由于氧化铁产生的Fe2+及其水解产物(包括Fe(OH)+、Fe(OH)2、Fe(OH)-3)受溶液pH影响较大,而且在不同pH条件下,磷酸盐的存在形式也不同,考察了pH对吸附磷的影响,如图 7所示.
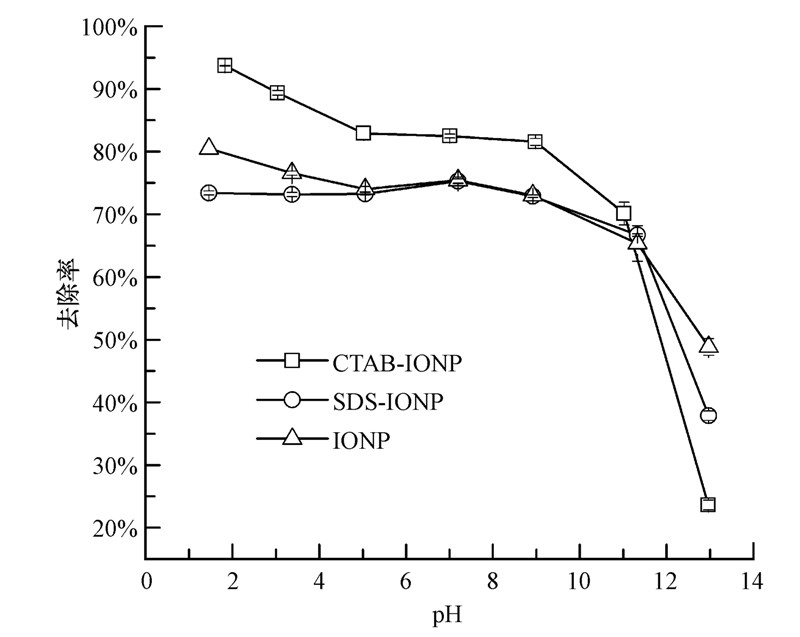 |
| 图 7 溶液pH对吸附磷的影响 Fig.7 Effect of solution pH on phosphate adsorption |
结果表明,随着pH的增加,3种材料对磷酸根的去除率均呈现先缓慢下降后骤降的趋势. 当pH<2时,含磷物相主要是H3PO4和H2PO-4,氧化铁表面结构为 ≡(FeOH2)+,在静电吸附和羟基化吸附的共同作用下CTAB-IONP的去除率(93.69%)明显高于IONP(80.47%)和SDS-IONP(73.39%);当pH为2~7时,磷主要以H2PO-4 的形式存在(Chowdhury and Yanful, 2010 ),氧化铁表面结构为 ≡ FeOH,此时以羟基化吸附为主要吸附作用;pH增加到11时,CTAB-IONP,SDS-IONP,IONP对磷的去除率分别降至70.12%,66.68%,65.33%,这可能是因为随着pH增加,HPO2-4和PO3-4为主要含磷相(pH>7.2),纳米氧化铁表面结构变为 ≡ FeO-、HPO2-4和PO3-4与 ≡ FeO-在溶液中发生静电排斥作用(Liu et al., 2008 ),不利于HPO2-4和PO3-4在氧化铁表面上的吸附. 当pH>13时,过量的OH-和Fe(OH)3既占据了氧化铁表面的吸附位点也通过静电斥力抑制磷酸根在氧化铁表面的吸附,导致CTAB-IONP,SDS-IONP,IONP对磷的去除率分别降至23.62%,37.87%和48.82%. 结果表明本研究制得的氧化铁不同于其他氧化物吸附剂(Yoon et al., 2014 ; Su et al., 2013 ),能在较宽的pH范围(1~11)内的水体中实现磷的有效去除. 不同pH条件下可能的吸附机制主要包括:
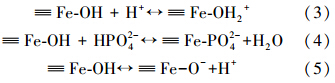
分别利用公式(6)、(7)对3种材料吸附磷的实验数据进行伪一级动力学模型和伪二级动力学模型拟合(Yoon et al., 2014 ),结果如表 1所示.
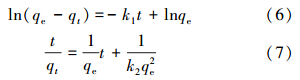
| 表 1 不同材料吸附磷的动力学参数 Table 1 The kinetic parameters of phosphate adsorption by different materials |
由表 1可知,伪一级动力学拟合的相关系数R2相对较低,理论吸附容量和实际吸附容量相差较大,而伪二级动力学拟合的相关性较好,R2均在0.99以上,理论吸附容量和实际吸附容量接近(见3.1节),这表明该反应更符合伪二级动力学(Yoon et al., 2014 ).CTAB-IONP和SDS-IONP吸附磷酸根的伪二级反应速率常数分别为0.0416 g · mg-1 · min-1和0.0390 g · mg-1 · min-1,比未改性IONP的伪二级反应速率常数(0.0122 g · mg-1 · min-1)均有提高,这说明吸附剂的分散性越好越有利于吸附质在吸附剂表面的扩散,从而提高反应速率.
4 结论(Conclusions)1)利用桉树叶提取液作为生物还原剂绿色合成出纳米氧化铁和表面活性剂改性的纳米氧化铁,并用作吸附剂,对磷的吸附性能较好.
2)表面活性剂改性后氧化铁对磷的去除能力不同. 其中,IONP通过配体交换吸附溶液中的磷酸根,去除率达到81.94%,改性后CTAB-IONP由于增加了静电吸附对磷的去除率比IONP增加了10.53%,而被阴离子表面活性剂包覆的SDS-IONP在静电斥力的作用下去除率略有下降.
3)通过SEM、EDS、UV-vis、FTIR等表征技术,对比3种氧化铁的形貌尺寸,发现SDS-IONP的平均粒径最小,CTAB-IONP次之,而未改性的IONP的平均粒径最大,这说明离子型表面活性剂有效地提高了氧化铁的分散性,降低了氧化铁的团聚.
4)Zeta电位结果证明IONP表面带负电,CTAB-IONP表面带正电,而SDS-IONP呈电中性,证实了不同的离子型表面活性剂改性氧化铁的表面电荷不同. 此外,3种材料均能在较宽的pH范围(1~11)内的水体中实现磷的有效去除,其中,CTAB-IONP的去除效果最好.
5)动力学研究发现3种材料去除磷的反应都符合伪二级动力学模型,相关系数r>0.99,伪二级反应速率常数随着纳米氧化铁分散性的提高而增大.
| [1] | Ande rson M A, Rubin A J. 1989. 水溶液吸附化学[M]. 刘莲生等译. 北京: 科学出版社. 3-15 |
| [2] | Chowdhury S R, Yanful E K. 2010. Arsenic and chromium removal by mixed magnetite-maghemite nanoparticles and the effect of phosphate on removal[J]. Journal of Environmental Management, 91(11): 2238-2247 |
| [3] | Gao S Y, Shi Y G, Zhang S X, et al. 2008. Biopolymer-assisted green synthesis of iron oxide nanoparticles and their magnetic properties[J]. Journal of Physical Chemistry C, 112(28): 10398-10401 |
| [4] | Iravani S. 2011. Green synthesis of metal nanoparticles using plants[J]. Green Chemistry, 13(10): 2638-2650 |
| [5] | 金晓英, 黄兰兰, 陈祖亮. 2014. CTAB作用下绿色合成纳米铁的制备及降解孔雀绿[J]. 环境科学学报, 34(3): 645-650 |
| [6] | Jin Y J, Liu F, Tong M P, et al. 2012. Removal of arsenate by cetyltrimethylammonium bromide modified magnetic nanoparticles[J]. Journal of Hazardous Materials, 227-228: 461-468 |
| [7] | Kavas H, Durum Z, Senel M, et al. 2010. CTAB-Mn3O4 nanocomposites: Synthesis, NMR and low temperature EPR studies[J]. Polyhedron, 29(5): 1375-1380 |
| [8] | Kharissova O V, Dias H V R, Kharisov B I, et al.2013. The greener synthesis of nanoparticles[J]. Trends Biotechnol, 31(4): 240-248 |
| [9] | 李国亮, 张高生, 陈静, 等. 2012. 纳米结构 Fe3O4/Y2O3磁性颗粒的制备、表征及磷吸附行为研究[J]. 环境科学学报, 32(9): 2167-2175 |
| [10] | 李敏, 朱润良, 葛飞, 等. 2013. 磷酸根和镉离子在羟基铁改性膨润土表面的协同吸附机制研究[J]. 环境科学学报, 33(12): 3205-3210 |
| [11] | Liu H L, Sun X F, Yin C Q, et al. 2008. Removal of phosphate by mesoporous ZrO2[J]. Journal of Hazardous Materials, 151(2): 616-622 |
| [12] | Carneiro-da-Cunha M G, Cerqueira M A, Souza B W S, et al. 2011. Influence of concentration, ionic strength and pH on zeta potential and mean hydrodynamic diameter of edible polysaccharide solutions envisaged for multinanolayered films production[J]. Carbohydrate Polymers, 85(3): 522-528 |
| [13] | Njagi E C, Huang H, Stafford L, et al. 2011. Biosynthesis of iron and silver nanoparticles at room temperature using aqueous sorghum bran extracts[J]. Langmuir, 27(1): 264-271 |
| [14] | Pandey G, Shrivastav S, Sharma H K. 2014. Role of solution pH and SDS on shape evolution of PbS hexagonal disk and star/flower shaped nanocrystals in aqueous media[J]. Physica E: Low-dmensional Systems and Nanostructures, 56: 386-392 |
| [15] | Su Y, Cui H, Li Q, et al. 2013. Strong adsorption of phosphate by amorphous zirconium oxide nanoparticles[J]. Water Research, 47(14): 5018-5026 |
| [16] | Tang S C N, Lo I M C. 2013. Magnetic nanoparticles: Essential factors for sustainable environmental applications[J]. Water Research, 47(8): 2613-2632 |
| [17] | Venkateswarlu S, Rao Y S, Balaji T, et al. 2013. Biogenic synthesis of Fe3O4 magnetic nanoparticles using plantain peel extract[J]. Materials Letters, 100: 241-244 |
| [18] | 汪婷, 高滢, 陈祖亮, 等. 2013. 纳米四氧化三铁同步去除水中的Pb(II)和Cr(III)离子[J]. 环境工程学报, 7(9): 3476-3482 |
| [19] | Wang T, Jin X Y, Chen Z L, et al. 2014. Green synthesis of Fe nanoparticles using eucalyptus leaf extracts for treatment of eutrophic wastewater[J]. Science of The Total Environment, 466-467: 210-213 |
| [20] | 向衡, 韩芸, 刘琳, 等. 2013. 低浓度含磷水体除磷填料的选择研究[J]. 环境科学学报, 33(12): 3227-3233 |
| [21] | 肖进新, 赵振国. 2003. 表面活性剂应用原理[M]. 北京: 化学工业出版社. 97-100 |
| [22] | 杨迈之, 李会铭, 蔡生民, 等. 1994. 氧化铁超微粒的光电化学特性[J]. 物理化学学报, 10(4): 376-380 |
| [23] | Yoon S Y, Lee C G, Park J A, et al. 2014. Kinetic, equilibrium and thermodynamic studies for phosphate adsorption to magnetic iron oxide nanoparticles[J]. Chemical Engineering Journal, 236: 341-347 |
 2015, Vol. 35
2015, Vol. 35


