2. 工业生态与环境工程教育部重点实验室, 大连理工大学盘锦校区食品与环境学院, 盘锦 124000
2. Key Laboratory of Industrial Ecology and Environmental Engineering(Ministry of Education), School of Food and Environmental Science and Technology, Dalian University of Technology, Panjin 124000
近年来,伴随着含硒化合物在印染业、玻璃制造业、电子产业等各行业中被广泛使用,产生了大量含有亚硒酸盐、硒酸盐的工业废水,这些废水未经处理释放到环境中对动植物具有较大的毒害作用,其中,亚硒酸盐的毒性更强(李子超等,2011).自然界中存在多种微生物具有将氧化态的硒(Se(VI)及Se(Ⅳ))还原为硒纳米颗粒(SeNPs)的能力,生成的红色SeNPs易于回收,且毒性较小,可有效地用于含氧化态硒废水的处理,具有较好的环境友好性.
从应用的角度而言,SeNPs本身具有独特的光电特性、半导体特性及X射线传感性质,在太阳能电池材料、传感器及静电复印等领域应用广泛(Panahi-Kalamuei et al., 2014;Wang et al., 2010).传统的化学方法合成的SeNPs多为无定形结构,Se原子的堆积方式松散,这直接影响了SeNPs的应用价值.研究表明,多种微生物可以还原氧化态硒并合成性质稳定、尺度均一的硒纳米晶,如嗜碱性假单胞菌(Pseudomonas alcaliphila)(Zhang et al., 2011)、希瓦氏菌(Shewanella putrefaciens 200、Shewanella sp.HN-41)(Jiang et al., 2012;Lee et al., 2007)和芽孢杆菌(Bacillus cereus)(Dhanjal et al., 2010)等.因此,利用环境友好的生物法获得具有特定形貌和晶型的SeNPs具有重要的研究意义和潜在的应用价值.
本实验室前期从重金属污染土壤中分离得到一株具有杂环芳烃降解能力的贪铜杆菌(Cupriavidus metallidurans)SHE,并通过研究发现,其可以还原多种重金属和非金属化合物生成纳米颗粒.在此基础上,本文进一步研究了菌株SHE还原Se(Ⅳ)生成SeNPs的能力,考察温度、Se(Ⅳ)浓度、pH对Se(Ⅳ)还原的影响,并对合成的纳米颗粒进行表征.
2 材料和方法(Materials and methods) 2.1 菌株贪铜杆菌SHE分离自大连理工大学牛角山泥土样品,现已鉴定并保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC NO.9266.
2.2 培养基LB培养基:蛋白胨10.0 g · L-1,酵母粉5.0 g · L-1,NaCl 10.0 g · L-1;对应固体培养基加入2%琼脂.
2.3 试剂本实验中采用的主要试剂二氧化硒由天津市化学试剂研究所生产,草酸(H2C2O4)由天津市博迪化工有限公司生产,十二烷基磺酸钠(SDS)由美国Sigma-Aldrich公司生产,2,3-二氨基萘(DAN)由百灵威科技有限公司生产;乙二胺四乙酸(EDTA)由生工生物工程(上海)有限公司生产.试剂纯度均为分析纯.
2.4 Se(Ⅳ)的测定方法Se(Ⅳ)含量采用紫外可见分光光度法,于379.3 nm处进行测定(Huang et al., 1996).配制0.1 mol · L-1 HCl溶液、0.05 mol · L-1 SDS溶液、0.1%DAN溶液(以0.1 mol · L-1HCl为溶剂,且现配现用)、0.1 mol · L-1 EDTA与0.05 mol · L-1 H2C2O4混合液.取2.0 mL反应后的样品,在12000 r · min-1下离心10 min,取上清液100 μL,加300 μL去离子水稀释备用.在10 mL比色管中加入1.0 mL EDTA与H2C2O4混合液、0.6 mL HCl溶液、0.4 mL DAN溶液及100 μL上述处理后的样品溶液.摇匀后沸水浴5 min,冷却至室温后,加入2.5 mL SDS溶液,用去离子水稀释至10 mL,以紫外分光光度计测量其在379.3 nm处的吸光度.以蒸馏水替代反应体系作为空白对照.
2.5 菌株SHE合成SeNPs配置含有1.0 mmol · L-1 Se(Ⅳ)的LB固体培养基,将生长至对数期中期的菌株SHE稀释不同倍数后分别涂布于平板上,孵化48 h.
2.6 不同pH、温度及底物浓度对Se(Ⅳ)还原率的影响向100 mL LB培养基中加入5 mmol · L-1 Se(Ⅳ),接种量为5%,分别在pH值为6、7、8、9的条件下,摇床培养48 h,测定Se(Ⅳ)的还原率.在最适pH条件下,选取温度为25、30、35、40 ℃,摇床培养48 h,测定Se(Ⅳ)的还原率.在最适pH及温度条件下,调节Se(Ⅳ)浓度分别为0.5、1.0、2.0、5.0、10.0 mmol · L-1,摇床培养48 h,测定Se(Ⅳ)的还原率.在最优条件下,间隔特定的时间段取样测定溶液中Se(Ⅳ)的含量变化,并绘制Se(Ⅳ)的还原曲线.
2.7 硒纳米颗粒的分离对还原产物的部分表征需将生成的硒纳米颗粒与微生物体分离,采用高温灭菌法使微生物释放体内的硒纳米颗粒(Fesharaki et al., 2010).将反应48 h后的培养液灭菌,冷却至室温后,3000 r · min-1下离心5 min,收集红色产物,并用超纯水洗涤2~3次.随后将得到的产物于80 ℃下干燥24 h备用.
2.8 紫外全波光谱扫描及粒径分析在Se(Ⅳ)还原反应的最优条件下,利用菌株SHE还原Se(Ⅳ),反应48 h后将微生物体与还原产物分离,将得到的还原产物用紫外分光光度计(UV-9000,中国上海)在波长200~800 nm范围内进行全波长扫描,检测还原产物特征吸收峰.并通过纳米粒度仪(ZS90,英国)考察合成纳米颗粒的粒径大小.
2.9 透射电子显微镜将摇匀的菌体/纳米颗粒悬浮液或已分离的纳米颗粒分散液滴于铜网上,用红外灯干燥后在透射电子显微镜(FEI Tecnai T12,美国)下观察纳米颗粒的形貌及相对微生物细胞的位置.
2.10 傅里叶红外光谱取适量干燥好的KBr于玛瑙研钵中充分研磨,将研磨好的粉末压片,在室温下采用傅里叶红外光谱仪(Shimadzu IRPrestige-21,日本)测量其吸收光谱,作为空白.分别取少量烘干后的菌体及反应后菌体与SeNPs混合物,再与KBr混合,于玛瑙研钵中充分混合研磨,将研磨好的粉末压片,在室温下测量其吸收光谱.实验条件:扫描范围400~4000 cm-1,每2 nm采集一次数据,扫描速度为5 kHz.
2.11 X射线衍射分析利用X射线衍射仪(X′Pert PRO,荷兰)分析红色还原产物的晶型,操作条件为:Cu Kα辐射源,2θ扫描区间5°~90°.
3 结果与分析(Results and analysis) 3.1 菌株SHE还原Se(Ⅳ)性能菌株SHE在含有1.0 mmol · L-1 Se(Ⅳ)的LB固体培养基上孵育48 h后,菌落颜色由黄色变为红色(图 1).蒋华东等(2010)报道了假单胞菌MBR还原亚硒酸钠的研究,证明了红色的产物为单质硒.因此,推测菌株SHE同样具有还原亚硒酸盐的能力.
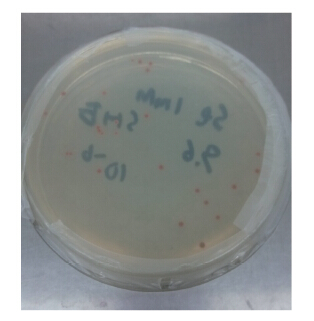 |
| 图 1 菌株SHE还原Se(Ⅳ)平板照片 Fig. 1 Digital photo of red products from the reduction Se(Ⅳ)by strain SHE |
pH可通过影响酶的活性进而影响菌株对Se(Ⅳ)的还原能力.为了得到菌株SHE还原Se(Ⅳ)的最适pH,对不同pH条件下Se(Ⅳ)的还原率进行了研究.在pH为6~9的范围内均可以观察到红色还原产物的形成,实验结果如图 2所示.由图可知,菌株SHE在所考察的pH范围内,对Se(Ⅳ)的还原率先增加后降低.在pH为8时,对5.0 mmol · L-1Se(Ⅳ)的还原率最高,为33.0%.
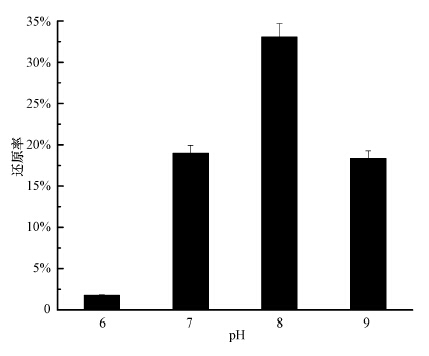 |
| 图 2 pH对菌株SHE还原Se(Ⅳ)的影响 Fig. 2 Effect of pH on Se(Ⅳ)reduction |
温度的变化会影响微生物的生长情况和酶活性,进而影响微生物对Se(Ⅳ)的还原情况.实验考察了不同温度对Se(Ⅳ)还原率的影响,结果如图 3所示.由图可知,菌株SHE在25~35 ℃范围内均可以对Se(Ⅳ)进行不同程度的还原.其中,30 ℃条件下还原率最高,为19.0%,此温度也是微生物生长的最适温度.当温度低于或高于30 ℃时,Se(Ⅳ)还原率有所下降,当温度达到40 ℃时,菌株不能够还原Se(Ⅳ),这主要是由于在40 ℃时,菌株SHE生长缓慢.
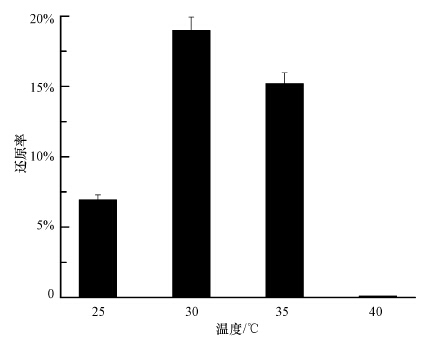 |
| 图 3 温度对菌株SHE还原Se(Ⅳ)的影响 Fig. 3 Effect of temperature on Se(Ⅳ)reduction |
因为Se(Ⅳ)对微生物具有一定的毒性作用,因此,本实验考察了不同底物浓度下菌株SHE对Se(Ⅳ)的还原情况,结果如图 4所示.由图可知,当Se(Ⅳ)浓度在5.0 mmol · L-1以下时,菌株SHE对Se(Ⅳ)具有一定的还原能力,其中,Se(Ⅳ)浓度为0.5、1.0 mmol · L-1时,菌株SHE可完全还原Se(Ⅳ);2.0、5.0 mmol · L-1条件下还原率分别为37.3%、19.5%.对几种不同Se(Ⅳ)浓度下的还原量进行计算,发现Se(Ⅳ)浓度为1.0 mmol · L-1时还原量最大,100 mL反应体系的还原量为7.8 mg,因此,后续实验采用1.0 mmol · L-1的底物浓度.Li等(2014)报道了菌株Rhodopseudomonas palustris N1在厌氧条件下对不同浓度Se(Ⅳ)的还原率,在200 h后,菌株Rhodopseudomonas palustris N1对1.0、2.0、4.0和8.0 mmol · L-1的SeO32-还原率分别为100%、82.0%、31.7%和2.4%.与之相比,菌株SHE对1.0 mmol · L-1Se(Ⅳ)的还原速率更快,但对于高浓度Se(Ⅳ)的还原率相对较低.
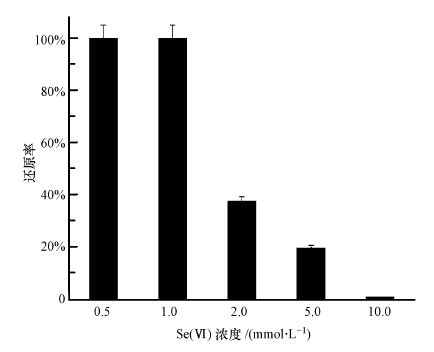 |
| 图 4 Se(Ⅳ)浓度对菌株SHE还原Se(Ⅳ)的影响 Fig. 4 Effect of the initial Se(Ⅳ)concentration on reduction |
为了确认菌株SHE还原Se(Ⅳ)的具体过程,在Se(Ⅳ)还原的最优条件下,测定了菌株SHE生长曲线及培养基中Se(Ⅳ)含量随时间的变化曲线,结果如图 5所示.由图可知,菌株SHE在开始的12 h内生长处于延滞期,此时的Se(Ⅳ)被少量还原,表明Se(Ⅳ)对菌株SHE具有一定的毒性作用.随后菌株SHE在12~24 h内快速生长,进入对数期,Se(Ⅳ)的还原率进一步从9.4%上升到34.4%,表明在对数期内,菌株SHE大量生长,摄入更多的Se(Ⅳ)进行后续的还原过程.而在24~48 h内,菌株SHE生长达到稳定期,此阶段末期的Se(Ⅳ)还原率即可达96.7%,表明稳定期菌株SHE表达了大量与Se(Ⅳ)还原相关的酶,可以快速地还原溶液中的Se(Ⅳ).最终菌株SHE的生物量发生减少,Se(Ⅳ)的还原率发生少量的反弹,这可能是菌体死亡时,释放出了少量未被继续转化的Se(Ⅳ)所致.
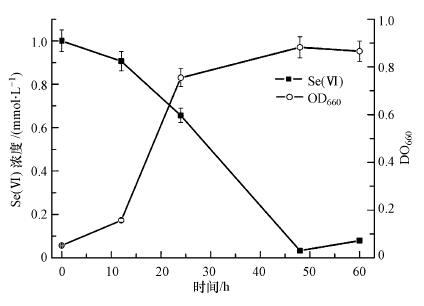 |
| 图 5 Se(Ⅳ)还原曲线与菌株SHE还原亚硒酸盐的生长曲线 Fig. 5 Se(Ⅳ)reduction curve and growth profiles of strain SHE |
对还原产物进行紫外全波光谱扫描,实验结果如图 6所示.由图可知,在606 nm和310 nm左右下出现特征吸收峰.SeNPs的最大吸收波长与颗粒本身的形貌和粒径有关,其范围可从20 nm至500 nm.本实验中的606 nm吸收峰属于硒纳米球的特征吸收峰(Lin et al., 2005).利用纳米粒度仪进一步对合成的SeNPs粒子直径进行分析,测定结果为(130.2±27.0)nm.Dhanjal等(2010)利用Bacillus cereus合成了球型的硒纳米颗粒,其对应的紫外吸收最大波长为590 nm,粒径大小为(182.8±33.2)nm,与本实验合成的SeNPs粒径大小类似.此外,SeNPs的形貌和晶型同样对于吸收波长具有显著的影响.An等(2003)利用水热法合成的尺寸在50~120 nm的硒纳米线紫外最大吸收波长为306 nm,据此推测,利用菌株SHE合成的还原产物在310 nm处的吸收峰可能归属于硒纳米线的吸收峰.
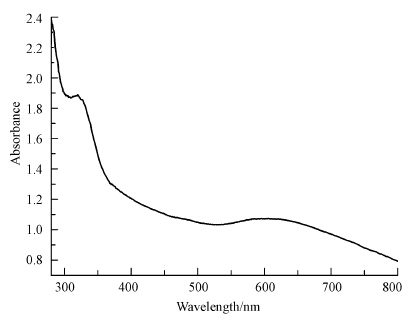 |
| 图 6 还原产物SeNPs紫外全波光谱图 Fig. 6 UV/Vis absorption spectum of SeNPs |
为了观察菌株SHE合成的SeNPs形貌特征,对反应后产物进行透射电镜表征,结果如图 7所示.由图 7a可知,菌株SHE与还原产物SeNPs共存条件下,可观察到大量的SeNPs颗粒分布在细胞表面及其胞外分泌物中,且球形颗粒大小比较均一.高温灭菌分离SeNPs后,如图 7b所示,除球型颗粒外,SeNPs出现了由小的球状颗粒组装而成的线状结构,分析原因为高温灭菌过程中温度的变化导致该现象的出现(Wang et al., 2011).硒纳米线形貌的出现也进一步证实了之前紫外光谱中310 nm处最大吸收峰的归属.
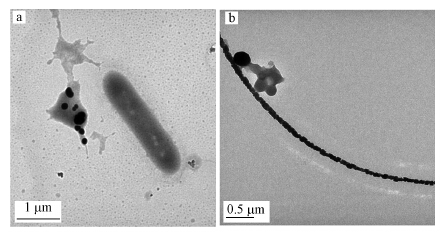 |
| 图 7 菌株SHE与还原产物SeNPs(a)及单独还原产物SeNPs(b)的透射电镜图 Fig. 7 TEM images of SeNPs with(a) and without SHE(b) |
同时,为了进一步确认还原产物为SeNPs,对还原产物进行EDX表征,结果如图 8所示.由图可知,在11.2 keV处出现硒的特征吸收峰,表明还原产物的主要成分为硒元素(Shakibaie et al., 2010).谱图中出现Cu的信号,来自于铜网,C、P、O元素可能来源于菌体的胞外分泌物(Zhang et al., 2011,Dhanjal et al., 2010).
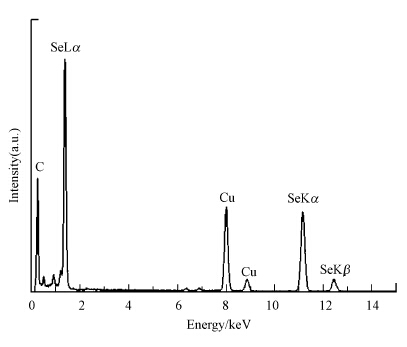 |
| 图 8 还原产物SeNPs的EDX谱图 Fig. 8 EDX spectrum of SeNPs |
为了探索SeNPs形成的可能机制,利用红外光谱分析研究了菌株SHE自身及菌株SHE/SeNPs共存条件下的红外光谱,结果如图 9所示.由图可知,菌株SHE与Se(Ⅳ)共同孵育48 h后,菌体表面1650 cm-1处C O伸缩振动峰有32 cm-1左右的蓝移,并且1400 cm-1处N—H伸缩振动吸收峰消失,这两个峰本身归属于菌体自身的蛋白质分子,由此表明,SeNPs的形成可能由细胞膜或者胞内的蛋白质介导产生(Zhang et al., 2011).
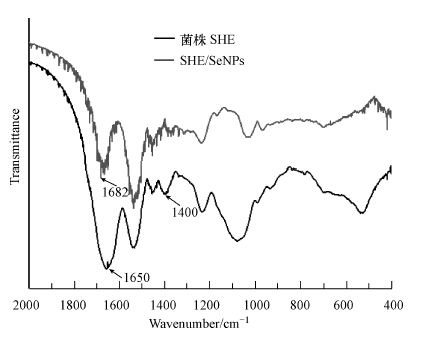 |
| 图 9 菌株SHE及菌株SHE与还原产物SeNPs混合物的红外光谱图 Fig. 9 FTIR of bacterial cells with and without SeNPs |
通过XRD分析还原产物SeNPs的晶型,结果如图 10所示.从衍射图谱中可以看出,菌株SHE合成的SeNPs具有尖锐的吸收峰,其与JCDPS数据库中编号为86-2244的标准品谱图吻合,属于六方晶型,即纤维锌矿结构.而目前利用生物法合成的SeNPs多为无定形颗粒或者面心立方晶型,六方晶型尚不多见(Srivastava et al., 2013).根据文献报道(Zhang et al., 2005),螺旋状硒链通过弱的范德华相互作用力形成六方晶格,硒链之间的晶格参数大小约为0.438 nm,大于氢分子的直径0.289 nm,因此,其可以作为一种潜在的贮氢材料.
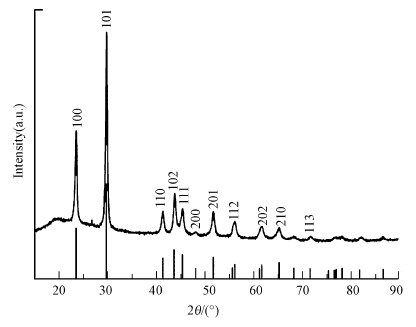 |
| 图 10 还原产物SeNPs的XRD谱图 Fig. 10 XRD spectrum of SeNPs |
本研究证实了一株贪铜杆菌SHE能够将Se(Ⅳ)还原为红色SeNPs颗粒.对贪铜杆菌SHE还原Se(Ⅳ)的培养条件进行优化,得到该菌株还原Se(Ⅳ)的最优条件为:pH=8,温度30 ℃,Se(Ⅳ)浓度1.0 mmol · L-1.通过紫外全波光谱扫描、透射电镜观察、粒径分析及X射线衍射等手段,证明贪铜杆菌SHE可合成具有六方晶型的硒纳米球或硒纳米线,在催化领域具有潜在的应用价值.
| [1] | An C H, Tang K B, Liu X M, et al. 2003. Large-scale synthesis of high quality trigonal selenium nanowires[J]. European Journal of Inorganic Chemistry, 2003(17):3250-3255 |
| [2] | Dhanjal S, Cameotra S S. 2010. Aerobic biogenesis of selenium nanospheres by Bacillus cereus isolated from coalmine soil[J]. Microbial Cell Factories, 9:52 |
| [3] | Fesharaki P J, Nazari P, Shakibaie M, et al. 2010. Biosynthesis of selenium nanoparticles using Klebsiella pneumoniae and their recovery by a simple sterilization process[J]. Brazilian Journal of Microbiology, 41(2):461-466 |
| [4] | Huang X R, Jie N Q, Zhang W J, et al. 1996. Study on the spectrophotometric determination of micro amounts of selenium (IV) with 2, 3-diaminonaphthalene in the presence of sodium dodecylsulphate[J]. Fresenius' Journal of Analytical Chemistry, 354(2):195-199 |
| [5] | 蒋华东, 何晓红, 张礼霞, 等. 2010. 一株假单胞菌 (Pseudomonas alcaliphila MBR) 好氧还原亚硒酸钠为红色单质硒[J]. 微生物学报, 50(10):1347-1352 |
| [6] | Jiang S H, Ho C T, Lee J-H, et al. 2012. Mercury capture into biogenic amorphous selenium nanospheres produced by mercury resistant Shewanella putrefaciens 200[J]. Chemosphere, 87(6):621-624 |
| [7] | Lee J H, Han J, Choi H, et al. 2007. Effects of temperature and dissolved oxygen on Se (IV) removal and Se (0) precipitation by Shewanell sp. HN-41[J]. Chemosphere, 68(10):1898-1905 |
| [8] | Li B Z, Liu N, Li Y Q, et al. 2014. Reduction of selenite to red elemental selenium by Rhodopseudomonas palustris strain N[J]. PLoS ONE, 9(4):e95955 |
| [9] | 李子超, 肖娜, 李昀锴, 等. 2011. 沼泽红假单胞菌对亚硒酸盐还原脱毒的研究[J]. 微生物学通报, 38(5):660-667 |
| [10] | Lin Z H, Chris Wang C R C. 2005. Evidence on the size-dependent absorption spectral evolution of selenium nanoparticles[J]. Materials Chemistry and Physics, 92(2/3):591-594 |
| [11] | Panahi-Kalamuei M, Salavati-Niasari M, Hosseinpour-Mashkani S M. 2014. Facile microwave synthesis, characterization, and solar cell application of selenium nanoparticles[J]. Journal of Alloys and Compounds, 617:627-632 |
| [12] | Shakibaie M, Khorramizadeh M R, Faramarzi M A, et al. 2010. Biosynthesis and recovery of selenium nanoparticles and the effects on matrix metalloproteinase-2 expression[J]. Biotechnology and Applied Biochemistry, 56(1):7-15 |
| [13] | Srivastava N, Mukhopadhyay M. 2013. Biosynthesis and structural characterization of selenium nanoparticles mediated by Zooglea ramigera[J]. Powder Technology, 244:26-29 |
| [14] | Wang T T, Yang L B, Zhang B C, et al. 2010. Extracellular biosynthesis and transformation of selenium nanoparticles and application in H2O2 biosensor[J]. Colloids and Surfaces B:Biointerfaces, 80(1):94-102 |
| [15] | Wang X F, Zhang W Q, Shen Y H, et al. 2011. Facile, one-step controlled synthesis of Se nanocrystals in the presence of L-tyrosine[J]. Materials Science and Engineering:B, 176(14):1093-1098 |
| [16] | Zhang B, Dai W, Ye X C, et al. 2005. Solution-phase synthesis and electrochemical hydrogen storage of ultra-long single-crystal selenium submicrotubes[J]. The Journal of Physical Chemistry B, 109(48):22830-22835 |
| [17] | Zhang W J, Chen Z J, Liu H, et al. 2011. Biosynthesis and structural characteristics of selenium nanoparticles by Pseudomonas alcaliphila[J]. Colloids and Surfaces B:Biointerfaces, 88(1):196-201 |
 2015, Vol. 35
2015, Vol. 35


