2. 北京师范大学环境学院水环境模拟国家重点实验室, 北京 100875
2. State Key Laboratory of Water Environment Simulation, School of Environment, Beijing Normal University, Beijing 100875
作为高级氧化技术的一种,芬顿氧化法常用于水中难降解有机污染物的处理过程,反应产生的具有强氧化性的· OH能将水体中难降解有机污染物降解去除并矿化为对环境无污染的CO2和H2O,是一种环境友好的绿色催化工艺(Karthikeyan et al., 2012).均相芬顿反应虽然催化效率较高,但体系中铁离子浓度高,在处理过程中会产生大量铁泥,增加后续处理成本,同时催化剂难以分离与回收、铁离子流失造成二次污染(Karthikeyan et al., 2012;Ay and Kargi, 2010).而非均相芬顿反应由于可以克服这些缺点而逐渐引起研究者的广泛关注.非均相芬顿反应体系中催化剂多以载体负载活性金属成分制备而成(Dükkanc et al., 2010;Wang et al., 2015;Navalon et al., 2010).目前,非均相芬顿反应体系研究的关键集中在催化剂的开发和反应体系的条件优化两个方面.
MCM-41分子筛是常见的一种重要介孔载体,但这种纯硅介孔分子筛存在诸如骨架中晶格缺陷少、缺乏酸性中心、水热稳定性较差等明显缺陷(赵彬和王向宇,2013).因此需要对MCM-41进行结构改性以提高其性能.含金属成分掺杂改性的MCM-41系列催化材料由于引入金属离子,使骨架中羟基活化,产生较强的酸性位,在氧化反应过程中表现出较好的催化性能(赵彬和王向宇,2013; Xia et al., 2011;Pradhan and Parida, 2012).此外,还可以通过调整模板剂、有机官能团改性或采用扩孔剂、杂多酸等非金属成分对MCM-41进行结构改性和载体优化,再负载活性金属(赵彬和王向宇,2013;Singha et al., 2011;Jatupisarnpong and Trakarnpruk, 2012).但是改性后的MCM-41并没有完全克服本身存在的缺陷,酸位脱落和水热稳定性问题仍不够理想(赵彬和王向宇,2013).由于石墨烯具有独特的二维平面结构及较大的比表面积、高化学稳定性、较好的吸附能力以及较强的电子输送性能,将石墨烯掺杂于催化材料中,可以充分利用石墨烯显著特质提高催化反应的效率(何光裕等,2012).本课题组通过水热晶化法制备了石墨烯掺杂介孔分子筛MCM-41复合载体,利用该载体浸渍负载氧化铁制备了非均相芬顿催化剂gh-MCM-41-Fe.
考察反应条件对催化效果的影响,对于催化剂开发的相关研究、优化反应体系的工艺条件、加速该催化体系的工业化应用显得尤为重要.钟贵江等以载铁活性炭作为非均相芬顿催化剂,考察了催化剂投加量、pH条件及反应时间对苯酚废水降解的影响,发现催化剂投加量是主要因素,pH次之(钟贵江等,2012).陈娴等发现反应温度对非均相芬顿降解反应体系的影响很大(陈娴等,2013).田志茗等制备的Fe/SBA-15用于降解亚甲基蓝废水,侧重优化了反应体系中H2O2用量和初始pH两个重要的影响因素(田志茗等,2014).Liu等采用负载铁锰氧化物的活性炭与H2O2联合降解三氯酚,研究了H2O2用量、pH、反应温度和CO32-对反应的影响,发现H2O2用量的影响最大(Liu et al., 2011).谭万春等在进行单因素实验确定反应体系的最优实验条件时,发现H2O2用量为1/2理论投加量时,可以大幅度降低在实际应用中的成本(谭万春等,2014).邓景衡等在进行Fe3O4/MWCNTs催化降解染料废水的条件优化实验中,发现,在最佳pH=3.5时,H2O2用量、反应温度以及共存的阴离子均对反应体系产生不同程度的影响(邓景衡等,2014).Bautista等采用浸渍法得到的Fe/r-Al2O3用于湿式催化降解苯酚废水,优化了反应操作条件以提高催化剂的催化降解效果,其中反应温度和pH是主要的影响因素(Bautista et al., 2011).张瑛洁等制备的负载高价铁树脂催化H2O2降解橙黄Ⅳ的反应速率常数与H2O2用量和污染物初始浓度均具有很好的正相关性(张瑛洁等,2010).
本文以苯酚为模拟废水,以石墨烯掺杂介孔分子筛MCM-41为载体,通过浸渍法负载氧化铁制备了非均相芬顿催化剂gh-MCM-41-Fe,研究了催化剂和H2O2投加量、水质因素(苯酚初始浓度、反应温度和水中腐殖酸和草酸)等对gh-MCM-41-Fe芬顿催化降解苯酚效能的影响,以期为该新型催化剂的相关研究和应用提供理论参考.
2 材料与方法(Materials and methods) 2.1 实验仪器与试剂UV-2500型紫外可见分光光度计、戴安U3000型高效液相色谱仪(HPLC,DIONEX公司)、Inertsil ODS-3型色谱柱(日本GL Sciences公司)、Autosorb-iQ3全自动比表面和孔径分布分析仪(美国康塔仪器公司)、X640型扫描电子显微镜(日本Hitachi公司)、H600型透射显微镜(日本Hitachi公司)、Avanti J-25离心机、真空管式高温烧结炉(GSL-1500X)、DRB200型COD消解仪(美国HACH公司)、FE20K型pH计、84-1A四联磁力搅拌器.
实验所用试剂均为分析纯,实验用水为去离子水.
2.2 催化材料制备 2.2.1 氧化石墨烯溶液的制备采用改进的Hummers法(Hummers et al., 1958),称取4 g可膨胀石墨和2 g硝酸钠混合,量取80 mL 浓 H2SO4加入到上述混合物中,冰浴,搅拌,缓慢加进12 g高锰酸钾,搅拌15 min,撤除冰浴,升温至35 ℃,反应4 h;继续升温至97 ℃,缓慢加进150 mL去离子水,15 min后再加进200 mL去离子水,慢速加进30%双氧水直至混合液颜色变为金黄色;配制5% HCl溶液清洗上述混合液两次,再用去离子水清洗3次;将上述混合液进行高速离心,得到暗黄色粘稠物;加入450 mL去离子水,超声30 min,经过离心后,取上层溶液,即为所述氧化石墨烯溶液,浓度为7.75 mg·mL-1.
2.2.2 石墨烯-MCM-41复合载体的制备按重量计份,将8份硅酸钠加热40 ℃溶解于25份去离子中,用3 mol·L-1硫酸调节pH为9~10,搅拌0.5 h,使溶液形成粘稠凝胶状;先后加入6份模板剂CTAB(溴代十六烷基三甲胺)和30份氧化石墨烯溶液,搅拌5 h至形成棕黑色胶状混合物;将其放入反应釜中加热130 ℃晶化24 h,室温冷却,过滤,洗涤,干燥,得到黑色粉状固体,并经过氮气保护550 ℃煅烧6 h,得到石墨烯-MCM-41复合载体,记为gh-MCM-41,其中gh表示石墨烯.
2.2.3 复合催化剂gh-MCM-41-Fe的制备按重量计份,称取0.3670份九水合硝酸铁溶解于20 mL乙醇水溶液(体积比1 ∶ 1)中;称取1份复合载体gh-MCM-41浸置于上述三价铁盐溶液中,振荡,超声,过滤,干燥,之后经过氮气保护550 ℃煅烧6 h,得到本文所述的复合催化剂gh-MCM-41-Fe.
2.3 实验方法量取200 mL模拟苯酚废水于500 mL烧杯中,用0.1 mol·L-1 H2SO4和NaOH调节pH=3.5,称取一定量的催化剂加入上述烧杯中,磁力搅拌一定时间,投加一定浓度H2O2,开始计时,不同时间点取样,滴加一滴1 mol·L-1 NaOH终止反应,并用0.22 μm滤膜过滤,取滤液进行分析测定.
苯酚废水降解实验的基准条件为:pH=3.5,100 mg·L-1苯酚初始浓度,9.80 mmol·L-1 H2O2用量,0.5 g·L-1催化剂投加量,25 ℃反应温度.进行单因素条件优化时,只改变其中一个因素,其它因素同基准条件.
利用高效液相色谱仪测定苯酚浓度,处理效果采用苯酚降解率表示. 苯酚降解率的计算公式: D=(C0-Ct)/ C0×100%. 式中,D为苯酚去除率,C0为苯酚初始浓度,Ct为反应一定时间点苯酚溶液浓度.
2.4 分析方法苯酚的测定采用高效液相色谱仪(HPLC),流动相为50%色谱级甲醇和50%超纯水(0.1%磷酸);柱流速为1 mL·min-1,柱温30 ℃;检测波长为270 nm.有机物浓度通过标准曲线测定,处理效果采用苯酚降解率表示.
铁溶出含量采用邻菲罗啉分光光度法测定(傅翠梨等,2012).
苯酚废水COD值采用快速消解分光光度法(HJ/T 399—2007)测定(国家环境保护总局,2008).COD测定前需在滤液中加入一定量25 g·L-1 Na2CO3溶液,于90 ℃水浴锅中反应90 min,以消除滤液中剩余的H2O2对COD测定的干扰(Wu and Englehardt, 2012).
3 结果与讨论(Results and discussion) 3.1 gh-MCM-41-Fe电镜图表征通过利用场发射扫描电镜和透射电镜可以分析材料的结构形貌特征.图 1为gh-MCM-41-Fe催化材料的扫描电镜图和透射电镜图.由电镜图可以看出,gh-MCM-41-Fe催化材料呈不规则球状颗粒均匀分布,颗粒粒径平均尺寸在20~50 nm,用于掺杂改性的石墨烯均匀分散并修饰于分子筛MCM-41的结构中,所负载的催化活性成分氧化铁均匀分布于石墨烯-MCM-41复合载体表面.
 |
| 图 1 gh-MCM-41-Fe的扫描电镜图(a)和透射电镜图(b) Fig.1 SEM (a) and TEM (b) images of gh-MCM-41-Fe |
利用gh-MCM-41-Fe芬顿催化降解苯酚效能见图 2.可以看出,未加H2O2,gh-MCM-41-Fe对苯酚具有一定的吸附能力,30 min即可达到吸附饱和,吸附容量为20.0 mg·g-1,90 min苯酚吸附去除率为10.1%.通过分析可知该催化剂比表面积(BET)为521.228 m2·g-1,孔径(BJH)为2.745 nm,为介孔催化材料,具有较大的比表面积,因此具有一定的吸附能力,进而利于催化剂表面催化反应的进行.加入H2O2后,反应前15 min,苯酚催化降解迅速,去除率达到了73.7%,随后由于苯酚浓度降低,反应速率变缓,当反应60 min,苯酚去除率高达97.6%,COD去除率为65.9%,而铁溶出只有0.825 mg·L-1,反应符合准一级降解动力学方程.由于H2O2氧化还原电位较低,基本不能单独氧化苯酚(图 2中单独投加H2O2苯酚浓度几乎没有变化),所以可知gh-MCM-41-Fe对苯酚具有明显的催化降解能力.与他人研究结果相比,其效果优于文献中相似反应条件下的催化材料Fe/AC、Fe/海泡石、Fe/凹凸棒、Fe/r-Al2O3、Fe/Y分子筛、Fe3O4/沸石等(陈娴等,2013;谭万春等,2014;Bautista et al., 2011;杨岳主等,2013;姜远光等,2011).
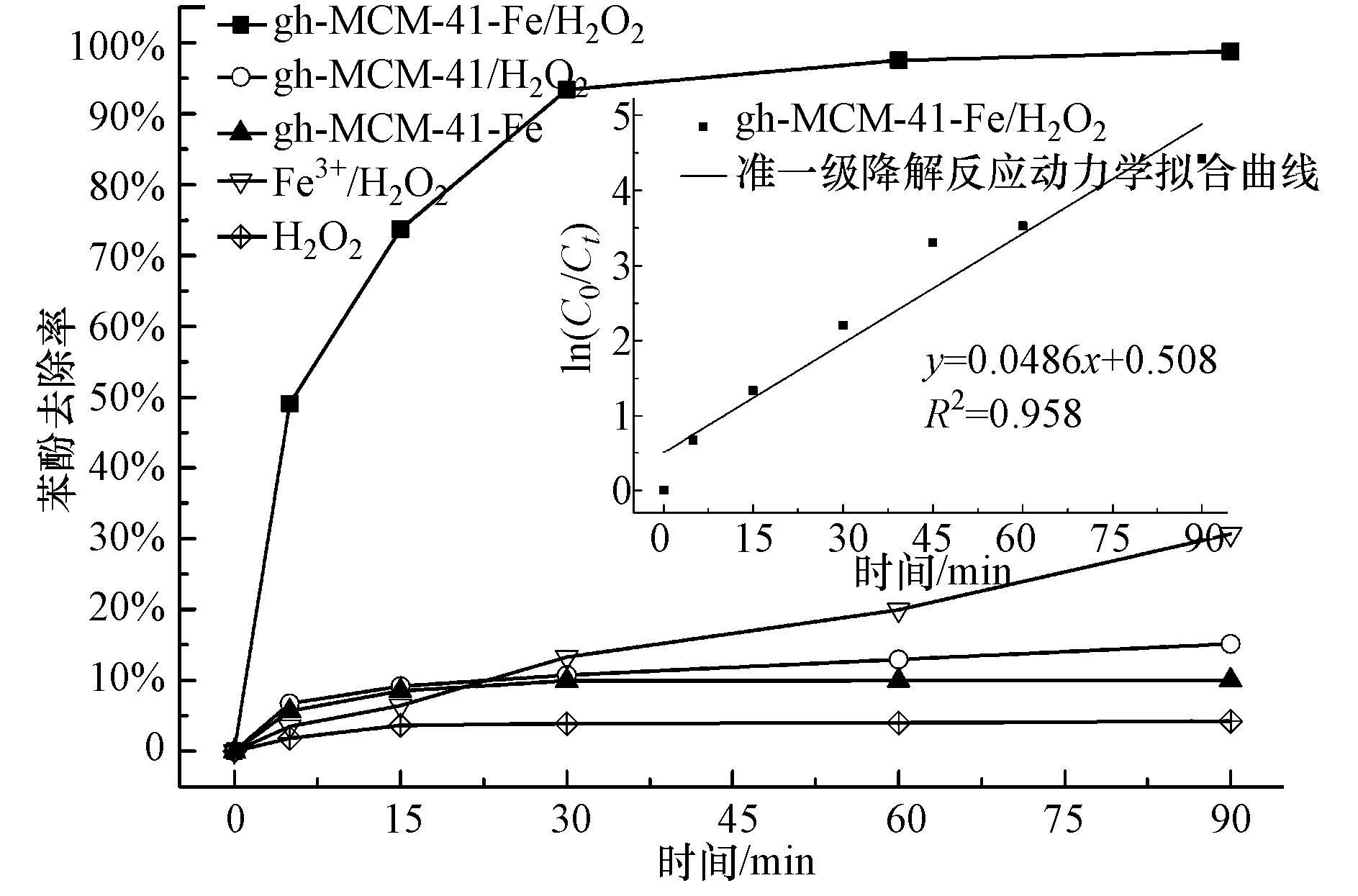 |
| 图 2 gh-MCM-41-Fe催化降解苯酚的效果及其准一级降解反应动力学方程拟合 (pH=3.5,100 mg·L-1苯酚浓度,9.80 mmol·L-1 H2O2,0.5 g·L-1催化剂,25 ℃) Fig.2 Catalytic degradation of phenol by gh-MCM-41-Fe and its pseudo first-order kinetic equation (pH=3.5, initial phenol concentration =100 mg·L-1, H2O2 amount=9.80 mmol·L-1, catalyst dosage=0.5 g·L-1,t=25 ℃) |
由于未负载氧化铁的载体gh-MCM-41在H2O2存在条件下,苯酚去除率仅有15.2%,所以氧化铁是该催化体系的主要活性组分.在该体系中,铁元素主要以固定态(氧化铁)和游离态(铁离子)两种形式存在.根据体系中铁离子溶出情况,考察了均相Fe3+离子/ H2O2降解苯酚效果,Fe3+离子与H2O2的反应见式3和4.当体系中Fe3+离子浓度为1 mg·L-1时,Fe3+/H2O2降解苯酚废水能力比较弱,90 min苯酚去除率只有30.6%.由此可见,利用gh-MCM-41-Fe芬顿催化降解苯酚,载体上负载的氧化铁催化作用明显高于游离出的铁离子,是催化主要活性组分.
3.3 催化剂和H2O2投加量的影响图 3a为不同催化剂投加量对苯酚降解效果的影响,可以看出,反应符合准一级降解动力学方程.催化剂投加量由0.25 g·L-1增加到0.5 g·L-1,苯酚降解效率明显增加,反应90 min,苯酚去除率由62.3%上升到98.9%,当催化剂用量进一步增加,苯酚去除率没有明显变化.当催化剂投加量增加,催化活性中心数量亦增加,产生的· OH和其它自由基数量增加,因此苯酚降解率增加.但是,当催化剂投加量过多,其可以作为· OH和·O2H自由基的捕获剂,分别反应生成OH-和O2H-(反应式(1)和(2)),进而对苯酚降解效果产生不利影响(Romero et al., 2009).同时,过多的催化剂投加量虽然没有明显改变苯酚降解率,但是铁溶出量却明显增加,体系中过多的溶解铁离子会发生反应式(5)~(7)的反应,消耗部分· OH及其它自由基,亦可降低苯酚降解率(Neyens and Baeyens, 2003;Kang and Hua, 2005).此外,催化剂投加过多,虽然这样会使催化活性组分含量增多,但是过量的催化剂在溶液中会分散不均匀,造成结块团聚的现象,降低了活性组分的利用率.因此,当催化活性组分进一步增加,苯酚降解率并没有明显变化.因此,本反应体系中催化剂的最佳用量为0.5 g·L-1.


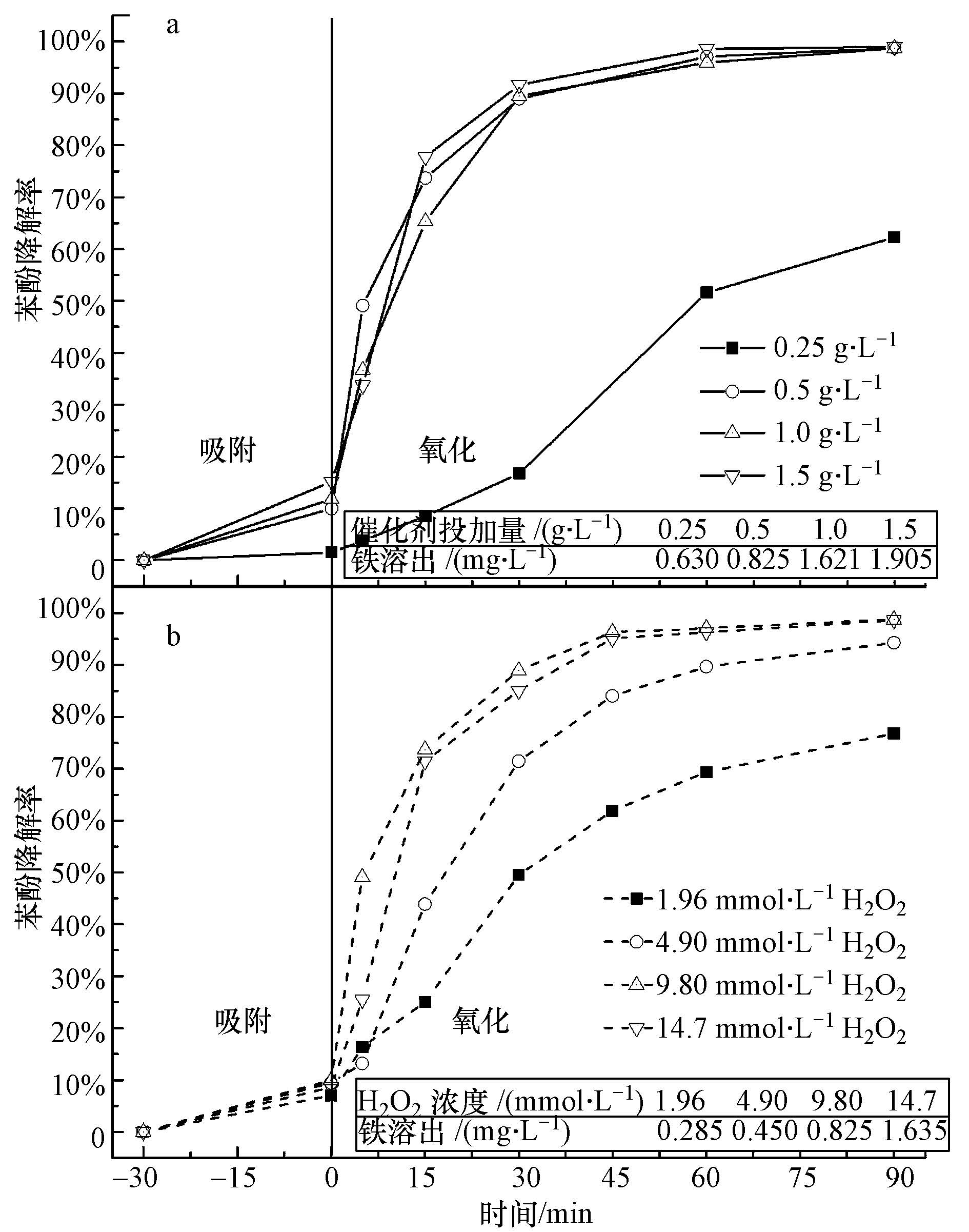 |
| 图 3 催化剂投加量对苯酚降解效果的影响 (pH=3.5,100 mg·L-1苯酚浓度,9.80 mmol·L-1 H2O2,25 ℃) (a); 不同H2O2用量对苯酚降解效果的影响 (pH=3.5,100 mg·L-1苯酚浓度,0.5 g·L-1催化剂,25 ℃) (b) Fig.3 Phenol degradation by the catalyst with different dosages (pH=3.5, initial phenol concentration =100 mg·L-1, H2O2 amount=9.80 mmol·L-1, t=25 ℃) (a) and Phenol degradation by the catalyst with different H2O2 amounts (pH=3.5, initial phenol concentration =100 mg·L-1, catalyst dosage=0.5 g·L-1, t=25 ℃) (b) |
图 3b为不同H2O2用量对苯酚降解效果的影响,反应符合准一级降解反应动力学方程.结果表明,当H2O2用量分别为1.96、4.90、9.80 mmol·L-1时,苯酚的降解速率随H2O2用量的增加而增大,但是当H2O2用量进一步增加至14.7 mmol·L-1时,苯酚降解速率略有降低.当体系中H2O2用量增加,芬顿反应生成的· OH数量增多,从而加速苯酚的降解.但过量的H2O2亦可作为· OH的捕获剂,与· OH反应生成·O2H自由基(反应式(8)),·O2H进一步与· OH反应生成H2O和O2(反应式(9)),因此H2O2过量可导致溶液中· OH减少,且生成的·O2H自由基氧化能力低于· OH的氧化能力,因此苯酚降解速率有所降低(Nguyen et al., 2011).从图中表可知,苯酚降解过程中,催化剂中活性组分铁溶出含量随H2O2用量增加而增加,说明H2O2用量的增加会促发催化剂中铁元素组分的溶出.而溶出的铁离子除了会发生副反应(反应式(3)和(4)),还会消耗溶液中· OH和HO2·自由基(反应式(5)~(7)),降低H2O2的有效利用率,不利于苯酚降解的过程(Neyens and Baeyens, 2003;Kang and Hua, 2005).因此,本反应体系中H2O2的最佳用量为9.80 mmol·L-1.
| 表 1 不同影响因素下gh-MCM-41-Fe催化降解苯酚的准一级动力学拟合方程 Table 1 Phenol degradation by the catalyst under different influencing factors and its pseudo first-order kinetic equations |
图 4为不同苯酚初始浓度对催化降解效果的影响.可以看出,当苯酚初始浓度梯度分别为10、50、80 mg·L-1和100 mg·L-1时,随着苯酚初始浓度的增加,苯酚降解速率降低,当反应30 min,苯酚去除率均达到93%以上,反应符合准一级降解反应动力学方程.据文献报道(Romero et al., 2009;Neyens and Baeyens, 2003),铁基非均相芬顿反应的反应过程如下:


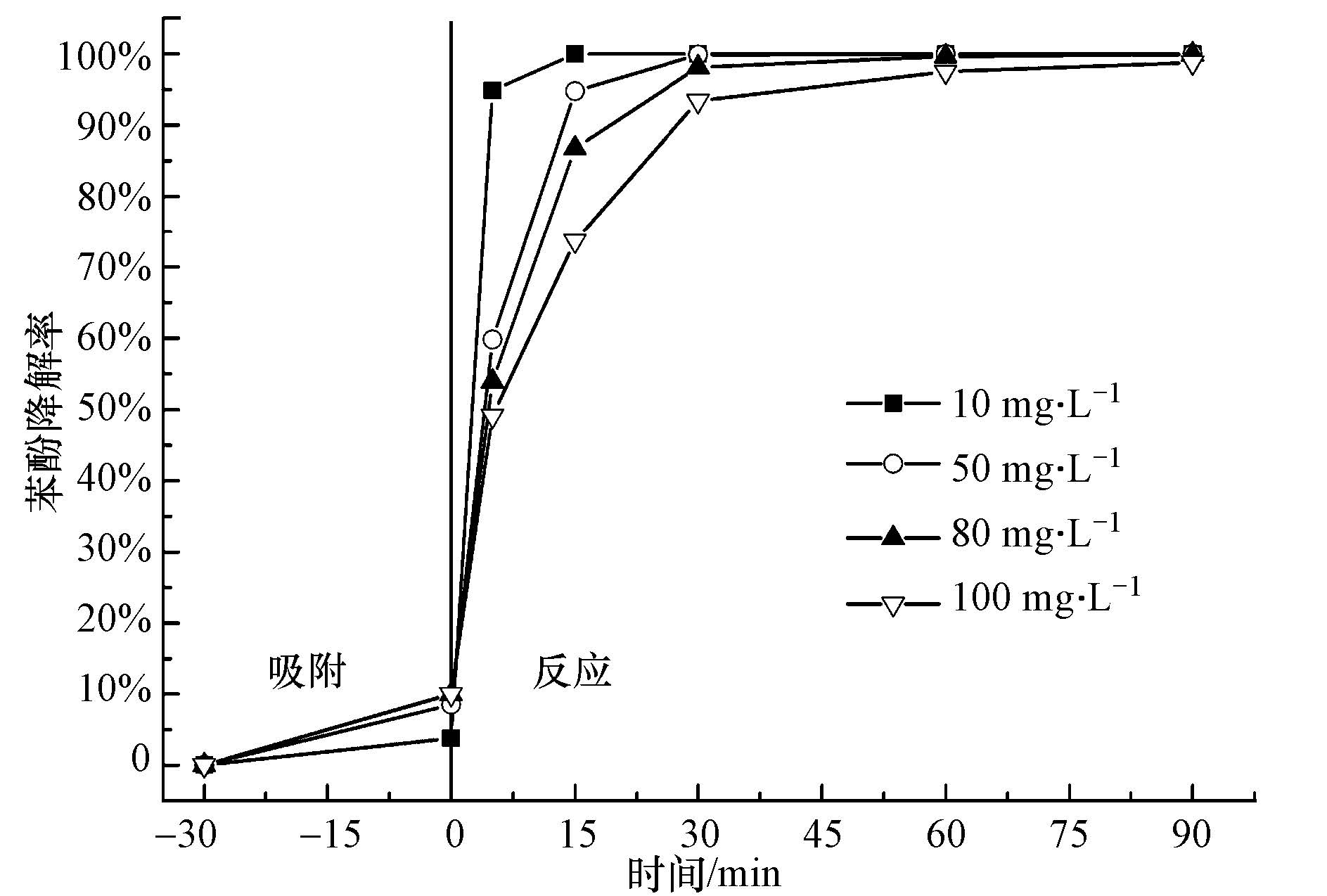 |
| 图 4 不同苯酚初始浓度的降解效果比较 (pH=3.5,9.80 mmol·L-1 H2O2,0.5 g·L-1催化剂,25 ℃) Fig.4 Comparison of phenol degradation by the catalyst with different initial concentrations of phenol (pH=3.5, H2O2 amount=9.80 mmol·L-1, catalyst dosage=0.5 g·L-1, t=25 ℃) |
式中,RH为污染物,R′(COOH)2为污染物开环后的有机酸,ads表示被吸附于催化剂界面,s表示固相.
体系中催化剂投加量和H2O2用量是一定的,催化剂表面的活性位点数也是一定的,其催化分解H2O2产生· OH自由基的量也是固定的;随着体系中苯酚初始浓度的增大,苯酚分子及其降解中间产物在催化剂表面发生竞争吸附,使得催化剂表面用于催化分解 H2O2活性位点的数目减少,影响· OH自由基的生成速度,导致单位时间· OH自由基产生的数目减少,从而降低了体系的反应速率(反应式(10)~(12)).但是,随着苯酚初始浓度的增大,增大了苯酚分子与· OH自由基的碰撞频率,从而减缓了· OH自由基在体系中副反应的发生,提高了· OH自由基的有效利用率(反应式(10)~(14)).苯酚初始浓度从10 mg·L-1增加到100 mg·L-1,反应开始阶段,苯酚降解速率降低了,但是当反应进行到30 min,苯酚降解率均达到93.4%以上,60 min后苯酚去除率均几乎达到100%.说明即使苯酚初始浓度增至100 mg·L-1,其在本反应体系中仍能保持较好的降解效果,而体系中的· OH自由基有效利用率也随着苯酚初始浓度的增加而增大.
3.4.2 反应温度的影响考察了25、35、45 ℃ 3个温度下催化剂对水体苯酚的催化降解效果,见图 5a,当温度从25 ℃增至45 ℃,反应速率常数递增,在反应0~5 min时,45 ℃下苯酚降解率低于25 ℃的苯酚降解率;但在反应5 min以后,45 ℃下苯酚降解反应速率迅速提高,大于25 ℃、35 ℃下的反应速率;60 min以后,不同温度下苯酚降解率均接近100%.从苯酚废水COD去除率分析可知,不同反应温度下,反应时间从30 min到90 min,COD去除率差别比较小,90 min COD去除率均达到65%以上,说明本催化剂对苯酚废水COD去除效果比较好.温度升高可促进· OH的生成,提高催化降解反应速率;在温度升高的驱动下,· OH可对包括苯酚及其降解中间产物进行有效氧化从而加速了苯酚的降解去除效果.但是,温度提高亦会促进H2O2热分解生成O2和H2O(反应式(15)),并且使得产生的过多· OH在出现的瞬间部分会迅速被自身消耗(反应式(16)),从而降低对苯酚的氧化降解效率(Romero et al., 2009).因此,两种作用相抵消,反应温度对于苯酚废水降解率和COD去除率影响不大.

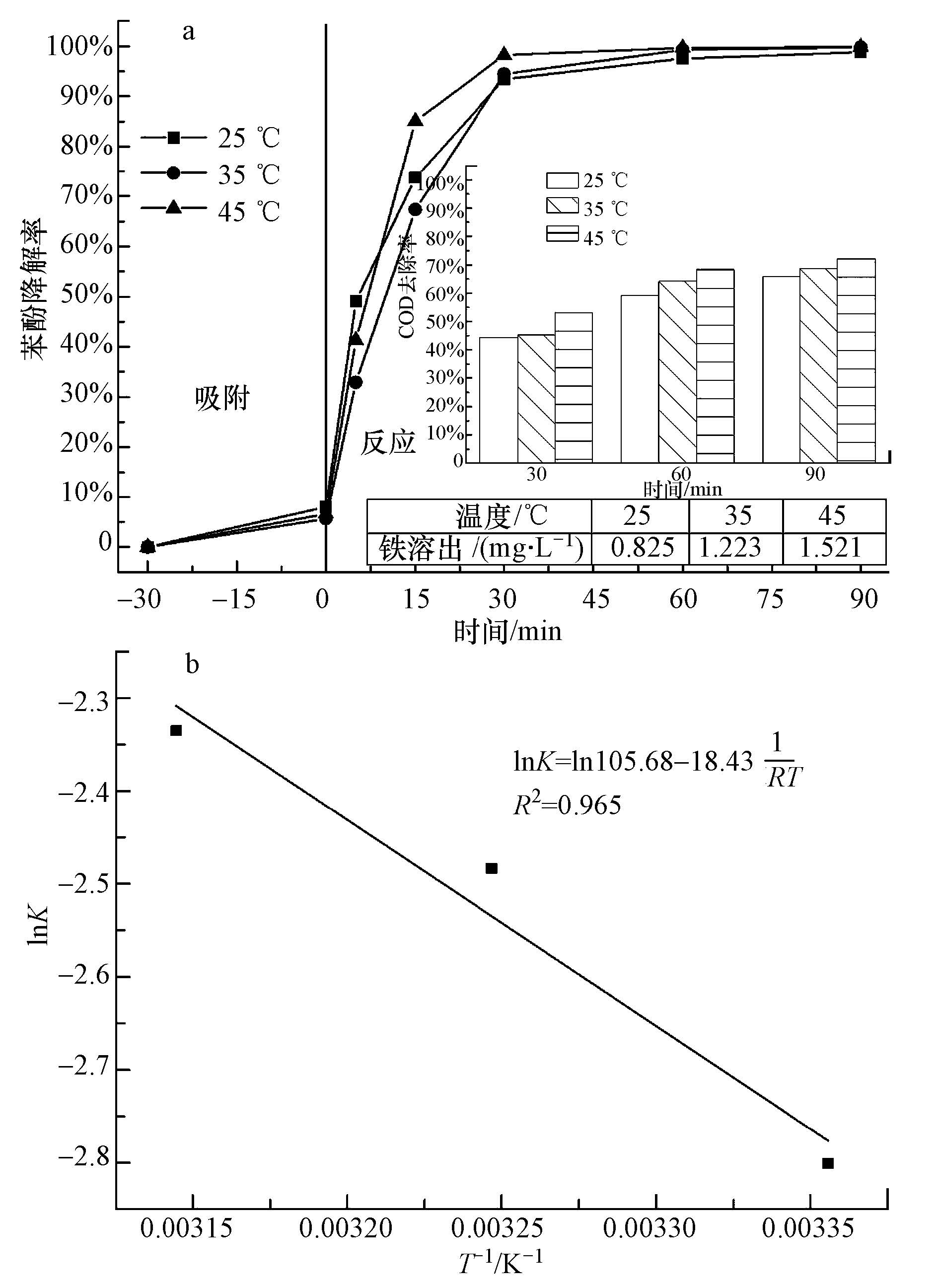 |
| 图 5 不同反应温度下苯酚降解及其COD去除效果的比较(a);苯酚降解反应的Arrhenius图 (b)(pH=3.5,100 mg·L-1苯酚浓度,9.80 mmol·L-1 H2O2,0.5 g·L-1催化剂) Fig.5 Phenol degradation and its COD removal by the catalyst under different temperatures (a) and Arrhenius plot for phenol degradation(b)(pH=3.5, initial phenol concentration =100 mg·L-1, H2O2 amount=9.80 mmol·L-1, catalyst dosage=0.5 g·L-1, t=25 ℃) |
将InK对1/T作图并进行线性回归拟合,得到Arrhenius方程式,InK=In105.68-18.43  ,见图 4b.由此可知,苯酚降解反应表观频率因子为105.68 min-1,表观活化能为18.43 kJ·mol-1,小于一般化学反应活化能60~250 kJ·mol-1范围,说明反应体系对温度的敏感程度比较弱(Fan et al., 2009).而陈娴等制备的分子筛固载金属芬顿催化剂Fe-Cu-Y,其降解苯酚反应活化能为47.56 kJ·mol-1(陈娴等,2013);张瑛洁等制备的负载高价铁树脂催化H2O2降解橙黄Ⅳ的反应活化能为59.94 kJ·mol-1(张瑛洁等,2010).说明本文非均相芬顿反应体系的发生需要比较小的反应活化能,体系反应速率快,催化降解效果好.
,见图 4b.由此可知,苯酚降解反应表观频率因子为105.68 min-1,表观活化能为18.43 kJ·mol-1,小于一般化学反应活化能60~250 kJ·mol-1范围,说明反应体系对温度的敏感程度比较弱(Fan et al., 2009).而陈娴等制备的分子筛固载金属芬顿催化剂Fe-Cu-Y,其降解苯酚反应活化能为47.56 kJ·mol-1(陈娴等,2013);张瑛洁等制备的负载高价铁树脂催化H2O2降解橙黄Ⅳ的反应活化能为59.94 kJ·mol-1(张瑛洁等,2010).说明本文非均相芬顿反应体系的发生需要比较小的反应活化能,体系反应速率快,催化降解效果好.
腐殖酸是一种芳香族化合物和含氮化合物的缩合体,结构复杂,分子量由几百到几百万,粒径由3 nm到10 nm,富含羧基、羟基、甲氧基、酚羟基、醌基、氨基等活性官能团(Chai et al., 2012).天然水体中腐殖酸的浓度范围由地下水的20 μg·L-1到地表水的30 mg·L-1,一般水源的腐殖酸浓度在10 mg·L-1左右(Chai et al., 2012).腐殖酸能与其它有机物争夺活性氧化自由基,如· OH等(反应式(17)),这种竞争现象对水体中有机污染物的去除有重要影响(Romero et al., 2009;Kang and Hua, 2005;Romero et al., 2011).

图 6a和c为不同腐殖酸(HA)浓度对苯酚废水降解效果的影响.由图可知,反应前15 min,HA添加浓度为50 mg·L-1的苯酚降解速率优于其它HA添加浓度的苯酚降解速率,反应15 min后,HA零添加时的苯酚降解速率超过其它HA添加浓度的苯酚降解速率;反应前15 min,不同HA添加浓度的苯酚降解速率提升都很快,对应苯酚废水COD的去除速率提升也很快,原因为反应初期,HA通过氢键作用与苯酚分子结合,使得苯酚分子占据HA部分官能团活性位点,此时苯酚分子可以与体系中的氧化自由基进行充分接触而被降解(Chai et al., 2012;Romero et al., 2011);反应15 min后,HA零添加时的苯酚降解率超过其它HA添加浓度时的苯酚降解率,反应30 min达到93.4%以上,60 min几乎完全去除苯酚;相应地,HA浓度从12.5 mg·L-1增加到50 mg·L-1,30 min时苯酚降解率分别为76.2%、78.1%、80.5%,30 min以后苯酚降解速率趋于平缓,降解效果没有明显增加,与相应COD去除率变化的结果一致.原因为,随着反应的进行,苯酚降解中间产物从HA的活性结合点脱落,使得体系中HA捕获并消耗溶液中更多的氧化自由基,降低了H2O2和氧化自由基的有效利用率,影响了溶液中苯酚及其降解中间产物的进一步深度降解,从而降低了后续反应中苯酚的降解速率和废水COD去除率.因此,由于HA能与其它有机物争夺并大量消耗活性氧化自由基,HA不利于水体中苯酚的降解以及COD的降低.
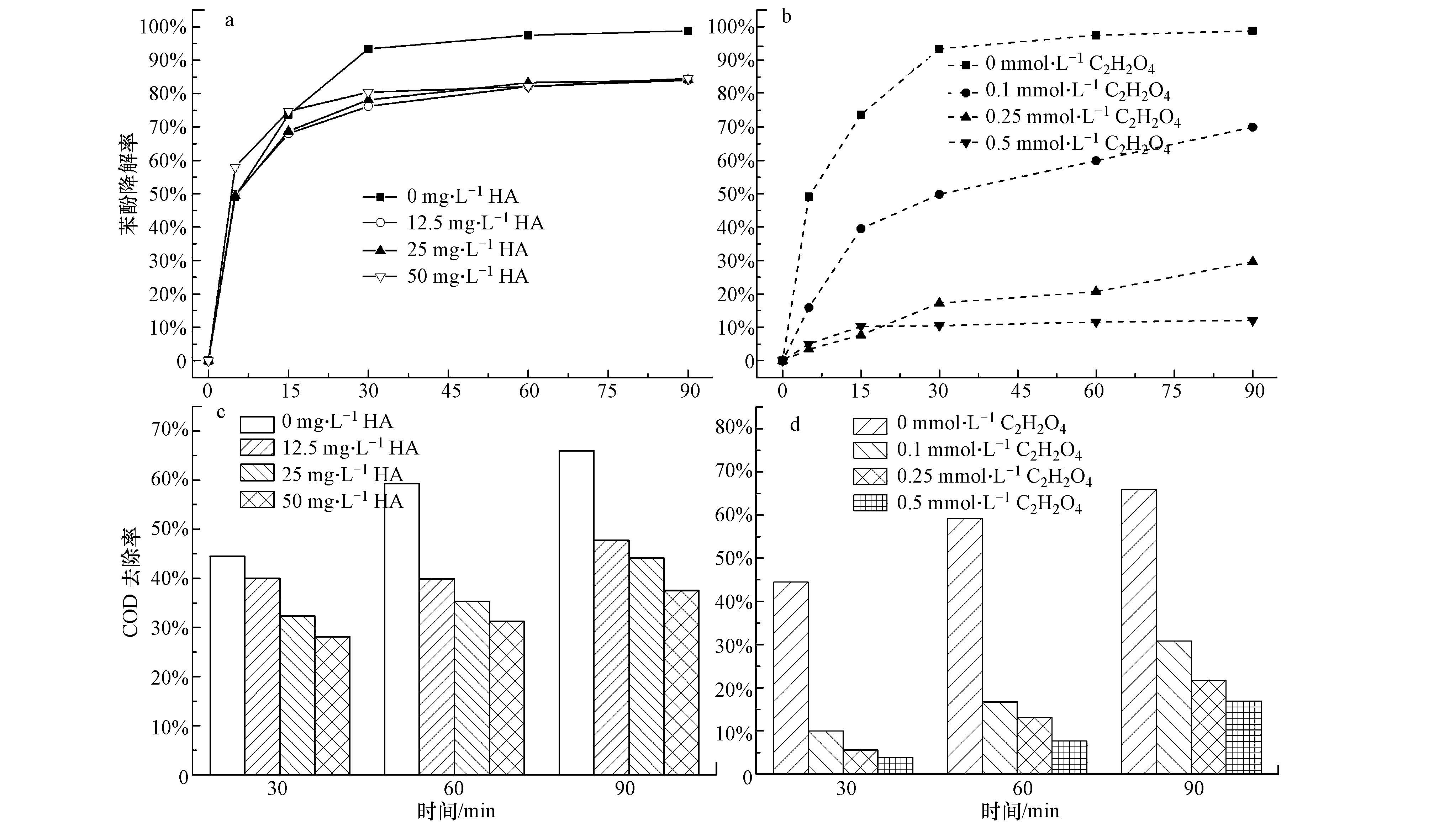 |
| 图 6 HA (a,c)和草酸(b,d)对苯酚降解效果的影响 (pH=3.5,100 mg·L-1苯酚浓度,9.80 mmol·L-1 H2O2,0.5 g·L-1催化剂,25 ℃) Fig.6 Phenol degradation by the catalyst with different concentrations of humin acid (a,c) and oxalate (b,d)(pH=3.5, initial phenol concentration =100 mg·L-1, H2O2 amount=9.80 mmol·L-1, catalyst dosage=0.5 g·L-1, t=25 ℃) |
小分子有机酸是指分子量低于250的有机酸.其中,草酸(C2H2O4)是常见的小分子有机酸,还是有机物高级氧化降解过程中的中间产物,它的存在会影响水体的水质(Huang et al., 2011).图 6b和d为不同草酸浓度对苯酚废水降解效果的影响.由图b和d可知,草酸添加浓度由0.1 mmol·L-1增加至0.5 mmol·L-1,反应60 min苯酚降解率依次为59.93%、20.68%、11.57%,反应90 min苯酚的降解率依次为69.97%、29.60%、12.05%,均低于相同时刻草酸零添加时苯酚的降解率;相应地,苯酚废水COD去除率在90 min时刻依次为30.87%、21.71%、16.92%,均低于相同时刻草酸零添加时的COD去除率.说明在非均相芬顿体系中,草酸会与苯酚争夺活性氧化自由基(如· OH自由基等),大幅度降低体系中苯酚废水的降解效果,对苯酚降解和COD的降低起到极大的抑制作用.因此,草酸抑制水体中苯酚的降解以及COD的降低.
4 结论(Conclusions)1)本文制备的非均相芬顿催化剂gh-MCM-41-Fe,在反应60 min催化降解100 mg·L-1苯酚的去除率高达97.6%,COD去除率为65.9%,而铁溶出只有0.825 mg·L-1,降解反应符合准一级反应动力学模型,其反应表观频率因子为105.68 min-1,表观反应活化能为18.43 kJ·mol-1,催化剂的催化降解效果较好.
2)苯酚降解速率随着催化剂和H2O2投加量的增加而增加,但投加量过多,会消耗体系中的氧化自由基从而不利于苯酚降解过程;苯酚初始浓度从10 mg·L-1增至100 mg·L-1,苯酚降解速率相应降低,但体系中H2O2及· OH自由基的有效利用率反而增加,反应60 min后苯酚均能几乎完全去除;反应温度对于苯酚降解和废水COD去除率影响不大.
3)由于腐殖酸和草酸会与苯酚争夺活性氧化自由基,腐殖酸和草酸对苯酚废水降解体系均有不同程度的抑制作用,其中草酸的抑制作用比较大.
| [1] | Ay F, Kargi F. 2010. Advanced oxidation of amoxicillin by Fenton's reagent treatment[J]. Journal of Hazardous Materials, 179(1/3): 622-627 |
| [2] | Bautista P, Mohedane A F, Casas J A, et al. 2011. Highly stable Fe/γ-Al2O3 catalyst for catalytic wet peroxide oxidation[J]. Journal of Chemical Technology and Biotechnology, 86(4): 497-504 |
| [3] | Chai X L, Liu G X, Zhao X, et al. 2012. Fluorescence excitation-emission matrix combined with regional integration analysis to characterize the composition and transformation of humic and fulvic acids from landfill at different stabilization stages[J]. Waste management, 32(3): 438-447 |
| [4] | 陈娴, 叶招莲, 李蔚, 等. 2013. 分子筛固载双金属Fenton催化剂的制备及其反应性能[J]. 水处理技术, 39(2): 65-68 |
| [5] | 邓景衡, 文湘华, 李佳喜. 2014. 碳纳米管负载纳米四氧化三铁多相类芬顿降解亚甲基蓝[J]. 环境科学学报, 36(6): 1436-1442 |
| [6] | Dükkancı M, Gündüz G, Yılmaz S, et al. 2010. Heterogeneous Fenton-like degradation of Rhodamine 6G in water using CuFeZSM-5 zeolite catalyst prepared by hydrothermal synthesis[J]. Journal of hazardous materials, 181(1/3): 343-350 |
| [7] | Fan J, Guo Y H, Wang J J, et al. 2009. Rapid decolorization of azo dye methyl orange in aqueous solution by nanoscale zerovalent iron particles[J]. Journal of Hazardous Materials, 166(2-3): 904-910 |
| [8] | 傅翠梨, 陈文瑞, 郭阿明, 等. 2012. 邻菲啰啉光度法测定高岭土中可溶铁和非可溶铁[J]. 岩矿测试, 31(4): 621-626 |
| [9] | 国家环境保护总局. 2008. HJ/T 399-2007. 水质-化学需氧量的测定-快速消解分光光度法[S]. 北京: 中国环境科学出版社 |
| [10] | 何光裕, 张艳, 钱茂公, 等. 2012. 磁性Fe3O4/石墨烯Photo-Fenton催化剂的制备及其催化活性[J]. 无机化学学报, (11): 2306-2312 |
| [11] | Huang Y H, Shih Y J, Liu C H. 2011. Oxalic acid mineralization by electrochemical oxidation processes[J]. Journal of hazardous materials, 188(1/3): 188-192 |
| [12] | Hummers Jr W S, Offeman R E. 1958. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 80(6): 1339 |
| [13] | Jatupisarnpong J, Trakarnpruk W. 2012. Transition metal-substituted polyoxometalates supported on MCM-41 as catalysts in the oxidation of cyclohexane and cyclooctane with H2O2[J]. Mendeleev Communications, 22(3): 152-153 |
| [14] | 姜远光, 刘玉茹, 王少坡. 2011. Fe3+和Mn2+双金属负载型非均相类Fenton催化剂的制备及性能[J]. 天津城市建设学院学报, 17(2): 114-118 |
| [15] | Kang N, Hua I. 2005. Enhanced chemical oxidation of aromatic hydrocarbons in the soil systems[J]. Chemosphere, 61(7): 909-922 |
| [16] | Karthikeyan S, Gupta V K, Boopathy R, et al. 2012. A new approach for the degradation of high concentration of aromatic amine by heterocatalytic Fenton oxidation: Kinetic and spectroscopic studies[J]. Journal of Molecular Liquids, 173: 153-163 |
| [17] | Liu Z Z, Deng H P, Chen Z L. 2011. Removal of 2, 4, 6-trichlorophenol by iron and manganese oxides/granular activated carbon with H2O2[J]. Advanced Materials Research, 154-155: 28-33 |
| [18] | Navalon S, Alvaro M, Garcia H. 2010. Heterogeneous Fenton catalysts based on clays, silicas and zeolites[J]. Applied Catalysis (B: Environmental), 99(1/2): 1-26 |
| [19] | Neyens E, Baeyens J. 2003. A review of classic Fenton's peroxidation as an advanced oxidation technique[J]. Journal of Hazardous Materials, 98(1/3): 33-50 |
| [20] | Nguyen T D, Phan N H, DO M H, et al. 2011. Magnetic Fe2MO4 (M: Fe, Mn) activated carbons: Fabrication, characterization and heterogeneous Fenton oxidation of methyl orange[J]. Journal of Hazardous Materials, 185(2/3): 653-661 |
| [21] | Pradhan A C, Parida K M. 2012. Facile synthesis of mesoporous composite Fe/Al2O3-MCM-41: an efficient adsorbent/catalyst for swift removal of methylene blue and mixed dyes[J]. Journal of Materials Chemistry, 22(15): 7567-7579 |
| [22] | Romero A, Santos A, Vicente F. 2009. Chemical oxidation of 2, 4-dimethylphenol in soil by heterogeneous Fenton process[J]. Journal of Hazardous Materials, 162(2/3): 785-790 |
| [23] | Romero A, Santos A, Cordero T, et al. 2011. Soil remediation by Fenton-like process: Phenol removal and soil organic matter modification[J]. Chemical Engineering Journal, 170(1): 36-43 |
| [24] | Singha S, Parida K M, Dash A C. 2011. Fe(Ⅲ)-salim anchored MCM-41: synthesis, characterization and catalytic activity towards liquid phase cyclohexane oxidation[J]. Journal of Porous Material, 18(6): 707-714 |
| [25] | 谭万春, 喻辰雪, 胡帅飞, 等. 2014. 沸石负载Fe3O4光催化氧化去除水中苯酚[J]. 环境工程学报, 8(6): 2353-2358 |
| [26] | 田志茗, 赵银秋, 邓启刚. 2014. 非均相类芬顿催化剂Fe/SBA-15的制备及其催化性能的研究[J]. 石油化工, 43(2): 205-209 |
| [27] | Wang Y B, Zhao H Y, Zhao G H. 2015. Iron-copper bimetallic nanoparticles embedded within ordered mesoporous carbon as effective and stable heterogeneous Fenton catalyst for the degradation of organic contaminants[J]. Applied Catalysis (B: Environmental), 164: 396-406 |
| [28] | Wu T T, Englehardt J D. 2012. A new method for removal of hydrogen peroxide interference in the analysis of chemical oxygen demand[J]. Environmental Science & Technology, 46(4): 2291-2298 |
| [29] | Xia M, Long M C, Yang Y D, et al. 2011. A highly active bimetallic oxides catalyst supported on Al-containing MCM-41 for Fenton oxidation of phenol solution[J]. Applied Catalysis (B: Environmental), 110: 118-125 |
| [30] | 杨岳主, 李玉平, 杨道武, 等. 2013. 铁铜催化剂非均相Fenton降解苯酚及机制研究[J]. 环境科学, 34(7): 2658-2664 |
| [31] | 张瑛洁, 马军, 赵吉, 等. 2010. 树脂负载高价铁催化H2O2降解橙黄Ⅳ[J]. 哈尔滨工业大学学报, (4): 576-579 |
| [32] | 赵彬, 王向宇. 2013. 用于氧化反应的改性介孔分子筛MCM-41研究进展[J]. 工业催化, 21(1): 1-5 |
| [33] | 钟贵江, 唐小平, 叶小丽, 等. 2012. 非均相Fenton试剂降解苯酚废水的条件优化[J]. 安徽农业科学, 40(16): 9087-9090 |
 2015, Vol. 35
2015, Vol. 35


