自1955年首次报道生物“超量摄磷”现象以来,污水生物除磷技术已被广泛地应用于工程实际中.目前,在生物除磷的研究中,人们将焦点集中于3个方面.一是环境因素对除磷的影响.人们通常关注环境条件的改变对除磷效果的影响,并企图通过改变工艺条件,解决因碳源不足、溶解氧过剩和pH波动等对除磷效果的影响(丁艳等,2010; 吴昌永,2010; 杨勇光,2010).二是生化模型,见图 1.在众多的除磷模型中,Mino模型颇具代表性(Mino et al.,1998).该模型主要考虑了除磷过程中的能量变化及物质转化(彭永臻等,2006).三是聚磷微生物.聚磷微生物是生物除磷过程的主要担当者(张自杰等,2000),但对它们的认识并不清楚,不同的研究方法得到的认识也存在一定差异(Reddy and Bux,2004;徐立杰等,2011).整体上,目前鲜有从酶学角度展开的相关研究,忽视了酶是微生物实现相应功能并被调节的根本因素,生物除磷过程也不例外.生物除磷是依靠聚磷微生物在厌氧条件下分解多聚磷酸盐释放磷,在好氧条件下超过其生理需要,过量地从外部环境摄取磷,并将磷以多聚磷酸盐的形式贮存在生物体内,形成高磷污泥,排出系统外,达到除磷目的.在此过程中,磷酸盐的厌氧释放与好氧摄取是生物除磷的核心,而与其合成与分解密切相关的是生物体内的磷酸盐转运方式和代谢相关酶.
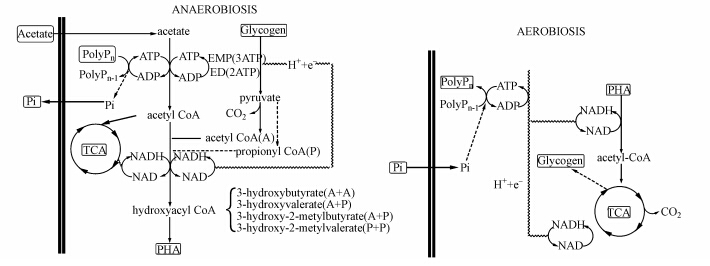 |
| 图 1 A/O交替条件下聚磷菌代谢机制(Lemos et al.,1998) Figure.1 Metabolism of polyphosphate accumulating bacteria under alternation of anaerobiosis and aerobiosis |
强化生物除磷系统(Enhanced Biological Phosphorus Removel,EBPR)中微生物种类繁多,多年来各研究组都致力于其中起关键作用的微生物的分离和鉴定.随着分子生物学技术在环境领域的应用与发展,早期的结论被不断地更新与否定.
Fuhs和Chen(1975)首次将不动杆菌(Acinetobacter)认定为EBPR处理系统中的优势菌种.之后的数十年中,各国研究者相继以不同的培养方式对生物除磷系统中的微生物进行了分离培养,但经生物学鉴定大多数都属于γ-变形菌门(γ-Proteobacteria)中的Acinetobacter,所以Acinetobacter是优势聚磷菌这一结论被广泛接受.随后,运用FISH技术通过设计特殊的基因探针进行杂交实验研究表明,Acinetobacter仅占EBPR处理系统微生物总数的10%以下,并不是优势聚磷菌(刘燕等,2006).Nakanura等从实验室规模的EBPR处理系统中分离出一株球状革兰氏阳性化能异养菌-聚磷小月菌(Microlunatus phosphovorus),能够以好氧阶段积累的多聚磷酸盐(poly-P)作为厌氧阶段吸收有机物的能量来源,但不能以乙酸为碳源(Nakamura et al.,1995).后来,利用核磁共振技术发现,这种细菌体内没有糖原和聚羟基烷酸(PHAs)的循环.这与聚磷菌表现出的整体性质不一致(Oehmen et al.,2007).Sudiana在以乙酸为碳源驯化活性污泥时发现β-变形菌门(β-Proteobacteria)为除磷系统中的优势菌种(Sudiana et al.,1998).Bond以及Christensson两位研究者也认同Sudiana的观点(Bond et al.,1999; Christensson et al.,1998).Zilles等通过FISH技术发现β-Proteobacteria中的红环菌属(Rhodocyclus)是EBPR系统中的优势菌.Rhodocyclus能够表现出传统聚磷菌A/O交替的代谢模式,体内也存在poly-P和PHAs的循环.通过分子生物学技术研究表明Rhodocyclus的16S rRNA片段和EBPR处理系统中微生物的16S rRNA片段相似度极高(Zilles et al.,2002),根据这类菌的16S rRNA不同区段设计的基因探针已被广泛地用于EBPR处理系统中聚磷微生物的菌群分析,见表 1(徐立杰等,2011).还有研究者认为俊片菌(Lampropediaa spp.)(Stante et al.,1997)、酵母菌型PAOs(王海燕等,2005; 吴蕾等,2007)、肠杆菌(Enterobacteriaceae)(张培玉等,2011)、变形菌(Alphaprotenbacteria)(Nguyen et al.,2012)、葡萄球菌(Staphyloccocus)(南亚萍等,2013; Choi and Yoo,2000)产碱杆菌(Alcaligenes sp.)(庄志刚等,2014)也是聚磷菌并有可能是除磷系统中的优势菌,甚至存在反硝化聚磷功能(Yang et al.,2011;Qiu et al.,2012).
| 表 1 EBPR系统中聚磷菌的几种常用杂交探针 Table 1 Several 16S rRNA-based FISH probes used for targeting PAOs in EBPR systems |
目前人们对聚磷菌的认识尚不清楚,研究结果也存在分歧.有学者观测到,在厌氧状态下气单胞菌对不动杆菌属所需的发酵产物的产生起到重要作用,且只有在气单胞菌得到繁殖的情况下不动杆菌除磷作用才变得明显.因此,聚磷现象的发生是通过菌种间的相互协同作用实现的(南亚萍等,2011).Ltter和Murphy(1985)也发现气单胞菌和假单胞菌能除磷,同时发现细菌间有一定的协作能力.也有研究者实验发现,某些聚磷菌属具有“互生”关系,只有群居时,才会发生聚磷现象,一旦分离,则不表现聚磷功能.
2.2 多聚磷酸盐(poly-P)多聚磷酸盐(poly-P)是由数个到数千个无机磷酸盐单体通过高能磷酸键聚合而成的线状或环状多聚物(Gómez-García et al.,2003; Rangarajan et al.,2006).最早在迂回螺菌体内发现,称其为“迂回体”.这类物质易被碱性染料着色而呈紫红色,又称其为“异染颗粒”(Yeoman et al.,1988).研究表明所有的生物体细胞内都含有poly-P,但由于各生物体代谢能力和生理功能差异,不同的生物在同一生长时期poly-P的存在形式和含量有所不同;另外,就同一生物而言,poly-P的存在形式和含量也会随着细胞分裂和生长而发生变化.对谷氨酸棒状杆菌一项研究表明,菌体内存在两种形式的poly-P—颗粒型和可溶型(Klauth et al.,2006).在对数增长中期,细胞内poly-P含量最低,而在对数增长期末或刚进入稳定期时,poly-P明显积累.随后的研究表明,对数增长期主要以颗粒型poly-P为主,而稳定期积累的主要是可溶型poly-P.作为生物体内的主要组成物质,在生物代谢过程中poly-P发挥着重要的作用(Doruk et al.,2013; Lee et al.,2006):充当细胞内磷源和能源贮存库;调节ATP和其他核酸及辅酶的合成及其基因表达;构成生物体阳离子选择性通道;作为Mn2+、Mg2+和Ca2+等二价阳离子的螯合剂(Kornberg,1999);调节细菌运动性、耐药性、渗透性和参与细菌生物膜形成并对胁迫响应(GSR)和营养差异作出反应(Kuroda et al.,2001;Rao and Kornberg,1996);调节菌体适应外界环境压力和营养缺乏条件;作为细菌生长稳定期基因表达相关的调控因子(Shiba et al.,1997).
2.3 磷酸盐转运从生化及遗传学角度对大肠杆菌的无机磷酸盐超量摄取和贮存现象研究发现无机磷酸盐并不以主动运输的方式进入细胞,而要借助于细胞内的磷酸盐转运系统得以实现,而这恰恰又是poly-P代谢过程中的限速步骤(Wu et al.,1999).目前,公认的磷酸盐穿透细胞膜进入细胞的方式有两种:组成型低亲和磷转运系统(Pit)和可诱导性高亲和磷转运系统(Pst)(Wu et al.,1999; Lee et al.,2009).
2.3.1 组成型低亲和磷转运系统(Pit)在Pit转运系统中,参与信息传递的蛋白仅有膜转运蛋白,而细胞周质磷结合蛋白在此并未发挥作用.当菌体处于压抑环境时,poly-P开始降解导致胞内磷酸盐浓度升高,磷与金属离子螯合(MeHPO-4/H+),然后以共运输的方式经Pit系统排出,伴随产生的质子驱动力(pmf)可与其它需能反应偶联,参与其它代谢活动,比如形成Na+泵、产生ATP和积累L-赖氨酸等(Van Veen et al.,1994).
2.3.2 可诱导性高亲和磷转运系统(Pst)Pst转运系统仅调节细胞内外少量磷交换并且这种交换可能受到解耦联剂抑制.它主要实现HPO-4和HPO2-4的转运,此时,HPO-4和HPO2-4并不与MeHPO-4/H+螯合(Van Veen,1997).Pst由4个亚单位组成(Wu et al.,1999; Lee et al.,2009):一个细胞周质磷结合蛋白(PstS)、两个疏水性的膜组成蛋白(PstA和PstC)和一个ATP结合蛋白(PstB).在Pst系统中PhoR蛋白可充当蛋白酶,也可作为PhoU的一种附属蛋白.Pst系统与PhoU蛋白共同调节PhoR蛋白的磷酸化和脱磷酸化活性.Pst系统由Pho调节子通过跨膜信号传导完成磷酸盐转运行为,其途径为( van Veen,1997):无机磷酸盐(Pi)依次与Pst系统中的PstS、PstA和PstC、PstB结合,然后通过负调节子PhoU编码的U蛋白将Pi传递给细胞内部磷感应受体PhoR编码的R蛋白及感应受体激活元件PhoB/PhoP(革兰氏阳性菌称PhoP,革兰氏阴性菌称PhoB)编码的B/P蛋白并与其结合而将磷转运到细胞内.
3 聚磷相关酶及其酶学调控 (Enzymes and their regulation involved in microbial polyphosphate accumulation)在生物体内,多种酶共同调控poly-P的合成和分解代谢,见图 2(Brown and Kornberg,2008; 魏峥等,2009):多聚磷酸盐激酶(PPK)、多聚磷酸盐酯酶(PPX)、多聚磷酸盐内切酶(PPN)、聚磷酸盐葡萄糖激酶(PPGK)、poly-P-AMP-磷酸转移酶(PAP)、聚磷酸盐果糖激酶和聚磷酸盐甘露糖激酶等.在上述各种酶中,研究较为深入的是PPK和PPX.它们与poly-P的代谢密切相关,分别由ppk和ppx基因编码.
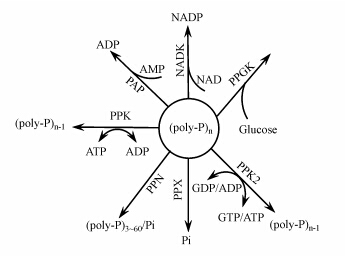 |
| 图 2 细胞内poly-P的代谢 Figure.2 Intracellular metabolism of poly-P |
多聚磷酸盐激酶是与生物体内poly-P代谢相关的关键酶.它催化ATP末端的磷酸基团可逆地转移到长链多聚磷酸盐(poly-P)上,形成长度可达1000甚至更长的正磷酸盐线状或环状多聚物,又称PPK(Shi et al.,2015; Hossain et al.,2008).反应式:
ATP+(poly-P)n↔ADP+(poly-P)n+1(PPK);
除PPK外,近年来研究表明,一些微生物还存在另一种结构比PPK简单,既可催化GTP上的磷酸基团转移到poly-P上,同时又可催化poly-P生成GTP的酶PPK2(Ishige et al.,2002; Sureka et al.,2009; Gangaiah et al.,2010; Nocek et al.,2008).其反应式:
GDP+(poly-P)n+1↔GTP+(poly-P)n(PPK2);
PPK最为保守,与PPK2的氨基酸序列相似度极低.PPK2和PPK具有4个显著不同的特征.①从进化程度分析证实PPK2是比PPK更古老的蛋白(Achbergerová and Nahálka,2014);② PPK和PPK2对鸟苷酸和腺苷酸的选择性不同(黄金玲等,2014; Díaz et al.,2013):PPK2可同等程度的催化GTP和ATP合成poly-P;而PPK只能以ATP为底物合成poly-P.PPK2也能够利用poly-P合成GTP或ATP,且利用poly-P合成GTP的能力是合成ATP的30多倍;③与PPK相比,PPK2作用底物是短链poly-P,且主要参与poly-P的分解代谢(黄金玲等,2014);④当poly-P的含量足够时,poly-P间可发生齐聚反应使生物体内的PPK2活性提高10倍,但PPK并不因此而发生变化.
目前为止,已从上百种细菌体内分离纯化出PPK,而对真核生物体内PPK的研究不多.有研究者从假丝酵母(C and ida sp.)和盘基网柄菌(D. discoideum)中发现了PPK的存在.研究发现盘基网柄菌的PPK具有1050个氨基酸残基,而大肠杆菌的PPK只有688个氨基酸残基,其氨基端多出的370多个氨基酸残基与大肠杆菌的PPK蛋白无同源性(Rao et al.,2009).可以推断在蛋白结构上真核生物PPK和原核生物的PPK是有差异的.大肠杆菌的PPK结构分析显示其PPK是一个具有4个结构域的二聚体,其活性位点位于一个ATP结合口袋(ABP)的结构通道内,通道调节着poly-P的迁移(Brown and Kornberg,2008).Kornberg对PPK结构分析发现,ABP有可能是PPK抑制因子的靶位点,一旦抑制因子与ABP结合就会破坏PPK二聚体结构致使PPK失活(Brown and Kornberg,2008).Kumble等研究表明,在大肠杆菌形成poly-P的过程中,ATP末端磷酸基团先被转移到PPK的组氨酸残基H441和H460上形成一个磷酸酶中介体,随后,在PPK的催化下,使poly-P的链长增加.一旦对H441和H460进行定点诱变发现突变体蛋白不具有合成poly-P的能力.对变铅青链霉菌(S.lividans)的组氨酸标签蛋白分析发现其PPK与大肠杆菌的PPK具有相似的酶学特性,所不同的是S.lividans的磷酸酶中介体可能是ATP的末端磷酸基团被转移到保守组氨酸残基H517和H536上而形成的.
3.2 多聚磷酸盐酯酶(PPX)多聚磷酸盐酯酶是一个催化poly-P释放其末端磷酸基团的酶,反应式:
(poly-P)n↔(poly-P)n-1↔(Pi)n(PPX);
PPX催化长链poly-P(约500个磷酸基团)不断地释放出无机磷酸盐基团直至出现焦磷酸盐(PPi).PPX也可催化短链poly-P(约15个磷酸基团)释放磷酸基团但催化效率不高(Akiyama et al.,1993),如研究发现酿酒酵母(S.cerevisiae)的PPX可催化三聚磷酸盐的水解.大肠杆菌具有两个PPX:即PPX1和PPX2(也就是GPPA,鸟苷五磷酸磷酸水解酶).PPX1晶体结构表明大肠杆菌的PPX1具有4个结构域(Ⅰ、Ⅱ、Ⅲ和Ⅳ),结构域Ⅰ和Ⅱ与超嗜热菌(A.aeolicus)的PPX结构域Ⅰ和Ⅱ相似度较高,所不同的是大肠杆菌的这两个结构域处于紧密的“关闭状态”,而A.aeolicus处于“开放状态”.这种差异可能与酶的活性相关,因为这两个结构域通过开闭程度调节酶与底物的结合(Kristensen et al.,2004; Rangarajan et al.,2006).A.aeolicus的PPX蛋白的晶体结构显示结构域Ⅰ和Ⅱ之间存在一个活性位点;而大肠杆菌 PPX结构域Ⅰ和Ⅱ的交接处存在两个活性位点—poly-P结合位点和阻挡核苷结合位点,这两个活性位点可调节信号素的水解(Kristensen et al.,2008).Rangarajan等发现由6个α螺旋组成的结构域Ⅲ与磷酸水解酶HD超家族蛋白的结构相似,可能是HD超家族的成员,但与鸟苷四磷酸水解酶(SpoT)蛋白的相似度不高,不具有催化活性但对二聚体和poly-P通道形成过程发挥重要作用(Rangarajan et al.,2006).Alvarado等认为结构域Ⅲ可作为第二个PPX活性位点,参与鸟苷五磷酸(pppGpp)的水解(Alvaradoet al. 2006).结构域Ⅳ和与冷休克相关的RNA结合蛋白结构相似,至于其功能目前还未知(石廷玉等,2011)
3.3 PPK和PPX对微生物磷代谢的调控作为poly-P代谢过程中的关键酶,PPK和PPX共同调节着生物体内的磷代谢.
研究发现在低磷条件下,大肠杆菌分解自身贮存的poly-P为其生长提供足够的磷源致使poly-P含量下降(Gómez-García et al.,2003).在此过程中菌体内ppk基因会被强力诱导表达,PPK活性是富磷条件下的10~20倍,而PPX活性减弱;直到重新加入过量的磷酸盐时,致使PPK变构激活,poly-P又重新合成.当poly-P含量达到最大值后PPK活性开始下降(Van Dien and Keasling,1999).这表明PPK和PPX的确具有调节poly-P代谢的作用,且两者共同作用调节生物体内poly-P的含量:①通过提高PPK活性生成poly-P;②通过降低PPX活性而减少poly-P的分解;③当磷酸盐含量增加时,PPK活性并不因此而立即下降,而是在poly-P含量达到生物体自身合成的最大限度后,开始下降.也有研究显示在低磷条件下,poly-P的分解主要是由PPX催化完成而不依靠PPK的逆催化,当磷酸盐含量再次增加时,PPX催化活性才会下降.poly-P的含量不仅受到无机磷酸盐的调控而且还与氨基酸严谨应答反应有关系,但关于氨基酸缺乏对poly-P积累的酶学调控,说法不一.Kuroda认为PPK可激发蛋白表达以适应缺氨基酸的环境(Kuroda et al.,1999).当将ppk基因缺失的大肠杆菌突变菌转移到贫营养环境中时,蛋白表达停止,菌体生长受限.然而,Kornberg在研究氮匮乏对poly-P生成的影响时发现,氮缺乏会诱导poly-P的大量积累,PPX活性大幅度降低,而PPK活性没有太大变化,poly-P的合成速率不变而分解速率下降,宏观上表现出poly-P积累(Kornberg,1999; Alvarado et al.,2006; Ohtake et al.,1985).有学者认为这可能是活体细胞产生的调节信号鸟苷四磷酸(ppGpp)选择性地抑制了PPX而不影响PPK活性(Hirota et al.,2010).南亚萍等在PPK活性测定的研究中也发现了类似的现象,对此解释为PPK可能属于生物体内的组成酶,其活性不随环境的改变而发生变化,而PPX则可能属于诱导酶,环境变化会改变PPX的活性及表达量(南亚萍等,2012; Zhang et al.,2007).也有学者研究发现在氨基酸饥饿环境中,大肠杆菌胞内的poly-P提高到原来的1000倍,但胞内的PPK和PPX活性并没有发生改变.其他环境压力,如渗压震扰和氧化压力等可使菌体产生胁迫诱导蛋白(RpoS)与其他的调控信号共同抑制PPX或激发PPK.上述研究显示相互矛盾的结果:①PPK与PPX相互影响,相互制约,共同调控生物体内的poly-P含量;② poly-P的合成与分解似乎与PPK无关而与PPX相关;③ PPK和PPX都没有参与到poly-P的代谢过程,可能生物体还存在其他的调节机制或者酶来调控poly-P 代谢.
随着分子生物技术和生物信息学的发展,研究者也通过基因改造技术研究了PPK和PPX在维持生物形态和代谢中发挥的作用.敲除铜绿假单胞菌PAO1菌株ppk基因后其泳动、爬动和颤动都有缺陷,然而ppk基因回补后又恢复动力.说明ppk基因在生物的运动方面发挥重要作用;此外还发现假铜绿假单胞菌(P. aeruginosa)的rpoS转录激活受PPK的调节(Shiba et al.,1997).有研究者将ppk基因转入原本不聚磷的生物体内使其表达,发现聚磷能力显著提高(李波等,2009; 王勤等,2006; 杜宏伟等,2009).Shi等(2015)研究发现蜡状芽孢杆菌(B. cereus)ppk基因缺失菌株poly-P的含量不到野生菌的5%,而ppx缺失菌株的poly-P含量约是野生型的1000倍,PPK活性提高了10倍.敲除ppk后的恶臭假单胞菌(P.putida)突变菌形态和某些细胞功能发生改变.但与原始菌相比,突变菌并没有因为ppk基因的缺失而明显丧失聚磷能力(Fraley et al.,2007).分析原因可能是PPK活性丧失,使细胞内poly-P链长发生改变而引起细胞功能的减弱或缺失.菌体细胞内可能还存在另一个与poly-P合成相关的基因或者其它选择性途径.王智敲除了中华根瘤菌的ppx基因,发现其摄磷能力大幅度提高(王智,2008).
4 结论与展望(Conclusion and future work)尽管与生物体磷代谢有关的转运与酶学调控机制已做了一些研究,也取得了一定的成就,但还存在以下不足:①转运方式.目前公认的转运方式有两种—Pit和Pst,对它们的认识尚不深入,是否还有其它的方式,还需进一步研究;②聚磷相关酶.PPK和PPX在生物体磷代谢过程中发挥着重要作用,但从目前的研究进展看还存在各种矛盾:生物体内PPK和PPX活性的变化是否会受到营养条件的限制和同一营养条件下一种酶活性的上调是否会影响到另一种酶的活性;就酶的活性中心位置目前还不统一;③工程实践性.目前关于微生物酶学调控的研究多拘泥于纯种微生物,很少将视角转移到如强化生物除磷系统(EBPR)中的混合微生物菌群.关于PPK和PPX在活性污泥中的变化规律及其基因表达水平等的研究更是鲜见.因此笔者结合国内外有关生物聚磷行为及相关酶研究进展,提出了今后的几个研究重点.
1)应将研究视角从纯种微生物培养转移至如EBPR处理系统中的混合菌群,通过研究PPK、PPX在活性污泥中的演替变化规律,对透彻认识生物体磷代谢生化模型及除磷机理有着重要意义.
2)随着生物技术的发展,无论是FISH还是DAPI已被广泛的应用于EBPR中聚磷菌的定性和定量分析,但这些方法所涉及的探针都是依据聚磷优势菌的16S rRNA不同区段设计而成.今后,如果能够凭借生物信息学手段对生物除磷系统中所筛选出的优势菌种的磷代谢相关酶结构进行分析,找出其活性中心的共性并以此设计基因探针,对于深入认识聚磷微生物是一次突破.
3)通过对生物磷代谢过程中的关键基因—PPK和PPX的研究,运用分子生物学手段通过基因改造技术构造聚磷工程菌,对提高污水磷高效去除意义重大.
| [1] | Achb ergerová L, Nahálka J. 2014. PPK1 and PPK2—which polyphosphate kinase is older? [J]. Biologia, 69(3): 263-269 |
| [2] | Akiyama M, Crooke E, Kornberg A. 1993. An exopolyphosphatase of Escherichia coli. The enzyme and its ppx gene in a polyphosphate operon[J]. Journal of Biological Chemistry, 268(1): 633-639 |
| [3] | Alvarado J, Ghosh A, Janovitz T, et al. 2006. Origin of exopolyphosphatase processivity: fusion of an ASKHA phosphotransferase and a cyclic nucleotide phosphodiesterase homolog[J]. Structure, 14(8): 1263-1272 |
| [4] | Bond P L, Keller J, Blackall L L. 1999. Bio-P and non-bio-P bacteria identification by a novel microbial approach[J]. Water Science and Technology, 39(6): 13-20 |
| [5] | Brown M R, Kornberg A. 2008. The long and short of it-polyphosphate, PPK and bacterial survival[J]. Trends in Biochemical Sciences, 33(6): 284-290 |
| [6] | Christensson M, Blackall L, Welander T. 1998. Metabolic transformations and characterisation of the sludge community in an enhanced biological phosphorus removal system[J]. Applied Microbiology and Biotechnology, 49(2): 226-234 |
| [7] | Crocetti G R, Hugenholtz P, Bond P L, et al. 2000. Identification of polyphosphate-accumulating organisms and design of 16S rRNA-directed probes for their detection and quantitation[J]. Applied and Environmental Microbiology, 66(3): 1175-1182 |
| [8] | Choi S S, Yoo Y J. 2000. Removal of phosphate in a sequencing batch reactor by Staphylococcus auricularis[J]. Biotechnology Letters, 22(19): 1549-1552 |
| [9] | Díaz M, Sevillano L, Rico S, et al. 2013. High level of antibiotic production in a double polyphosphate kinase and phosphate-binding protein mutant of Streptomyces lividans[J]. FEMS Microbiology Letters, 342(2): 123-129 |
| [10] | 丁艳, 王冬波, 李小明, 等. 2010. pH值对SBR单级好氧生物除磷的影响[J]. 中国环境科学, 30(3): 333-338 |
| [11] | 杜宏伟, 武俊, 肖琳, 等. 2009. 聚磷激酶基因在假单胞菌中的整合和表达[J]. 环境科学, 30(10): 3011-3015 |
| [12] | Doruk T, Avican U, Camci I Y, et al. 2013. Overexpression of polyphosphate kinase gene (ppk) increases bioinsecticide production by Bacillus thuringiensis [J]. Microbiological Research, 168(4): 199-203 |
| [13] | Fraley C D, Rashid M H, Lee S S, et al. 2007. A polyphosphate kinase 1 (ppk1) mutant of Pseudomonas aeruginosa exhibits multiple ultrastructural and functional defects[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(9): 3526-3531 |
| [14] | Fuhs G W, Chen M. 1975. Microbiological basis of phosphate removal in the activated sludge process for the treatment of wastewater [J]. Microbial Ecology, 2(2): 119-138 |
| [15] | Gómez-Garćia M R, Losada M, Serrano A. 2003. Concurrent transcriptional activation of ppa and ppx genes by phosphate deprivation in the cyanobacterium Synechocystis sp. strain PCC 6803[J]. Biochemical and Biophysical Research Communications, 302(3): 601-609 |
| [16] | Hirota R, Kuroda A, Kato J, et al. 2010. Bacterial phosphate metabolism and its application to phosphorus recovery and industrial bioprocesses[J]. Journal of Bioscience and Bioengineering, 109(5): 423-432 |
| [17] | Hossain M M, Tani C, Suzuki T, et al. 2008. Polyphosphate kinase is essential for swarming motility, tolerance to environmental stresses, and virulence in Pseudomonas syringae pv. tabaci 6605[J]. Physiological and Molecular Plant Pathology, 72(4/6): 122-127 |
| [18] | 黄金玲, 魏峥, 于常海. 2014. 多聚磷酸相关蛋白结构及生物学功能[J]. 中国生物化学与分子生物学报, 30(2): 115-124 |
| [19] | Ishige K, Zhang H Y, Kornberg A. 2002. Polyphosphate kinase (PPK2), a potent, polyphosphate-driven generator of GTP [J]. Proceedings of the National Academy of Sciences of the United States of America, 99(26): 16684-16688 |
| [20] | Gangaiah D, Liu Z, Arcos J, et al. 2010. Polyphosphate kinase 2: a novel determinant of stress responses and pathogenesis in Campylobacter jejuni [J]. PLoS One, 5(8): e12142 |
| [21] | Kornberg A. 1999. Inorganic polyphosphate: a molecule of many functions[M]. New York: Springer. 1-18 |
| [22] | Kristensen O, Laurberg M, Liljas A, et al. 2004. Structural characterization of the stringent response related exopolyphosphatase/ guanosine pentaphosphate phosphohydrolase protein family[J]. Biochemistry, 43(28): 8894-8900 |
| [23] | Kristensen O, Ross B, Gajhede M. 2008. Structure of the PPX/GPPA phosphatase from Aquifex aeolicus in complex with the alarmone ppGpp[J]. Journal of Molecular Biology, 375(5): 1469-1476 |
| [24] | Kuroda A, Tanaka S, Ikeda T, et al. 1999. Inorganic polyphosphate kinase is required to stimulate protein degradation and for adaptation to amino acid starvation in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 96(25): 14264-14269 |
| [25] | Kuroda A, Nomura K, Ohtomo R, et al. 2001. Role of inorganic polyphosphate in promoting ribosomal protein degradation by the Lon protease in E. coli[J]. Science, 293(5530): 705-708 |
| [26] | Klauth P, Pallerla S R, Vidaurre D, et al. 2006. Determination of soluble and granular inorganic polyphosphate in Corynebacterium glutamicum [J]. Applied Microbiology and Biotechnology, 72(5): 1099-1106 |
| [27] | Lee S J, Lee Y S, Lee Y C, et al. 2006. Molecular characterization of polyphosphate (PolyP) operon from Serratia marcescens[J]. Journal of Basic Microbiology, 46(2): 108-115 |
| [28] | Lee S J, Lee Y S, Lee S C, et al. 2009. Molecular cloning and analysis of phosphate specific transport (pst) operon from Serratia marcescens KCTC 2172 [J]. Journal of Life Science, 19(5): 566-572 |
| [29] | Lemos P C, Viana C, Salgueiro E N, et al. 1998. Effect of carbon source on the formation of polyhydroxyalkanoates (PHA) by a phosphate-accumulating mixed culture[J]. Enzyme and Microbial Technology, 22(8): 662-671 |
| [30] | Lötter L H. Murphy M. 1985. The identification of heterotrophic bacteria in an activated sludge plant with particular reference to polyphosphate accumulation [J]. Water Science Application, 11(4): 179-184 |
| [31] | 李波, 刘卫东, 刘娟, 等. 2009. 高效除磷工程菌Pseudomonas putida GM6-PPK1的构建及其除磷能力研究[J]. 土壤, 41(4): 600-606 |
| [32] | 刘燕, 陈银广, 周琪, 等. 2006. 强化生物除磷系统中生化机理研究进展[J]. 水处理技术, 32(5): 1-4 |
| [33] | Mino T, Van Loosdrecht M C M, Heijnen J J. 1998. Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research, 32(11): 3193-3207 |
| [34] | Nocek B, Kochinyan S, Proudfoot M, et al. 2008. Polyphosphate-dependent synthesis of ATP and ADP by the family-2 polyphosphate kinases in bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(46): 17730-17735 |
| [35] | Nakamura K, Hiraishi A, Yoshimi Y, et al. 1995. Microlunatus phosphovorus gen. nov., sp. nov., a new gram-positive polyphosphate-accumulating bacterium isolated from activated sludge[J]. International Journal of Systematic Bacteriology, 45(1): 17-22 |
| [36] | Nguyen H T T, Nielsen J L, Nielsen P H. 2012. ‘Candidatus Halomonas phosphatis’, a novel polyphosphate-accumulating organism in full-scale enhanced biological phosphorus removal plants [J]. Environmental Microbiology, 14(10): 2826-2837 |
| [37] | 南亚萍, 袁林江, 吕婧, 等. 2011. 两株不同大肠杆菌菌株释磷聚磷特性研究[J]. 西北大学学报(自然科学版), 41(4): 637-642 |
| [38] | 南亚萍, 袁林江, 何志仙, 等. 2012. 生物除磷过程中活性污泥聚磷酶活性的变化[J]. 中国给水排水, 28(9): 26-29 |
| [39] | 南亚萍, 袁林江, 王洋. 2013. 金黄色葡萄球菌聚磷特性研究[J]. 环境科学学报, 33(4): 1028-1034 |
| [40] | Oehmen A, Lemos P C, Carvalho G, et al. 2007. Advances in enhanced biological phosphorus removal: from micro to macro scale[J]. Water Research, 41(11): 2271-2300 |
| [41] | Ohtake H, Takahashi K, Tsuzuki Y, et al. 1985. Uptake and release of phosphate by a pure culture of Acinetobacter calcoaceticus [J]. Water Research, 19(12): 1587-1594 |
| [42] | Qiu X F, Wang T W, Zhong X M, et al. 2012. Screening and characterization of an aerobic nitrifying-denitrifying bacterium from activated sludge [J]. Biotechnology and Bioprocess Engineering, 17(2): 353-360 |
| [43] | 彭永臻, 刘智波, Mino T. 2006. 污水强化生物除磷的生化模型研究进展[J]. 中国给水排水, 22(4): 1-5 |
| [44] | Rangarajan E S, Nadeau G, Li Y G, et al. 2006. The structure of the Exopolyphosphatase (PPX) from Escherichia coli O157: H7 suggests a binding mode for long polyphosphate chains[J]. Journal of Molecular Biology, 359(5): 1249-1260 |
| [45] | Rao N N, Kornberg A. 1996. Inorganic polyphosphate supports resistance and survival of stationary-phase Escherichia coli[J]. Journal of Bacteriology, 178(5): 1394-1400 |
| [46] | Rao N N, Gómez-García M R, Kornberg A. 2009. Inorganic polyphosphate: essential for growth and survival [J]. Annual Review of Biochemistry, 78: 605-647 |
| [47] | Reddy T, Bux F. 2004. The effect of media on evaluating the phosphate uptake capacity of activated sludge bacterial isolates [J]. Water Science Application, 28(2): 159-164 |
| [48] | Shi T Y, Ge Y, Zhao N, et al. 2015. Polyphosphate kinase of Lysinibacillus sphaericus and its effects on accumulation of polyphosphate and bacterial growth[J]. Microbiological Research, 172: 41-47 |
| [49] | Shiba T, Tsutsumi K, Yano H, et al. 1997. Inorganic polyphosphate and the induction of rpoS expression [J]. Proceedings of the National Academy of Sciences of the United States of America, 94(21): 11210-11215 |
| [50] | Stante L, Cellamare C M, Malaspina F, et al. 1997. Biological phosphorus removal by pure culture of Lampropedia spp[J]. Water Research, 31(6): 1317-1324 |
| [51] | 石廷玉, 王怀林, 谢建平. 2011. 多聚磷酸盐及其代谢酶的研究进展[J]. 生理科学进展, 42(3): 181-187 |
| [52] | Sudiana I M, Mino T, Satoh H, et al. 1998. Morphology in situ characterization with rDNA targetted probes and respiratory quinone profiles of enhanced biological phosphorus removal sludge[J]. Water Science Technology, 38(8/9): 69-76 |
| [53] | Sureka K, Sanyal S, Basu J, et al. 2009. Polyphosphate kinase 2: a modulator of nucleoside diphosphate kinase activity in mycobacteria[J]. Molecular Microbiology, 74(5): 1187-1197 |
| [54] | Van Dien S J, Keasling J D. 1999. Control of polyphosphate metabolism in genetically engineered Escherichia coli[J]. Enzyme and Microbial Technology, 24(1/2): 21-25 |
| [55] | Van Veen H W, Abee T, Kortstee G J, et al. 1994. Generation of a proton motive force by the excretion of metal-phosphate in the polyphosphate-accumulating Acinetobacter johnsonii strain 210A[J]. Journal of Biological Chemistry, 269(47): 29509-29514 |
| [56] | Van Veen H W. 1997. Phosphate transport in prokaryotes: molecules, mediators and mechanisms[J]. Antonie Van Leeuwenhoek, 72(4): 299-315 |
| [57] | Wu H, Kosaka H, Kato J, et al. 1999. Cloning and characterization of Pseudomonas putida genes encoding the phosphate-specific transport system [J]. Journal of Bioscience and Bioengineering, 87(3): 273-279 |
| [58] | 王海燕, 周岳溪, 蒋进元. 2005. 强化生物除磷系统的微生物种群及其表征技术[J]. 微生物学通报, 32(1): 118-122 |
| [59] | 王勤, 赵庆顺, 肖琳, 等. 2006. 转聚磷激酶基因的大肠杆菌去除水体中的磷[J]. 中国环境科学, 26(6): 742-745 |
| [60] | 王智. 2008. 磷代谢关键基因的克隆及高效聚磷工程菌构建的研究[D]. 北京: 中国农业科学院. 36-48 |
| [61] | 魏峥, 聂琰晖, 刘乐庭, 等. 2009. 多聚磷酸盐在原核和真核生物中的研究进展[J]. 生理科学进展, 40(3): 197-202 |
| [62] | 吴昌永. 2010. A2/O工艺脱氮除磷及其优化控制的研究[D]. 哈尔滨: 哈尔滨工业大学 |
| [63] | 吴蕾, 宋志文, 温少鹏, 等. 2007. 生物除磷微生物研究进展[J]. 四川环境, 26(3): 94-98 |
| [64] | 徐立杰, 郭春艳, 彭永臻, 等. 2011. 强化生物除磷系统的微生物学及生化特性研究进展[J]. 应用与环境生物学报, 17(3): 427-434 |
| [65] | Yeoman S, Stephenson T, Lester J N, et al. 1988. The removal of phosphorus during wastewater treatment: a review[J]. Environmental Pollution, 49(3): 183-233 |
| [66] | Yang X P, Wang S M, Zhang D W, et al. 2011. Isolation and nitrogen removal characteristics of an aerobic heterophic nitrifying-denitrifying bacterium, Bcaillus subtilis A1[J]. Bioresource Technology, 102(2): 854-862 |
| [67] | 杨勇光. 2010. 碳源种类对反硝化除磷系统的影响及反硝化聚磷菌(DPB)的分离 . 重庆: 重庆大学 |
| [68] | Zilles J L, Peccia J, Kim M-W, et al. 2002. Involvement of rhodocyclus-related organisms in phosphorus removal in full-scale wastewater treatment plants[J]. Applied and Environmental Microbiology, 68(6): 2763-2769 |
| [69] | Zhang H Y, Gómez-García M R, Shi X B, et al. 2007. Polyphosphate kinase 1, a conserved bacterial enzyme, in a eukaryote, Dictyostelium discoideum, with a role in cytokinesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(42): 16486-16491 |
| [70] | 张自杰, 林荣忱, 金儒霖. 2000. 排水工程 [M]. 北京: 中国建筑工业出版社. 315-320 |
| [71] | 张培玉, 孙梦, 张晨. 2011. 一株嗜盐聚磷菌的筛选及除磷性能初探 [J]. 环境科学学报, 31(11): 2368-2373 |
| [72] | 庄志刚, 韩永和, 章文贤, 等. 2014. 高效聚磷菌Alcaligenes sp. ED-12菌株的分离鉴定及其除磷特性[J]. 环境科学学报, 34(3): 678-687 |
 2015, Vol. 35
2015, Vol. 35


