随着纳米材料的工业化及商业化,大量的纳米材料被开发应用到生产生活当中.纳米TiO2(nTiO2)作为一种常见的纳米材料被广泛应用于涂料、抗老化、污水净化、化妆品等方面(Nowack and Bucheli, 2007).在生产、运输、使用、废弃等过程中nTiO2都可能被释放到环境中.大量研究表明nTiO2会对皮肤、细胞及DNA造成损伤(Rahman et al., 2002).nTiO2对生态系统中的水相生物、土壤细菌、动物也存在一定毒理学作用(Bang et al., 2011; Chen et al., 2004; Wilson et al., 2008).nTiO2在环境中的归宿和毒性效应均与其在环境中的移动行为密切相关(Batley et al., 2013).因此,充分了解nTiO2在环境中的移动能力,全面评估nTiO2对环境及人类健康的潜在风险是十分必要的.
nTiO2在环境中的移动性与其悬浮稳定性密切相关.一般nTiO2的稳定性越好,在环境中的移动能力越强.腐殖酸能增加纳米材料的稳定性,并有利于纳米材料在多孔介质中的迁移(禇灵阳等,2011;Chen et al., 2012).在nTiO2生产加工过程中通常会加入表面活性剂使其保持良好的稳定性(Tkachenko et al., 2006).这种表面改性后的nTiO2往往表现出更强的移动能力.Godinez和Darnault(2011)研究指出,当pH接近nTiO2的等电荷零点时,nTiO2会发生明显的团聚,而表面活性剂的包裹则降低了nTiO2团聚体的水力学直径,增加了nTiO2在石英砂中的迁移能力.Godinez等(2013)研究了离子强度和表面活性剂的耦合作用,结果表明高离子强度会导致nTiO2发生严重的团聚使其在石英砂中迁移时发生明显的沉积,而表面活性剂改性后的nTiO2能削弱离子强度的作用,使nTiO2具有更好的悬浮稳定性,从而在石英砂中表现出了更强的迁移能力.纳米材料的高移动性会大大增加其对环境安全的风险,并有可能促进环境中污染物的迁移(方婧和温蓓,2011;方婧等,2011).
国内外研究者们最初针对纳米材料悬浮体系中的水溶液化学性质(如:pH、离子强度、离子类型、有机质)对纳米材料稳定性的影响开展了大量的研究工作(吴其圣等,2012;French et al., 2009; Buettner et al., 2010; Domingos et al., 2009).近几年,有研究开始深入到粘土矿物对纳米材料悬浮稳定性的影响.Zhou等(2012)通过研究蒙脱石在不同pH条件下对Ag和TiO2稳定性的影响,指出当pH低于蒙脱石边缘部分的等电荷点时,会降低Ag和TiO2的稳定性.同时,随着离子强度的升高,蒙脱石降低两种纳米材料稳定性的作用会越强烈.Han等(2008)考察了蒙脱石、高岭石对表面活性剂悬浮的多壁碳纳米管稳定性的影响.结果表明两种粘土矿物对SDBS悬浮的多壁碳纳米管的稳定性没什么影响,但会显著降低CTAB悬浮的多壁碳纳米管的稳定性.由此可见,粘土矿物可以作为纳米材料净化修复材料,降低纳米材料在环境中的扩散.然而,自然环境中的土壤颗粒对纳米材料悬浮稳定性能的影响至今未被探讨.土壤颗粒是土壤体系的主要组成部分,含有矿物质、有机质及有机无机复合体等复杂成分.我们推测其组分的多样性会直接降低纳米材料在环境中的稳定性和移动性,使纳米材料被大量截留于土壤颗粒上,有利于增加自然环境对纳米材料的抗冲击能力.
因此,本研究选取自然环境采集的土壤和3种类型表面活性剂(十二烷基苯磺酸钠、辛烷基酚聚氧乙醚、十六烷基三甲基溴化铵),在有表面活性剂和不含表面活性剂两种情况下,分别研究土壤颗粒对nTiO2悬浮液稳定性的作用机制,以期为nTiO2在水相及土壤中的环境行为及其生态风险评估提供理论依据.
2 材料与方法(Materials and methods) 2.1 土壤和石英砂本实验所用土壤采自杭州市的公园土,土壤深度为0~20 cm.将所采集的土壤风干,去除石块及植物残体等大颗粒杂质,过1 mm筛,装入密封袋中备用.土壤性质的测定参考Fang 等(2009)的方法,试验土壤的主要性质如表 1所示.实验使用的石英砂购买自上海凌峰化学试剂有限公司,由99.8%的SiO2和痕量的金属氧化物组成,平均颗粒直径为325 μm,Zeta电位为-31 mV.
| 表 1 供试土壤的基本物理化学性质 Table 1 The physical and chemical properties of the tested soil |
nTiO2粉末购买自杭州万景新材料公司,其中含锐钛矿型99.9%、比表面积为32.5 m2 · g-1、初始颗粒大小为80 nm.nTiO2稳定悬浮液的制备方法参考Fang等(2009).取4 g nTiO2粉末于烧杯中加2000 mL去离子水搅拌均匀,之后将nTiO2混合液超声30 min,在干燥阴凉处静置10 d.nTiO2在去离子水中沉淀10 d以后的悬浮液被收集起来作为本实验用的nTiO2稳定悬浮液的储备液,该储备液具有良好的稳定性,能稳定悬浮30 d以上.nTiO2的电位和粒径用Zetasizer(Nano-ZS90,Malvern,Engl and )测定.悬浮液中nTiO2的浓度测定参照Zhang等(2007)的方法,首先将nTiO2悬浮液(5 mL)在三角瓶中缓慢加热烘干,然后加入5 mL硫酸-硫酸铵消解液进行消解.将上述消解液定容,用ICP-OES测定其钛离子浓度,则nTiO2的浓度就可以根据钛离子的浓度计算出来了.
2.3 nTiO2沉淀实验nTiO2沉淀实验所用的nTiO2悬浮液是经过nTiO2稳定悬浮储备液稀释而来,其中nTiO2浓度约为72 mg · L-1.本实验选取了3种广泛使用的表面活性剂分别为阴离子表面活性剂——十二烷基苯磺酸钠(SDBS)、非离子表面活性剂——辛烷基酚聚氧乙醚(TX-100)、阳离子表面活性剂——十六烷基三甲基溴化铵(CTAB).3种表面活性剂的临界胶束浓度(CMC)分别为1.2、0.2、1.0 mmol · L-1.
首先考察去离子水体系中表面活性剂对nTiO2悬浮液稳定性的影响.对于每种表面活性剂而言,取4个250 mL 烧杯分别编号为1、2、3、4号,每个烧杯中加入250 mL nTiO2悬浮液(起始浓度记为C0),然后分别加入一定量的表面活性剂使体系中的表面活性剂浓度为0、0.1、0.5、1.0 CMC,充分混合后静置,每隔0.5 h在200 mL刻度线处取样2.5 mL测定悬浮液中nTiO2浓度(记为C),持续监测9 h.以C/C0的比值变化表示nTiO2的浓度的变化.
其次,考察土壤颗粒对nTiO2悬浮液稳定性的影响.12.5 g土壤加入到一系列250 mL nTiO2悬浮液(起始浓度记为C0)中,其中纳米TiO2悬浮液分别含有0、0.1、0.5、1.0 CMC 的表面活性剂,搅拌均匀静置,每隔一定时间在200 mL刻度线处取样2.5 mL,测定nTiO2浓度(记为C).nTiO2的沉淀动力学过程通过其在上层悬浮液中浓度的减少量来考察.nTiO2浓度用硫酸-硫酸铵消解后通过ICP-OES测定其浓度,CTAB存在体系除外.CTAB存在时,悬浮液样品消解后会发黑导致无法用ICP-OES测定.因此采用分光光度法来测定其中的纳米TiO2的浓度.nTiO2的吸光度用721分光光度计在550 nm波长下测定.预实验表明在浓度为0~72 mg · L-1范围内,nTiO2的吸光度与浓度呈良好的线性关系.同时,设置不含nTiO2的土壤-CTAB溶液作为控制组.悬浮液中nTiO2的浓度即通过土壤-CTAB-nTiO2测得的吸光度与土壤-CTAB测得的吸光度之间的差值计算而来.
所有试验均设置不含nTiO2的土壤-表面活性剂体系作为控制组.控制组主要是考察表面活性剂对土壤颗粒本身沉淀过程的影响.土壤沉淀过程中,悬浮液中土壤颗粒的浓度采用分光光度法在550 nm处测定其吸光度(记为A),起始土壤悬浮液的吸光度记为A0.具体做法是12.5 g土壤加入到一系列250 mL去离子水中,其中分别含有0、0.1、0.5、1.0 CMC 的表面活性剂,搅拌均匀静置,每隔一定时间在200 mL刻度线处取样2.5 mL,测定悬浮液的吸光度记为A.同时,采用硫酸-硫酸铵消解法测定样品中nTiO2浓度作为试验的控制背景.所有试验均设两组平行.试验组测定的nTiO2浓度扣除控制背景浓度即为实际的nTiO2浓度,记为C.以时间为横坐标,C/C0为纵坐标绘制nTiO2的沉淀动力学曲线.
此外,为了更好地探讨土壤颗粒对nTiO2悬浮稳定性的影响机制,我们考察了成分相对单一的石英砂碰撞作用对nTiO2稳定性的影响.称取12.5 g石英砂加入到一系列250 mL nTiO2悬浮液(起始浓度记为C0)中,其中纳米TiO2悬浮液分别含有0、0.1、0.5、1.0 CMC 的表面活性剂.由于石英砂可以在1分钟内完全沉淀至烧杯底部,因此nTiO2沉淀实验过程始终采用搅拌形式,每隔一定时间在200 mL刻度线取样2.5 mL,测定nTiO2浓度.我们还考察了土壤溶液对nTiO2稳定性的影响.准备一系列125 mL nTiO2悬浮液,加入一定量的表面活性剂使体系中的表面活性剂浓度为0、0.1、0.5、1.0 CMC,然后加入125 mL土壤溶液,充分混合后静置(起始浓度记为C0),土壤溶液由一定量的土壤与去离子水按水土比1 ∶ 20(质量比)混合后经0.45 μm滤膜过滤获得.每隔0.5 h在200 mL刻度线处取样2.5 mL测定悬浮液中nTiO2浓度(记为C),持续监测9 h.以C/C0的比值变化表示nTiO2的浓度的变化.
2.4 表面活性剂在土壤、石英砂和nTiO2上的吸附实验表面活性剂在土壤和石英砂上的吸附实验参考陈宝梁(2004)的方法,在15 mL离心管中,分别加入0.2 g土样或石英砂、10 mL一系列浓度的表面活性剂溶液(50~600 mg · L-1),盖紧盖子;在25 ℃和150 r · min-1条件下振荡24 h,振荡结束后以6000 g离心15 min.取离心后的上层清液用紫外-可见分光光度计测定其浓度.TX-100、SDBS和CTAB的平衡浓度分别用紫外-可见分光光度计在275 nm、223 nm、210 nm处的吸光度值表征,经空白校正后,计算表面活性剂的平衡浓度,用差减法计算表面活性剂的吸附量;实验平行两次,平衡浓度和吸附量取平均值后绘制吸附等温线.
表面活性剂在nTiO2上的吸附试验参考Tkachenko等(2006)的方法,在15 mL离心管中,加入10 mL nTiO2(72 mg · L-1),然后加入一定量的表面活性剂,盖紧盖子;在25 ℃和150 r · min-1条件下振荡24 h,振荡结束后以10000 g离心20 min,过0.22 μm滤膜.取过膜后的滤液用紫外-可见分光光度计测定其浓度.TX-100、SDBS和CTAB的平衡浓度分别用紫外-可见分光光度计在275 nm、223 nm、210 nm处的吸光度值表征,经空白校正后,计算表面活性剂的平衡浓度,用差减法计算表面活性剂的吸附量;实验平行两次,平衡浓度和吸附量取平均值后绘制吸附等温线.
2.5 XDLVO/DLVO能量计算DLVO理论描述胶体颗粒之间的相互作用力主要考虑了范德华力和静电力.DLVO理论将颗粒之间的总势能表示为(Derjaguin and Landau, 1941; Verwey and Overbeek, 1948):

式中,Vtotal、 Velec 和 Vvdw分别是颗粒之间的总势能、静电力和范德华力.通常,Vtotal、 Velec 和 Vvdw均除以Boltzmann常数(k = 1.38 × 10-23 J · K-1)和绝对温度(T)以无量纲的形势表示.
颗粒之间的静电作用可表示为:
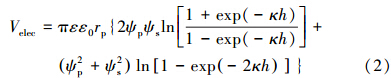
式中,ε为水的相对介电常数(78.5);ε0为真空的绝对介电常数(8.854×10-12 C2 · N-1 · m-2);rp 是nTiO2的平均粒径;ψp和ψs分别是nTiO2和土壤的表面电势;h是nTiO2和土壤颗粒表面之间的距离(nm);κ是Debye参数.
颗粒之间的范德华力可以表示为:
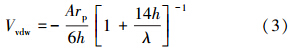
式中,λ为特征波长(100 nm);A为Hamaker常数(1×10-20).
由于表面活性剂的吸附提供的附加作用力,2个颗粒之间变得不易发生团聚的现象已被很多研究论证.因此本研究中考虑了表面活性剂的渗透作用(Vosm)和弹性排斥力(Veles),对于均包裹有表面活性剂的颗粒可表示为(Phenrat et al. 2008; Liang et al., 2013):
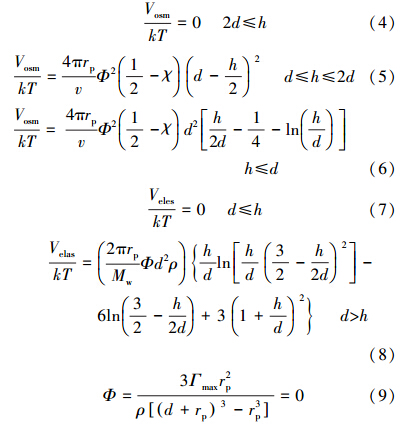
式中:Ф为表面活性剂包裹的体积分数;d为吸附层厚度(TX-100:1.31 nm,SDBS:10 nm,CTAB:3.2 nm)(Liang et al., 2009; Muller et al., 1998; Yuan et al., 2002);Гmax为表面活性剂的最大吸附浓度(TX-100:1.0 mg · m-2,SDBS:10.0 mg · m-2,CTAB:1.5 mg · m-2)(Tkachenko et al., 2006; Li and Tripp, 2004);χ 为弗洛里赫金斯参数(0.45);Mw为表面活性剂的摩尔质量(TX-100:628 g · mol-1,SDBS: 348.48 g · mol-1,CTAB: 364.45 g · mol-1);ρ为表面活性剂吸附层的密度(TX-100:0.98 g · cm-3,SDBS: 1.1 g · cm-3,CTAB: 0.95 g · cm-3);v为水分子体积(0.03 nm3)(Wang et al., 2012).
对于包裹有表面活性剂的nTiO2和没有吸附表面活性剂的土壤表面之间的渗透作用和弹性排斥力可表示为(Song et al., 2011):
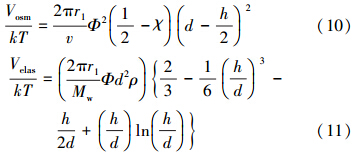
因此,XDLVD计算的总势能(VT)为:
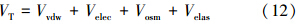
在不同体系中,nTiO2的Zeta电位如表 2所示.当体系中不含表面活性剂时,nTiO2的Zeta电位为-36.2 mV,具有较高的负电性.作为一种非离子型表面活性剂,TX-100的吸附会掩蔽nTiO2表面一些负电荷位点,但这种吸附对Zeta电位的影响十分微弱,含有TX-100的nTiO2的Zeta电位依然保持较高的负电性,其数值为-33.9~-35.9 mV.作为一种阴离子表面活性剂,SDBS显著增加了nTiO2的Zeta电位的负电性,其数值为-46.1~-47.9 mV.在阳离子表面活性剂CTAB体系中,nTiO2的Zeta电位由负电性转为带正电,同时随着体系中CTAB浓度的升高而明显增加.0.1、0.5、1.0 CMC CTAB体系中,nTiO2的Zeta电位分别为24.7 mV、30.2 mV、51.2 mV.
| 表 2 nTiO2的性质及XDLVO/DLVO理论计算 Table 2 Properties of nTiO2 and energy barrier as calculated by XDLVO/DLVO theory |
XDLVO/DLVO能量计算结果显示(表 2),当没有表面活性剂时,nTiO2- nTiO2、nTiO2-土壤颗粒及nTiO2-石英砂之间的能垒分别为210 kT、59.8 kT、144.3 kT,但它们的第二极小值数值均为正值.nTiO2和nTiO2以及nTiO2和石英砂之间的作用能垒相对较高(大于100 kT),颗粒的碰撞作用很难克服能垒作用而发团聚.因此,nTiO2不易发生自团聚,且石英砂表面不利于nTiO2沉积.而nTiO2和土壤颗粒之间的能垒相对较低(59.8 kT),nTiO2与土壤颗粒的碰撞作用可能导致其在与土壤颗粒表面发生沉积.当体系中存在TX-100时,nTiO2-nTiO2、nTiO2-土壤颗粒及nTiO2-石英砂之间的能垒分别为4.9×103 kT、0.6×103 kT、0.7×103 kT.TX-100的空间阻力作用是导致颗粒间能垒升高的主要原因(Godinez and Darnault, 2011).SDBS不仅能通过空间位阻作用稳定nTiO2,还可以通过增加nTiO2表面的负电性,从而增大颗粒之间的排斥力来稳定nTiO2.如表 2所示,SDBS体系中的nTiO2-nTiO2、nTiO2-土壤颗粒及nTiO2-石英砂之间的能垒分别(6.0~6.1)×105 kT、0.6×105 kT、0.6×105 kT.这说明,单从能量的角度来看,TX-100和SDBS的存在将显著增强nTiO2在去离子水、土壤和石英砂体系中的悬浮稳定性.对于阳离子表面活性剂CTAB体系而言,nTiO2-nTiO2、nTiO2-土壤颗粒及nTiO2-石英砂之间的能垒也比较高(800~2.4×105 kT),但nTiO2-土壤颗粒和nTiO2-石英砂之间的第二极小值出现了显著的负值.0.1、0.5、1.0 CMC CTAB条件下,nTiO2-土壤颗粒之间的第二极小值分别为-188.6 kT、-244.8 kT、-541.5 kT.nTiO2-石英砂之间的第二极小值分别为-323.6 kT、-406.9 kT、-829.4 kT.第二极小值为负值,表明颗粒之间在第二极小值位置不存在能垒,即颗粒之间十分容易发生团聚,尽管这一作用是可逆的(Tufenkji and Elimelech, 2005).因此,由于第二极小值的作用,CTAB悬浮的nTiO2十分容易在土壤颗粒或石英砂表面发生异质性团聚或沉积.
3.2 去离子水体系中表面活性剂对nTiO2悬浮液稳定性的影响图 1是nTiO2在分别含有TX-100、SDBS、CTAB的去离子水体系中沉淀动力学.可以发现,不管是否含表面活性剂,nTiO2几乎没有发生沉淀作用.C/C0始终保持在96%~99%,表明nTiO2非常稳定.这与XDLVO/DLVO能量计算的结果一致,无论有无表面活性剂存在下,nTiO2-nTiO2的能垒都很高,nTiO2很难发生自团聚而沉淀.静电排斥力和空间位阻作用是稳定nTiO2的重要原因.
 |
| 图 1 含有TX-100(a)、SDBS(b)、CTAB(c)去离子水体系中nTiO2的沉淀动力学 Fig. 1 Sedimentation kinetics of nTiO2 in deionized water system with surfactants TX-100(a),SDBS(b) and CTAB(c) |
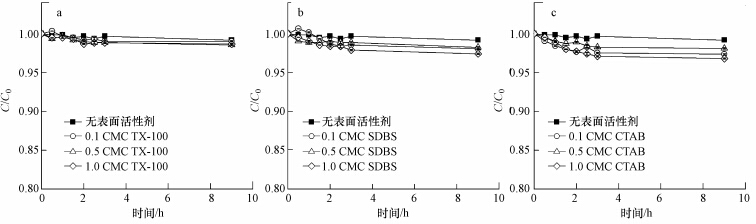
如图 2a~c所示,当体系中不含表面活性剂时,土壤颗粒的存在显著加速了nTiO2的沉淀.nTiO2的沉淀过程,包括一段快速沉淀期和一段悬浮稳定期.在0~1 h,上层悬浮液中nTiO2浓度迅速下降,降为最初的0.86,显著低于去离子水体系中的0.99.在1~9 h,上层悬浮液中nTiO2浓度基本保持稳定(C/C0=0.86).此外,需要指出的是,如图 2c所示,用分光光度计获得的nTiO2的沉淀动力学曲线与图 2a,b中用ICP-OES测得的nTiO2的沉淀动力学曲线数值十分接近,表明用分光光度法测nTiO2的沉淀动力学方法也是可靠的.
 |
| 图 2 nTiO2在土壤颗粒存在下沉淀动力学曲线(a、b、c)和土壤颗粒本身沉淀动力学曲线 (d、e、f) Fig. 2 Sedimentation kinetics of soil particles(a,b,and c) and sedimentation kinetics of nTiO2 in the presence of soil particles(d,e,and f) |
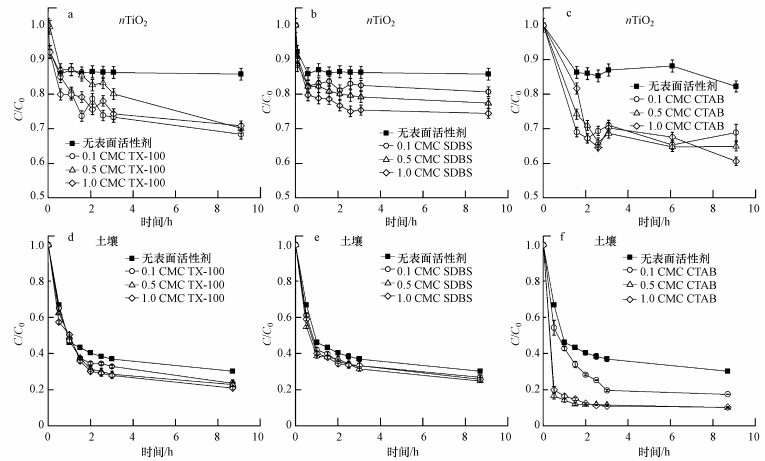
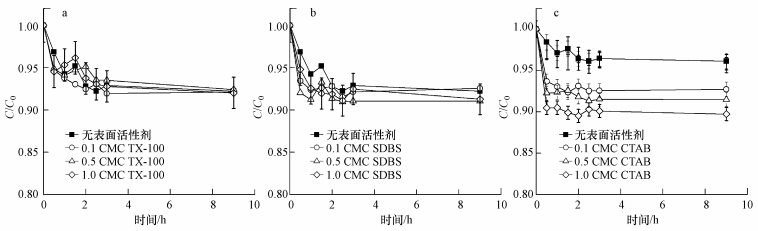
由于nTiO2本身在去离子水体系中能稳定悬浮,因此在土壤体系中nTiO2的脱稳沉淀与土壤颗粒的沉淀行为密切相关.如图 2d~f所示,土壤颗粒的沉淀过程包括一段快速沉淀期和一段慢速沉淀期.在0~1 h,由于大颗粒的快速沉淀,土壤悬浮液的吸光度降为最初的46%.在随后的1~9 h,土壤中粉粒和粘粒等小颗粒的慢速沉淀使吸光度缓慢地下降并最终降低至最初的30%.由此可见,nTiO2的快速沉淀期与土壤颗粒的快速沉淀期一致,说明nTiO2与土壤中的大颗粒(砂粒)发生了共沉淀.而在土壤小颗粒的慢速沉淀期(1~9 h),nTiO2并没有发生进一步沉降,说明nTiO2可能没有与土壤小颗粒发生共沉淀.这一推测通过SEM观察获得了确认.如图 3a和图 3b所示.在没有表面活性剂体系中,nTiO2主要吸附在土壤的大颗粒表面,仅仅只有很少的nTiO2在小颗粒上被发现.土壤大颗粒一般多为砂粒,因此进一步研究了石英砂对nTiO2悬浮稳定性的影响.如图 4所示,石英砂增加了nTiO2的沉淀性能.在0~1 h,上层悬浮液中nTiO2浓度迅速下降,降为最初的0.94,在随后的1~9 h,基本保持稳定(C/C0:0.92~0.94).这一结果表明,大颗粒的碰撞作用的确能降低nTiO2悬浮稳定性,且这种降低作用集中在最初的1 h之内.此外,石英砂的降低作用要弱于土壤颗粒,这可能与土壤的异质性、粗糙度高有关.土壤颗粒表面的金属氧化物往往带正电荷,有利于带负电荷的nTiO2发生沉积,同时土壤颗粒表面的粗糙结构会使nTiO2在运动过程中容易被土壤颗粒捕获.另外,土壤颗粒中的有机质及阳离子的溶出也可能改变nTiO2的悬浮稳定性,因此我们还考察了土壤溶液对nTiO2的悬浮稳定性影响.如图 5所示,实验结果表明nTiO2在土壤溶液中均保持良好的悬浮稳定性(C/C0>0.95).土壤或表面活性剂也 可能改变nTiO2悬浮体系的pH,特别是当pH接近等电荷点时,nTiO2就可能发生严重的团聚.然而,本实验中nTiO2、土壤和TX-100(或CTAB)三元复合体系中pH基本为中性(6.98~7.13),与nTiO2悬浮液本身的pH(7.1)差别十分微小.当体系中含有SDBS时,pH呈碱性(9.18~10.41),而碱性的环境条件会增加nTiO2的负电性,有利于nTiO2的悬浮稳定(Godinez and Darnault, 2011),因此实验过程中pH的变化对nTiO2悬浮稳定性的影响是可以忽略不计的.综上所述,我们认为nTiO2与土壤颗粒的共沉淀是其脱稳的主要原因.
 |
| 图 3 土壤溶液体系沉淀过程中nTiO2的扫描电镜图:不含表面活性剂(a、b);含TX-100(c、d) Fig. 3 Scanning electron microscope of nTiO2 during the sedimentation experiment in the soil dispersion systems sampled from suspension in the absence of surfactant(a,b) and in the presence of TX-100(c,d) |
 |
| 图 4 含表面活性剂的去离子水体系中石英砂对nTiO2沉淀性能的影响(a. TX-100、b. SDBS、c. CTAB) Fig. 4 Impact of quartz s and on the sedimentation of nTiO2 in deionized water system with surfactants(a. TX-100,b. SDBS,c. CTAB) |
 |
| 图 5 nTiO2在土壤溶液中沉淀动力学曲线(a. TX-100、b. SDBS、c. CTAB) Fig. 5 Sedimentation kinetics of nTiO2 in soil solution(a. TX-100,b. SDB,c. CTAB) |
当体系中含有表面活性剂时,土壤颗粒导致nTiO2脱稳沉淀的作用更加强烈.如图 2a~c所示,在0~1 h,悬浮的nTiO2浓度迅速降为最初浓度的79%~86%(TX-100)、78%~83%(SDBS),略低于没有表面活性剂时的86%.在CTAB体系中,土壤颗粒导致nTiO2脱稳沉淀的作用最严重.与没有表面活性剂的体系中不同,在1~9 h,nTiO2继续发生微弱的沉淀,出现一个慢速沉淀期.沉淀9 h时,表面活性剂存在下的nTiO2浓度分别为最初浓度的68%~71%(TX-100)、74%~81%(SDBS)、60%~69%(CTAB).这种慢速沉淀期与土壤颗粒的慢速沉淀期十分相似,表明在表面活性剂存在的情况下,nTiO2不仅会随着大颗粒发生共沉淀,nTiO2与土壤小颗粒也可能发生共沉淀.这一结论进一步通过SEM得到了论证.从图 3c和3d可以发现,在表面活性剂体系中,有较多的nTiO2吸附在土壤小颗粒的表面.
表面活性剂存在下,土壤颗粒存在导致nTiO2脱稳沉淀作用更加强烈的原因,一方面可能是由于表面活性剂影响了土壤颗粒的沉淀;另一方面是表面活性剂影响了nTiO2与土壤颗粒的作用力.如图 2d~f所示,表面活性剂存在下,土壤颗粒存在一段快速沉淀期和一段慢速沉淀期.TX-100和SDBS对土壤颗粒的沉淀影响较小.在1 h后,土壤颗粒悬浮液的吸光度分别下降为最初的47%~50%和39%~42%.在1~9 h,土壤颗粒继续沉降使吸光度下降并最终降低至最初的21%~24%(TX-100),25%~27%(SDBS),略低于没有表面活性剂时的30%.而阳离子表面活性剂CTAB显著加强了土壤颗粒的沉淀.在0~1 h,土壤悬浮液的吸光度迅速下降为最初的14%~42%.在1~9 h,土壤悬浮液吸光度缓慢下降并最终降低至最初的10%~17%.因此,表面活性剂加快了土壤颗粒的沉淀是导致nTiO2加速脱稳沉淀的重要原因之一.
尽管从DLVO能量来看,在TX-100和SDBS体系中,土壤颗粒表面是不利于nTiO2沉积的.但是,表面活性剂在土壤上的吸附作用可能导致表面活性剂-nTiO2更加容易与土壤颗粒结合,使更多的nTiO2与土壤颗粒发生共沉淀.如图 6所示,土壤对3种表面活性剂均具有较好的吸附能力,试验浓度范围内的最大吸附量均大于2000 mg · kg-1.同时,nTiO2对表面活性剂也具有很强的吸附能力,试验浓度范围内的最大吸附量大于500000 mg · kg-1,与Tkachenko等(2006)研究结果一致,表明体系中表面活性剂与nTiO2的结合能力非常强.表面活性剂在土壤和nTiO2上强烈的吸附作用,使得表面活性剂可能充当土壤和nTiO2相结合的媒介,促进nTiO2和土壤颗粒的异质性团聚.TX-100和SDBS亲水头吸附在nTiO2表面,疏水头则能与土壤颗粒表面的疏水位置发生作用,从而可能形成nTiO2和土壤颗粒之间的桥键作用,使更多的nTiO2与土壤颗粒共沉淀(Han et al., 2008;Rao and He, 2006).此外,土壤具有强烈的电荷异质性,土壤组成中的金属氧化物成分表面往往带正电荷,这些电荷异质性为负电荷SDBS-nTiO2提供了沉积位点,从而增加nTiO2沉淀现象.同时,SDBS自身带的钠离子可将土壤中的钙离子通过阳离子交换释放到悬浮体系中,这将促进SDBS- nTiO2的团聚而沉淀(Jafvert and Heath, 1991).对于CTAB体系而言,除了吸附作用之外,nTiO2和土壤颗粒之间存在显著的负数第二极小值,表明nTiO2能够在第二极小值位置与土壤颗粒结合,从而与土壤颗粒一起快速沉淀.
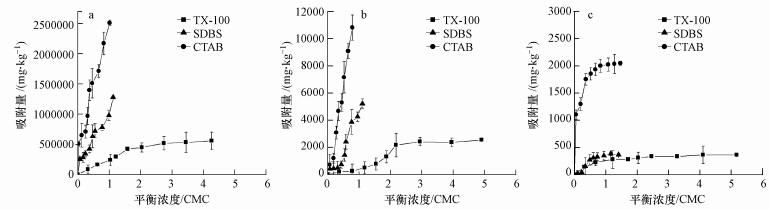 |
| 图 6 TX-100、SDBS、CTAB在nTiO2(a)、土壤(b)和石英砂(c)上的吸附等温线 Fig. 6 Sorption isotherms of TX-100、SDBS、CTAB on nTiO2(a),soil(b) and quartz s and (c) |
为了进一步证明土壤颗粒对表面活性剂的吸附作用对nTiO2沉降过程的影响机制,我们考察了石英砂对表面活性剂悬浮的nTiO2稳定性影响.如图 4所示,在CTAB存在下,石英砂显著增强了nTiO2的沉降.当体系中含有0.1、0.5、1.0 CMC的CTAB时,9 h后,C/C0分别为0.85、0.83、0.79.CTAB体系中,nTiO2-石英砂之间的第二极小值均为负值,故nTiO2与石英砂能发生异质性团聚,从而促进了nTiO2的沉淀.与在土壤颗粒体系中不同的是,TX-100和SDBS在石英砂体系中对nTiO2的沉淀几乎没有影响.我们认为这种差异与TX-100和SDBS在土壤和石英砂上的吸附能力的显著差异有关.如图 6所示,在相同的试验浓度内,TX-100和SDBS在土壤上的最大吸附量比它们在石英砂上的最大吸附量高1~2个数量级.Lu等(2013)也指出,表面活性剂在石英砂上的吸附作用是微弱的,因为石英砂缺少有利吸附位点.石英砂对表面活性剂TX-100和SDBS微弱的吸附作用,使得表面活性剂很难在nTiO2和石英砂之间形成桥键作用,从而很难促进nTiO2与石英砂发生共沉淀.
4 结论(Conclusions)当体系中不存在表面活性剂时,土壤颗粒增加了nTiO2的沉淀性能.nTiO2与土壤大颗粒的共沉淀是nTiO2沉淀的主要形式.当体系中表面活性剂存在时,表面活性剂显著增强了nTiO2与土壤颗粒的共沉淀作用.nTiO2不仅与土壤大颗粒发生共沉淀,也与土壤小颗粒发生共沉淀.表面活性剂存在下,土壤颗粒导致nTiO2脱稳沉淀的作用更加强烈的原因主要有两个:一方面表面活性剂促进了土壤颗粒本身的沉降;另一方面土壤对表面活性剂强烈的吸附作用促进了nTiO2在土壤表面的沉积.
| [1] | Bang S H, Le T H, Lee S K, et al. 2011. Toxicity assessment of titanium(Ⅳ) oxide nanoparticles using Daphnia magna (water flea) [J]. Environmental Health and Toxicology, 26. http://dx.doi.org/10.5620/eht.2011.26.e2011002 |
| [2] | Batley G E, Kirby J K, Mclaughlin M J. 2013. Fate and risks of nanomaterials in aquatic and terrestrial environments [J]. Accounts of Chemical Research, 46(3): 854-862 |
| [3] | Buettner K M, Rinciog C I, Mylon S E. 2010. Aggregation kinetics of cerium oxide nanoparticles in monovalent divalent electrolytes [J]. Colloids and Surfaces A-Physicochemical & Engineering Aspects, 366(1/3): 74-79 |
| [4] | 陈宝梁. 2004. 表面活性剂在土壤有机污染修复中的作用及机理[D]. 杭州: 浙江大学. 1-129 |
| [5] | Chen G X, Liu X Y, Su C M. 2012. Distinct effects of humic acid on transport and retention of TiO2 rutile nanoparticles in saturated sand columns [J]. Environmental Science & Technology, 46(13): 7142-7150 |
| [6] | Chen Y, Chen J, Dong J, et al. 2004. Comparing study of the effect of nanosized silicon dioxide and microsized silicon dioxide on brogenesis in rats [J]. Toxicology and Industrial Health, 20(1/5): 21-27 |
| [7] | 禇灵阳, 汪登俊, 王玉军, 等. 2011. 不同环境因子对纳米羟基磷灰石在饱和填充柱中迁移规律的影响 [J]. 环境科学, 32(8): 2284-2291 |
| [8] | Derjaguin B, Landau L. 1941. Theory of the stability of strongly charged lyophobic sols and of the adhesion of strongly charged particles in solutions of electrolytes [J]. Progress in Surface Science, 43(1/4): 30-59 |
| [9] | Domingos R F, Tufenkji N, Wilkinson K J. 2009. Aggregation of titanium dioxide nanoparticles: Role of a fulvic acid [J]. Environmental Science & Technology, 43(5): 1282-1286 |
| [10] | Fang J, Shan X Q, Wen B, et al. 2009. Stability of titania nanoparticles in soil suspensions and transport in saturated homogeneous soil columns [J]. Environmental Pollution, 157(4): 1101-1109 |
| [11] | 方婧, 温蓓. 2011. TX100悬浮的多壁碳纳米管在土壤中运移及其对菲迁移的影响 [J]. 环境科学学报, 31(2): 334-340 |
| [12] | 方婧, 周艳萍, 温蓓. 2011. 二氧化钛纳米颗粒对铜在土壤中运移的影响 [J]. 土壤学报, 48(3): 549-556 |
| [13] | French R A, Jacobson A R, Kim B, et al. 2009. Influence of ionic strength pH, and cation valence on aggregation kinetics of titanium dioxide nanoparticles [J]. Environmental Science & Technology, 43(5): 1354-1359 |
| [14] | Godinez I G, Darnault C J G. 2011. Aggregation and transport of nano-TiO2 in saturated porous media: effects of pH, surfactants and flow velocity [J]. Water Research, 45(2): 839-851 |
| [15] | Godinez I G, Darnault C J G, Khodadoust A P, et al. 2013. Deposition and release kinetics of nano-TiO2 in saturated porous media: effects of solution ionic strength and surfactants [J]. Environmental Pollution, 174: 106-113 |
| [16] | Han Z T, Zhang F W, Lin D H, et al. 2008. Clay minerals affect the stability of surfactant-facilitated carbon nanotube suspensions [J]. Environmental Science & Technology, 42(18): 6869-6875 |
| [17] | Jafvert C T, Heath J K. 1991. Sediment- and saturated-soil-associated reactions involving an anionic surfactant (Dodecylsulfate) 1. Precipitation and micelle formation [J]. Environmental Science & Technology, 25(6): 1031-1038 |
| [18] | Li H Y, Tripp C P. 2004. Interaction of sodium polyacrylate adsorbed on TiO2 with cationic and anionic surfactants [J]. Langmuir, 20(24): 10526-10533 |
| [19] | Liang C H, Yang C J, Huang N B. 2009. Tarnish protection of silver by octadecanethiol self-assembled monolayers prepared in aqueous micellar solution [J]. Surface & Coatings Technology, 203(8): 1034-1044 |
| [20] | Liang Y, Bradford S A, Simunek J, et al. 2013. Sensitivity of the transport and retention of stabilized silver nanoparticles to physicochemical factors [J]. Water Research, 47(7): 2572-2582 |
| [21] | Lu Y Y, Xu X P, Yang K, et al. 2013. The effects of surfactants and solution chemistry on the transport of multiwalled carbon nanotubes in quartz sand-packed columns [J]. Environmental Pollution, 182: 269-277 |
| [22] | Muller D, Malmsten M, Bergenstahl B, et al. 1998. Competitive adsorption of gelatin and sodium dodecylbenzenesulfonate at hydrophobic surfaces [J]. Langmuir, 14(11): 3107-3114 |
| [23] | Nowack B, Bucheli T D. 2007. Occurrence, behavior and effects of nanoparticles in the environment [J]. Environmental Pollution, 150(1): 5-22 |
| [24] | Phenrat T, Saleh N, Sirk K, et al. 2008. Stabilization of aqueous nanoscale zerovalent iron dispersions by anionic polyelectrolytes: adsorbed anionic polyelectrolyte layer properties and their effect on aggregation and sedimentation [J]. Journal of Nanoparticle Research, 10(5): 795-814 |
| [25] | Rahman Q, Lohani M, Dopp E, et al. 2002. Evidence that ultrafine titanium dioxide induces micronuclei and apoptosis in Syrian hamster embryo fibroblasts [J]. Environmental Health Perspectives, 110(8): 797-800 |
| [26] | Rao P H, He M. 2006. Adsorption of anionic and nonionic surfactant mixtures from synthetic detergents on soils [J]. Chemosphere, 63(7): 1214-1221 |
| [27] | Song J E, Phenrat T, Marinakos S, et al. 2011. Hydrophobic interactions increase attachment of gum Arabic- and PVP-coated Ag nanoparticles to hydrophobic surfaces [J]. Environmental Science & Technology, 45(14): 5988-5995 |
| [28] | Tkachenko N H, Yaremko Z M, Bellmann C, et al. 2006. The influence of ionic and nonionic surfactants on aggregative stability and electrical surface properties of aqueous suspensions of titanium dioxide [J]. Journal of Colloid and Interface Science, 299(2): 686-695 |
| [29] | Tufenkji N, Elimelech M. 2005. Breakthrough of colloid filtration theory: role of the secondary energy minimum and surface charge heterogeneities [J]. Langmuir, 21(3): 841-852 |
| [30] | Verwey E J W, Overbeek J T G. 1948. Theory of the Stability of Lyophobic Colloids [M]. Amsterdam, The Netherlands: Elsevier |
| [31] | Wang L L, Huang Y, Kan A T, et al. 2012. Enhanced transport of 2, 2', 5, 5'-polychlorinated biphenyl by natural organic matter (NOM) and surfactant-modified fullerene nanoparticles (nC60) [J]. Environmental Science & Technology, 46(10): 5422-5429 |
| [32] | Wilson M A, Tran N H, Milev A S, et al. 2008. Nanomaterials in soils [J]. Geoderma, 146(1/2): 291-302 |
| [33] | 吴其圣, 杨琛, 胡秀敏, 等. 2012. 环境因素对纳米二氧化钛颗粒在水体中沉降性能的影响 [J]. 环境科学学报, 32(7): 1596-1603 |
| [34] | Yuan W L, O'Rear E A, Grady B P, et al. 2002. Nanometer-thick poly(pyrrole) films formed by admicellar polymerization under conditions of depleting adsolubilization [J]. Langmiur, 18(8): 3343-3351 |
| [35] | Zhang X Z, Sun H W, Zhang Z Y, et al. 2007. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles [J]. Chemosphere, 67(1): 160-166 |
| [36] | Zhou D X, Abdel-Fattah A I, Keller A A. 2012. Clay particles destabilize engineered nanoparticles in aqueous environments [J]. Environmental Science & Technology, 46(14): 7520-7526 |
 2015, Vol. 35
2015, Vol. 35


