随着水体富营养化日益严重,氨氮被确定为水污染总量控制污染物之一,国家对污水排放也提出越来越严格的标准.在众多废水脱氮工艺中,生物脱氮因经济高效、无二次污染和易操作等优点极具发展前景,但传统生物脱氮系统由于硝化细菌比例低、生长慢且易流失,使得硝化反应成为制约含氮废水生物脱氮速率提高的瓶颈(Ni et al., 2008),故通过驯化活性污泥富集高效硝化菌,并采取简单高效的方式将硝化菌固定下来提高硝化菌的体积浓度,可以最终提高硝化效率.
Davies等(1998)发表的关于细菌群体感应(Quorum Sensing,QS)对细菌生物膜形成重要性的研究为促进细菌附着聚集生长、减少流失提供了一个新的视角.研究表明,信号分子能调控细菌生理行为,影响微生物的群集运动、聚集生长、胞外多糖的合成和生物膜形成(Withers et al., 2001;李蒙英等,2007; Klausen et al., 2003;Ren et al., 2010),影响污泥微生态组成与功能、菌群增殖速度与世代长短等指标,从而影响菌群结构和优势菌(Valle et al., 2004; 孙颉等,2013).而且,通过人为手段外加信号分子能强化QS系统,从而促进生物膜形成,强化生物膜(Chen et al., 2002).信号分子有3类,革兰氏阴性细菌的信号分子多属N-酰化高丝氨酸内酯(AHLs)类,硝化菌作为革兰氏阴性菌其产生的信号分子大多是AHLs.废水处理系统中常见的欧洲亚硝化单胞菌Nitrosomonas europaea已被检测到可以产生AHLs类信号分子N-(β-酮己酰)-L-高丝氨酸内酯(OHHL)(Batchelor et al., 1997)和N-己酰-L-高丝氨酸内酯(C6-HSL)、N-辛酰-L-高丝氨酸内酯(C8-HSL)、N-癸酰-L-高丝氨酸内酯(C10-HSL)(Burton et al., 2005).已有研究证实,C8-HSL对生物膜形成有促进作用,通过人为外加能促使受损生物膜恢复(Gamage et al., 2011),且OHHL能够大幅度缩短处于饥饿状态的Nitrosomonas europaea的停滞期(Batchelor et al., 1997).但目前针对含氮废水生物处理系统中的硝化污泥混合菌群体系,AHLs 对其附着生长及硝化效果所起的作用并不是很清楚,恰当类型和浓度的信号分子很可能会提高硝化污泥活性,调控胞外多聚物产量,强化硝化污泥形成生物膜或颗粒污泥,从而提高硝化效率.
基于此,本研究拟选取C8-HSL和OHHL两种信号分子人为添加到硝化污泥系统中,考察硝化污泥附着生长特性及硝化效率的变化,以明确这两种信号分子对硝化污泥的影响,为通过投加信号分子快速实现硝化菌富集及提高硝化效率提供理论依据.
2 实验材料和方法(Materials and methods) 2.1 实验材料用于实验的信号分子N-octanoyl-DL-homoserine lactone(C8-HSL)和N-(3-oxohexanoyl)-L-homoserine lactone(OHHL)均购自Sigma-aldrich.
2.2 硝化污泥培养本研究将取自肖家河污水处理厂的回流污泥作为接种污泥,接种到序批式生物反应器(Sequencing Batch Reactor,SBR)中,通过逐步提高进水中碳源、氮源负荷的方法来驯化富集具有硝化功能的活性污泥.驯化初期,接种到反应器的污泥MLSS为3.5 g · L-1,初始接种污泥SVI为72.6 mL · g-1,平均粒径145 μm,氨氮降解效率64.23%.SBR反应器有效体积为2.4 L(直径6 cm,高85 cm),水力停留时间8 h,按4 h一个循环周期(依次是进水4 min、曝气182 min、沉降50 min和出水4 min)在室温下运行,运行期间保持DO>2 mg · L-1,pH在7.5~8.0之间.反应器进水采用人工配水,碳源为葡萄糖和醋酸钠(比例为1∶1),氮源为氯化铵,还包括营养元素MgSO4、CaCl2、FeCl3、KH2PO4、Na2HPO4,以及H3BO4、CuCl2、MnSO4、(NH4)6Mo7、AlCl3、CoCl2、NiCl2等微量元素.
反应器在运行100多天后,进水氨氮从初始的50 mg · L-1逐渐提高到150 mg · L-1,期间进水COD按C/N=8随着N负荷的变化相应递增.反应器进出水氮组分的历时变化如图 1所示.在进水氨氮浓度稳步增加的情况下,出水氨氮及亚硝氮一直保持在较低水平,氨氮降解效率接近100%;同时,出水中的硝氮逐渐积累,呈升高走势.表明污泥中硝化菌逐渐增多,污泥硝化能力逐步增强.
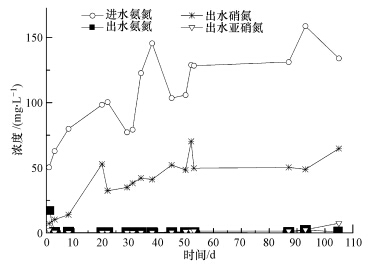 |
| 图 1 反应器进出水氮组分变化 Fig. 1 The change of nitrogen components in effluent with increasing ammonium concentration in influent |
采用微孔板(六孔板,总容积15 mL · 孔-1)作为反应器,以SBR反应器中的硝化污泥为菌源,分别选用不同菌悬液浓度(OD600=0.8、0.6、0.4、0.2、0.1、0.05)和培养时间(12、18、24 h),添加一定浓度的营养基质后将微孔板在30 ℃下静置培养,培养结束后测定微生物附着量.营养基质的配方与SBR反应器进水相同,进水COD浓度为800 mg · L-1,氨氮浓度为100 mg · L-1.
2.4 硝化污泥附着实验为探究信号分子对硝化污泥附着生长能力的影响,采用微孔板(六孔板)作为反应器,以SBR反应器中的硝化污泥为菌源开展附着实验.首先向微孔板板孔中加入5 mL(OD600=0.1)活性污泥悬浮液(清洗后匀浆)和营养基质,同时将不同类型的信号分子(C8-HSL、OHHL)按2 μmol · L-1人为分别添加到板孔中; 然后将微孔板在30 ℃下静置培养一定时长,包括24 h、48 h(a)(24 h后只添加营养)、48 h(b)(24 h后同时添加营养和信号分子)3种培养条件;培养结束后,测定微生物附着量,同时测定溶液中各种形态N的浓度,并用SPSS软件分析有无显著性差异.营养基质的配方与SBR反应器进水相同,进水COD为800 mg · L-1,氨氮浓度为100 mg · L-1.
2.5 硝化污泥序批式运行生长特性实验将SBR反应器的硝化污泥清洗后分别接种到3个有效体积为200 mL的反应器中(内径40 mm,高160 mm).反应器采用序批式运行,24 h一个循环,半连续进水方式(每8 h进水一次,每个循环进水3次),沉淀后从反应器中部排水,水力停留时间为48 h.反应器初始污泥浓度约为3.4 g · L-1(以MLSS计),氨氮负荷为0.15 kg · m-3 · d-1,COD负荷为1.2 kg · m-3 · d-1,保持DO>2 mg · L-1,pH在7.5~8.0之间.3个反应器(空白组、C8-HSL组、OHHL组)在相同条件下运行2 d后,开始每天分别向实验组中添加2 μmol · L-1的信号分子C8-HSL、OHHL,空白组作为对照.每天监测反应器MLSS、MLVSS、ESS(出水污泥浓度)及出水各种形态氮的浓度,以便分析污泥的氨氮降解能力和生长特性变化.
2.6 硝化污泥氨氮降解实验为探究直接外加信号分子对硝化污泥降解氨氮的影响,实验中采用锥形瓶培养硝化污泥(空白组、C8-HSL组、OHHL组),培养过程中间隔取样测定氨氮变化,直到氨氮基本降解完全且浓度比较稳定时停止取样.先制备OD600=0.1的硝化污泥悬浮液300 mL,平均分装到3个250 mL的锥形瓶(有效容积100 mL)中,分别向其中加入营养基质(N负荷100 mg · L-1,碳负荷800 mg · L-1)和2 μmol · L-1的信号分子(C8-HSL或OHHL),置于恒温摇床(33 ℃、130 r · min-1)中培养,最后通过分析测得的各种形态氮的浓度变化来分析信号分子对硝化污泥氨氮降解能力的影响.
2.7 分析方法结晶紫染色法(Stepanović et al.,2000;Taweechaisupapong et al., 2005)测定附着生物量:先用无菌生理盐水将待测的生物膜清洗3次,除去所有未附着微生物,自然干燥或低温烘干;然后将附着在板孔上的微生物用5 mL 99%的甲醇固定15 min,倒去甲醇干燥;接着用3 mL 2%的结晶紫染色30 min,多余的染液用自来水冲洗干净,干燥;最后将固定在孔板上的染液用5 mL 33%的冰醋酸溶解1 h,用酶标仪在600 nm下测OD值.
水质监测指标主要包括NH+4-N、NO-3-N、NO-2-N、DO和pH,污泥特性监测指标包括总悬浮固体浓度MLSS、总挥发性悬浮固体浓度MLVSS、出水固体浓度ESS(Eaton et al., 2005).NH+4-N的测定采用纳氏试剂分光光度法,NO-3-N的测定采用紫外分光光度法,NO-2-N的测定采用N-(1-萘基)乙二胺分光光度法.DO和pH分别采用溶氧仪(FG4,梅特勒-托利多)和pH计(PHBJ-260,雷磁)实时测定.
3 结果与讨论(Results and discussion) 3.1 硝化污泥附着实验条件优化在探究菌悬液浓度和培养时间对微生物附着量的影响(图 2)时发现,在同样的菌悬液浓度下,微生物附着量会随培养时间的延长而增加,考虑到相对较多的微生物附着量有利于对比不同实验条件下的微生物附着情况并减少实验误差,在营养物质未耗尽的条件下,尽量选用较长的培养时间.比较不同菌悬液浓度下培养24 h后的微生物附着量发现,菌悬液OD600=0.1时其附着量高于菌悬液OD600=0.05、0.2、0.4实验组,且与菌悬液OD600=0.6、0.8组相比差别不大.综合考虑,选定后续硝化污泥附着实验采用菌悬液浓度OD600=0.1.
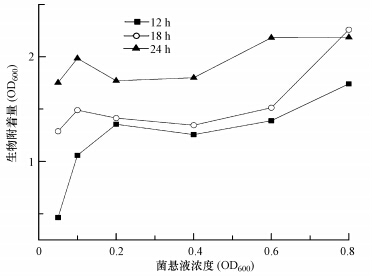 |
| 图 2 菌悬液浓度及培养时长对硝化污泥附着效果的影响 Fig. 2 Effect of cell suspension and incubation time on the adhesion of nitrifying sludge |
以选定的实验条件开展的硝化污泥附着特性研究(图 3)表明,不同的培养时长(24 h和48 h)下信号分子对微生物附着的影响趋势一致,均是C8-HSL对硝化污泥附着有抑制作用,而OHHL则对硝化污泥附着有促进强化作用(尤其在培养48 h后其强化作用更明显).对比 48 h(a)和48 h(b)的结果发现,在24 h后是否添加信号分子对附着几乎无影响,说明信号分子在一定时间内对硝化污泥附着能持续发挥促进或抑制作用.同时,各组微生物附着量均随培养时间的延长而增加,这与实验条件优化部分的结果一致.说明培养时间是影响微生物附着的重要因素之一,微生物生长、附着是一个动态的过程.
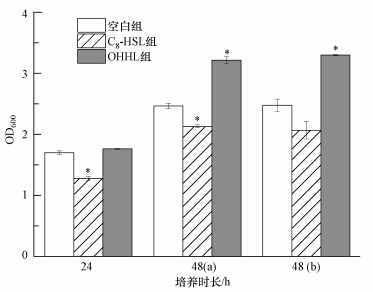 |
| 图 3 信号分子对硝化污泥静态附着的影响(48 h(a)表示24 h后只加营养物质组,48 h(b)表示24 h后同时加营养和信号分子组;*表示实验组与空白组相比有显著性差异) Fig. 3 Effect of AHLs on the adhesion of nitrifying sludge(48 h(a): only nutrients added into the reactor after 24 h,48 h(b): nutrients and AHLs were added into the reactor simultaneously after 24 h. *: Significance difference between experimental and control groups) |
对比硝化污泥序批式运行8 d前后的状况(表 1)发现,虽然初始接种污泥量基本一样,且在序批式运行过程中3个反应器每天的出水污泥浓度基本维持在0.1 g · L-1左右(图 4),但在运行8 d后,实验组C8-HSL、OHHL的MLSS分别达到(6.42±0.24)g · L-1、(6.41±0.41)g · L-1,明显比空白组((5.69±0.23)g · L-1)高.综合比较空白组和实验组的VSS/SS(C8-HSL组0.73,OHHL组0.72,空白组0.69)和平均生长速率(C8-HSL组0.463 g · L-1 · d-1(以SS计),OHHL组0.469 g · L-1 · d-1(以SS计),空白组0.316 g · L-1 · d-1(以SS计))发现,实验组的平均生长速率和VSS/SS都明显高于空白组,且C8-HSL、OHHL组的硝化污泥生物量及活性水平相当.分析实验组与空白组的不同可知,两种信号分子都能促进微生物生长,提高微生物生长速率,并增强硝化污泥活性.
| 表 1 序批式运行反应器的硝化污泥生长特性 Table 1 The growth characteristics of nitrifying activated sludge in sequence batch reactor |
 |
| 图 4 序批式反应器的出水污泥浓度 Fig. 4 The sludge concentration in effluent of the sequence batch reactor |
在完成微孔板静态附着实验后测定微孔板中的氨氮浓度表明,向菌悬液中投加信号分子对24 h后的氨氮降解率影响不大,空白组、C8-HSL组、OHHL组的氨氮降解率在培养24 h后分别是79.58%、81.78%、83.6%,48 h(在24 h后只加营养物质)后分别是80.17%、82.77%、80.43%,48 h(在24 h后同时加营养和信号分子)后分别是78.1%、80.17%、76.2%.分析数据得出,各组氨氮降解率差异不显著,基本都维持在80%左右,而且无明显变化趋势,信号分子对氨氮降解的影响不大,可能是由于溶解氧(DO)和培养时间的限制使得最终氨氮降解率趋于一致,需要进一步对DO和培养时间两个因素进行分析探究.
在利用锥形瓶连续动态培养硝化污泥的过程中,间隔取样测定氨氮浓度动态变化(图 5).实验结果表明在培养19 h后各组氨氮基本降解完全,19~24 h微生物处于营养匮乏状态;空白组、C8-HSL组、OHHL组的氨氮降解速率系数分别是0.6898、0.7602、0.7005 h-1,添加C8-HSL信号分子实验组的氨氮降解速率明显高于空白组,而添加OHHL实验组的氨氮降解速率则和空白组差别不大,说明C8-HSL信号分子能提高硝化污泥的氨氮降解速率,OHHL信号分子则对硝化污泥的氨氮降解速率影响不大.空白组、C8-HSL组、OHHL组在培养24 h后的氨氮降解率分别达到98.02%、98.63%、98.39%,基本都维持在98%附近,这与微孔板培养24 h后各组氨氮降解率(基本都维持在80%附近)的趋势是一致的,但整体上锥形瓶动态培养与微孔板静态培养相比其降解率更高.锥形瓶振荡培养有利于提高DO含量,有助于硝化污泥降解氨氮,从而证实了DO是限制氨氮降解率的主要因素之一.解决了DO和营养对微生物生长的限制后,反应器不仅取得了很好的氨氮降解效果,而且氨氮降解率明显提高,生物量及其活性明显增加.C8-HSL虽然不能强化硝化污泥的附着能力,但能显著提高硝化污泥的氨氮降解速率;OHHL则能促进硝化污泥附着生长,但对其氨氮降解效率影响不大.
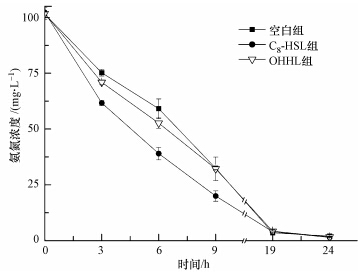 |
| 图 5 信号分子对硝化污泥氨氮降解的影响 Fig. 5 Effect of AHLs on ammonia degradation of nitrifying sludge |
24 h后测定锥形瓶中的各种形态氮(图 6)显示,空白组、C8-HSL组、OHHL组的总氮分别是40.37、33.14、29.97 mg · L-1,实验组与空白组的差异说明实验组有一部分氮很可能被用于微生物自身生长而未反应生成硝态氮,这与序批式运行中信号分子能促进微生物生长(表 1)的结论是一致的;各组氨氮剩余量基本一致,但实验组的硝氮和亚硝氮浓度明显低于空白组,且亚硝氮的差距比硝氮的差距大,说明C8-HSL、OHHL两种信号分子很可能有助于提高硝化效率,使得实验组的亚硝氮剩余量更少,硝化效率更高.
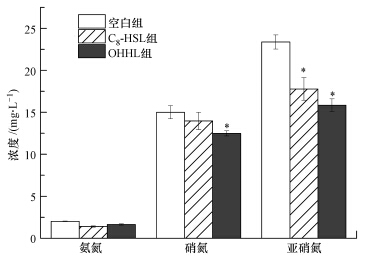 |
| 图 6 信号分子对硝化污泥培养24 h后的硝化效果影响 Fig. 6 Effect of AHLs on the sludge nitrification after 24 h |
序批式运行8 d的氮浓度变化如图 7所示,空白和实验组的氨氮降解效果都很好,几乎达到100%,实验组每天的氨氮降解水平均与空白组接近,与锥形瓶动态培养24 h时的各组降解趋势较一致;由于序批式运行采用流量计控制微孔曝气,溶氧充足,所以基本没有亚硝氮积累;但实验组出水硝氮浓度均低于空白组且有持续走低的趋势,与锥形瓶动态培养24 h后的硝氮变化趋势一致,这是由于添加信号分子提高了微生物的生长速率(表 1),而微生物生长需要利用氮源合成自身物质,添加信号分子的实验组生物量明显高于空白组,必然会消耗更多的氨氮,使得参与硝化反应的氨氮减少,从而导致实验组出水硝氮浓度低于空白组.
 |
| 图 7 信号分子对序批式反应器硝化效果的影响 Fig. 7 Effect of AHLs on the sludge nitrification in SBRs |
1)信号分子OHHL能显著促进并强化硝化污泥附着生长,并能在一定时间内持续发挥作用,有助于硝化生物膜的形成;而信号分子C8-HSL对硝化污泥附着生长基本无促进甚至有抑制作用.
2)信号分子C8-HSL能促进硝化污泥降解氨氮,提高其氨氮降解速率;而信号分子OHHL对硝化污泥的氨氮降解效率影响不大.
3)C8-HSL、OHHL两种信号分子均能促进硝化污泥生长,提高微生物生长速率及硝化污泥活性,加速硝化污泥生物量累积,在相同的氮负荷条件下添加C8-HSL或OHHL信号分子,不仅能保证氨氮降解效率还能降低出水硝氮浓度,减轻氮污染.
| [1] | Batchelor S E,Cooper M,Chhabra S R,et al.1997.Cell density-regulated recovery of starved biofilm populations of ammonia-oxidizing bacteria [J].Applied and Environmental Microbiology,63(6): 2281-2286 |
| [2] | Burton E O,Read H W,Pellitteri M C,et al.2005.Identification of acyl-homoserine lactone signal molecules produced by Nitrosomonas europaea strain Schmidt [J].Applied and Environmental Microbiology,71(8): 4906-4909 |
| [3] | Chen X,Schauder S,Potier N,et al.2002.Structural identification of a bacterial quorum-sensing signal containing boron [J].Nature,415(6871): 545-549 |
| [4] | Davies D G,Parsek M R,Pearson J P,et al.1998.The involvement of cell-to-cell signals in the development of a bacterial biofilm [J].Science,280(5361): 295-298 |
| [5] | Eaton A D,Clesceri L S,Rice E W,et al.2005.Standard Methods for the Examination of Water & Wastewater: Centennial Edition (21st ed) [M].Washington,DC,USA: American Public Health Administration |
| [6] | Gamage A M,Shui G H,Wenk M R,et al.2011.N-Octanoylhomoserine lactone signalling mediated by the BpsI-BpsR quorum sensing system plays a major role in biofilm formation of Burkholderia pseudomallei [J].Microbiology,157(4): 1176-1186 |
| [7] | Klausen M,Aaes-Jørgensen A,Molin S,et al.2003.Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms [J].Molecular Microbiology,50(1): 61-68 |
| [8] | 李蒙英,陆鹏,张迹,等.2007.生物膜中群体感应因子细菌的分离及成膜能力[J].中国环境科学,27(2): 194-198 |
| [9] | Ni B J,Fang F,Xie W M,et al.2008.Growth,maintenance and product formation of autotrophs in activated sludge: taking the nitrite-oxidizing bacteria as an example[J].Water Research,42(16): 4261-4270 |
| [10] | Ren T T,Yu H Q,Li X Y.2010.The quorum-sensing effect of aerobic granules on bacterial adhesion,biofilm formation,and sludge granulation [J].Applied Microbiology and Biotechnology,88(3): 789-797 |
| [11] | Stepanović S,Vukovi ć D,Daki ć I,et al.2000.A modified microtiter-plate test for quantification of staphylococcal biofilm formation [J].Journal of Microbiological Methods,40(2): 175-179 |
| [12] | 孙颉,宋协法,马真.2013.两种AHLs信号分子对生物膜法养殖污水处理条件下水体内环境的影响[J].环境工程学报,7(6): 2250-2254 |
| [13] | Taweechaisupapong S,Kaewpa C,Arunyanart C,et al.2005.Virulence of Burkholderia pseudomallei does not correlate with biofilm formation [J].Microbial Pathogenesis,39(3): 77-85 |
| [14] | Valle A,Bailey M J,Whiteley A S,et al.2004.N-acyl-L-homoserine lactones (AHLs) affect microbial community composition and function in activated sludge [J].Environmental Microbiology,6(4): 424-433 |
| [15] | Withers H,Swift S,Williams P.2001.Quorum sensing as an integral component of gene regulatory networks in Gram-negative bacteria [J].Current Opinion in Microbiology,4(2): 186-193 |
 2015, Vol. 35
2015, Vol. 35


