随着核能的和平利用及核电的不断发展,放射性核废物,特别是高放废物,由于其中含有毒性较大、半衰期很长的放射性核素,对其处理成为一个世界难题,同时也是关系到核电能否进一步发展的关键问题之一(张晖等,2011; 梁洪祥等,2013).在核电发展过程中产生的放射性核素63Co(Ⅱ)是一种非常重要的裂变产物,其半衰期为96年.重金属Co(Ⅱ)和63Co(Ⅱ)的物化性质非常相似,因此,研究Co(Ⅱ)对于了解放射性核素具有重要意义(梁洪祥等,2013).目前,关于治理及去除重金属或放射性金属污染废水的方法主要有化学沉淀法、离子交换法、电解法及吸附法等.吸附法由于具有吸附容量大、无二次污染、稳定性好、再生能力强、价格低廉等优点而受到广范的重视(Ajouyed et al., 2011).
埃洛石(Al2Si2O5(OH)4 · nH2O)是一种天然的纳米管状材料(Du et al., 2010;张中杰等,2013),与碳纳米管(CNTs)具有相似的结构形态,如均具有比表面积高、空隙率大、羟基基团丰富及良好的离子交换性能等特点,常被用作良好的吸附材料.但CNTs存在一定的缺点,如价格昂贵、供应有限、具有生物毒害性等,这也限制了其在生活中的实际应用(张毅等,2012).埃洛石作为一种新型的纳米材料,与碳纳米管相比具有独特的结构特点和明显的资源优势,已成为吸附材料领域的前沿和热点(马智等,2012).
关于Fe3O4负载于吸附材料上的研究已有一定的报道.然而,有关磁性埃洛石(埃洛石与Fe3O4的质量百分数分别为54%和46%)作为吸附材料并对Co(Ⅱ)吸附的研究甚少.采用化学共沉淀法制备磁性埃洛石吸附材料,兼具埃洛石和Fe3O4的性质,具有吸附容量较大、操作简单、易于磁场分离、可重复使用等优点(肖玲等,2012).
因此,本文主要对磁性埃洛石对Co(Ⅱ)的吸附性能进行研究,考察吸附剂浓度、时间、温度、pH值等因素对吸附效果的影响.同时,从吸附动力学模型及热力学角度初步探究吸附机理,以期为其在天然水体中处理Co(Ⅱ)和63Co(Ⅱ)的应用提供理论依据和实践参考.
2 实验部分(Experimental) 2.1 材料与仪器材料:七水合硫酸亚铁、六水合氯化铁、氢氧化钠、六水合二氯化钴、偶氮氯膦(Ⅲ)、乙酸、乙酸钠、盐酸、氢氧化钠等均为分析纯,埃洛石购于冉阳化工科技有限公司(广州).
仪器:KQ-250DV型数控超声清洗器(昆山市超声仪器有限公司)、TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司)、BSA224S-CW电子天平(赛多利斯科学仪器有限公司)、IKA KS 4000i控温摇床(成都智诚科灵仪器仪表有限公司)、pH计(赛多利斯科学仪器有限公司)、台式高速离心机(H1850 cence 湘仪)、真空干燥箱(DZF-6050)、Nexus 670 FT-IR(美国Nicolet公司)、场发射电子显微镜(日本电子JSM)和X-射线衍射仪XRD(KYKY-EM3200)、振动样品磁强计VSM(Lake Shore 7410).
2.2 实验方法 2.2.1 磁性埃洛石复合材料的制备在氮气保护下,采用化学共沉淀法制备磁性埃洛石复合材料.具体制备过程如下:分别称取6.0 g FeCl3 · 6H2O和3.0 g FeSO4 · 7H2O于250 mL烧杯中,同时加入3.0 g的埃洛石粉(200目),用0.05 mol · L-1的NaOH溶液调节pH值至11左右,转入圆底烧瓶中,70 ℃恒温水浴,机械搅拌5 h后停止.冷却至室温,用蒸馏水洗涤至中性,最后用乙醇洗涤两次.于真空70 ℃下干燥24 h,研磨,备用.
2.2.2 吸附实验采用静态批式法,取一定量的磁性埃洛石储备液和Co(Ⅱ)溶液于15 mL聚乙烯离心管中,并通过微量进样器添加HCl或NaOH溶液来调节pH值,设置24 h作为振荡反应时间.在8000 r · min-1下离心30 min,取一定量的上层清液,采用分光光度法在波长660 nm处测定上清液中Co(Ⅱ)的含量.所有实验数据均为3次实验数据的平均值,所测数据的相对误差约为±5%.
2.2.3 数据处理Co(Ⅱ)吸附率(Y)和平衡吸附容量(Qe)的计算公式如下:

式中,C0为吸附剂的初始浓度(mg · L-1),Ce为Co(Ⅱ)在吸附剂上的平衡浓度(mg · L-1),Ct为吸附t时Co(Ⅱ)在吸附剂上的浓度(mg · L-1),V为悬浮液的总体积(mL),m为吸附剂的质量(g).
3 结果与讨论(Results and discussion) 3.1 样品表征 3.1.1 TEM分析从图 1可以看出,埃洛石呈现管状结构,埃洛石纳米管上附着有大量的颗粒,且呈现团簇状(Xie et al.,2011),表明Fe3O4成功地负载到了埃洛石表面.
 |
| 图 1 埃洛石(a)和磁性埃洛石(b)透射电镜(TEM)图片 Fig. 1 TEM images of halloysite(a) and magnetic halloysite(b) |
图 2为埃洛石与磁性埃洛石的FT-IR谱图.由图 2可知,埃洛石与磁性埃洛石的FT-IR谱图曲线峰型几乎完全一样.3699、3622和912 cm-1处为埃洛石表面羟基振动吸收峰,1640 cm-1处为水的变形振动吸收峰,1097 cm-1处为Si—O伸缩振动峰,1035、468 cm-1处为Si—O—Si的伸缩振动峰(蔡力锋等,2013;2012;席国喜等,2011).而曲线b中,在586 cm-1处出现一小峰,为Fe—O键的伸缩振动峰,表明Fe3O4负载在了埃洛石表面.
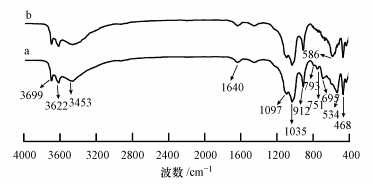 |
| 图 2 埃洛石(a)与磁性埃洛石(b)的FT-IR谱图 Fig. 2 FTIR spectra of halloysite(a) and magnetic halloysite(b) |
图 3是埃洛石与磁性埃洛石的XRD衍射图谱.由图 3可知,磁性埃洛石与埃洛石的特征峰相比较,除了衍射峰半峰宽之外,两者基本没有明显的变化.在2θ为11.7°、20.1°、24.1°、26.2°处(图中k处),曲线a和b上均出现了埃洛石的特征衍射峰,而2θ为30.2°、35.7°、43.2°、57.5°和63.1°处(图中q),曲线b上则出现了Fe3O4的特征衍射峰.表明Fe3O4成功负载到埃洛石纳米管上,这与SEM和FT-IR谱图分析的结果是相吻合的.
 |
| 图 3 埃洛石(a)与磁性埃洛石(b)的XRD谱图 Fig. 3 X-ray diffraction patterns of halloysite(a) and magnetic halloysite(b) |
由图 4可知,该磁性复合粒子的磁滞回线过原点,且以原点成中心对称,饱和磁化强度为28.34 emu · g-1.与纯的Fe3O4相比有所降低,但复合材料仍具有良好的磁性能,在外加磁场作用下,容易实现富集和分离(程昌敬等,2011).从图 5可以清楚地看到,磁性埃洛石能够有效地被外加磁场吸引.结果表明,磁性粒子成功地负载到埃洛石上,并且能够作为一个可行的磁分离载体.
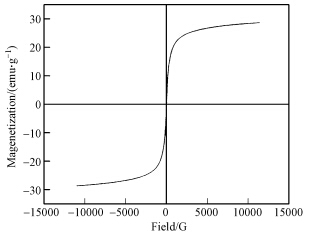 |
| 图 4 磁性埃洛石的磁滞回线 Fig. 4 VSM curve of magnetic halloysite |
 |
| 图 5 磁性埃洛石的外磁场作用图 Fig. 5 Effect of an externally magntetic field |
由图 6可知,随着磁性埃洛石吸附剂初始浓度的增加,对Co(Ⅱ)的吸附率逐渐增大.原因是随着吸附剂浓度的增加,Co(Ⅱ)在吸附剂上的吸附位点也会增加,Co(Ⅱ)被吸附的概率相应地也会增大,所以吸附率会增加.从图中还可以了解到平衡吸附容量Qe值会随着吸附剂浓度的增加而逐渐减少,可能归因于吸附剂浓度的变化,吸附剂表面官能团存在竞争或者团聚,即增多的可吸附位点使得Co(Ⅱ)的吸附率增大;同时,增多的官能团之间的竞争又使得吸附剂的吸附和络合能力下降,从而导致Qe值下降(Liu et al., 2012; Zhang et al., 2012).
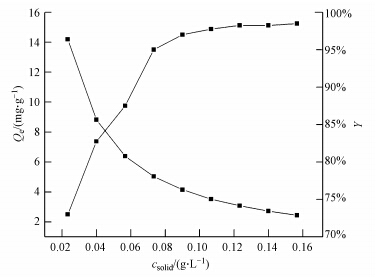 |
| 图 6 磁性埃洛石初始浓度对Co(Ⅱ)吸附效果的影响(T=293.15 K,pH=6.5±0.1,C(Co(Ⅱ))0.4 mg · L-1) Fig. 6 Adsorption of Co(Ⅱ)on magnetic halloysite as a function of solid content |
由图 7可知,Co(Ⅱ)在磁性埃洛石上的吸附速率随着时间的增加而增加,从吸附开始到5 h之间急剧增长,之后逐渐趋于平稳直至基本保持不变.吸附在5 h内达到平衡,这表明Co(Ⅱ)在磁性埃洛石上的吸附关系主要是化学吸附,而不是物理吸附(刘霞等,2012).Co(Ⅱ)在磁性埃洛石的吸附动力学Lagrange准二阶方程为:
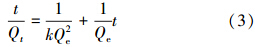
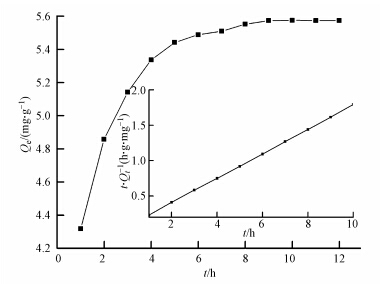 |
| 图 7 吸附时间对Co(Ⅱ)吸附的影响及磁性埃洛石吸附Co(Ⅱ)的准二级动力学模型(内图)(T=293.15 K,pH=6.5±0.1,c0(Co(Ⅱ))=0.4 mg · L-1,C(磁性埃洛石)=0.0667 g · L-1) Fig. 7 Effect of contact time on the adsorption of Co(Ⅱ)on magnetic halloysite(the inset figure is the pseudo-second-order rate equation fit of Co(Ⅱ)kinetic adsorption on magnetic halloysite) |
式中,Qt和Qe分别是吸附t时和吸附平衡是的吸附量(mg · g-1),t为吸附时间(h),k为二级吸附速率常数(g · mg-1 · h-1).内插图是(t/Qt)-t的线性拟合结果,相关的动力学参数可以利用公式(3)求得:Qe=5.754 mg · g-1,k=3.11 g · mg-1 · h-1,R2=0.9999.动力学模型所求的理论吸附量数据与实验测得数据相差不多,加之线性拟合关系非常好.表明Lagrange准二级动力学模型可以很好地拟合Co(Ⅱ)在磁性埃洛石上的吸附动力学.另外,实验中对混合悬浮浊液振荡24 h完全可以使吸附实验达到平衡.
3.2.3 pH对Co(Ⅱ)吸附的影响图 8为pH对Co(Ⅱ)在磁性埃洛石上吸附的影响关系图.从图 8可以看出:当pH<7时,Co(Ⅱ)在磁性埃洛石上的吸附量随着pH值的增大而急剧增大;当pH>7时,Co(Ⅱ)在磁性埃洛石上的平衡吸附量随着pH值的增大而基本保持不变.磁性埃洛石对Co(Ⅱ)的最佳吸附pH值是7.5.这种变化可能由于埃洛石表面官能团和表面电荷所致.埃洛石的主要化学成分为SiO2和Al2O3,其外表面的化学性质类似于SiO2的性质和属性,内部圆筒状表面化学性质和Al2O3相关联.体系pH在2~12之间,埃洛石表面带负电荷,由于外层SiO2所带的负电荷多余内层圆筒状Al2O3表面的正电荷,随着pH的增加,埃洛石表面带有更多的负电荷,从而增加了埃洛石和Co(Ⅱ)之间的静电引力.加之,在高的pH与低的pH下,埃洛石表面有更多的功能基团解离,因而也增加了更多的吸附位点(Dong et al., 2012).Tewari等(1972;1975)研究了Co(Ⅱ)在氧化物Fe3O4、A12O3、MnO2、TiO2和ZiO2上的吸附,发现在体系pH=5~8时,吸附率显著增加.因而Co(Ⅱ)在氧化物和埃洛石上的吸附具有相似的吸附现象.在该pH值范围内,Co(Ⅱ)在埃洛石上的吸附强烈地依赖于体系的pH值,同时也说明了此pH值范围内的吸附机理主要是表面络合(池亚玲等,2012).
 |
| 图 8 pH对Co(Ⅱ)吸附效果的影响(T=293.15 K,c0(Co(Ⅱ))=0.4 mg · L-1,C(磁性埃洛石)= 0.0667 g · L-1) Fig. 8 Effect of pH on Co(Ⅱ)adsorption on magnetic halloysite |
本实验考察了在温度分别为293.15、308.15和323.15 K的情况下,磁性埃洛石吸附剂对Co(Ⅱ)的吸附行为.从图 9可以看出,磁性埃洛石对Co(Ⅱ)的吸附率随着温度的升高而增大,表明升高温度是有利于吸附的进行.
 |
| 图 9 3种温度下Co(Ⅱ)在磁性埃洛石上的吸附等温线(pH=6.5±0.1,C(磁性埃洛石)=0.0667 g · L-1) Fig. 9 Adsorption isotherms of Co(Ⅱ)on magnetic halloysite at three different temperatures |
Langmuir和Freundlich 模型通常被用来描述吸附剂的吸附性能,是吸附工艺及设备选择的重要依据(赵颖华等,2012).其中,Langmuir模型最初是用来判定气体在固体表面的吸附,假设吸附是单分子层的,其线性表达式如式(4)所示(邵大冬等,2008).拟合的相关参数列于表 1.

| 表 1 不同温度下Langmuir和Freundlich模型的拟合参数 Table 1 Parameters for Langmuir and Freundlich isotherms at different temperatures |
式中,ce为吸附平衡时液相Co(Ⅱ)的浓度(mmol · L-1);cs为吸附平衡时固相上吸附Co(Ⅱ)的量(mmol · g-1);cmax为Co(Ⅱ)在固相上的最大吸附容量(mmol · g-1).由图 10a可知,对于ce/cs-ce的线性拟合,3种温度下的R2值分别为0.9877、0.9905、0.9731.
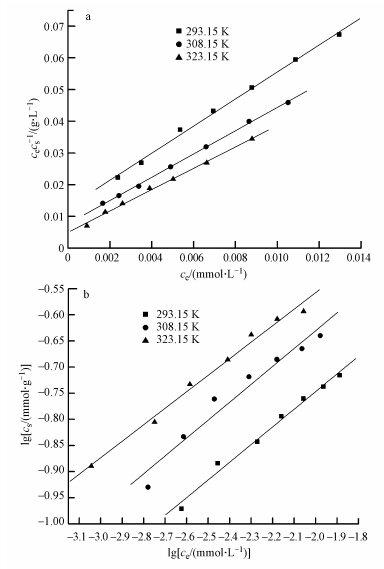 |
| 图 10 3种温度下Co(Ⅱ)在磁性埃洛石上的吸附模型(pH=6.5±0.1,C(磁性埃洛石)=0.0667 g · L-1) Fig. 10 Langmuir(a) and Freundlich(b)isotherms of Co(Ⅱ)adsorption on magnetic halloysite at three different temperatures |
Freundlich模型规定被吸附的物质与其浓度的比率是溶液的函数,表述了表面不均匀性和活性吸附位及其能量的指数分布(Donat et al., 2005).经验模型和活性中心指数分布及非均匀表面的特征相一致.被吸附的物质与其在溶液中的浓度关系如下(邵大冬等,2008):
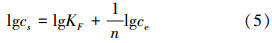
式中,KF(mmol1-n · Ln · g-1)及n为经验常数,分别表示吸附程度及溶液与浓度之间的非线性程度.3种温度下的R2值分别为0.9977、0.9819、0.9807.
3.2.5 磁性埃洛石对Co(Ⅱ)的吸附热力学特征分别在293.15、308.15和323.15 K下测定Co(Ⅱ)在磁性埃洛石上的吸附性能,可得到吸附过程的相关热力学焓变△Hθ、△Sθ和△Gθ,具体可通过图 11中lnKd和1/T拟合直线的斜率和截距,并结合公式(6)和(7),相关计算结果列于表 2.从表 2可以看出,△Sθ> 0,表明此过程是一个趋于无序的吸附过程;△Gθ<0,说明该吸附过程是自发进行的;△Hθ> 0,说明Co(Ⅱ)在磁性埃洛石上的吸附过程是吸热的.Co(Ⅱ)在磁性埃洛石上的吸附过程是水合钴离子脱水形成单一钴离子,而后钴离子与磁性埃洛石表面发生络合作用.因为脱去水合水所需要的能量大于生成表面络合化学键所释放的能量,因此整个吸附过程表现为吸热.总之,在该实验条件下,高温利于吸附(刘霞等,2012).
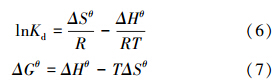
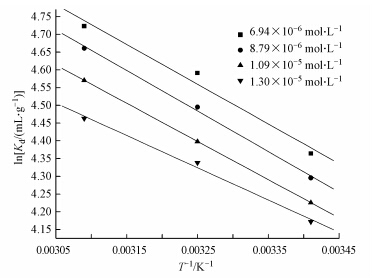 |
| 图 11 Co(Ⅱ)在磁性埃洛石上吸附的热力学参数评价(pH=6.5±0.1,C(磁性埃洛石)=0.0667 g · L-1) Fig. 11 Values of thermodynamic parameters for Co(Ⅱ)sorption on magnetic halloysite |
| 表 2 Co(Ⅱ)在磁性埃洛石上的吸附热力学参数 Table 2 Thermodynamic data of Co(Ⅱ)adsorption on magnetic halloysite at different temperatures |
1)实验的因素中,温度和pH值对Co(Ⅱ)在磁性埃洛石上的吸附都存在明显的影响,升高温度有利于吸附,最佳的吸附pH值为7.5.
2)Co(Ⅱ)在磁性埃洛石上的吸附于5 h内达到吸附平衡,该过程遵守Lagrange准二级动力学模型.
3)Co(Ⅱ)在磁性埃洛石上的吸附是自发吸热过程,并且该吸附符合Langmuir等温线.
| [1] | Ajouyed O,Hurel C,Marmier N.2011.Evaluation of the adsorption of hexavalent chromium on kaolinite and illite [J].Journal of Environment Protection,2(10): 1347-1352 |
| [2] | 蔡力锋,郑炳云,傅明连,等.2012.埃洛石纳米管表面修饰及其对次甲基蓝的吸附研究[J].莆田学院学报,19(2): 86-89 |
| [3] | 蔡力锋,林旺,林素英,等.2013.埃洛石纳米管热敏复合微球的制备及吸附性能[J].功能材料,44(10): 1428-1430; 1436 |
| [4] | 程昌敬,左芳,吴莉莉.2011.羧甲基化壳聚糖修饰磁性Fe3O4纳米粒子去除Cu(II)离子[J].化工进展,30(11): 2549-2553 |
| [5] | 池亚玲,陈元涛,邵大冬,等.2012.时间、固液比、pH值、离子强度、腐殖酸等因素对钴离子在凹凸棒石上吸附的影响[J].核化学与放射化学,34(6): 347-351 |
| [6] | Donat R,Akdogan A,Erdem E,et al.2005.Thermodynamics of Pb2+ and Ni2+ adsorption onto natural bentonite from aqueous solutions[J].Journal of Colloid Interface Science,286(1): 43-52 |
| [7] | Dong Y H,Liu Z J,Chen L.2012.Removal of Zn(II) from aqueous solution by natural halloysite nanotubes[J].Journal of Radioanalytical and Nuclear Chemistry,292(1): 435-443 |
| [8] | Du M L,Guo B C,Jia D M.2010.Newly emerging applications of halloysite nanotubes: a review[J].Polymer International,59(5): 574-582 |
| [9] | 梁洪祥,姚献东.2013.环境因素对蛭石吸附重金属钴离子的影响及机理[J].化学试剂,35(6): 551-554 |
| [10] | 刘霞,陈元涛,胡君,等.2012.pH、离子强度、时间和温度对Cd(II)在伊利石上吸附的影响[J].核化学与放射化学,34(6): 358-363 |
| [11] | Liu X,Chen Y T,Chi Y L,et al.2012.Effect of pH,ionic strength,foreign ions,humic acid and temperature on sorption of radionuclide 60Co(Ⅱ) on illite [J].Journal of Radioanalytical and Nuclear Chemistry,292(3): 1357-1366 |
| [12] | 马智,王金叶,高祥,等.2012.埃洛石纳米管的应用研究现状[J].化学进展,24(2/3): 275-283 |
| [13] | 邵大冬,许笛,王所伟,等.2008.pH值和离子强度对放射性核素镍在MX-80黏土上的吸附影响和模型研究[J].中国科学 (B 辑: 化学),38(11): 1025-1034 |
| [14] | Tewari P H,Campbell A B,Lee W.1972.Adsorption of Co2+ by oxides from aqueous solution[J].Canadian Journal of Chemistry,50(11): 1642-1648 |
| [15] | Tewari P H,Lee W.1975.Adsorption of Co(Ⅱ) at the oxide-water interface[J].Journal of Colloid and Interface Science,52(1): 77-78 |
| [16] | 肖玲,马珊.2012.纳米磁性壳聚糖对腐殖酸和重金属离子混合吸附研究[J].武汉大学学报(工学版),45(6): 855-859 |
| [17] | 席国喜,邢新艳,路宽,等.2011.聚乙二醇/埃洛石复合相变材料的制备及其性能研究[J].化工新型材料,39(10): 54-56; 81 |
| [18] | Xie Y F,Qian D Y,Wu D L,et al.2011.Magnetic halloysite nanotubes/iron oxide composites for the adsorption of dyes[J].Chemical Engineering Journal,168(2): 959-963 |
| [19] | Zhang C C,Liu Z J,Chen L,et al.2012.Influence of pH,humic acid,ionic strength,foreign ions,and temperature on 60Co(Ⅱ) sorption onto γ-Al2O3 [J].Journal of Radioanalytical and Nuclear Chemistry,292(1): 411-419 |
| [20] | 张晖,张丽鹏,于先进,等.2011.放射性核素60Co(Ⅱ)在伊利石上的吸附行为[J].核化学与放射化学,33(3): 168-172 |
| [21] | 张毅,赵武,杨华明.2012.基于天然纳米管功能修饰的新材料制备[J].材料导报,26(1): 1-6 |
| [22] | 张中杰,卢昶雨.2013.埃洛石纳米管的改性及其在水处理中的应用[J].应用化工,42(2): 325-327; 331 |
| [23] | 赵颖华,李登新.2012.改性膨胀石墨对含铅废水吸附特性[J].环境工程学报,6(10): 3613-3617 |
 2015, Vol. 35
2015, Vol. 35


