二氧化硫(SO2)是常见的大气污染物,主要源于煤、石油的燃烧及含硫矿石的冶炼.硫是维持植物生命活动的必需元素之一,与植物的正常生长发育密切相关.适量的SO2对植物是有益的,能够促进植物生长发育;但若大气中SO2浓度过高,超出植物的需求量和适应能力,会使气孔运动机能异常,发生不可逆关闭,继而影响光合作用和呼吸过程,导致植株生长发育抑制或死亡.我们前期的研究表明,SO2胁迫时植株可通过多种调节途径增强对环境的适应性,如叶面气孔开度和开放面积减小,抗氧化酶活性提高,相关防御基因表达增强(Li et al.,2008; Li and Yi, 2012).
植物叶片上分布的气孔是植物与外界环境进行气体交换的主要通道,与物质代谢、光合作用和呼吸作用等过程息息相关.组成气孔的保卫细胞能够敏感地感应内外环境的变化,通过改变自身的膨压来调节气孔的开闭,优化气体交换.一氧化氮(NO)作为植物体的内源性分子,能调节植物的生长发育、气孔运动等过程,在植物应对非生物胁迫如盐、重金属、低温胁迫中具有信号分子的作用(Rodríguez-Serrano et al.,2006; Zhao et al.,2007,2009).研究认为,植物细胞内NO合成包括酶促途径和非酶途径,主要的酶促途径有依赖于精氨酸的一氧化氮合酶(NOS)途径和依赖于NADPH的硝酸还原酶(NR)途径(Neill et al.,2003).其中,关于植物NR基因及其在内源性NO合成中的作用已被证实,但NOS及其生理功能有待深入研究:虽然在拟南芥中发现了哺乳动物NOS基因的同源基因AtNOS1,动物NOS抑制剂能显著抑制植物胁迫生理中NO的合成(Guo et al., 2003),然而AtNOS1作为NO合成酶的功能未被证实.我们前期研究发现,SO2可诱发蚕豆保卫细胞内NO水平升高,NO水平与胁迫期间气孔运动有关(仪慧兰等,2012),硝酸还原酶途径产生的NO参与了SO2胁迫下拟南芥气孔运动的调节(赵均等,2014).但NOS途径是否与SO2胁迫生理有关尚不明确.大气中的SO2经气孔进入植物体内,溶于细胞质中形成SO2-3和HSO-3(Pfanz and Heber,1986),因此,本文以蚕豆为材料,研究SO2衍生物(Na2SO3-NaHSO3,3 ∶ 1,mmol · L-1)对NOS活性的影响,以期为揭示NO和NOS在植物逆境生理中的作用提供实验依据.
2 材料与方法(Materials and methods) 2.1 材料准备蚕豆(Vicia faba L.)种子清洗消毒后用自来水浸泡24 h,湿纱布包裹催芽2~3 d,播种于营养土中.培养温度25 ℃,光照强度300 μmol · m-2 · s-1,相对湿度50%~70%,光/暗周期为16 h/8 h.幼苗长至4周时用于实验.取蚕豆顶端第2节完全展开的叶片,用镊子撕取其下表皮,去除叶肉细胞,切成长宽均为0.5 cm的小块,置于表皮条缓冲液(MES)中.MES缓冲液含50 mmol · L-1 KCl,10 mmol · L-1 MES,0.1 mol · L-1 tris-(hydroxymethyl)aminomethane(Tris),pH为7.0.
2.2 气孔开度检测根据前期研究结果(仪慧兰等,2012),选择不影响保卫细胞活性、浓度低于250 μmol · L-1的SO2衍生物(Na2SO3-NaHSO3)处理蚕豆表皮条或叶片.将蚕豆表皮条或叶片置于MES缓冲液中于23 ℃光照2 h诱导气孔开放,转移至SO2处理液中继续光照2 h.SO2处理液采用MES配制的浓度7.5~200 μmol · L-1的Na2SO3-NaHSO3(3 ∶ 1,mmol · L-1,以Na2SO3浓度计算)溶液;缓解组分别用L-NAME、c-PTIO或LaCl3预处理组织10 min后,加入一定浓度的SO2衍生物.
将药物处理后的表皮条置于光学显微镜下观察,OLYMPUS DP72数码成像系统采集图像,软件DP2-BSW测量气孔开度.每个处理取3个表皮条,每个表皮条随机选取20个视野(40×),每个视野测量10个气孔的开度.每个处理至少重复3次.
2.3 一氧化氮合酶活性测定取药物处理后的蚕豆叶片0.1 g,加入0.34 mL的0.2 mol · L-1 HEPES(pH 7.2)缓冲液冰浴研磨,7000 g离心10 min,取上清参考试剂盒(购自南京建成生物工程研究所)说明书测定酶活.先后重复3次.
2.4 NO和Ca2+信号检测应用特异性荧光探针Fluo-3AM和DAF-FM DA检测保卫细胞内Ca2+和NO水平(薛美昭和仪慧兰,2014).Fluo-3AM和DAF-FM DA可穿过细胞膜进入胞内,被酯酶剪切形成Fluo-3和DAF-FM后,分别与胞内Ca2+和NO结合产生荧光分子.因此,可通过荧光强度的检测衡量胞内Ca2+和NO浓度.
表皮条先装载荧光探针,再用200 μmol · L-1 的Na2SO3-NaHSO3单独或与0.2 mmol · L-1c-PTIO或25 μmol · L-1 LaCl3共同处理2 h,置于荧光显微镜(BX 51,Olympus,Japan)下,每隔1 min采集记录所选视野内保卫细胞荧光信号,连续记录30 min.
采用图像分析软件Image-Pro Plus 6.0(Olympus)测量细胞荧光强度,每个处理测量300个细胞,计算各处理组荧光信号的平均值.将对照组荧光信号值计为1,其余各组的相对荧光值为各自的荧光信号值与对照荧光信号值的比值.
2.5 数据统计分析计算每组3个重复实验的平均值和标准误,F检验后,采用Duncan方法进行多重比较,分析不同处理组与对照组之间的差异显著性.相同字母表示组间差异不显著,不同字母表示组间差异显著(p﹤0.05).
3 结果(Results) 3.1 SO2衍生物对蚕豆气孔运动的影响气孔开度检测发现,经SO2衍生物处理后蚕豆叶面气孔开度显著减小.浓度7.5~200 μmol · L-1 的SO2衍生物处理组气孔开度明显小于对照组,且随着SO2衍生物浓度的升高气孔开度逐渐减小(图 1).该结果表明,SO2衍生物暴露能降低气孔开度,从而影响植物的正常生理过程;较低浓度SO2衍生物即可影响叶面的气孔运动,说明植物对环境中SO2衍生物含量的变化具有非常灵敏的反应.
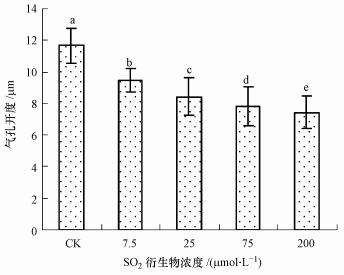 |
| 图 1 SO2衍生物对蚕豆叶面气孔开度的影响 Fig. 1 Effect of SO2 hydrates on stomatal aperture in V. faba leaves |
在SO2衍生物处理液中加入0.2 mmol · L-1的NO清除剂c-PTIO后,蚕豆气孔开度明显大于SO2衍生物单独处理组,说明胞内NO水平升高与SO2衍生物诱发的气孔关闭有关.NOS抑制剂L-NAME以25 μmol · L-1加入SO2衍生物处理液后,气孔开度显著大于SO2衍生物单独处理组,说明抑制NOS活性可阻滞SO2衍生物诱发的气孔关闭效应(图 2),NOS途径可能参与SO2胁迫期间NO的生成.
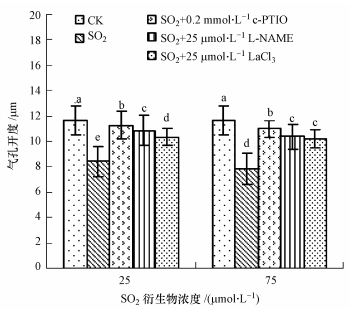 |
| 图 2 c\|PTIO、L\|NAME和LaCl3对SO2衍生物作用下蚕豆气孔运动的影响 Fig. 2 Effect of c\|PTIO,L\|NAME and LaCl3 on SO2 hydrates\|induced stomatal movement in V. faba |
在SO2衍生物处理液中加入25 μmol · L-1 的质膜Ca2+通道抑制剂LaCl3后,气孔开度大于SO2衍生 物单独处理组(图 2),说明SO2衍生物诱导气孔关 闭与胞内Ca2+水平升高有关,胞外Ca2+内流是胁迫组胞内Ca2+升高的诱因.
为证实胁迫中NO和Ca2+对气孔运动的影响,采用特异性荧光探针对蚕豆保卫细胞内NO和Ca2+水平进行检测发现,200 μmol · L-1 的SO2衍生物组保卫细胞内NO相对荧光值是对照组的2.78倍(图 3a),Ca2+相对荧光值是对照组的1.91倍(图 3b),说明SO2衍生物处理组蚕豆保卫细胞内NO和Ca2+水平升高,SO2衍生物暴露可激活胞内NO和Ca2+信号途径.为分析NO和Ca2+在气孔运动中的关系,本文研究了NO清除剂和Ca2+干扰剂对胁迫组胞内NO和Ca2+水平的影响,发现加入200 μmol · L-1的NO清除剂c-PTIO可阻止SO2衍生物引发的胞内NO和Ca2+水平升高,加入25 μmol · L-1 的质膜Ca2+通道特异性抑制剂LaCl3能阻止SO2衍生物引发的胞内Ca2+和NO水平升高(图 3).该结果表明,NO对胞内Ca2+水平具有一定的调节作用,Ca2+亦能影响胞内NO水平,即胞内NO和Ca2+存在一定的相互调控过程.
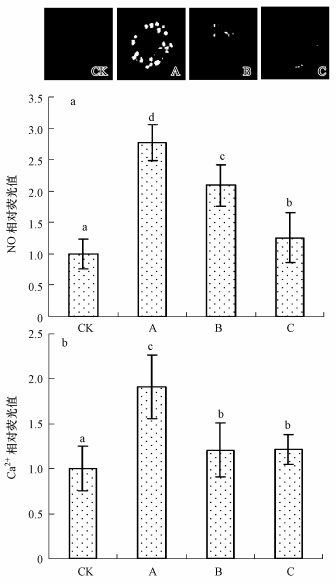 |
| 图 3 SO2衍生物诱发蚕豆保卫细胞内NO水平和Ca2+水平升高(CK.对照组; A.200 μmol · L-1 SO2衍生物; B.200 μmol · L-1 SO2衍生物+25 μmol · L-1 LaCl3; C.200 μmol · L-1 SO2衍生物+0.2 mmol · L-1 c\|PTIO) Fig. 3 SO2 hydrates enhanced the intracellular levels of NO and Ca2+ in guard cell of V. faba |
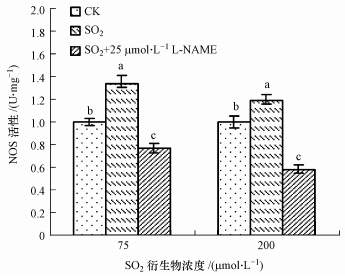 |
| 图 4 SO2衍生物对蚕豆叶片NOS活性的影响 Fig. 4 Effect of SO2 hydrates on activity of NOS in V. faba leaves |
为探究胁迫中胞内NO的来源,我们检测了SO2衍生物处理对蚕豆叶片(以FW计)NOS 活性的影响,发现经75和200 μmol · L-1的SO2衍生物处理后蚕豆叶组织中NOS活性显著增强,SO2衍生物处理液中加入NOS活性抑制剂L-NAME后叶片NOS活性低于SO2衍生物单独处理组(图 4).
4 讨论(Discussion)植物叶面气孔控制着自身与外界环境之间的气体与水分交换,在植物的生命活动中具有重要作用.NO参与调节干旱、紫外辐照等逆境下气孔关闭过程(García-Mata and Lamattina, 2001; He et al., 2013).本研究发现,SO2衍生物处理引发蚕豆叶面气孔开度降低,加入NO清除剂c-PTIO后气孔关闭效应被抑制,说明胞内NO水平与SO2胁迫响应中气孔运动的调节有关.之后用NO荧光探针DAF-FM DA标记证实,SO2衍生物胁迫能诱发蚕豆保卫细胞内NO水平增高.随后用NOS抑制剂干预NO合成,发现NOS抑制剂L-NAME能显著抑制SO2衍生物诱发的气孔关闭,说明植物对SO2响应中参与气孔运动调节的NO可能来自NOS途径.
有研究表明,NOS参与植物低氧、低温胁迫下的应答(Guo and Crawford, 2005; Zhao et al., 2009).为证实SO2胁迫响应中胞内NO升高与NOS途径的关系,本文选用2个不同浓度的SO2衍生物处理,检测了蚕豆叶片NOS活性,发现SO2衍生物胁迫组NOS活性明显增强,而加入NOS抑制剂L-NAME后,SO2衍生物诱发的NOS活性增强被抑制,与同期气孔关闭效应被抑制相对应,即:SO2衍生物胁迫诱导的植物气孔关闭与NOS激活相关.该结果说明,SO2衍生物可激活蚕豆叶片中的NOS活性,且NOS途径产生的NO参与了植株对SO2衍生物胁迫响应中气孔运动的调节.我们前期研究表明:NR途径介导的NO合成参与了拟南芥对SO2衍生物胁迫的响应(赵均等,2014),综合本研究结果我们认为,SO2胁迫可使植物细胞内NO合成的两条酶促途径增强,NOS途径和NR途径介导的NO合成均参与了植株对SO2胁迫响应中气孔运动的调节.
钙离子是植物细胞的重要组分,在植物生长、发育和防御反应中具重要作用,许多刺激信号在植物细胞中的转导过程都以Ca2+作为第二信使.有研究表明NO信号转导通路与Ca2+水平相关(Delledonne,2005).为研究SO2衍生物诱发气孔运动中NO和Ca2+的相互关系,我们检测了保卫细胞内NO和Ca2+水平,发现加入NO清除剂c-PTIO降低蚕豆保卫细胞NO水平后,胞内Ca2+水平随之下降,即胞内NO水平影响Ca2+水平,在SO2衍生物胁迫信号传导过程中NO位于Ca2+信号上游发挥作用.此外,Ca2+也在一定程度上调节着胞内NO水平,NO、Ca2+以及胞内其它信号分子组成复杂的信号网络共同调节着植物的逆境生理,有待进一步深入研究.
SO2衍生物浓度低至7.5 μmol · L-1时即可诱发蚕豆气孔关闭,其影响气孔运动的有效浓度与植物信号分子过氧化氢、脱落酸等接近,而下游胞内NO和Ca2+信号途径的参与,似乎表明SO2衍生物分子可能具有某种信号分子的功能.
5 结论(Conclusions)一定浓度的SO2衍生物可诱导蚕豆叶片气孔开度降低,使保卫细胞内NO水平升高,叶片中NOS活性增强.SO2衍生物胁迫组NOS活性增强是叶组织中NO水平升高的重要来源,NO介导胞内Ca2+水平升高,进而调节气孔运动,使气孔开度减小以减少细胞对SO2衍生物的摄入,进一步增强植物对SO2衍生物的适应性.
| [1] | Dell edonne M. 2005. NO news is good news for plants[J]. Current Opinion in Plant Biology, 8(4): 390-396 |
| [2] | García-Mata C, Lamattina L. 2001. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress[J]. Plant Physiology, 126(3): 1196- 1204 |
| [3] | Guo F Q, Okamot M, Grawford N M. 2003. Identification of a plant nitric oxide synthase gene involved in hormonal signaling[J]. Science, 302(5642): 100-103 |
| [4] | Guo F Q, Crawford N M. 2005. Arabidopsis nitric oxide synthase1 is targeted to mitochondria and protects against oxidative damage and dark-induced senescence[J]. The Plant Cell, 17(12): 3436-3450 |
| [5] | He J M, Ma X G, Zhang Y, et al. 2013. Role and interrelationship of Gα protein, hydrogen peroxide, and nitric oxide in Ultraviolet B-induced stomatal closure in Arabidopsis leaves[J]. Plant Physiology, 161(3): 1570-1583 |
| [6] | Li L H, Yi H L, Wang L, et al. 2008. Effects of sulfur dioxide on the morphological and physiological biochemical parameters in Arabidopsis thaliana plants[J]. Journal of Agro-Environment Science, 27(2): 525-529 |
| [7] | Li L H, Yi H L. 2012. Effect of sulfur dioxide on ROS production, gene expression and antioxidant enzyme activity in Arabidopsis plants[J]. Plant Physiology and Biochemistry, 58: 46-53 |
| [8] | Neill S J, Desikan R, Hancock J T. 2003. Nitric oxide signalling in plants[J]. New Phytologist, 159(1): 11-35 |
| [9] | Pfanz H, Heber U. 1986. Buffer capacities of leaves, leaf cells, and leaf cell organelles in relation to fluxes of potentially acidic gases[J]. Plant Physiology, 81(2): 597- 602 |
| [10] | Rodríguez-Serrano M, Romero-Puertas M C, Zabalza A, et al. 2006. Cadmium effect on oxidative metabolism of pea (Pisum sativum L.) roots: imaging of reactive oxygen species and nitric oxide accumulation in vivo[J]. Plant, Cell & Environment, 29(8): 1532-1544 |
| [11] | 薛美昭, 仪慧兰. 2014. 砷诱导蚕豆气孔保卫细胞死亡的毒性效应[J]. 生态学报 , 34(5): 1134-1139 |
| [12] | 仪慧兰, 刘鑫, 尹晶晶. 2012. 活性氧与NO在SO2诱导蚕豆气孔运动中的作用[J]. 河南大学学报(自然科学版), 42(5): 593-598 |
| [13] | 赵均, 薛美昭, 白鹤丽, 等. 2014. 硝酸还原酶介导的NO合成参与SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报, 34(3): 796-800 |
| [14] | Zhao M G, Tian Q Y, Zhang W H. 2007. Nitric oxide synthase-dependent nitric oxide production is associated with salt tolerance in Arabidopsis[J]. Plant Physiology, 144(1): 206-217 |
| [15] | Zhao M G, Chen L, Zhang L L, et al. 2009. Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance in Arabidopsis[J]. Plant Physiology, 151(2): 755-767 |
 2015, Vol. 35
2015, Vol. 35


