2. 工业聚集区污染控制与生态修复教育部重点试验室, 广州 510006
2. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters of Ministry of Education, Guangzhou 510006
高氯酸盐(ClO4-)是一种新型持久性无机污染物,被广泛用于火箭推进器、烟火制造、汽车气袋、皮革加工、橡胶制造等领域(Choi et al., 2008; Sahu et al., 2009).高氯酸盐具有高水溶性、低吸附性、高稳定性和高流动扩散性的特点(Yoon et al., 2009),其在一般环境条件下可存在达数十年之久,ClO4-在较低浓度范围内即具有干扰人体内碘的吸收以及抑制甲状腺调节荷尔蒙分泌和新陈代谢能力的毒理学特征(Kirk,2006).
目前,水中ClO4-的去除方法主要有:吸附法、离子交换法、生物修复法、膜分离法及化学还原法.吸附法和化学还原法处理效率低,离子交换法和膜分离法处理成本高,生物修复法环境影响因素较大,治理周期长(彭银仙等,2011).因此,研究一种低成本、高效的ClO4-去除方法是十分迫切的.
橘子皮作为一种生活中常见的水果皮,其一般处置办法都是作为生活废物扔弃,这不仅对环境造成了污染,而且浪费了有用的资源,橘子皮中含有丰富的纤维素和木质素等有机成分,其可与一些化学试剂发生交联反应,从而制得有效的吸附剂材料,用于去除水中的污染物,这样达到了变废为宝,以废治废的目的.国内外报道了一些改性橘子皮吸附重金属的研究(Feng et al., 2009),但在高氯酸盐吸附方面的研究尚无报道,此外,于哲等(2013)研究了一些常见吸附材料(木质活性炭、 膨润土、壳聚糖等)对高氯酸盐的吸附效果,结果显示这些材料对高氯酸盐的最大单位吸附量为4.42 mg · g-1,表明常见吸附材料对高氯酸盐的去除效果较差.本实验利用化学试剂与橘子皮发生反应,通过N,N-二甲基甲酰胺作为反应的溶剂;吡啶作为反应的催化剂;环氧氯丙烷作为反应的“桥”;二甲胺作为反应的引入基团,通过一系列反应后,橘子皮表面合成了叔胺盐基团,该基团上含有可交换的氯离子,从而合成了具有高效阴离子交换功能的改性橘子皮.NO3-、SO42-、PO43-是水体中常见的含氧阴离子,当它们以一定浓度存在水体中时会引起生态问题(Clark and Keller, 2012).考虑到常见废水中的复杂问题,本实验研究了NO3-、SO42-、PO43-与ClO4-共存下改性橘子皮吸附ClO4-的影响实验,分别研究了在不同pH范围内对ClO4-吸附的影响;单、双组分体系下热力学、动力学的吸附机理以及利用红外光谱表征不同竞争吸附条件下吸附剂材料的结构特征.
2 材料与方法(Materials and methods) 2.1 材料实验中所用的橘子皮由广东生产的柑橘所得,清洗干净后,干燥、粉碎后过40目筛备用.环氧氯丙烷,N,N-二甲基甲酰胺,吡啶,无水乙醇,高氯酸钠,硝酸钠,硫酸钠,磷酸钠等试剂均为国产分析纯,33%二甲胺水溶液为化学纯.实验用水为超纯水.
2.2 实验方法 2.2.1 改性橘子皮的制备称取4 g经预处理后过40目筛的橘子皮于三口圆底烧瓶中,加入60 mL环氧氯丙烷和80 mL N,N-二甲基甲酰胺混合搅拌,在100 ℃下恒温活化1 h;然后加入催化剂(砒碇)15 mL,在100 ℃下恒温催化1 h;再缓慢加入30 mL二甲胺,继续恒温100 ℃反应3 h,冷却,静置片刻后,将产物分别用c(NaOH)=0.1 mol · L-1的水溶液、HCl(0.1 mol · L-1)、C2H5OH(质量分数50%)和c(NaCl)=0.1 mol · L-1的水溶液清洗,然后抽滤,最好在60 ℃下干燥12 h(Baidas et al., 2011).
2.2.2 竞争吸附下,pH对吸附的影响分别配置浓度为ClO4-(100 mg · L-1)+ NO3-(100 mg · L-1),ClO4-(100 mg · L-1)+ SO42-(100 mg · L-1),ClO4-(100 mg · L-1)+ PO43-(100 mg · L-1)的溶液各100 mL,分别配置6份置于锥形瓶中,用0.1 mol · L-1的HCl和0.1 mol · L-1的NaOH将每组溶液中的pH分别调至2、4、6、8、10、12,再在各溶液中加入0.2 g 改性橘子皮,将所有配好的混合液置于恒温摇床中以150 r · min-1频率振荡,24 h后,取样用0.45 μm滤膜过滤后分析ClO4-浓度.
2.2.3 单组分吸附等温线测定将配置好的60~500 mg · L-1 ClO4-溶液100 mL放入含有0.2 g 改性橘子皮的锥形瓶中,在30 ℃条件下振荡24 h,然后膜滤测定ClO4-的浓度.
NO3-、SO42-、PO43-吸附等温线的测定方法同上.
2.2.4 双组分吸附等温线测定配置浓度为60、80、100、200、300、400、500 mg · L-1ClO4-溶液,再分别加入浓度为60、80、100、300、500 mg · L-1 NO3-的5个系列溶液,各溶液的体积均为100 mL,在各溶液中加入0.2 g 改性橘子皮,将混合液置于恒温(30 ℃)条件下振荡24 h,然后膜滤测定溶液中ClO4-和NO3-的浓度.
SO42-、PO43-分别与ClO4-共存下的吸附等温线测定方法同上.
2.2.5 吸附动力学配置浓度为ClO4-(100 mg · L-1)+ NO3-(100 mg · L-1)溶液100 mL,加入0.2 g改性橘子皮,将混合液置于30 ℃,转速150 r · min-1的恒温摇床振荡,期间定时取样,膜滤后分析ClO4-浓度.
SO42-、PO43-分别与ClO4-共存下的吸附动力学测定方法同上.
2.3 分析方法ClO4-、NO3-、SO42-和PO43-采用离子色谱测定.仪器采用Dionex ICS-1000(美国Dionex公司)离子色谱仪分析,采用AS20(4 mm×250 mm)色谱柱和AG20(4 mm×50 mm)保护柱,200μL大体积定量环进样,淋洗液NaOH浓度为2.5 mmol · L-1,抑制电流为87 mA.
2.4 计算方法按下式计算改性橘子皮对阴离子的吸附量:

图 1为改性前后橘子皮及吸附ClO4-后橘子皮的Zeta电位与pH的关系图.由图可以看出,pH在3~11范围内,改性前橘子皮的Zeta电位都是负值,并且随着pH的增加,橘子皮的Zeta电位不断降低.然而,改性后橘子皮的Zeta电位变为正值,这是由于氨基基团嫁接到橘子皮上的缘故,并且从图中可以看出,改性后橘子皮的Zeta电位的大小随pH的变化不明显.吸附ClO4-后的改性橘子皮,其表面Zeta电位相比吸附前有所增加,这表明改性橘子皮吸附ClO4-不是由静电吸附的机制所决定(Xu et al., 2013).
 |
| 图 1 pH对橘子皮Zeta电位的影响 Fig.1 Effect of pH on Zeta potential of orange peel in aqueous suspension |
图 2为初始浓度均为100 mg · L-1的NO3-、SO42-、PO43-分别与100 mg · L-1的ClO4-共存时,不同pH条件下的ClO4-吸附效果情况.由图可见,在pH < 4时,随着pH的增加,共存离子影响下的ClO4-的吸附量均不断增加,这是由于在极酸条件下,ClO4-可能有一部分以HClO4的形式存在,从而会降低ClO4-的吸附量,另外,酸性条件下吸附容量下降可能是因为调节pH引入的Cl-1浓度过高对ClO4-的吸附有影响;当4 < pH < 10时,3种共存离子分别存在下,ClO4-的吸附量均趋于稳定,表明在此pH范围内,ClO4-吸附量的大小主要取决于竞争离子的种类;当pH>10时,3种共存离子分别存在下,ClO4-的吸附量迅速下降,这是由于溶液中大量OH-与ClO4-发生竞争吸附,占据了改性橘子皮表面的大部分交换位点,从而减少了ClO4-的吸附量.
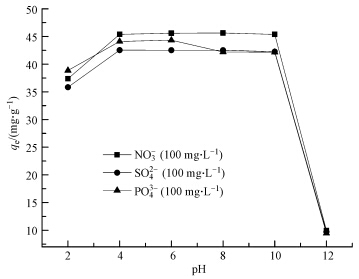 |
| 图 2 不同竞争离子在不同pH范围内对ClO4-吸附的影响 Fig.2 The effect of different anions for perchlorate adsorption at different pH range |
由图 2可见,在pH < 3时,竞争离子对ClO4-的影响顺序为SO42->NO3-> PO43-,由于离子价态因素的影响,高价态的离子对ClO4-的吸附影响更大,然而当pH < 3时,PO43-主要以H3PO4,H2PO4-形式存在(Wang et al., 2013),导致其对ClO4-的吸附影响最小.
当3 < pH < 10时,3种共存离子的ClO4-的竞争影响趋于稳定状态,并且此时竞争离子对ClO4-的影响顺序为SO42->PO43->NO3-,在此pH范围内,溶液中PO43-主要以H2PO4-,HPO42-的形式存在(Wang et al., 2013),其影响效果小于SO42-,大于NO3-.
当pH>10时,3种共存离子对ClO4-的吸附竞争影响趋于相同,并且随着pH的增加,ClO4-的吸附量迅速下降.这是由于此时大量OH-与 ClO4-发生竞争吸附导致3种共存离子对ClO4-的竞争作用被掩蔽了.
3.4 单组分平衡吸附图 3 所示为ClO4- 在单一组分系统中吸附等温线的非线性拟合曲线,表 1为模拟后的Langmuir和Freundlich吸附常数和相关系数.两种模型的公式如下(卢宁等,2008):
Langmuir 吸附模型:

Freundlich模型:

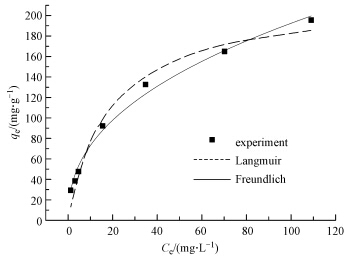 |
| 图 3 改性橘子皮对ClO4-的吸附等温线(T = 30℃; pH = 7.0±0.5) Fig.3 The adsorption isotherm of perchlorate by modified orange peels(T = 30℃; pH = 7.0±0.5) |
| 表 1 单一组分系统中各阴离子的Langmuir和Freundlich等温线参数 Table 1 The Langmuir and Freundlich isotherm parameters of various anions in single-solute system |
从表 1中可以看出,改性橘子皮吸附ClO4-更符合Freundlich模型(R2>0.99),表明改性橘子皮吸附ClO4-是不均匀的吸附,在低浓度时,吸附剂表面有足够多的活性位点,此时模型符合吸附的结果;在高浓度时,吸附剂表面活性位点趋于饱和,此时模型将不再代表吸附的结果,等温线达到一个稳定的状态(Wu et al., 2002).另外,由图 3可以看出改性橘子皮对ClO4-的最大单位吸附量超过了200 mg · L-1,于哲等人(2013)研究的一些材料对高氯酸盐的去除效果相比,改性橘子皮对ClO4-的吸附能力远大于常用的吸附材料,这主要是由于橘子皮通过改性处理,其表面引入了大量可交换的氯离子,因此,大幅度提高了其对ClO4-的吸附能力.
表 1也给出了其它3种阴离子的拟合结果,从表中可知,3种阴离子的等温线拟合结果均更符合Freundlich模型.考虑到4种阴离子拟合得到的Langmuir模型拟合常数属于同一数量级(Wu et al., 2002),并且拟合得到的相关系数在0.9左右,因此,比较最大吸附量qmax可得出改性橘子皮对4种阴离子的吸附程度,其顺序为ClO4->NO3->SO42->PO43-,这是由于不同阴离子在改性橘子皮上的吸附自由能不同所决定的(Clark and Keller, 2012).
3.5 双组分竞争吸附竞争吸附实验被用来决定不同吸附质在吸附剂表面的竞争程度.图 4分别为NO3-、SO42-、PO43-与ClO4-共存下,改性橘子皮对ClO4-的吸附量,从图中可以看出,随着3种阴离子的浓度不断增加,ClO4-的吸附量逐渐减小,而且当浓度达到300 mg · L-1时,ClO4-的吸附量发生明显的下降,说明高浓度的竞争阴离子大大增加了与ClO4-在改性橘子皮上的竞争作用.从图 4可以看出,3种阴离子对ClO4-的竞争影响顺序是:PO43->SO42->NO3-,并且竞争离子浓度越高表现的越明显,这可能是由于高价态阴离子相比于低价态阴离子具有更高的交换势,其与改性橘子皮具有更强的亲和力,因此,对ClO4-的吸附影响更大.综上结果表明,竞争条件下,改性橘子皮对ClO4-的吸附结果由改性橘子皮与竞争离子的亲和力及竞争离子的浓度共同决定.
 |
| 图 4 NO3-、SO42-、PO43-存在下,改性橘子皮对ClO4-的吸附量 Fig.4 Amount of ClO4- adsorbed by modified orange peels in the presence of NO3-,SO42-,PO43- |
在ClO4-(100 mg · L-1)、 NO3-(100 mg · L-1)、 SO42-(100 mg · L-1)、 PO43-(100 mg · L-1)、 ClO4-(100 mg · L-1)+ NO3-(100 mg · L-1)、 ClO4-(100 mg · L-1)+ SO42-(100 mg · L-1)、 ClO4-(100 mg · L-1)+ PO43-(100 mg · L-1)体系下,吸附剂对吸附质的总吸附量分别是47.7、39.1、48.5、44.8、78.4、81.0、73.0 mg · g-1.实验结果表明在双组分吸附系统下吸附剂的总吸附量要高于单组分吸附下的吸附量,这说明吸附剂表面的一些位点对于某些特定阴离子具有更强的吸附性,相似的结果被(Hingston et al., 1971)和(Violante et al., 1991)所发现,在PO43-+AsO43-、PO43-+SeO2-3、PO43-+C2O42- 3种体系下,混合离子占据吸附剂的位点要多于单一离子占据的位点.
在所有的二元组分系统中,随着NO3-、SO42-、PO43-浓度的增加,ClO4-的吸附量是不断减少的,并且3种阴离子竞争吸附下,ClO4-吸附的等温线形状是相似的.用Freundlich模型拟合各条件下ClO4-的吸附等温线,拟合参数见表 2.从表 2中可以看出,在3种阴离子竞争条件下,参数n随着竞争离子的浓度不断增加而增大,然而参数K的值逐渐减小,这表明竞争离子浓度越大,其对ClO4-的吸附影响也越大(Wu et al., 2002).相比于在单组分系统吸附下,ClO4-在二元系统吸附中的n值更大,但是K值却更小,这也表明ClO4-的吸附受共存离子的影响.
| 表 2 二元组分系统中ClO4-吸附的Freundlich等温线参数 Table 2 The Freundlich isotherm parameters of perchlorate adsorption in the binary-solute |
在室温(30 ℃)下,研究NO3-、SO42-、PO43-分别与ClO4-共存下,改性橘子皮对ClO4-的吸附动力学,3种阴离子分别与ClO4-竞争吸附下,ClO4-的吸附量与时间的关系如图 5所示.采用准二级动力学方程对实验数据进行拟合(Swain et al., 2013),结果如表 3所示,准二级动力学方程公式如下:

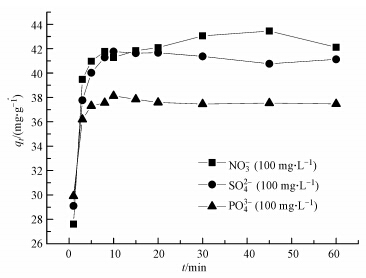 |
| 图 5 共存阴离子对改性橘子皮吸附ClO4-动力学的影响(C0(ClO4-) = 100 mg · L-1) Fig.5 The effect of coexisting anions for the kinetic of perchlorate adsorption by modified orange peels(C0(ClO4-) = 100 mg · L-1) |
从表 3可以看出,3种离子竞争下改性橘子皮吸附ClO4-的吸附动力学均能较好的用准二级动力学方程描述(R2 > 0.99),表明该吸附过程以化学吸附为主要速率控制步骤(Ho and McKay, 2000).从平衡吸附量可以看出,3种离子竞争吸附下,ClO4-的平衡吸附量都有所减小,并且影响的顺序为PO43->SO42->NO3-,这个结果与ClO4-等温线的实验分析结果一致.另外,NO3-、SO42-、PO43-存在下,ClO4-的吸附速率常数分别为0.087、0.402和1.06 g · mg-1 · min-1,说明在3种阴离子分别共存下,对ClO4-吸附速率的影响顺序为PO43->SO42->NO3-,这是由于一价的NO3-与吸附剂表面的Cl-发生交换作用,然而ClO4-会与一部分NO3-发生交换作用,从而导致了ClO4-达到吸附平衡的时间增大,相比之下,高价态的SO42-和PO43-由于它们分别需要2个和3个Cl-的等价交换,因而它们与吸附剂之间的作用力会更强,导致ClO4-更难从吸附剂上将它们置换出来,所以ClO4-吸附达到稳定的时间相比之下缩短了.
| 表 3 准二级动力学方程模拟参数 Table 3 The fitting parameters of Pseudo-second-order kinetic equation |
橘子皮改性前后及3种阴离子分别与ClO4-竞争吸附后改性橘子皮的红外光谱分析见图 6,由图可知,改性处理后,橘子皮的表面结构发生了一些变化,这可以从改性前后橘子皮的红外谱图进行分析,例如3420 cm-1处的-OH峰由于改性处理变弱了;2927 cm-1处的吸收峰为-CH3、-CH2中CH键的伸缩振动,由于改性处理消失了;另外,在1000~1500 cm-1区间段的一些吸收峰也消失了,由此表明橘子皮通过改性处理,其表面的一些官能团被反应掉了.
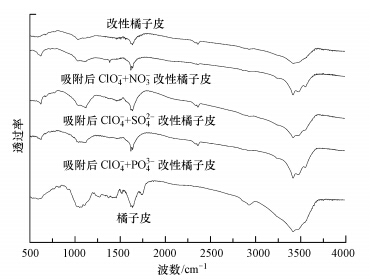 |
| 图 6 吸附剂的红外光谱图 Fig.6 FTIR spectra of different adsorbents |
由图可见,3种阴离子分别与ClO4-竞争吸附后的改性橘子皮在621 cm-1处均出现了新的吸收峰,此处为ClO4-吸附在改性橘子皮上后Cl-O反对称伸缩振动峰(Yoon et al., 2009),这说明3种阴离子竞争吸附下,ClO4-均吸附在了改性橘子皮上.对NO3-、SO42-、PO43-分别与ClO4-竞争吸附后改性橘子皮的红外光谱进行比较可以看出,其主要区别在于:NO3-竞争下的改性橘子皮在1384 cm-1处出现了新的吸收峰,此处为N-O的反对称伸缩振动峰;SO42-竞争下的改性橘子皮在1456 cm-1处出现了新的吸收峰,此处为S-O的反对称伸缩振动峰;PO43-竞争下的改性橘子皮在1120 cm-1处振动峰消失了,综上结果表明,NO3-、SO42-、PO43-均在改性橘子皮吸附ClO4-的过程中发生了竞争吸附.
4 结论(Conclusions)1)在pH < 3时,各竞争阴离子对ClO4-的影响顺序为SO42->NO3-> PO43-,当3 < pH < 10时,竞争离子对ClO4-的影响顺序为SO42->PO43->NO3-,当pH>10时,3种竞争离子对ClO4-的吸附影响趋于相等.
2)在单一组分吸附过程中,ClO4-、NO3-、SO42-、PO43-的吸附均符合Freundlich模型,并且改性橘子皮对4种阴离子的吸附量的大小顺序为ClO4->NO3->SO42->PO43-,这主要是和离子价态以及吸附剂的结构性质有关.
3)在双组分体系吸附中,改性橘子皮吸附阴离子的总量要高于单组分吸附下的吸附量.竞争吸附下,ClO4-的吸附等温线均符合Freundlich模型,并且由等温线拟合数据可知,3种阴离子对ClO4-的竞争影响顺序是:PO43->SO42->NO3-.
4)3种阴离子竞争吸附下,改性橘子皮吸附ClO4-的行为,符合准二级动力学方程,且由速率常数可得,3种阴离子分别共存下,对ClO4-吸附速率的影响顺序为PO43->SO42->NO3-,这是由于ClO4-与共存离子发生再次交换造成的.在实际多种离子共存情况下,应优先把影响因素最大的共存离子去除,再进行ClO4-的吸附,以节约吸附材料的使用量.
5)对3种阴离子竞争吸附后改性橘子皮的红外光谱比较分析,证明了NO3-、SO42-、PO43-均在改性橘子皮吸附ClO4-的过程中发生了竞争吸附.
| [1] | Baidas S, Gao B Y, Meng X G. 2011. Perchlorate removal by quaternary amine modified reed[J]. Journal of Hazardous Materials, 189(1/2):54-61 |
| [2] | Choi Y C, Li X, Raskin L, et al. 2008. Chemisorption of oxygen onto activated carbon can enhance the stability of biological perchlorate reduction in fixed bed biofilm reactors[J]. Water Research, 42(13):3425-3434 |
| [3] | Clark K K, Keller A A. 2012. Adsorption of perchlorate and other oxyanions onto magnetic permanently confined micelle arrays (Mag-PCMAs)[J]. Water Research, 46(3):635-644 |
| [4] | Feng N C, Guo X Y, Liang S. 2009. Adsorption study of copper (II) by chemically modified orange peel[J]. Journal of Hazardous Materials, 164(2/3):1286-1292 |
| [5] | Hingston F J, Posner A M, Quirk J P. 1971. Competitive adsorption of negatively charged ligands on oxide surfaces[J]. Discussions of the Faraday Society, 52:334-342 |
| [6] | Ho Y S, McKay G. 2000. The kinetics of sorption of divalent metal ions onto sphagnum moss peat[J]. Water Research, 34(3):735-742 |
| [7] | Kirk A B. 2006. Environmental perchlorate:Why it matters[J]. Analytica Chimica Acta, 567(1):4-12 |
| [8] | 卢宁, 高乃云, 黄鑫. 2008. 水中高氯酸根的颗粒活性炭吸附过程及影响因素分析[J]. 环境科学, 29(6):1572-1577 |
| [9] | 彭银仙, 吴春笃, 蔡翠云, 等. 2011. 改性桑枝粉及沸石对水中高氯酸盐的吸附研究[J]. 环境工程学报, 5(7):1497-1501 |
| [10] | Sahu A K, Conneely T, Nüsslein K R, et al. 2009. Biological perchlorate reduction in packed bed reactors using elemental sulfur[J]. Environmental Science & Technology, 43(12):4466-4471 |
| [11] | Swain S K, Patnaik T, Patnaik P C, et al. 2013. Development of new alginate entrapped Fe(III)-Zr(IV) binary mixed oxide for removal of fluoride from water bodies[J]. Chemical Engineering Journal, 215-216:763-771 |
| [12] | Tan I A W, Hameed B H, Ahmad A L. 2007. Equilibrium and kinetic studies on basic dye adsorption by oil palm fibre activated carbon[J]. Chemical Engineering Journal, 127(1/3):111-119 |
| [13] | Violante A, Colombo C, Buondonno A. 1991. Competitive adsorption of phosphate and oxalate by aluminum oxides[J]. Soil Science Society of America Journal, 55(1):65-70 |
| [14] | Wang X H, Liu F F, Lu L, et al. 2013. Individual and competitive adsorption of Cr(VI) and phosphate onto synthetic Fe-Al hydroxides[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 423:42-49 |
| [15] | Wu C H, Kuo C Y, Lin C F, et al. 2002. Modeling competitive adsorption of molybdate, sulfate, selenate, and selenite using a Freundlich-type multi-component isotherm[J]. Chemosphere, 47(3):283-292 |
| [16] | Xu X, Gao B Y, Tan X, et al. 2013. Uptake of perchlorate from aqueous solutions by amine-crosslinked cotton stalk[J]. Carbohydrate Polymers, 98(1):132-138 |
| [17] | Yoon I H, Meng X G, Wang C, et al. 2009. Perchlorate adsorption and desorption on activated carbon and anion exchange resin[J]. Journal of Hazardous Materials, 164(1):87-94 |
| [18] | 于哲, 陈维芳, 王宏岩, 等. 2013. 不同吸附材料对水中高氯酸盐的去除效果比较研究[J]. 水资源与水工程学报, 24(4):180-183 |
 2015, Vol. 35
2015, Vol. 35


