随着人类生产生活的快速发展,高氮污染已成为全世界高度关注的重大问题(Zhang et al., 2014;李焱生等,2010),其中,高亚硝酸盐氮会严重影响人与动物的生命活动,甚至导致死亡(杨小龙等,2011;Kroupova et al., 2005).因此,如何减少或去除水体中的亚硝酸盐氮成为当前人类亟待解决的一个问题.在去除亚硝酸盐氮污染的众多方法中,生物除氮是最行之有效且绿色环保的方法之一(周超等,2011;赵翠娟等,2013),然而,晚秋至来年初春期间,生物法去除亚硝酸盐氮因气温低效果不明显.前人研究表明,当温度低于10 ℃时会强烈地抑制硝化作用和反硝化作用的进行(Carrera et al., 2003;Rodriguez-Caballero et al., 2012).而目前国内外研究报道的反硝化除氮细菌温度一般都在30 ℃左右(Chen et al., 2012;Zhang et al., 2012;辛玉峰等,2011;金敏等,2009),还未见耐冷高效亚硝酸盐型反硝化细菌的研究报道.基于此,本研究在10 ℃条件下,从长期淹水的冬水田中分离出12株耐冷亚硝酸盐型反硝化细菌,通过检测12株亚硝酸盐型反硝化细菌对亚硝酸盐氮、总氮的去除效率及合成的生物量氮含量,筛选出一株耐冷高效亚硝酸型反硝化细菌Y-12,该菌对去除低温水体中亚硝酸盐氮具有很好的研究意义及应用前景.
2 材料与方法(Material and methods) 2.1 材料样品采于贵州(海拔2494 m,北纬N28°0′7.42″,东经E108°23′56.41″)长期淹水的冬水田.
2.2 培养基富集培养基(陈薇等,2011):葡萄糖5 g,NaCl 1 g,NaNO2 2 g,MgSO4 0.2 g,KH2PO4 4 g,K2HPO4 6 g,超纯水水定容至1 L,调pH至7.2.
根据反硝化细菌能够还原亚硝酸盐,使pH值升高,当pH大于7.6时BTB培养基变为蓝色(杨小龙等,2011)的原理设计BTB选择性培养基(Bromothymol Blue,BTB)(邵晴等,2008):NaNO2 1 g,KH2PO4 1 g,FeCl2·6H2O 0.5 g,CaCl2·7H2O 0.2 g,MgSO4 ·7H2O 1 g,琥珀酸钠8.5 g,琼脂20 g,BTB(1.5%溴百里酚蓝溶于无水乙醇)1 mL,超纯水定容至1 L,调pH至7.0.
反硝化培养基(Song et al., 2011):乙酸钠4.72 g,NaNO2 0.075 g,KH2PO4 1.5 g,Na2HPO4 0.42 g,MgSO4·7H2O 0.1 g,超纯水定容至1 L,调pH至7.2.
LB 培养基(陈薇等,2011):牛肉膏 3 g,蛋白胨 10 g,NaCl 5 g,蒸馏水定容至1 L(固体加2.0%的琼脂),调pH至7.2.以上所有培养基均在0.11 MPa、121 ℃下灭菌30 min,冷却后备用.
2.3 耐冷亚硝酸盐型反硝化细菌的富集、分离和纯化取1 g样品接入100 mL富集培养基中,10 ℃、150 r · min-1 下恒温振荡培养2 d,取培养液5 mL至100 mL新鲜富集培养基中,如此反复3次.将富集培养物分别取20、30、40 μL涂布于BTB平板培养基上,10 ℃培养2~3 d,挑取能使培养基变蓝的单菌落于新的BTB培养基上进行划线培养,纯化3~5次后,获得纯化的反硝化菌株,接种于LB斜面培养基上,编号,15 ℃培养1 d,4 ℃保存备用.
2.4 耐冷高效亚硝酸盐型反硝化细菌的筛选用灭菌的10 μL枪头从10 ℃培养的平板培养基上挑取一个单菌落于反硝化培养基中,于20 ℃、150 r · min-1条件下振荡培养,每12 h测定各培养液的OD600值,制作各细菌的生长曲线;将处于对数生长期的含约1.0×108 CFU的各菌悬液分别转接到新的反硝化培养基中,以不接菌的反硝化培养基为对照,于20 ℃、150 r · min-1条件下振荡培养,每24 h分别检测实验组和对照组反硝化培养基中亚硝态氮、总氮、细菌OD600及离心除菌后培养液中的总氮含量,以亚硝态氮和总氮去除率最高且合成生物量氮少为主要指标,筛选耐冷高效亚硝酸盐型反硝化细菌.用以下公式计算亚硝态氮和总氮的去除率:
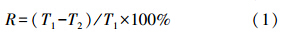
生物量氮通过氮平衡计算获得,其公式为:

将含约1.0×108 CFU的Y-12菌株悬液转接到新的反硝化培养基中,于15 ℃、50 r · min-1条件下振荡培养48 h后,分别检测亚硝酸氮、总氮的去除率及生物氮含量.
总氮浓度采用碱性过硫酸钾消解紫外分光光度法测定(国家环境保护局,2012.),亚硝态氮浓度采用N-(1-萘基)-乙二胺光度法测定(魏复盛等,2002),菌体生长量采用OD600光电比浊法测定.
2.6 细菌的鉴定特异性磷脂脂肪酸(Phospholipid fatty acid,PLFA)鉴定:对所培养的纯菌进行皂化、甲基化、萃取及碱洗涤后获得上机样品,用Agilent 6850气相色谱仪(FID检测器)分析PLFA的成分.色谱条件为:(25.0 m×200 μm×0.33 μm),进样量1 μL,分流比10 ∶ 1,载气(H2),尾吹气高纯N2,助燃气空气,流速0.8 mL · min-1.二阶程序升高柱温:170 ℃起始,5 ℃ · min-1升至260 ℃,而后以40 ℃ · min-1升温至310 ℃,维持1.5 min.各成分脂肪酸通过MIDI Sherlock微生物鉴定系统(Version 6.1,MIDI,Inc.,Newark,DE)进行,标准品购买于美国MIDI公司的C9~C20的脂肪酸甲酯,PLFA用C19:0做内标换算PLFA的绝对含量.
形态学鉴定:挑取单菌落于BTB培养基上划线,于20 ℃培养48 h后观察菌落形态,并挑取少量的菌体进行革兰氏染色和电镜扫描观察.
16S rRNA序列测定及同源性分析:以纯化细菌的基因组DNA为模板,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- GGTTACCTTGTTACGACTT-3′)进行16S rDNA聚合酶链式反应(PCR)扩增.扩增体系(50 μL):模板2 μL,27F和1492R各2 μL,2×Taq PCR Master Mix 25 μL,无菌水19 μL.扩增程序:94 ℃预变性5 min,94 ℃变性1 min,50.5 ℃退火30 s,72 ℃延伸1 min,循环30次,72 ℃延伸10 min.扩增完成后对目的条带进行切胶回收,纯化后将其连至pMD20-T载体,转化到E.coli Trans1-T1宿主细胞中,挑取阳性转化子扩大培养后送公司测序,将其测序结果在NCBI网站进行Blast比对分析.
3 结果(Results) 3.1 耐冷高效亚硝酸盐型反硝化细菌的富集、分离和纯化采用富集培养和酸碱指示剂相结合的方法进行分离和纯化,共获得12株反硝化细菌,分别编号为Y-1~Y-12,对其中反硝化活性较高的8株菌进行了16S rRNA鉴定,发现有7株菌为假单胞菌属(Pseudomonas),其中,2株菌与蒙氏假单胞菌(Pseudomonas monteilii)的同源性达到99%,1株菌与托拉斯假单胞菌(Pseudomonas tolaasii)的同源性达到99%,3株菌与恶臭假单胞菌(Pseudomonas putida)的同源性达到99%,1株菌与恶臭假单胞菌的同源性只有96%,这7株菌落形态相似;1株菌为节杆菌属,与阿氏节杆菌(Arthrobacter arilaiti)的同源性达到99%,这些细菌都具有一定的反硝化活性.
3.2 耐冷高效亚硝酸盐型反硝化细菌的筛选细菌在反硝化培养基中生长繁殖要经过4个时期,即延滞期、对数生长期、稳定期和衰亡期,当细菌生长处于对数期时其个体形态与生理特性都比较稳定,且对环境适应能力强.为了筛选出耐冷高效亚硝酸盐型反硝化细菌,需要将生长处于对数期的好氧反硝化细菌接入新的反硝化培养基中,因此,挑取了12株纯化后的单菌落于反硝化培养基中,测定各细菌的OD600值,绘制其生长曲线,结果如图 1所示.根据该生长曲线,将12株反硝化细菌大致分为两类:①对反硝化培养基适应能力强、生长量大、出现平台期晚的菌株(包括Y-1、Y-2、Y-6、Y-7、Y-8、Y-9和Y-12菌株);②对反硝化培养基适应能力弱、生长量少、出现平台期早的菌株(包括Y-3、Y-4、Y-5、Y-10和Y-11菌株).
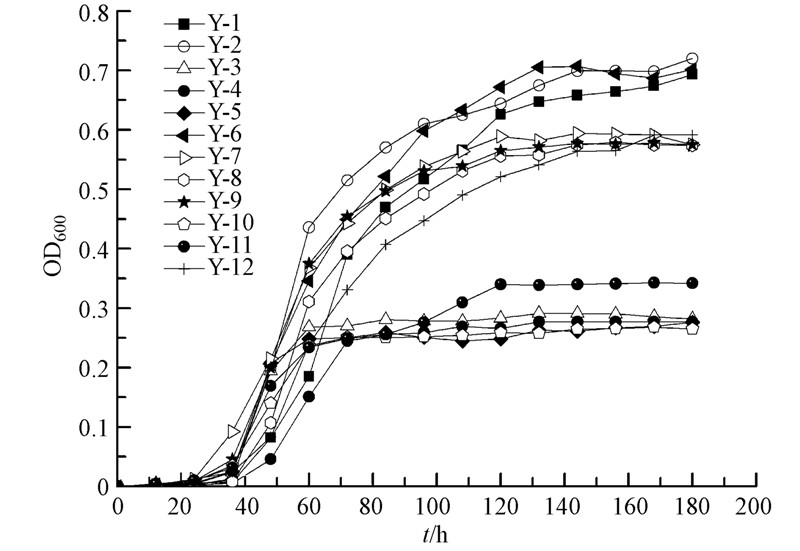 |
| 图 1 12株亚硝酸盐型反硝化细菌在反硝化培养基中的生长曲线 Fig.1 Growth of 12 nitrite denitrifying bacteria in the denitrification medium |
通过比较12株耐冷反硝化细菌对亚硝酸盐氮的去除效果发现(图 2),24 h内,Y-4对亚硝酸盐氮的去除量最大,可使其从15.30 mg · L-1降至2.71 mg · L-1,去除率为82.28%;Y-1对亚硝酸盐氮的去除效果最慢,仅从15.26 mg · L-1降至9.34 mg · L-1,去除率只有38.81%; 48 h内,Y-1、Y-2和Y-3菌株对亚硝酸盐氮的去除率分别为98.29%、96.99%和96.26%,其余菌株对亚硝酸盐氮的去除效率均高达99%以上,其中,Y-12对亚硝酸盐氮的去除率高达99.53%;72 h内,所有菌株对亚硝酸盐氮的去除率均达99%以上,但各菌株对亚硝酸盐氮的去除速率具有差异性(图 2).
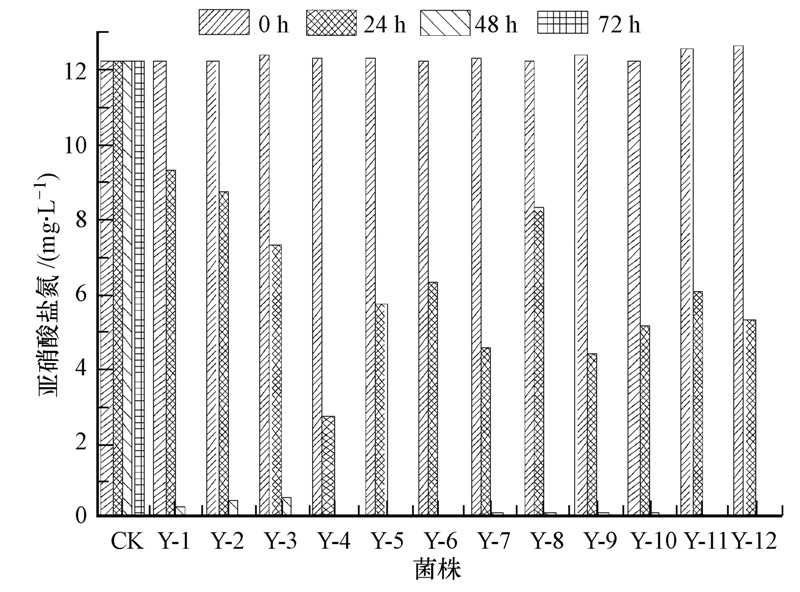 |
| 图 2 12株菌对亚硝酸盐的去除效果 Fig.2 Nitrite removal rate of 12 strains |
12株菌对总氮的去除量表现出了显著差异性,48 h内Y-12对总氮去除率最高,去除率为54.38%;72 h内,有5株反硝化细菌(Y-7、Y-9、Y-10、Y-11和Y-12)对总氮去除率较高,均达到了50%以上,这5株细菌对总氮的去除能力显著强于Zheng等(2011)分离的好氧反硝化细菌S1-1(实验条件:20 ℃、5 d、160 r · min-1,总氮去除率为31.89%),Y-12对总氮去除率最大,能使总氮由15.37 mg · L-1降至6.50 mg · L-1,去除率高达 57.74%(图 3).余下菌株对总氮的去除能力较弱,Y-5对总氮的去除率最低,只有25.13%.
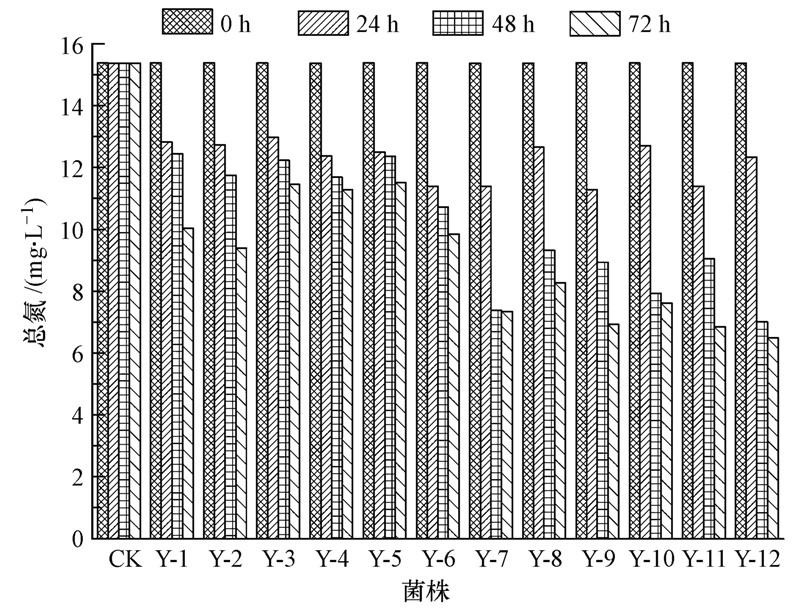 |
| 图 3 12株菌对总氮的去除效果 Fig.3 Total nitrogen removal rate of 12 strains |
通过氮平衡的方法计算出了菌体生长所合成的生物量氮含量,结果如图 4所示,其中,Y-1~Y-5生物量氮合成量较大,该类菌对亚硝酸盐氮和总氮的去除可能主要是将它们转化为了生物量氮或含氮物质的代谢产物,导致总氮下降不显著.相反Y-7、Y-11和Y-12三株反硝化细菌合成的生物量氮含量较少,分别为3.56、3.32和3.25 mg · L-1,该类菌对亚硝酸盐氮和总氮的去除可能主要是将它们转化为氮的氧化物或氮气,释放到大气中,使亚硝酸盐氮和总氮明显下降.
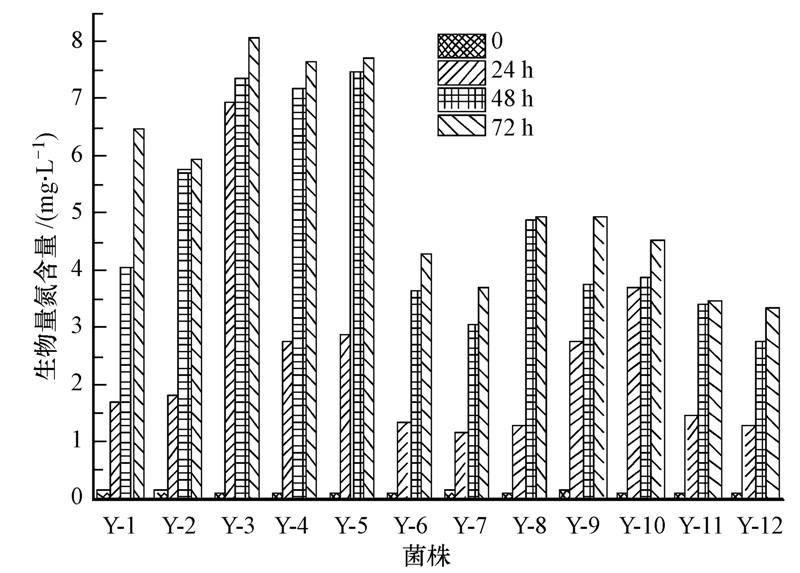 |
| 图 4 12株菌的生物量氮含量 Fig.4 Biomass nitrogen of 12 strains |
生物法除氮比物理和化学方法更加有效且低廉而受到广泛的研究(Wang et al., 2013),但在进行生物脱氮时,微生物会通过同化作用将部分亚硝酸盐氮转化为自身生长所必需的含氮化合物(如蛋白质、核糖核酸、脱氧核糖核酸等),微生物死亡后,这部分氮将会返回水环境,导致水体中有机氮含量增高,水体的透明度降低.由此可见,采用生物法除氮时生物氮含量不容忽视,因此,筛选出生物量氮合成少的亚硝酸盐型反硝化细菌对污水处理具有重要意义.
综合比较12株反硝化细菌对亚硝酸盐氮和总氮去除率、同化作用合成的生物量氮含量及在反硝化培养基中的生长速度,最终筛选出了一株耐冷高效亚硝酸盐型反硝化细菌,命名为Y-12.该菌在72 h内可将亚硝酸盐氮由15.22 mg · L-1降至0.02 mg · L-1,去除率为99.87%;总氮由15.37 mg · L-1降至6.50 mg · L-1,去除率为57.74%,其中,只有21.14%(3.25 mg · L-1)的转化成为生物量氮.
3.3 菌株Y-12的耐冷试验实验结果表明,Y-12菌株在15 ℃条件下,48 h内均能有效地去除亚硝酸盐氮和总氮(表 1),与该菌在20℃条件下除氮效果相比,其对亚硝酸盐氮的去除率没有表现出明显的差异,但对总氮的去除效果有所下降,生物量氮的合成量也有所降低,这也许是温度降低导致细菌生长减慢的原因.
| 表 1 Y-12在15℃条件下的除氮效果 Table 1 Nitrogen removal rate of Y-12 at 15℃ |
磷脂脂肪酸是生物体重要组成部分之一,不同微生物类群可通过不同代谢途径合成不同的磷脂脂肪酸,磷脂脂肪酸在不同的微生物类群中比较恒定,且具有微生物特异性和结构多样性,是磷脂脂肪酸图谱分析方法的重要依据,而气相色谱能够简单、快速、灵敏且精确地检测出细胞所持有的特异性磷脂脂肪酸(张国赏等,2005;蓝江林等,2010;Pratt et al., 2012).本研究对Y-12的特异性磷脂脂肪酸鉴定结果如表 2所示,该菌与恶臭假单胞菌(Pseudomonas-putida-biotype A)的相似指数为0.469,为非典型的恶臭假单胞菌.
| 表 2 特异性磷脂脂肪酸的鉴定结果 Table 2 The result of the specific phospholipid fatty acids identificatio |
菌株Y-12在BTB培养基上形成的菌落特征为淡蓝色,湿润,圆形,中央隆起,边缘整齐.革兰氏染色为阴性,油镜下观察细胞呈短杆状(图 5),通过对菌株Y-12电镜扫描,发现该菌也呈短杆状,且着生鞭毛(图 6).
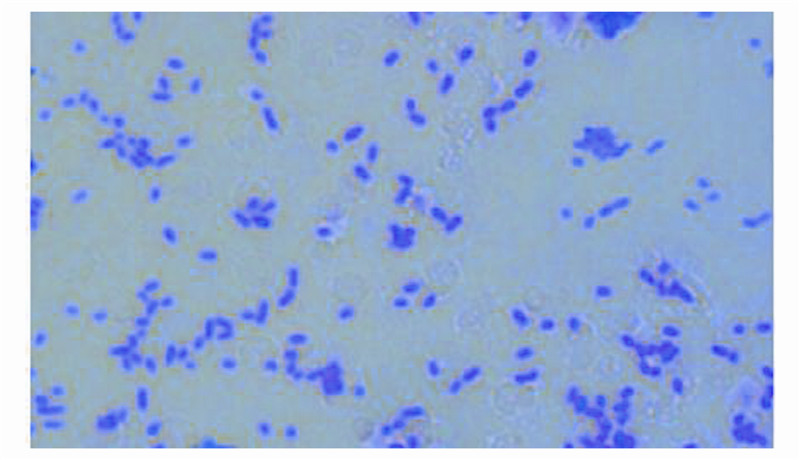 |
| 图 5 菌株Y-12菌体形态(10×100) Fig.5 Unicell morphology of strain Y-12(10×100) |
 |
| 图 6 电镜扫描下的Y-12菌株(15000×) Fig.6 Y-12 strain under the scanning electron microscope(15000×) |
对菌株Y-12的16S rRNA进行PCR扩增,克隆后的测序结果显示,该菌的16S rRNA全长为1459 bp.Blast比对分析发现,菌株Y-12与恶臭假单胞菌(Pseudomonas putida)系统发生地位基本相同,相似度达到99%.从GenBank数据库中选取该菌株对应的模式菌株,采用MEGA6.0软件进行多序列比对分析,并用邻近法构建系统发育树(图 7).结合菌株Y-12的形态学观察、特异性磷脂脂肪酸鉴定及16S rRNA鉴定结果显示,菌株Y-12与恶臭假单胞菌亲缘关系最近.
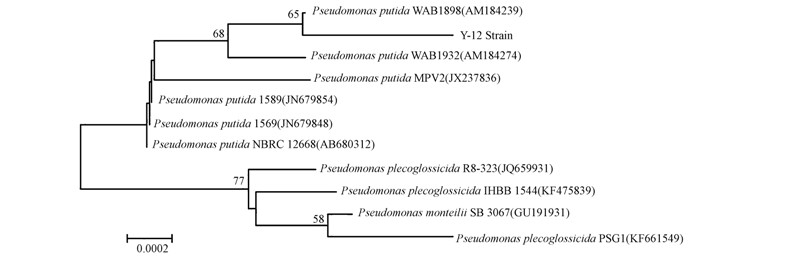 |
| 图 7 菌株Y-12的系统发育进化树 Fig.7 Phylogenetic tree of the Y-12 strain |
目前,国内外对反硝化细菌除氮的研究比较深入,同时取得了很大的进展,但对反硝化除氮过程所产生的生物量氮关注较少,Zheng等(2011)采用离心后用蒸馏水洗涤2遍,再按照测定总氮的方法进行生物量氮的测定,该方法的缺点在于:①用蒸馏水洗涤并不一定能将菌液中的氮全部清洗干净;②用蒸馏水洗涤可能带走部分菌体;③蒸馏水作为一种低渗溶液,不适合那些在低渗溶液中细胞容易破裂的细菌.这3个方面都将导致生物量氮测定不准确.本研究采用的是氮平衡法,即测定出总氮含量和去除菌体后培养液中的总氮含量,二者之差则为生物合成的氮含量,这种研究方法避免了以上各种因素导致的不准确性.
前人研究认为,能在0~5 ℃生长繁殖,最适生长温度在15 ℃以上,最高温度可达20 ℃以上的细菌为耐冷菌(Morita,1975;刘梦洋等,2011).本研究将分离筛选的Y-12菌株在LB平板培养基上划线,于10 ℃条件下培养,2 d可见大量菌落出现;在BTB平板培养基上划线,同等条件下培养,3 d可见大量菌落;挑取单菌落于反硝化培养基中,20 ℃条件下,48 h内其生长可进入对数期.为了快速筛选出耐冷高效亚硝酸盐型反硝化细菌,本试验根据前人研究耐冷脱氮菌进行生物脱氮时的最适温度(20 ℃)(Zheng et al., 2011;Huang et al., 2013;Yao et al., 2013)设置为筛选耐冷反硝化细菌的温度.筛选出来的Y-12菌株在15 ℃条件下,48 h内对亚硝酸盐氮和总氮的去除率分别能达到99.48%和51.53%,达到了较高水平.
据报道,温度对反硝化作用的限制比起其他影响因素(pH、低溶解氧浓度、有毒化合物、高有机负荷等)是最显著的,低温是导致亚硝酸盐还原潜势下降的主要原因(Carrera et al., 2003;Rodriguez-Caballero et al., 2012).为了提高微生物对晚秋至来年初春低温地区受氮化合物污染水体的脱氮能力,前人对低温反硝化细菌除氮进行一定的探索.如李军等(2012)从冬季淹水泥中分离筛选出一株耐冷反硝化细菌Y2,以10%的接种量考察了反硝化细菌在不同温度条件下对硝酸盐的去除情况,结果显示,3 d内,15 ℃条件下该菌对硝酸盐的去除率只有12.9%,在其最适温度条件下(25 ℃),对硝酸盐氮的去除率只有57.7%.Huang等(2013)对所分离获得的一株耐冷菌(Acinetobacter sp.)Y16的研究显示,该菌株在其最优温度(20 ℃)条件下对铵氮的去除率只有61.40%±1.01%.Zheng等(2011)对所分离的耐冷菌(Psychrobacter sp)的研究表明,该菌在其最适温度(20 ℃)条件下对亚硝酸盐的去除率为63.50%,对总氮的去除率只有31.89%.而本研究在10 ℃条件下分离出了一株耐冷高效亚硝酸盐型反硝化细菌Y-12,在20 ℃条件下,72 h内对亚硝酸盐氮和总氮的去除率分别能达到99.87%和57.74%,其脱氮率均显著高于前人所分离的好氧反硝化细菌,达到了较高的水平.此外,还未见能以亚硝酸盐为唯一氮源生长的耐冷亚硝酸盐型反硝化细菌的有关报道.
本研究以去除亚硝酸盐氮和总氮效率高、生物量氮合成少相结合的方法筛选耐冷高效亚硝酸盐反硝化细菌,避免了单一因素筛选的局限性.对所分离筛选得到的反硝化细菌采用特异性磷脂脂肪酸和16S rRNA进行双重鉴定,发现其均与恶臭假单胞菌的亲缘关系最近,因此,将其鉴定为恶臭假单胞菌具有可靠性.
5 结论(Conclusions)1)本研究在10 ℃条件下分离出了一株耐冷高效亚硝酸盐型反硝化细菌Y-12,该菌株在20 ℃条件下能有效地去除亚硝酸盐氮和总氮,其去除率分别为99.87%和57.74%,其中有21.14%(3.25 mg · L-1)的氮转化成为生物量氮;在15 ℃条件下,该菌对亚硝酸盐氮和总氮去除率分别为99.48%和51.53%,在该过程中只有19.60%(3.00 mg · L-1)的氮转化成为生物量氮.
2)Y-12菌株的16S rRNA序列与恶臭假单胞菌的同源性达到99%,其特异性磷脂脂肪酸与恶臭假单胞菌相似指数为0.469,结合其形态学特征,将其初步鉴定为恶臭假单胞菌.
| [1] | Carr era J,Vicent T,Lafuente F J.2003.Influence of temperature on denitrification of an industrial high-strength nitrogen wastewater in a two-sludge system[J].Water SA,29(1): 11-16 |
| [2] | Chen Q,Ni J R.2012.Ammonium removal by Agrobacterium sp.LAD9 capable of heterotrophic nitrification-aerobic denitrification[J].Journal of Bioscience and Bioengineering,113(5): 619-623 |
| [3] | 陈薇,丁祥力,贺月林,等.2011.亚硝酸盐降解菌的分离鉴定及其降解特性[J].环境科学与技术,34(12H): 37-41 |
| [4] | 国家环境保护局.2012.HJ636-2012 水质总氮的测定碱性过硫酸钾消解紫外分光光度法[S].北京: 中华人民共和国环境保护部 |
| [5] | Huang X F,Li W G,Zhang D Y,et al.2013.Ammonium removal by a novel oligotrophic Acinetobacter sp.Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J].Bioresource Technology,146: 44-50 |
| [6] | 金敏,王景峰,孔庆鑫,等.2009.好氧异养硝化菌 Acinetobacter sp.YY-5 的分离鉴定及脱氮机理[J].应用与环境生物学报,15(5): 692-697 |
| [7] | Kroupova H,Machova J,Svobodova Z.2005.Nitrite influence on fish: a review[J].Veterinarni Medicina,50(11): 461-471 |
| [8] | 蓝江林,刘波,陈璐,等.2010.芭蕉属植物内生细菌磷脂脂肪酸 (PLFA) 生物标记特性研究[J].中国农业科学,43(10): 2045-2055 |
| [9] | 李军,闫爽,邓娴,等.2012.一株耐冷反硝化菌的分离鉴定及其反硝化特性[J].沈阳建筑大学学报(自然科学版),28(4): 722-727 |
| [10] | 李焱生,魏民,张艾晓,等.2010.一株异养型亚硝酸盐氧化细菌的分离及其降解特性的研究[J].生物技术通报,(5): 196-202 |
| [11] | 刘梦洋,李明堂,翟强强.2011.耐冷菌在低温下处理污水的研究进展[J].北方环境,23(3): 124-126 |
| [12] | Morita R Y.1975.Psychrophilic bacteria[J].Bacteriological Reviews,39(2): 144-l67 |
| [13] | Pratt B,Riesen R,Johnston C G.2012.PLFA analyses of microbial communities associated with PAH-contaminated riverbank sediment[J].Microbial Ecology,64(3): 680-691 |
| [14] | Rodriguez-Caballero A,Hallin S,Phlson C,et al.2012.Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J].Water Science & Technology,65(2): 197-204 |
| [15] | 邵晴,余晓斌.2008.好氧反硝化细菌的筛选及反硝化特性研究[J].生物技术,18(3): 63-65 |
| [16] | Song Z F,An J,Fu G H,et al.2011.Isolation and characterization of an aerobic denitrifying Bacillus sp.YX-6 from shrimp culture ponds[J].Aquaculture,319(1/2): 188-193 |
| [17] | Wang P,Yuan Y Z,Li Q,et al.2013.Isolation and immobilization of new aerobic denitrifying bacteria[J].International Biodeterioration & Biodegradation,76: 12-17 |
| [18] | 魏复盛,毕彤,齐文启.2002.水和废水检测分析方法 (第四版)[M].北京: 中国环境科学出版社.104-105; 209-213; 243-248; 276-281 |
| [19] | 辛玉峰,曲晓华,袁梦东,等.2011.一株异养硝化—反硝化不动杆菌的分离鉴定及脱氮活性[J].微生物学报,51(12): 1646-1654 |
| [20] | 杨小龙,李文明,陈燕,等.2011.一株好氧反硝化菌的分离鉴定及其除氮特性[J].微生物学报,51(8): 1062-1070 |
| [21] | Yao S,Ni J R,Ma T,et al.2013.Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium,Acinetobacter sp.HA2[J].Bioresource Technology,139: 80-86 |
| [22] | 张国赏,吴文鹃,潘仁瑞.2005.气相色谱-质谱法检测细胞脂肪酸及其在细菌鉴定上的应用[J].合肥联合大学学报,10(4): 92-96 |
| [23] | Zhang H J,Qi S D,Dong Y L,et al.2014.A sensitive colorimetric method for the determination of nitrite in water supplies,meat and dairy products using ionic liquid-modified methyl red as a colour reagent[J].Food Chemistry,151: 429-434 |
| [24] | Zhang Q L,Liu Y,Ai G M,et al.2012.The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium,Bacillus methylotrophicus strain L7[J].Bioresource Technology,108: 35-44 |
| [25] | 赵翠娟,宋文军,朱高雄,等.2013.除氨氮菌在污水处理中的研究进展[J].生物技术通报,(2): 31-34 |
| [26] | Zheng H Y,Liu Y,Sun G D,et al.2011.Denitrification characteristics of a marine origin psychrophilic aerobic denitrifying bacterium[J].Journal of Environmental Sciences,23(11): 1888-1893 |
| [27] | 周超,高乃云,楚文海,等.2011.水体中亚硝酸盐生物毒性和去除的研究进展[J].给水排水,37(5): 104-108 |
 2015, Vol. 35
2015, Vol. 35


