抗生素因其具有促进生长,防止感染,治疗疾病的作用而被广泛应用于畜禽养殖业(Kemper,2008).据研究,大部分抗生素会通过畜禽粪便排出体外(Arikan et al.,2006).中国每年生产抗生素21万t,有50%的抗生素被用于畜牧养殖业(王云鹏和马越,2008).畜禽粪便中残留的抗生素,会对畜禽粪便的处理过程产生一定的影响.厌氧发酵是一种成熟的处理畜禽粪便方法不仅可以解决畜禽粪便所带来的环境问题,还能产生可再生的清洁能源(Mohring et al.,2009; lvarez et al.,2010).Massé等(2000)的研究表明青霉素会使中温厌氧发酵甲烷产量减产35%,而Arikan等(2006)的研究表明实验含有土霉素的奶牛粪便进行厌氧发酵使甲烷减产27%,但对挥发性物质和可溶性有机碳的降解没有影响.有文献甚至表明高浓度的抗生素对于厌氧发酵过程中甲烷产量没有影响(Lallai et al.,2002).Cetecioglu等(2013)连续对厌氧发酵系统中加入低浓度的四环素5个月后,发现厌氧发酵系统不仅停止产生沼气,且停止加入四环素后,微生物活性在10 d内依然没有恢复.
中国目前用于畜禽养殖业的抗生素以四环素类居多,四环素类抗生素主要有3种,即金霉素(chlortetracycline,CTC)、四环素(tetracycline,TC)和土霉素(oxytetracycline,OTC)(Sarmah et al.,2006).当前有关四环素和金霉素对厌氧发酵过程的影响研究较多,有关土霉素对厌氧发酵的影响目前研究较少(Ince et al.,2013).厌氧发酵是一个复杂的生物化学过程,据目前的研究可以分为3个阶段,即液化阶段,产酸阶段和产甲烷阶段.液化阶段主要由胞外酶起作用,产酸阶段则由胞内酶起主导作用,液化阶段和产酸阶段为大量甲烷的产生奠定了坚实的物质基础(Bryant,1979).脲酶与厌氧发酵中的氮素循环密切相关(陈琳等,2012),而脱氢酶则在厌氧发酵的能量循环和物质循环中扮演重要角色(解军等,2006),然而有关土霉素对于厌氧发酵过程中酶活性的影响至今尚缺少相关信息.甲烷产量是衡量厌氧发酵系统优劣的重要指标,故通过测量甲烷产量可以得出土霉素对于厌氧发酵系统的影响.土霉素的含量变化会影响厌氧发酵系统中微生物的群落组成,进而影响整个厌氧发酵进程,分析土霉素含量的动态变化,可以解释酶活性以及甲烷产量变化的原因.故本试验通过对猪粪添加不同浓度的土霉素,重点研究土霉素对猪粪厌氧发酵过程中脲酶活性和脱氢酶活性的影响,为研究土霉素对厌氧发酵过程中的抑制机理提供理论依据.
2 材料与方法(Materials and methods) 2.1 发酵原料土霉素购自Solarbio,纯度为97%,试验所用猪粪和小麦秸秆(作为调节物质)采自陕西杨凌五星村农户小型养殖场,农民以剩饭菜喂养猪,不含饲料添加剂.小麦秸秆和猪粪的主要成分及含量见表 1,接种物采自陕西杨凌崔西沟村农用沼气池中的沼液,其总固体含量(TS)为7.8%,pH为8.2,挥发性固体(VS)含量为48.8%.
| 表 1 试验材料基本性质 Table 1 Basic parameters of experiment materials |
小麦秸秆自然风干粉碎成2~5 cm的小段后,置于12 L塑料桶内,加入沼液(沼液与秸秆质量比为7 ∶ 3)(李连华等,2007)和占沼液与秸秆总质量0.8%的微生物腐解菌剂(该菌剂由西北农林科技大学资源环境学院提供(李鸣雷等,2004)).塑料桶置于37 ℃水浴锅内,每3 d充分搅拌1次,预处理7 d至小麦秸秆颜色发暗后作为发酵原料.
2.2 试验装置本试验装置如图 1所示.由2.5 L发酵罐、2 L量筒、2 L集气瓶3部分组成.量筒用于收集从集气瓶中排出的水,以计算产气量.发酵罐置于37 ℃恒温水浴锅中(DK-600,上海精宏实验设备有限公司),发酵罐与集气瓶瓶口用胶塞塞紧,各部分用乳胶管连接,所有接口处均用凡士林密封.
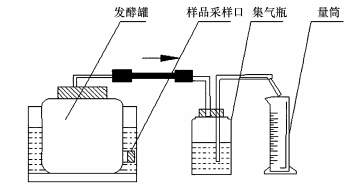 |
| 图 1 发酵装置示意图 Fig.1 Schematic diagram of experimental equipment |
取预处理完成的小麦秸秆和猪粪,根据两种原料含水率以及C/N加水调节总固体质量分数为8%,C/N=25 ∶ 1,接种沼液30%(湿重计).根据张树清等(2005)对猪粪中土霉素含量的研究,本试验共设置4个处理,添加土霉素的量(占干猪粪的比例)依次为:0 mg · kg-1(对照处理CK)、60 mg · kg-1(L处理)、100 mg · kg-1(M处理)、140 mg · kg-1(H处理).将土霉素溶液与原料充分混匀装入发酵罐内,密封在暗处进行发酵,每天早8点和晚8点各摇动1次,每个处理重复3次.
2.4 样品采集每5 d对沼液沼渣混合物进行采样,采样前晃动发酵罐混匀其中物料,将采集样品存于100 mL棕色细口瓶中,采样后样品分为两份,一份保存于4 ℃冰箱用于酶活性的测定;一份保存于-80 ℃冰箱用于土霉素浓度的测定.酶活性3 d之内完成测定,土霉素浓度待发酵结束后统一测定.
每天对沼气样品进行采样,用50 mL塑料针筒注射器对集气瓶进行取样,采集完毕后用三通阀进行封口,常温保存,1 d之内完成测定.
2.5 样品测定 2.5.1 酶活性的测定脲酶活性测定参照关松荫(1986)的方法,以24 h后1 mL样品中生成的NH3-N的毫克数表示,单位为mg · mL-1 · d-1.脱氢酶活性测定参照朱南文等(1996)的方法,以1 h后1 mL样品中生成的三苯基甲簪(TF)的微克数表示,单位为μg · mL-1 · h-1.
2.5.2 土霉素浓度的测定样品土霉素含量测定参照童子林等(2012)和孙刚等(2010)的方法,取4 mL沼液沼渣混合样品于15 mL离心管中,加入3 mL EDTA-Mcllvaine缓冲液,涡旋振荡30 s后超声萃取10 min(KQ-250DB,昆山市超声仪器有限公司),将萃取后的样品以4000 r · min-1离心20 min后,把上清液转移至另一离心管,加入10%三氯乙酸0.5 mL静置4 h.再次离心4000 r · min-1 20 min,上清液转移至另一离心管.重复提取2次,获得提取液备用.
将获得的提取液过已经活化的SPE小柱(SUPELCLEAN LC-18,3mL,色谱科公司,USA),首先用5 mL超纯水冲洗SPE小柱,然后用0.01 mol · L-1的草酸甲醇溶(3 mL)液洗脱土霉素,洗脱液在40 ℃条件下用高纯氮气吹至近干,用流动相定容至1 mL待测.
液相色谱仪(Waters 600E-2487液相色谱仪,USA)的工作条件如下:紫外检测器,检测波长为355 nm;流速为1.0 mL · min-1;流动相为草酸溶液(0.01 mol · L-1)、乙腈及甲醇的混合液(体积比为76 ∶ 16 ∶ 8,pH=2.5),进样体积为25 μL.
为了检测抗生素的提取效率,在测定样品中土霉素浓度的同时测定回收率.具体方法为在对照处理样品中添加不同浓度的土霉素,每个浓度重复3次,平衡3 h后用上述方法进行提取.回收率结果如表 2所示.
| 表 2 土霉素回收率 Table 2 Recovery rates of OTC |
气相色谱(Agilent 7890A气相色谱仪,USA)条件:手动进样,FID检测器(检测器温度为250 ℃,氢气流速为60 mL · min-1,空气流速为360 mL · min-1,尾吹气(N2)流速为20 mL · min-1),色谱柱为HP-INNOWAX(19091N-133)毛细管柱,规格为30 m×0.25 mm×0.25 μm,柱温30 ℃.
2.5.4 总固体(TS)和挥发性固体(VS)的测定总固体质量(TS):烘干法(105 ℃下烘4~6 h),挥发性固体(VS)质量测定:烘干法(马弗炉550 ℃下烘1 h).
2.5.5 数据处理根据排水法测定得出沼气产量,记为M.取气体样品进气相色谱进行测定,得出甲烷浓度,记为C.实际甲烷产量P=M · C.
数据采用SPSS(v19.0)进行统计分析,采用LSD(Least-Significant Difference)法分析差异是否显著,Sigma Plot(v10.0)进行绘图,数据为平均值±标准误差.
3 结果与分析(Results and analysis) 3.1 不同浓度土霉素对厌氧发酵中酶活性的影响 3.1.1 不同浓度土霉素对厌氧发酵中脲酶活性的影响脲酶是一种作用于线性酰胺C—N键的水解酶,它能催化酰胺化合物转变为氨,与氮素转化密切相关(梁东丽等,2009).脲酶活性的变化如图 2所示.脲酶活性整体呈现先升高后降低的趋势.厌氧发酵初期,L、M处理脲酶活性显著大于对照处理(p<0.05),H处理与对照相比虽然差异不显著,但其脲酶活性均值也大于对照处理.这可能是由于土霉素具有酰胺键结构(鲍艳姣等,2013),脲酶以酰胺键作为底物,根据底物诱导原理,导致在厌氧发酵初期,土霉素促进了脲酶的活性,这与陈智学等(2013)和姚志鹏等(2009)研究结果相类似.随着厌氧发酵的进行,在第10 d时,所有处理脲酶活性均达到了最大值,这可能是因为这一时期发酵原料充足,促进了微生物的生长和酶的合成,使酶活性逐渐增加至最大值(朴哲等,2001).30 d之后的脲酶活性表明,添加土霉素处理脲酶活性显著低于对照处理,H处理脲酶活性显著低于其他添加土霉素处理,原因可能在于土霉素的累积毒害作用开始显现,减少了分泌脲酶微生物的密度,进而使脲酶有所减少.厌氧发酵完成时,不同浓度土霉素对脲酶活性的抑制率从L至H依次为28%、21%、53%.第60 d添加土霉素处理脲酶活性相较于30 d有所升高,一方面可能是由于随着土霉素的不断降解,使得能分泌脲酶的微生物活性有所恢复;另一方面可能是因为抗性微生物的产生(Thiele-Bruhn and Beck, 2005)因此在厌氧发酵后期L至H处理脲酶活性得到一定的提升.
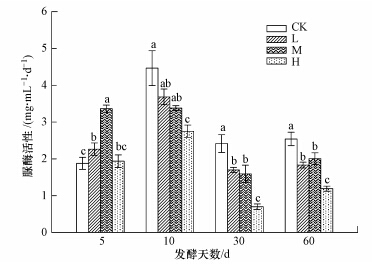 |
| 图 2 不同时间脲酶活性变化(图中不同小写字母表示差异著,差异显著性水平为p<0.05,误差棒是标准误差(n=3),下同) Fig.2 Temporal variation of urease activities(The error bar are the st and ard deviation(n=3), and different letters in the graph indicate difference at p<0.05,the same below) |
脱氢酶的活性可以用来表征生物体的活性状态,能直接表示生物细胞对其基质降解能力的强弱;是微生物降解有机物污染物,获得能量的必需酶(解军等,2006).脱氢酶活性变化如图 3,所有处理脱氢酶活性随着反应的进行呈下降趋势.发酵初期,随着添加土霉素浓度的增加,脱氢酶活性逐渐降低,添加土霉素处理的脱氢酶活性均显著低于对照处理,这与前人的研究结果相似(王静等,2011;Boleas et al., 2005).这是因为土霉素浓度越高,对微生物活性的抑制作用越明显,脱氢酶活性的大小恰好能反应厌氧发酵体系中微生物活性的大小(许晓路和申秀英,1993).随着发酵的继续,L、M处理脱氢酶活性变得和对照处理差异不显著(p>0.05),这可能与土霉素不断降解使微生物活性有所恢复有关.当厌氧发酵完成时,H处理脱氢酶活性显著小于其他处理,其酶活性大小分别占CK至M的24%、32%和35%,姚志鹏等(2009)也取得了与本研究类似的结果,这可能是因为H处理土霉素浓度过大,土霉素的累积毒性在厌氧发酵后期显现,使得H处理微生物活性降低,进而使得其脱氢酶活性小于其他处理.厌氧发酵完成时,不同浓度土霉素对脱氢酶活性的抑制率从L至H依次为28%、32%、76%.脲酶是一种胞外酶,脱氢酶是一种胞内酶.土霉素对于二者在厌氧发酵初期的影响效果不同,可能是由于土霉素的pKow在-1至-2,较大的Kow使土霉素具有更好的生物亲和性,Goel等(1998)认为生物亲和性好的化合物更容易进入细胞体内,对胞内酶影响更大,因此土霉素对于脱氢酶的影响更大,脱氢酶对于土霉素也更加敏感.
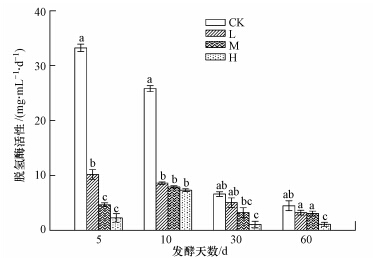 |
| 图 3 不同时间脱氢酶活性变化 Fig.3 Temporal variation of dehydrogenase activity |
由图 4可知,所有处理甲烷累积产量均随时间呈上升趋势.在厌氧发酵初期(前12 d),含有抗生素的处理,没有出现产甲烷停滞现象,这与Arikan等(2006)的研究结果一致,且L至H甲烷累计产量依次比对照高出31.7%、11.6%和23.4%,即添加土霉素处理甲烷累积生成量均高于对照(p<0.05).这表明,在厌氧发酵初期土霉素对产甲烷有一定促进作用.这可能是因为在厌氧发酵初期,土霉素对脲酶产生了一定的促进作用,脲酶活性较高,促进了氨态氮的产生,进而促进了产甲烷菌生长.厌氧发酵28 d后,对照处理甲烷累积产量开始高于其他处理,这种差距随着厌氧发酵的进行而逐渐增加,可能是因为土霉素对产甲烷微生物以及分泌脲酶微生物的负作用在厌氧发酵后期大于土霉素对脲酶所产生的正效应.H处理甲烷产量一直处于较低水平,可能是因为添加的抗生素浓度过大,导致VFA(挥发性脂肪酸)含量升高(尤其是乙酸)(Cetecioglu et al.,2013),抑制了产甲烷微生物的活性.当厌氧发酵结束时(第60 d),CK至H的累积甲烷产量依次为:16904 mL、15402 mL、16120 mL和15311 mL,同对照相比依次减少了8.9%,4.6%,9.4%.方差分析结果表明CK处理显著(p<0.05)高于其他处理,M处理显著高于L和H处理,L和H处理之间差异不显著.目前大多数文献结果表明添加土霉素浓度越高,对甲烷产量抑制越显著(Arikan et al., 2006; Loftin et al., 2005).而Lallai等(2002)研究表明即使土霉素浓度达到250 mg · L-1,仍然没有对甲烷产量产生抑制效应,后经研究发现Lallai等研究所用接种物取自之前已处理过含有抗生素猪粪的厌氧发酵反应器中,经过一定时间的驯化使得接种物中的微生物已经适应了较高浓度的土霉素.这表明接种物来源会影响最终甲烷产量,不仅如此,添加抗生素的浓度、反应器的尺寸、畜禽粪便来源等等均可以影响厌氧发酵最终的产气结果(lvarez et al., 2010),本研究表明,中浓度(M)土霉素处理对于甲烷产量的抑制效果小于低浓度(L)和高浓度(H)处理.造成本次试验结果与前人的研究有所不同的的原因比较复杂,可能因为经过本次试验的培养与驯化,使得含有中浓度土霉素这一厌氧发酵系统与其他两个处理相比最适宜接种物中微生物的生长(Beneragama et al.,2013),从而得出本研究的结果.
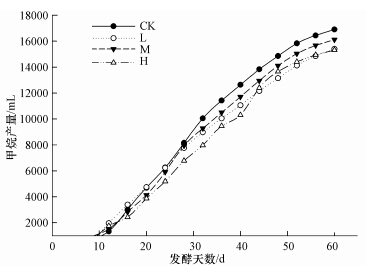 |
| 图 4 不同时间甲烷累积产量 Fig.4 Temporal variation of cumulative production of CH4 |
厌氧发酵中土霉素的含量变化如表 3所示.其中CK处理未检出土霉素,这可能是因为发酵原材料中不含有土霉素,也有可能是其含量过低超出本试验所用方法的检出限.整体看来,L至H处理土霉素含量随时间持续逐渐减少.由表可知,土霉素含量在第10 d大幅度减少,L至H的土霉素降解率依次为62%,70%和68%,这和Ince等(2013)的研究相类似.厌氧发酵30 d之后,L至H处理土霉素含量基本维持不变,这与lvarez等(2010)研究相似.30 d之后土霉素降解速度减慢,可能是因为土霉素被添加后,会与粪便中的蛋白质、污泥颗粒、有机组分产生吸附效应(Kümmerer,2001),导致一部分被吸附在有机组分之上,一部分和猪粪中大量存在的二价阳离子形成稳定的配合物,增强了土霉素的稳定性,延长了生物降解的时间(Loke et al.,2003).厌氧发酵结束时,L至H的土霉素降解率依次为80.9%,78.2%,82.2%.然而值得注意的是,lvarez等(2010)的研究表明伴随着土霉素的去除,土霉素会产生一些其他类型的代谢产物(如EOTC),其研究表明该类代谢产物只会有略微减少,随后稳定存在于厌氧发酵体系中的固相之中;而Arikan等(2006)的研究表明该类代谢产物会呈现先增加后减小的趋势.总之,在有所减小后,代谢产物均会出现在厌氧发酵产物之中.Halling-Srensen等(2002)研究表明,某些四环素类抗生素的降解产物(如ATC、EATC),其毒性大于母体抗生素,俞文和等(1988)也取得了相似的研究成果.假如把含有土霉素代谢产物的厌氧发酵产物作为一种优质肥料施入土壤,是否会对土壤环境、植物生长造成影响,有待进一步研究.
| 表 3 土霉素含量变化 Table 3 Variation of OTC concentration |
厌氧发酵前后物料挥发性固体含量如表 4所示.对照处理VS降解率最高,为66.7%,添加土霉素处理VS降解率均显著小于对照,但各添加土霉素处理VS降解率差异不显著,这与前人研究相类似(Beneragama et al., 2013),这可能是因为土霉素的添加会阻碍厌氧发酵系统中微生物对于VS的利用.由表可知,所有处理的VS含量随时间均有较大程度的下降(均在40%以上),这证明采用厌氧发酵处理畜禽粪便,能较为有效的减小其体积.
| 表 4 厌氧发酵前后VS质量变化 Table 4 Variation of VS during anaerobic digestion |
1)厌氧发酵初期,土霉素对于甲烷产量有一定的促进作用,以后转变为抑制作用.
2)土霉素对脲酶活性在厌氧发酵初期的激活作用有助于氨态氮的产生,进而有利于产甲烷菌的生长;厌氧发酵后期,土霉素对脲酶活性的影响转变为负效应.
3)低(60 mg · kg-1)、中(100 mg · kg-1)浓度土霉素对脱氢酶活的抑制作用在厌氧发酵后期解除,高浓度土霉素(140 mg · kg-1)对脱氢酶活性一直表现为抑制作用.
4)厌氧发酵不仅可以有效地去除猪粪中残留的土霉素,降低其环境风险,还可以回收生物质能源.
| [1] | Álva rez J A, Otero L, Lema J M, et al. 2010. The effect and fate of antibiotics during the anaerobic digestion of pig manure[J]. Bioresource Technology, 101(22): 8581-8586 |
| [2] | Arikan O A, Sikora L J, Mulbry W, et al. 2006. The fate and effect of oxytetracycline during the anaerobic digestion of manure from therapeutically treated calves[J]. Process Biochemistry, 41(7): 1637-1643 |
| [3] | 鲍艳姣, 丁洪生, 鲍艳宇, 等. 2013. 固液比对土霉素在腐殖酸上吸附和解吸的影响[J]. 应用化工, 42(6): 980-982 |
| [4] | Beneragama N, Lateef S A, Iwasaki M, et al. 2013. The combined effect of cefazolin and oxytertracycline on biogas production from thermophilic anaerobic digestion of dairy manure[J]. Bioresource Technology, 133: 23-30 |
| [5] | Boleas S, Alonso C, Pro J, et al. 2005. Toxicity of the antimicrobial oxytetracycline to soil organisms in a multi-species-soil system (MS·3) and influence of manure co-addition[J]. Journal of Hazardous Materials, 122(3): 233-241 |
| [6] | Bryant M P. 1979. Microbial methane production-theoretical aspects[J]. Journal of Animal Science, 48(1): 193-201 |
| [7] | Cetecioglu Z, Ince B, Gros M, et al. 2013. Chronic impact of tetracycline on the biodegradation of an organic substrate mixture under anaerobic conditions[J]. Water Research, 47(9): 2959-2969 |
| [8] | 陈琳, 谷洁, 高华, 等. 2012. Cu对厌氧发酵中水解酶活性及沼气产量的影响[J]. 农业工程学报, 28(9): 202-207 |
| [9] | 陈智学, 谷洁, 高华, 等. 2013. 土霉素对堆肥过程中酶活性和微生物群落代谢的影响[J]. 生态学报, 33(21): 6957-6966 |
| [10] | Goel R, Mino T, Satoh H, et al. 1998. Enzyme activities under anaerobic and aerobic conditions in activated sludge sequencing batch reactor[J]. Water Research, 32(7): 2081-2088 |
| [11] | 关松荫. 1986. 土壤酶及其研究法[M]. 北京: 农业出版社 |
| [12] | Halling-Srensen B, Sengelv G, Tjrnelund J. 2002. Toxicity of tetracyclines and tetracycline degradation products to environmentally relevant bacteria, including selected tetracycline-resistant bacteria[J]. Archives of Environmental Contamination and Toxicology, 42(3): 263-271 |
| [13] | Ince B, Coban H, Turker G, et al. 2013. Effect of oxytetracycline on biogas production and active microbial populations during batch anaerobic digestion of cow manure[J]. Bioprocess and Biosystems Engineering, 36(5): 541-546 |
| [14] | Kemper N. 2008. Veterinary antibiotics in the aquatic and terrestrial environment[J]. Ecological Indicators, 8(1): 1-13 |
| [15] | Kümmerer K. 2001. Drugs in the environment: emission of drugs, diagnostic aids and disinfectants into wastewater by hospitals in relation to other sources - a review[J]. Chemosphere, 45(6/7): 957-969 |
| [16] | Lallai A, Mura G, Onnis N. 2002. The effects of certain antibiotics on biogas production in the anaerobic digestion of pig waste slurry[J]. Bioresource Technology, 82(2): 205-208 |
| [17] | 李连华, 马隆龙, 袁振宏, 等. 2007. 农作物秸秆的厌氧消化试验研究[J]. 农业环境科学学报, 26(1): 335-338 |
| [18] | 李鸣雷, 谷洁, 高华. 2004. 一种促进农业废弃物快速腐解的微生物复合菌剂及制作方法[P]. 中国, 发明, 03134514. 2004-05-05 |
| [19] | 梁东丽, 谷洁, 秦清军, 等. 2009. 接种菌剂对猪粪高温堆肥中酶活性的影响[J]. 农业工程学报, 25(9): 243-248 |
| [20] | Loftin K A, Henny C, Adams C D, et al. 2005. Inhibition of microbial metabolism in anaerobic lagoons by selected sulfonamides, tetracyclines, lincomycin, and tylosin tartrate[J]. Environmental Toxicology and Chemistry, 24(4): 782-788 |
| [21] | Loke M L, Jespersen S, Vreeken R, et al. 2003. Determination of oxytetracycline and its degradation products by high-performance liquid chromatography-tandem mass spectrometry in manure-containing anaerobic test systems[J]. Journal of Chromatography B, 783(1): 11-23 |
| [22] | Massé D I, Lu D, Masse L, et al. 2000. Effect of antibiotics on psychrophilic anaerobic digestion of swine manure slurry in sequencing batch reactors[J]. Bioresource Technology, 75(3): 205-211 |
| [23] | Mohring S A, Strzysch I, Fernandes M R, et al. 2009. Degradation and elimination of various sulfonamides during anaerobic fermentation: a promising step on the way to sustainable pharmacy?[J]. Environmental Science & Technology, 43(7): 2569-2574 |
| [24] | 朴哲, 崔宗均, 苏宝林. 2001. 高温堆肥的生物化学变化特征及植物抑制物质的降解规律[J]. 农业环境保护, 20(4): 206-209 |
| [25] | Sarmah A K, Meyer M T, Boxall A B A. 2006. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere, 65(5): 725-759 |
| [26] | 孙刚, 袁守军, 彭书传, 等. 2010. 固相萃取-高效液相色谱法测定畜禽粪便中的土霉素、金霉素和四环素[J]. 环境化学, 29(4): 739-743 |
| [27] | Thiele-Bruhn S, Beck I C. 2005. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass[J]. Chemosphere, 59(4): 457-465 |
| [28] | 童子林, 刘元璐, 胡真虎, 等. 2012. 四环素类抗生素污染畜禽粪便的厌氧消化特征[J]. 环境科学, 33(3): 1028-1032 |
| [29] | 王静, 黄申斌, 江敏, 等. 2011. 抗生素类污染物对活性污泥酶活的影响研究[J]. 环境污染与防治, 33(12): 27-32 |
| [30] | 王云鹏, 马越. 2008. 养殖业抗生素的使用及其潜在危害[J]. 中国抗生素杂志, 33(9): 519-523 |
| [31] | 解军, 祁峰, 裴海燕, 等. 2006. 脱氢酶活性检测方法及其在环境监测中的应用[J]. 中国环境监测, 22(5): 13-18 |
| [32] | 许晓路, 申秀英. 1993. 活性污泥活性参数指标的选评[J]. 环境科学, 14(2): 58-62 |
| [33] | 俞文和, 扬纪根. 1988. 抗生素工艺[M]. 沈阳: 辽宁科学技术出版社 |
| [34] | 姚志鹏, 李兆君, 梁永超, 等. 2009. 土壤酶活性对土壤中土霉素的动态响应[J]. 植物营养与肥料学报,15(3): 696-700 |
| [35] | 张全国. 2005. 沼气技术及其应用[M]. 北京: 化学工业出版社 |
| [36] | 张树清, 张夫道, 刘秀梅, 等. 2005. 规模化养殖畜禽粪主要有害成分测定分析研究[J]. 植物营养与肥料学报, 11(6): 822-829 |
| [37] | 朱南文, 闵航, 陈美慈, 等. 1996. TTC—脱氢酶测定方法的探讨[J]. 中国沼气, 14(2): 3-5 |
 2015, Vol. 35
2015, Vol. 35


