2. 同济大学污染控制与资源化研究重点实验室, 上海 200092
2. State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092
应对水华事件的紧急处理手段通常是化学混凝去除.但是藻比重小,混凝后沉淀效果差,藻新陈代谢产生带负电分泌物附着在藻表面,增加了其稳定性,同时藻细胞自身的活性也抑制藻的混凝.因此,化学预氧化混凝成为含藻水处理中常用的工艺(Bernhardt and Clasen, 1991; Bernhardt and Clasen, 1994),而在所有氧化剂中,高锰酸钾是处理应急水华事件最方便的药剂(Ma et al., 2012).
高锰酸钾预氧化的主要优势表现在如下方面:高锰酸钾预氧化可以提高藻表面电位,减小藻细胞之间的静电排斥力,起到去稳的作用; Petruevski(Petruševski et al., 1996)报道称高锰酸钾预氧化可以同时提高颗粒物与藻类的去除率; 高锰酸钾的还原产物附着在藻的表面,可以增加藻的比重,有利于藻后续的混凝沉降(Chen and Yeh, 2005; Ma et al., 2012);高锰酸钾预氧化也是一种有效的控制气味和藻毒素的可行方法(Chen et al., 2005; Rodríguez et al., 2007).高浓度的高锰酸钾(≥mg · L-1)可以使细胞失活,降解胞外微囊藻毒素.但高浓度的高锰酸钾对饮用水的处理过程有害.并且,过量的预氧化会使藻细胞溶解,促进胞内有机物(IOM)的释放,而一些IOM是消毒副产物的前驱物(DBPs).大量的或者小分子量的IOM的释放会阻碍混凝.因此,当高锰酸钾被应用于原水处理的预氧化时一定要控制好高锰酸钾的用量.
在湖泊水华中,螺旋鱼腥藻和铜绿微囊藻是爆发最多的优势藻种,其中螺旋鱼腥藻优势种极为突出,占生物总量的95%以上,春末、夏初、初秋时在湖泊池塘大量繁殖造成水华,引起水质变臭,它的出现是水体富营养化的标志.但以往研究大都集中在对铜绿微囊藻的研究,本文选用了螺旋鱼腥藻为研究对象,使用不同浓度高锰酸钾氧化螺旋鱼腥藻,研究了藻液中Mn浓度,藻的光合作用能力,胞外有机物三维荧光和分子量分布的变化,并进行了预氧化强化混凝实验,为水华治理以及高锰酸钾预氧化藻的机理提供了理论指导和支撑.
2 实验材料与方法(Materials and methods) 2.1 微生物与试剂螺旋鱼腥藻(FACHB-498)购自武汉水生生物研究所,采用BG11培养基培养,无菌条件下接种于玻璃瓶中,在生化培养箱中培养,培养条件:25 ℃,光补偿点为30~40 mol(photons)· m-2 · s-1,光暗比(L ∶ D)=12 ∶ 12.
高锰酸钾(分析纯,国药集团化学试剂有限公司);0.2 μm、0.45 μm微孔滤膜(MFS,日本);亚硫酸钠(分析纯,国药集团化学试剂有限公司);PAC(含29% Al2O3,原液含1200 mg · L-1 Al2O3).
2.2 高锰酸钾预氧化实验将收获的对数期螺旋鱼腥藻稀释到所需的浓度,其浓度用紫外-可见分光光度计(UV-1800,上海美普达仪器有限公司)测定,稀释后OD680为0.105.
实验前,采用磷酸盐缓冲溶液(KH2PO4-NaOH)将pH调整到7.实验中,一定量高锰酸钾加入藻液中,慢速搅拌10 min,分别在接触时间为10、30、60、120和240 min时取样准备需要分析的样品.
2.3 样品分析在设定的不同预氧化时间后,取样5 mL采用调制叶绿素荧光(PHYTO-PAM)立即测定藻的有效光化学量子产量Φe,光合作用效率α.Φe是反映PSⅡ反应中心原初光能捕获效率,藻不经过暗适应直接在光下测定得到.α由 Ralph and Gademann(Behrenfeld et al., 2004)制定的方法测定,α反映藻对光的利用效率.
在不同的预氧化接触时间后,取样10 mL过0.45 μm的滤膜,消解后滤液采用ICP分析滤液中KMnO4的浓度.另取样10 mL采用亚硫酸钠进行终止反应,过0.45 μm的滤膜,采用凝胶过滤色谱测定有机物的分子量分布和三维荧光光谱.
2.4 混凝试验取藻液500 mL,投加不同剂量的高锰酸钾(1、2、4和6 mg · L-1),预氧化1 h后,投加20 mg · L-1PAC. 250 r · min-1快速搅拌3 min,30 r · min-1,慢速搅拌10 min. 静沉1 h后于藻液表面2 cm下取样分析藻的去除率.
3 结果与分析(Results and analysis) 3.1 藻液中Mn的变化高锰酸钾预氧化不同时间藻液中Mn的含量如图 1所示,表征了高锰酸钾预氧化藻的速率.从图 1可以看出高锰酸钾氧化主要在1 h内完成.高锰酸钾投加量分别为1、2、4和6 mg · L-1的藻液1 h后Mn的残余率分别为1.23%、7.10%、21.70%和36.40%,随后高锰酸钾残余量缓慢减小.高锰酸钾浓度为1和2 mg · L-1时,2 h后藻液中Mn的含量下降到0,是由于高锰酸钾氧化生成的MnO2附着在藻的表面,过滤时跟随藻被截留.研究表明(Chen and Yeh, 2005; Ma et al., 2012),附着在藻表面的MnO2可以增加藻的比重,有利于藻的沉降.
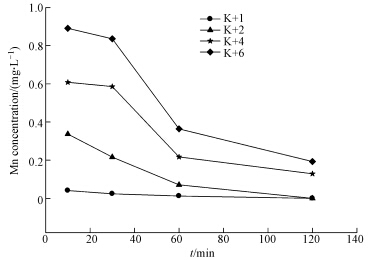 |
| 图 1 含藻水中的Mn浓度随高锰酸钾预氧化在不同时间的变化 Fig. 1 Variation of residual Mn concentration in algae bearing water with potassium permanganate pre-oxidation at different times |
高锰酸钾氧化1 h后藻液中胞外有机物的凝胶色谱分析如图 2所示.藻类有机物(Algae-derived Organic Matter,AOM)包括胞外分泌物(Extracellular Organic Matter,EOM)和胞内有机物(Intracellular Organic Matter,IOM).在实验中,没有引入外援有机物,藻液中存在的有机物主要为EOM.当藻细胞受到高锰酸钾氧化后,藻细胞分泌有机物到胞外,或者藻细胞受损,部分IOM释放到胞外,藻细胞壁被氧化也会产生部分的胞外有机物.因此对比预氧化前后有机物分子量的变化可以看出螺旋鱼腥藻的受损程度和溶液有机物的变化.
在没有高锰酸钾预氧化作用下可以看出,胞外分泌物的相对分子质量主要为0.45、1.3、2、2.5 kDa和9.7 kDa.在不同高锰酸钾预氧化1 h后藻溶液中都出现了新的有机物,相对分子质量为0.9 kDa.当高锰酸钾浓度为1.0和2.0 mg · L-1时,相对分子质量为2.5 kDa的有机物浓度与空白藻相差不大,当高锰酸钾浓度为4.0和6.0 mg · L-1时,螺旋鱼腥藻中产生了更多的2.5 kDa的有机物,高锰酸钾为6.0 mg · L-1时,相对分子质量为0.9~2.5 kDa的有机物的含量均增加,此时藻细胞受到破坏和分解,IOM释放到藻溶液中.
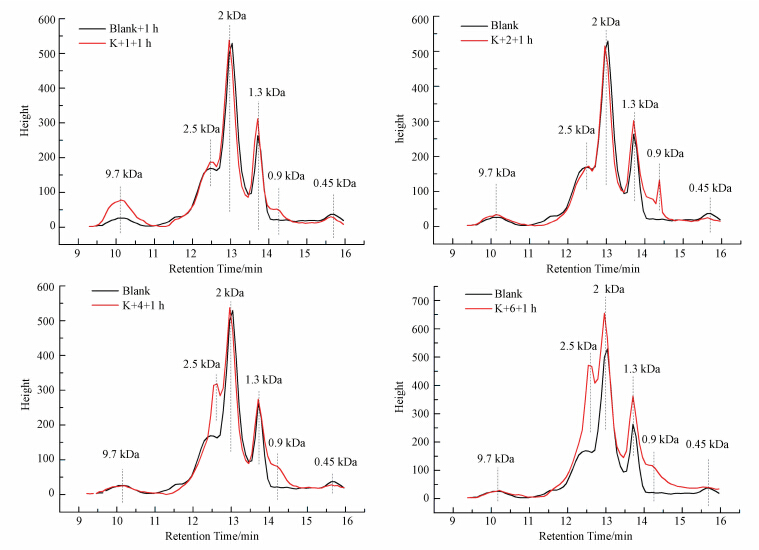 |
| 图 2 不同浓度高锰酸钾氧化对数生长期螺旋鱼腥藻1 h后有机物分子量分布 Fig. 2 Distribution of organic molecular weight of logarithmic phase Anabaena spiroides |
不同浓度高锰酸钾氧化作用下藻的三维荧光图如图 3所示.从图 3中可以看出主要有3个峰A、B和C(吕洪刚等,2005).图 3a为对数期未经高锰酸钾处理的对照样.从图中可以看出,A峰强度最大,属于类蛋白质峰;同时在λex>250 nm、λem>380 nm出现了两个强度低的峰B和C,为类腐殖酸峰.类蛋白质峰A属于微生物溶解性有机物,可能是一些带有荧光基团(色氨酸、苯丙氨酸、络氨酸)的氨基酸、多肽和蛋白质(酶)所组成,主要是藻的胞外分泌物.腐殖质(峰B和C)主要是藻体分泌物以及藻类细胞死亡后被细菌分解而产生,包括类富里酸和类腐殖酸等,成分复杂,响应值较低是由于此时藻处于对数生长期,藻细胞活性大,藻的降解和死亡较少.
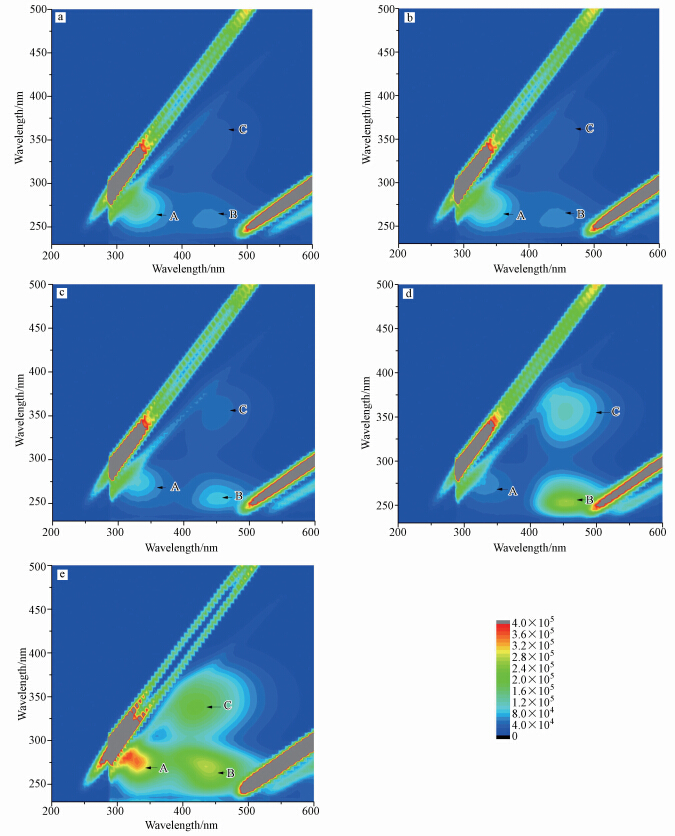 |
| 图 3 不同浓度高锰酸钾氧化后的藻有机物三维荧光分析 Fig. 3 Three-dimensional fluorescence after algae organic matter pre-oxidized by different concentrations of potassium permanganate |
图 3b,c,d和e分别为高锰酸钾投加量为1、2、4 mg · L-1时藻液的三维荧光光谱,从图中可以看出当高锰酸钾浓度为1 mg · L-1时与对照样无明显区别;当浓度为2 mg · L-1和4 mg · L-1时,A峰强度出现减小趋势,这是在高锰酸钾的氧化下,胞外分泌物中的类蛋白质物质被氧化,浓度下降,而B和C峰出现增大趋势,且4 mg · L-1时增强明显,分析认为加大高锰酸钾的量,会破坏藻细胞组织,部分藻的有机结构遭到破坏,产生类腐殖酸和类富里酸物质.当高锰酸钾浓度为6 mg · L-1时,藻液的A、B和C同时显著增强,可能是此时藻分泌了更多的胞外分泌物,或者是藻细胞遭到破坏,胞内部分类蛋白物质释放到胞外.同时在高浓度高锰酸钾的作用下,藻细胞遭到更大的破坏,产生了更多的类腐殖酸和类富里酸,B和C峰的荧光强度增强.
3.4 对藻光合能力的影响不同浓度高锰酸钾氧化作用下有效光量子产量的变化情况如图 4a所示,由图可以看出,有效光量子产量的总体趋势是随着高锰酸钾浓度的升高和时间的延长而减小,藻的光合活性下降.但是需要注意的是,当高锰酸钾浓度为1和2 mg · L-1时,Φe先上升后下降,可能是由于低浓度的高锰酸钾对藻有一定的刺激作用,导致藻的活性上升,捕获光能效率上升,而后随着高锰酸钾浓度上升,藻细胞受到一定的损伤,有效光量子产量出现下降.在高锰酸钾浓度为4和6 mg · L-1时,藻Φe显著下降,4 h时候,4和6 mg · L-1高锰酸钾作用下藻的有效光量子产量从0.4分别下降到0.27和0.19.Φe在光合作用中与电子传递的量子产量成正比,Φe的下降会伴随着光能捕获能力下降和抑制电子的传递,进而抑制后续的光合作用.
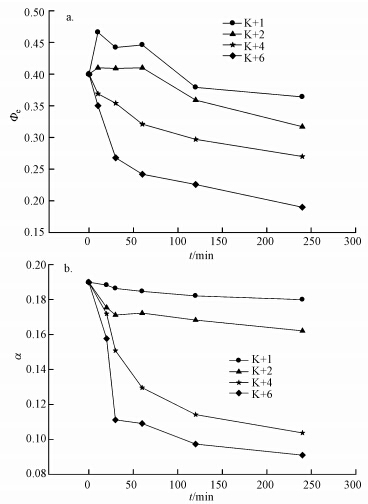 |
| 图 4 不同浓度高锰酸钾预氧化对藻光合能力的影响 Fig. 4 Effect of pre-oxidation by different concentrations of potassium permanganate on algae photosynthesis ability |
从图 4b可以看出,藻的光合作用效率随着高锰酸钾浓度的上升和接触时间的延长而降低,高锰酸钾为1和2 mg · L-1时,光合作用效率下降缓慢,当高锰酸钾浓度为4和6 mg · L-1时,光合作用效率显著下降.说明高锰酸钾氧化严重破坏了藻的光合作用系统,减小了藻的能量转换和捕获能力.并且从图中可以看出,有效光量子产量与光合作用效率的下降主要在1 h内完成,这也与前面Mn下降保持一致.同时Ou(2012)研究指出,在高锰酸钾氧化2 h后,所有的光合参数均出现下降,同时1 d后,高锰酸钾为2和5 mg · L-1时,光合参数均出现升高.而10、15和20 mg · L-1高锰酸钾处理后,1 d后光合参数都变为0.这说明藻对低浓度的外部胁迫有一定的调节能力,而高浓度的高锰酸钾可以直接杀死藻细胞.
3.5 预氧化强化混凝不同浓度高锰酸钾预氧化强化混凝1 h后藻的去除率如图 5所示.a为螺旋鱼腥藻静沉,1 h后藻的去除率为39.11%,b为投加20 mg · L-1 PAC混凝沉淀,1 h后藻的去除率为57.21%.c、d、e、f分别投加为1、2、4、6 mg · L-1高锰酸钾预氧化后再投加20 mg · L-1 PAC混凝沉淀,其去除率分别为91.2%、93.31%、93.37%、93.56%.由图可以看出,投加不同浓度高锰酸钾后,藻的去除率显著升高,比直接混凝增加33.99%~36.35%.
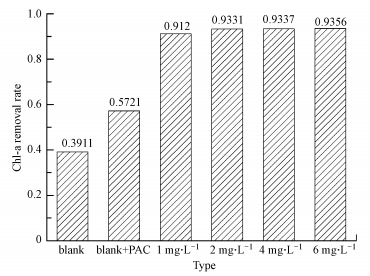 |
| 图 5 高锰酸钾预氧化强化混凝对藻的去除率的影响 Fig. 5 Effect of enhanced coagulation with potassium permanganate pre-oxidation on algae removal efficiency |
1)高锰酸钾预氧化主要在1 h内完成,随着反应进行,Mn浓度逐渐减少.
2)当高锰酸钾浓度小于2 mg · L-1时,对藻体无明显破坏,藻细胞的分子量分布也无显著变化;随着高锰酸钾浓度不断升高,藻细胞受到破坏程度增强,IOM释放到胞外,同时产生了类腐殖酸和类富里酸等分子量较大的物质.
3)随着高锰酸钾浓度的升高和时间的延长,藻的光合能力下降.
4)投加不同浓度高锰酸钾后,藻的去除率显著升高,当高锰酸钾投加量为2 mg · L-1时,去除率即可比直接混凝增加36.1%.
| [1] | Behrenfeld M J, Prasil O, Babin M, et al. 2004. In search of a physiological basis for covariations in light-limited and light-saturated photosynthesis[J]. Journal of Phycology, 40(1): 4-25 |
| [2] | Bernhardt H, Clasen J. 1991. Flocculation of microorganisms [J]. Journal of Water Supply: Research and Technology-AQUA, 40(2): 76-87 |
| [3] | Bernhardt H, Clasen J. 1994. Investigations into the flocculation mechanisms of small algal cells [J]. Journal of Water Supply: Research and Technology-AQUA, 43(5): 222-232 |
| [4] | Chen J J, Yeh H H. 2005. The mechanisms of potassium permanganate on algae removal[J]. Water Research, 39(18): 4420-4428 |
| [5] | Chen X G, Xiao B D, Liu J T, et al. 2005. Kinetics of the oxidation of MCRR by potassium permanganate [J]. Toxicon, 45(7): 911-917 |
| [6] | 吕洪刚, 张锡辉, 龚纯英,等. 2005. 藻类的三维荧光光谱辨别及算法研究[J]. 中国环境科学, 25(5): 581-584 |
| [7] | Ma M, Liu R P, Liu H J, et al. 2012. Effect of moderate pre-oxidation on the removal of Microcystis aeruginosa by KMnO4-Fe(II) process: Significance of the in-situ formed Fe(III)[J]. Water Research, 46(1): 73-81 |
| [8] | Ou H, Gao N Y, Wei C H, et al. 2012. Immediate and long-term impacts of potassium permanganate on photosynthetic activity, survival and microcystin-LR release risk of Microcystis aeruginosa[J]. Journal of Hazardous Materials, 219-220: 267-275 |
| [9] | Petruševski B, Van Breemen A N, Alaerts G J. 1996. Effect of permanganate pretreatment and coagulation with dual coagulants on algae removal in direct filtration[J]. Journal of Water Supply: Research and Technology-AQUA, 45(5): 316-326 |
| [10] | Rodríguez E, Majado M E, Meriluoto J, et al. 2007. Oxidation of microcystins by permanganate: Reaction kinetics and implications for water treatment[J]. Water Research, 41(1): 102-110 |
 2015, Vol. 35
2015, Vol. 35


