镉被广泛应用于现代工业生产中(Campbell,2006),已经成为水环境的主要污染物(Burger,2008),尤其对江河、湖泊、海洋等危害更加明显,引起了研究者的广泛关注(Kalman et al., 2010).镉极易通过钙通道穿过细胞膜进入组织细胞(Roesijadi and Robinson, 1994),急性和亚慢性接触会导致人和动物组织器官损害、细胞膜结构与功能的改变、DNA结构的变化和酶空间构象的改变(Bertin and Averbeck,2006;Levesgue et al., 2003;Ozturk et al., 2009).许多研究表明,镉的毒性与氧化损伤密切相关,镉诱导产生大量自由基和活性氧ROS而形成氧胁迫(Hegedüs et al., 2001),通过改变机体抗氧化系统平衡而诱发组织损伤.在研究鱼和甲壳动物中发现,镉可以干扰机体抗氧化系统,改变抗氧化酶活性,诱变遗传物质,引起细胞凋亡,并导致组织细胞结构的变化(Cao et al., 2012;金芬芬和王兰,2012;Li et al., 2011;Migliarini et al., 2005).
在“贻贝观察”体系中发现(贾晓平等,2000),双壳类对多种污染物具有一定的耐受性,是较理想的污染物指示模式物种,非常适合反映水体环境和底泥中重金属的污染状况(Marie et al., 2006;Pellerin and Amiard,2009).目前,有关双壳类的研究主要集中在扇贝、蛤蜊、贻贝等海产物种( Ch and urvelan et al., 2012;黄志斐等,2012;潘鲁青等,2012).但是,对于淡水贝类,例如背角无齿蚌(Anodonta woodiana)的研究主要集中在生态和代谢生理(温晓蔓等,2011)、重金属蓄积和元素分布(李威等,2010;王魏根等,2004)、矿质元素和氨基酸含量(马明硕等,2012)等方面.鉴于此,本文采用急性毒性实验方法,就镉对背角无齿蚌主要组织器官的氧化损伤和形态结构的影响进行了研究,旨在阐明镉对背角无齿蚌的毒性影响程度,为进一步探讨重金属对双壳类影响的毒性机理奠定基础,同时为筛选适合淡水水域重金属污染和评价的指示生物提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验动物背角无齿蚌购自太原市五龙口水产品批发市 场,置实验室水族箱(130 cm×50 cm×50 cm)中养殖 两周后进行实验.期间每隔3 d换水1次,隔天喂食1次.养殖用水曝气48 h,水温(20±2)℃,pH(7.5±0.3),溶氧量(8±1)mg · L-1.
2.2 实验设计根据镉(Cd)对背角无齿蚌96 h 的LC50(134.9 mg · L-1)的1/2、1/4、1/8、1/16、1/32,设置了4.22、8.43、16.86、33.72和67.45 mg · L-1 5个染毒组和对照组,分别处理24 h、48 h、72 h和96 h.实验时选择个体大小基本一致的个体(体重(48.0±4.0)g,壳长(6.8±0.3)cm)置处理缸中(40 cm×20 cm×20 cm),每缸6只,同时设2个重复组,每个组别合计18只样本.处理期间不喂食、不换水,定时检查背角无齿蚌存活情况,随时拣出死亡个体.
2.3 实验用品实验试剂:氯化镉(CdCl2 · 2.5H2O)、二甲苯、无水乙醇均为分析纯;苏木素和伊红购于Amresco公司.SOD和CAT活性测定试剂盒及蛋白质含量测定试剂盒均购于南京建成生物工程研究所.
仪器设备:多功能酶标仪(MD SpectraMax M5)、全自动切片机(Leica RM2255)、冷冻离心机(Eppendorf 5804R)、生物组织包埋机(BMJ-1B)、冷冻台(BMJ-1B)、展烤片机(ZKPJ-1A)、电动匀浆仪(FLUKO F6/10)、研究级成像光学显微镜(Olympus BX51).
2.4 样品制备分别在Cd处理24、48、72和96 h,活体解剖背角无齿蚌取消化腺和斧足,滤纸吸净表面水分,称量后置-80℃冰箱中备用.实验时按质量与体积比为1/4,加入预冷生理盐水,冰上匀浆制备20%的组织匀浆液,4000 r · min-1冷冻离心10 min,取上清液.按照SOD和CAT活性试剂盒说明书实验步骤操作.
选取67.45 mg · L-1处理组,分别在24、48、72和96 h解剖背角无齿蚌取出消化腺和斧足,迅速放入Bouin′s液固定24 h,乙醇梯度脱水、二甲苯透明、常规石蜡切片、H.E染色、中性树胶封片,显微镜观察并拍照.
2.5 数据处理实验结果所得数据采用SPSS 15.0软件包的单因素方差分析(One-Way ANOVA)进行处理分析,显著性检验通过LSD法比较,所得结果均为平均值±标准差(mean±SD),*p<0.05表示有显著差异,**p<0.01表示有极显著差异.
3 结果(Results) 3.1 镉对背角无齿蚌消化腺和斧足中SOD和CAT活性的影响 3.1.1 镉对SOD活性的影响图 1显示,同一时间,随着Cd浓度的升高,24 h消化腺中SOD活性显现升高的趋势;48 h和72 h SOD活性先升后降;96 h SOD活性逐渐升高,均呈现显著和极显著性差异(p<0.05,p<0.01).同一浓度,随着时间的延长,SOD活性基本表现为逐渐升高.在72 h、Cd浓度8.43 mg · L-1时,SOD活性达到最大值(p<0.01).
 |
| 图 1 镉对背角无齿蚌消化腺SOD活性的影响 Fig.1 Effect of Cd on SOD activities in digestive gl and of A. woodiana |
观察图 2发现,同一时间,随着Cd浓度的升高,48 h斧足中 SOD活性呈现先升高后下降的趋势;除Cd浓度16.82 mg · L-1之外,72 h和96 h SOD活性显著或极显著性升高(p<0.05,p<0.01).同一浓度,随着时间的延长,SOD活性逐渐升高.在96 h、Cd浓度4.22 mg · L-1时,SOD活性达到最大值(p<0.01).
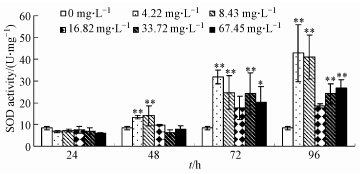 |
| 图 2 镉对背角无齿蚌斧足SOD活性的影响 Fig.2 Effect of Cd on SOD activities in foot of A. woodiana |
由图 3看出,同一时间,随着Cd浓度的升高,24 h消化腺中CAT活性在高浓度组显著升高(p<0.05);48 h、72 h和96 h CAT活性呈现先升高后又降低的趋势.同一浓度,随着时间的延长,CAT活性总体趋势是先升高后降低.在72 h、Cd浓度4.22 mg · L-1时,CAT活性达到最大值(p<0.01).
 |
| 图 3 镉对背角无齿蚌消化腺CAT活性的影响 Fig.3 Effect of Cd on CAT activities in digestive gl and of A. woodiana |
图 4显示,同一时间,随着Cd浓度的升高,48 h和96 h 斧足中CAT活性呈现先升高后下降的趋势;72 h CAT活性逐渐升高,且呈现极显著性差异(p<0.01).同一浓度,随着时间的延长,CAT活性总体趋势是先升高后降低.在48 h、Cd浓度4.22 mg · L-1时,CAT活性达到最大值(p<0.01).
 |
| 图 4 镉对背角无齿蚌斧足CAT活性的影响 Fig.4 Effect of Cd on CAT activities in foot of A. woodiana |
由图 5观察到,对照组消化腺横切面排列规则,有结缔组织(Ct)和血窦腔(Bs).消化腺组织由单层柱状上皮细胞(Ce)构成,其中散在分布杯状细胞(Gc),杯状细胞底部狭窄,顶部膨大,细胞核偏于细胞一侧,胞质内充满粗大的嗜酸性颗粒.67.45 mg · L-1 Cd处理后,细胞结构出现了不同程度的变化.24 h,细胞结构变化不明显(图B1、B2);48 h,杯状细胞数目增加,管间结缔组织连接松散(图C1、C2);72 h,腺体结构受损严重,上皮细胞胞浆崩解,细胞间界限模糊、消失;细胞膜肿胀、变形;细胞核碎裂、肿胀明显甚至消失,有的发生明显坏死并脱落至腺腔内,上皮细胞部分与基膜分离、脱落,消化腺基底膜(Bm)较清晰(图D1、D2);96 h,细胞结构变化更加明显,基膜破损或坏死(Nt),大片呈红染区域、无结构、颗粒状,其中可见散在的核碎片(图E1、E2).
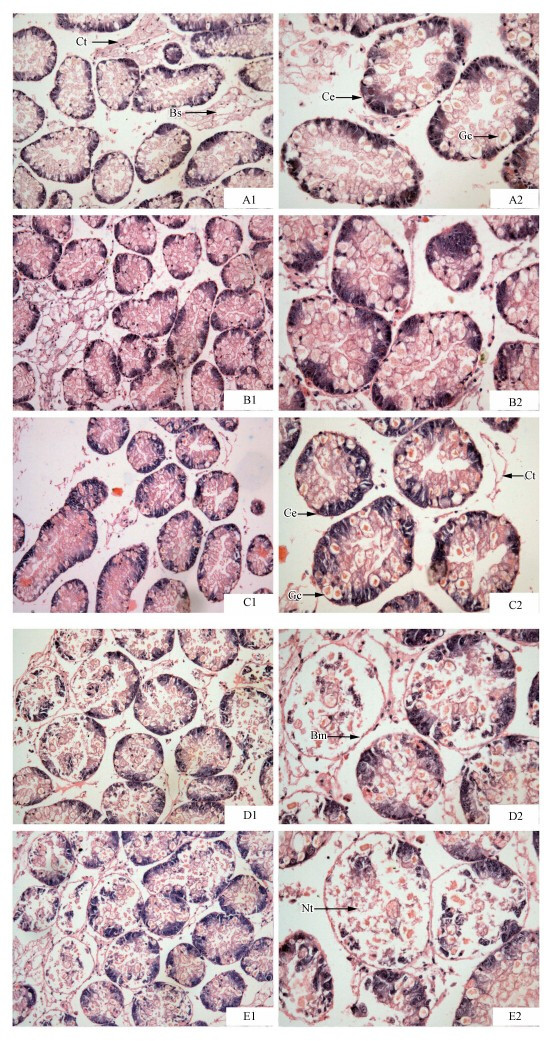 |
| 图 5 镉对背角无齿蚌消化腺细胞形态结构的影响(A1-2:对照组(×100,×200);B1-2:Cd处理24 h(×100,×200);C1-2:Cd处理48 h(×100,×200);D1-2:Cd处理72 h(×100,×200);E1-2:Cd处理96 h(×100,×200).Bs:血窦;Ct:结缔组织;Ce:柱状上皮;Gc:杯状细胞;Bm:基底膜;Nt:坏死组织) Fig.5 Effect of Cd on morphology of digestive gl and of A. woodiana(A1-2: control group(×100,×200); B1-2: treated with Cd for 24 h(×100,×200); C1-2: treated with Cd for 48 h(×100,×200); D1-2: treated with Cd for 72 h(×100,×200); E1-2: treated with Cd for 96 h(×100,×200). Ct: connective tissue; Bs: blood sinus; Ce: cylindrical epithelium; Gc: goblet cells; Bm: basement membrane; Nt: necrotic tissue) |
观察图 6发现,对照组斧足的表面被覆单层高柱状上皮细胞(Ce),排列紧密,细胞表面有大量纤毛(Ci),但结缔组织(Ct)较少.上皮下方可见大量肌纤维区域,肌层主要由两种细胞构成,表层的肌细胞与上皮细胞垂直,胞浆丰富,嗜酸性强,核巨大且异型性(Hn)明显,染色质丰富.内部的肌组织细胞(Mc)相对较小,但胞浆丰富,细胞核圆形或椭圆形,肌细胞成束且平行或垂直分布.但是,67.45 mg · L-1 Cd处理后,斧足组织细胞结构变化不明显.
 |
| 图 6 镉对背角无齿蚌斧足细胞形态结构的影响(A1-2:对照组(×100,×200);B1-2:Cd处理24 h(×100,×200);C1-2:Cd处理48 h(×100,×200);D1-2:Cd处理72 h(×100,×200);E1-2:Cd处理96 h(×100,×200).Bs:血窦;Mc:肌肉细胞;Hn:异型核;Ce:柱状上皮;Ci:纤毛;Ct:结缔组织) Fig.6 Effect of Cd on morphology of foot of A. woodiana(A1-2: control group(×100,×200); B1-2: treated with Cd for 24 h(×100,×200); C1-2: treated with Cd for 48 h(×100,×200); D1-2: treated with Cd for 72 h(×100,×200); E1-2: treated with Cd for 96 h(×100,×200). Bs: blood sinus; Mc: muscle cells; Hn: heteromorphic nucleus; Ce: cylindrical epithelium; Ci: cilium; Ct: connective tissue) |
SOD和CAT是广泛存在于生物体内防御氧化损伤、对生物体的氧化与抗氧化平衡起着至关重要作用的酶.SOD可以将O2·-歧化为过氧化氢(H2O2),CAT则可以将H2O2转化成水和氧气,二者组成生化反应链,协同防御内、外环境中超氧离子对生物体的侵害,故能够很灵敏地反映外界因素刺激对生物体的损伤程度(孙存普,1999).
SOD属于底物诱导酶,在短时间或低浓度Cd胁迫下,背角无齿蚌消化腺和斧足中SOD活性显著升高,说明此时组织中产生了大量O· -2,进而促使机体启动抗氧化防御体系,产生适应性诱导反应,清除过量的活性氧自由基,保护机体免受自由基损伤,一些研究也证实了这一点(陆慧贤和徐永健,2011;王晓宇,2009;杨国军等,2013).也有研究认为(Stebbing,1982),外界毒物在低剂量下的这种刺激反应,称为“毒物兴奋反应”.在低剂量Cd胁迫下,消化腺和斧足中SOD活力上升以清除组织中产生的O· -2,反应生成大量的H2O2和羟自由基(· HO),会对机体产生很强的氧化损伤,需要被及时清除.此时,消化腺和斧足中CAT活性也相应被激活,显著升高,以清除机体内大量的H2O2.
SOD是一种金属酶,真核细胞内有Mn-SOD和Cu/Zn-SOD两种SOD,分别位于线粒体内和细胞质中.Cd与锌为同族元素,且Cd与Zn和Mn具有相似的离子结构,Cd可以取代Zn形成Cu/Cd-SOD,或取代Mn而形成Cd-SOD,使SOD失去活性(Casalino et al., 2002).另外,Cd还可以影响SOD的转录水平(项翠琴等,2001),通过干扰SOD表达过程中的转录量,使SOD的表达量减少.随着Cd浓度的增加,背角无齿蚌SOD活性虽没有被显著抑制,但是逐渐回落到正常水平.大量的Cd会增加替换SOD中Zn和Mn形成Cu/Cd-SOD和Cd-SOD的机率,改变了SOD原有的分子构象,使SOD活性回落,甚至下降、丧失(闫博等,2007).此时,CAT活性也表现出相似的变化规律,活性也逐渐回落,CAT活性在低浓度Cd胁迫下活性上升,在高浓度Cd胁迫下活性回落的变化趋势与SOD活性的变化趋势较为吻合,印证了二者在生物体内抗氧化机能的协同性,这与Mourente(2002)的研究结果相同.
4.2 镉对背角无齿蚌消化腺和斧足组织细胞结构的影响消化腺是复管泡状腺,处理48 h,腺体内部结缔组织出现明显变性损伤,腺体管腔扩大,分泌细胞数量增多,尤其胞内酸性颗粒增多.这可能是细胞内酸性磷酸酶合成加快,进而增强机体免疫力,达到解毒功效(绳秀珍等,2001);处理72 h,腺体结缔组织松散,细胞膜、核膜裂解,出现不完整的细胞结构,但基底膜仍保持完整.权赫梅(2003)认为,Cd能够导致细胞质溶酶体膜稳定性下降,促使溶酶体水解,释放水解酶,使细胞膜、细胞核及细胞器等发生严重损伤,生物合成受阻,生理代谢紊乱,细胞发生自溶,加速周围组织细胞的坏死;96 h后,腺体基底膜破损,组织出现明显坏死.Cd在引发细胞发生自溶的同时,还诱导大量吞噬细胞增多,对管壁上皮细胞造成严重损伤,并促使细胞凋亡现象加重,腺体结构破坏,消化、解毒功能丧失.
综上所述,在Cd急性处理背角无齿蚌以后,随着处理时间的延长,组织细胞膜和细胞内膜系统受到破坏,Cd逐渐进入背角无齿蚌组织细胞内,在背角无齿蚌组织内不断蓄积.Cd在细胞内可以与羧基、巯基、氨基、肽基等蛋白质功能基团结合,破坏功能蛋白的代谢机能,或通过置换SOD及其它功能酶的活性中心的金属元素(Zn、Mn)使酶失活,影响组织正常的生理机能.Cd作用初期对背角无齿蚌组织结构变化不明显,损伤不显著,组织酶活性多表现为诱导效应,反应了机体对低剂量Cd的应激保护反应.随着Cd处理时间的延长和浓度的增加,机体会通过调节金属硫蛋白和GSH来清除Cd(刘娜等,2008; Pan and Zhang,2006),当Cd蓄积的速度超过机体清除Cd能力的阈值后,组织内脂质过氧化反应加重,产生了大量的活性氧物质,超过机体抗氧化防御系统清除能力后,酶活性受到抑制,Cd和活性氧中间体会促使蛋白质(酶)、DNA、组织生物膜和细胞器损伤加重,诱发细胞凋亡、组织免疫力下降、代谢系统紊乱,促使大量的组织细胞坏死(苗晶晶等,2007).
| [1] | Bertin G, Averbeck D. 2006. Cadmium:cellular effects, modifications of biomolecules, modulation of DNA repair and genotoxic consequences (a review)[J]. Biochimie, 88(11):1549-1559 |
| [2] | Burger J. 2008. Assessment and management of risk to wildlife from cadmium[J]. Science of the Total Environment, 389(1):37-46 |
| [3] | Campbell P G C. 2006. Cadmium-a priority pollutant[J]. Environmental Chemistry, 3:387-388 |
| [4] | Cao L, Huang W, Shan X J, et al. 2012. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology and Pharmacology, 33(1):16-25 |
| [5] | Casalino E, Calzaretti G, Sblano C, et al. 2002. Molecular inhibitory mechanisms of antioxidant enzymes in rat liver and kidney by cadmium[J]. Toxicology, 179(1/2):37-50 |
| [6] | Chandurvelan R, Marsden I D, Gaw S, et al. 2012. Impairment of green-lipped mussel (Perna canaliculus) physiology by waterborne cadmium:Relationship to tissue bioaccumulation and effect of exposure duration[J]. Aquatic Toxicology, 124-125:114-124 |
| [7] | Hegedüs A, Erdei S, Horváth G. 2001. Comparative studies of H2O2 detoxifying enzymes in green and greening barley seedlings under cadmium stress[J]. Plant Science, 160(6):1085-1093 |
| [8] | 黄志斐, 张喆, 马胜伟, 等. 2012. BDE209胁迫对翡翠贻贝(Perna viridis)SOD、MDA和GSH的影响[J]. 农业环境科学学报, 31(6):1053-1059 |
| [9] | 贾晓平, 林钦, 李纯厚, 等. 2000. ""南海贻贝观察"":广东沿海牡蛎体中Zn含量水平及其变化趋势[J]. 海洋环境科学, 19(4):31-45 |
| [10] | 金芬芬, 王兰. 2012. 镉对河南华溪蟹肝胰腺线粒体自由基代谢的影响[J]. 环境科学学报, 32(2):457-464 |
| [11] | Kalman J, Riba I, DelValls T Á, et al. 2010. Comparative toxicity of cadmium in the commercial fish species Sparus aurata and Solea senegalensis[J]. Ecotoxicology and Environmental Safety, 73(3):306-311 |
| [12] | Levesgue H M, Dorval J, Hontela A, et al. 2003. Hormonal, morphological, and physiological responses of yellow perch (Perca flavescens) to chronic environmental mental exposures[J]. Journal of Toxicology & Environmental Health Part A, 66(7):657-676 |
| [13] | Li R J, Zhou Y Y, Wang L, et al. 2011. Low-molecular-weight-chitosan ameliorates cadmium-induced toxicity in the freshwater crab, Sinopotamon yangtsekiense[J]. Ecotoxicology and Environmental Safety, 74(5):1164-1170 |
| [14] | 李威, 杨健, 陈修报, 等. 2010. 背角无齿蚌组织中的元素分布研究[J]. 农业环境科学学报, 29(3):597-603 |
| [15] | 刘娜, 闫博, 李涌泉, 等. 2008. Cd2+对长江华溪蟹谷胱甘肽系统的影响[J]. 环境科学, 29(8):2302-2307 |
| [16] | 陆慧贤, 徐永健. 2011. 镉胁迫下缢蛏(Sinonovacula constricta)抗氧化酶活性及DNA损伤的研究[J]. 海洋环境科学, 30(1):96-101 |
| [17] | 马明硕, 陈修报, 苏彦平, 等. 2012. 野生和养殖背角无齿蚌矿质元素和氨基酸含量的特征分析[J]. 食品科学, 33(8):142-145 |
| [18] | Marie V, Baudrimont M, Boudou A. 2006. Cadmium and zinc bioaccumulation and metallothionein response in two freshwater bivalves (Corbicula fluminea and Dreissena polymorpha) transplanted along a polymetallic gradient[J]. Chemosphere, 65(4):609-617 |
| [19] | 苗晶晶, 潘鲁青, 王静. 2007. 苯并[a]芘对栉孔扇贝(Chlamys farreri)组织显微和超微结构的影响[J]. 环境科学学报, 27(9):1497-1503 |
| [20] | Migliarini B, Campisi A M, Maradonna F, et al. 2005. Effects of cadmium exposure on testis apoptosis in the marine teleost Gobius niger[J]. General and Comparative Endocrinology, 142(1/2):241-247 |
| [21] | Mourente G, Díaz-Salvago E, Bell J G. 2002. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil:attenuation by dietary vitamin E[J]. Aquaculture, 214(1/4):343-361 |
| [22] | Ozturk I M, Buyukakilli B, Balli E, et al. 2009. Determination of acute and chronic effects of cadmium on the cardiovascular system of rats[J]. Toxicology Mechanisms and Methods, 19(4):308-317 |
| [23] | Pan L Q, Zhang H X. 2006. Metallothionein, antioxidant enzymes and DNA strand breaks as biomarkers of Cd exposure in a marine crab, Charybdis japonica[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 144(1):67-75 |
| [24] | 潘鲁青, 刘娜, 王静. 2012. 栉孔扇贝在B[a]P胁迫下生物标志物筛选的研究[J]. 水生生物学报, 36(2):299-306 |
| [25] | Pellerin J, Amiard J C. 2009. Comparison of bioaccumulation of metals and induction of metallothioneins in two marine bivalves (Mytilus edulis and Mya arenaria)[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 150(2):186-195 |
| [26] | 权赫梅. 2003. 镉暴露条件下紫贻贝成体消化盲囊结构的研究[J]. 解剖科学进展, 9(2):125-127 |
| [27] | Roesijadi G, Robinson W. 1994. Metal regulation in aquatic animals:mechanisms of uptake, accumulation and release. In:Malins D C, Ostrander G K eds. Aquatic Toxicology-Molecular, Biochemical and Cellular Perspectives[M]. Boca Raton, FL:Lewis Publishers. 387-420 |
| [28] | 绳秀珍, 刘晓云, 任素莲, 等. 2001. 栉孔扇贝(Chlamys (Azumapecten) farreri)消化盲囊的组织学和组织化学的研究[J]. 青岛海洋大学学报, 31(3):361-367 |
| [29] | Stebbing A R D. 1982. Hormesis-the stimulation of growth by low levels of inhibitors[J]. Science of The Total Environment, 22(3):213-234 |
| [30] | 孙存普. 1999. 自由基生物学导论[M]. 合肥:中国科学技术大学出版社. 66-70 |
| [31] | 王魏根, 王丽珍, 刘永定, 等. 2004. 椭圆背角无齿蚌对重金属元素的积累作用[J]. 云南大学学报(自然科学版), 26(6):541-543 |
| [32] | 王晓宇. 2009. 四角蛤蜊Mactra veneriformis对镉和汞污染胁迫的生理响应[D]. 青岛:中国科学院研究生院(海洋研究所). 1-146 |
| [33] | 温晓蔓, 孙陆宇, 禹娜, 等. 2011. 温度和盐度对背角无齿蚌(Anodonta woodiana)代谢的影响[J]. 复旦学报(自然科学版), 50(5):632-639 |
| [34] | 项翠琴, 梅兵, 吴自荣, 等. 2001. 低剂量镉对肾脏SOD基因表达及其活力的影响[J]. 中华劳动卫生职业病杂志, 19(2):91-94 |
| [35] | 闫博, 王兰, 李涌泉, 等. 2007. 镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J]. 动物学报, 53(6):1121-1128 |
| [36] | 杨国军, 宋伦, 王年斌. 2013. 悬浮物对四角蛤蜊生存和抗氧化酶活性的影响[J]. 生态学杂志, 32(8):2097-2103 |
 2015, Vol. 35
2015, Vol. 35


