2. 中山大学环境科学与工程学院, 广州 510275
2. School of Environmental Science and Engineering of Sun Yat-Sen University, Guangzhou 510275
水体中的重金属含量受工业、生活及农业活动的影响较大,并可通过工业和生活废水、地表径流和大气沉降等多种方式进入水体.进入水体中的重金属即使微量存在也可对生物产生毒性效应,且因其具有生物富集和放大作用,可通过饮水、食物链等途径直接或间接进入人体,对人类健康造成严重威胁,使其成为当今世界最严重的环境问题之一(杨学福等,2013).
翁江发源于广东省韶关市翁源县东北部,是北江的一级支流,而北江是广东省北部、广州及佛山等地的城镇供水水源;此外,翁江也是沿岸两侧农田的主要灌溉水源,因此,其水质状况的好坏影响着北江流域不同地区人群的身体健康.北江流域拥有丰富的矿产资源,有色冶金企业较多,既有国有大型特大型企业,也有私营甚至非法的小采矿和小冶炼厂.其中,大宝山矿区是亚洲最大的铅锌矿生产基地,自1966年正式投产以来已有48年的开采历史,矿山开采和金属冶炼过程中产生的废水、废渣及降尘未经处理直接排放,造成整个矿区及北江流域水体的污染,对流域生态系统产生了极大影响(李永涛等,2004).而目前对翁江的研究主要集中在翁江流域的水文特性分析及其支流横石河重金属污染等方面(付善明等,2007;邹晓锦等,2008; Chen et al., 2007; Lin et al., 2005;魏焕鹏等,2011),对翁江干流的重金属污染的研究较少,对水质发光菌生物毒性测试的研究更未见有文献报道.发光菌生物毒性测试法是一种具有快速、灵敏、方便等优点的直接生物测试法,反映的是能被生物利用的所有化学物质的生态效应,可补充化学检测对目标物质选择上的不足.因此,本文以翁江上游地区的河水、地下水作为研究对象,通过分析翁江上游地区水体重金属的时空变化及生态毒性特征,以期为该区水环境的治理及北江供水安全提供科学依据.
2 材料与方法(Material and methods) 2.1 研究区域概况研究区位于广东省韶关市翁源县内,地理坐标介于东经113°39′22″~114°18′15″,北纬24°7′4″~24°40′之间(图 1),属亚热带季风型气候,年平均气 温为21 ℃,多年平均降雨量约为1900 mm,雨量主要集中在4—8月,约占总降雨量的71%.水文地质方面,研究区北及东北部与南岭土地相接,主要由中、下泥盆纪变质石英砂岩组成;南及西南部则与北江谷地冲积平原毗邻,主要为燕山期花岗岩组成的低矮山丘;中部盆地为第四纪沉积物,并夹杂有石炭纪硅质灰岩峰丛出露.区域内煤、铁、锰、硫铁矿、黑钨矿、沥青铀矿、金、银、铜、锡、钼、铋、锑、铅、锌等矿产资源丰富,有色冶金企业较多,受矿山开采的影响,县内多个村镇(如上坝村、凉桥村等)成为了皮肤病、肝病、癌症等高发区.此外,翁源县是农业大县,农产品丰富,生产量大,是我国重要的农产品生产基地.
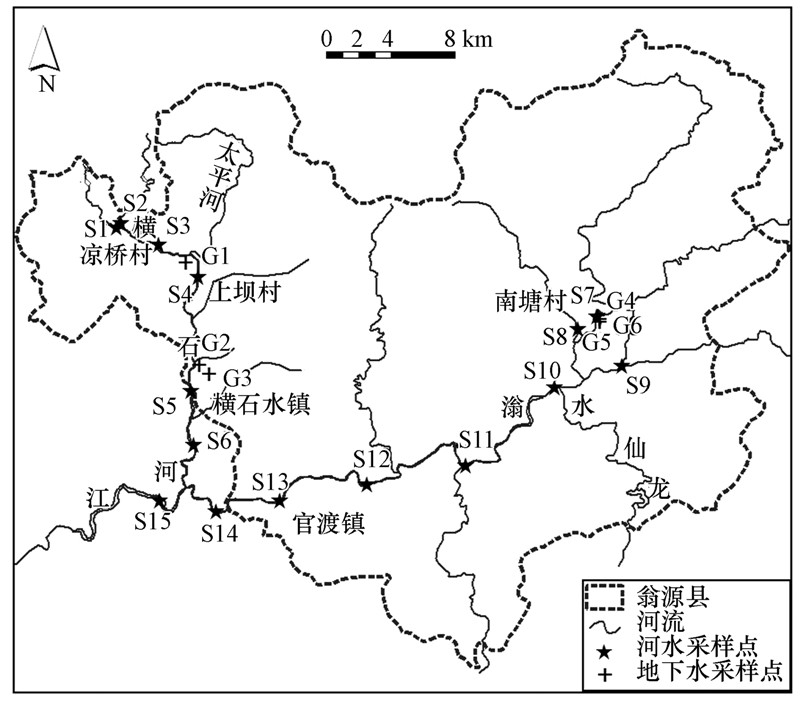 |
| 图 1 研究区域与采样点分布图 Fig. 1 Map of the study area and the distribution of sampling sites |
分别于2013年8月(丰水期)和2014年3月(枯水期)在翁江上游及横石河流域采集河水和地下水,河水主要采自于河道中心位置,地下水均采自当地的民用井,共采集30个河水和12个地下水样品.为方便分析,本研究将横石河沿岸区域划分为Ⅰ区,翁江沿岸区域划分为Ⅱ区.其中,S1~S6、G1~G3位于I区,S7~S15、G4~G6位于II区,具体采样点位置和信息见图 1和表 1.现场采用哈希便携式水质分析仪测定pH、电导率(EC)等指标.样品采集后立即用0.45 μm的微孔滤膜过滤,将滤液分成两份,一份直接存储于聚乙烯塑料瓶中,一份加HNO3酸化至pH<2后存储于聚乙烯塑料瓶中,用胶带密封瓶盖,带回实验室置于4 ℃冰箱中保存待测.
| 表 1 地下水采样点信息 Table 1 Information of groundwater sampling sites |
经预处理后的水样采用电感耦合等离子体质谱仪(ICP-MS)测定重金属As、Cd、Cu、Ni、Pb和Zn的浓度,采用等离子体原子发射光谱仪(ICP-AES)测定Ca2+、Mg2+浓度,采用液相色谱质谱联用(LC-MS)技术分析环丙沙星(Ciprofloxacin)、氧苄二氨嘧啶(Trimethoprim)、四环素(Tetracycline)、对乙酰氨基酚(Acetaminophen)、咖啡因(Caffeine)、磺胺甲 唑(Sulfamethoxazole)、红霉素(Erithromycin-H2O)、立痛定(Carbamazepine)、避蚊胺(DEET)9种医药品及个人护理用品(Pharmaceuticals and personal care products,PPCPS)的浓度.
2.4 发光菌毒性测试发光菌毒性测试采用LUMIStox 300测量仪和LUMIStherm恒温仪联用测定,测定方法参照BS EN ISO 11348(International Organization for St and ardization, 1999).水样抑制率(I)大于30%或60%时,对水样进行等对数浓度稀释,测定导致20%或50%抑制率的水样稀释浓度(EC20或EC50).每个水样做3个平行试验.根据水样的抑制率大小将水样的毒性分为6级:无毒(I≤10%)、低毒(10%<I≤30%)、中毒(30%< I≤50%)、重毒(50%< I≤70%)、高毒(70< I≤90%)和剧毒(I >90%)(高磊等,2013).
2.5 毒性单位评价法由抑制率的大小可知道水体毒性的强弱,但从毒性总量上不能说明问题.为了方便计算毒性总量,引入毒性单位TU(Toxicity Unit),其计算公式为(方战强等,2003):

式中,EC50为水样半数有效抑制浓度.
3 结果与讨论(Results and discussion) 3.1 水体pH、EC值的变化特征分析图 2为翁江上游及横石河水体丰水期、枯水期pH、EC值的变化.从季节变化来看,枯水期水样pH值均略高于丰水期,I区存在一个突变点—S3,其枯水期pH值(8.52)显著高于丰水期pH值(3.89),呈碱性.据野外调查可知,枯水期采样时,为降低酸性废水的影响,在S3上游地区存在往河流中投放石灰的现象;而阳离子检测结果也显示,枯水期时Ca2+(158 mg · L-1)、Mg2+(61.1 mg · L-1)的含量显著高于丰水期(43.7 mg · L-1和28.2 mg · L-1).因此,投放石灰是造成此处pH值显著升高的主要原因.从空间变化来看,I区水样pH变化较显著,S1~S3段河水明显呈酸性,丰水期和枯水期的水样pH平均值分别为3.69和5.84,说明S1~S3河段受上游大宝山矿山酸性废水排放的影响较大;从S4开始,在其上游一较大清水支流太平河(图 1)汇入后的稀释作用下,水体pH明显升高,呈弱碱性,II区翁江干流(S7~S15)pH值的季节和沿程变化不大,无论是枯水期还是丰水期的水样pH值均大于7,属于弱碱性水平.就地下水体而言,其pH值的沿程和季节变化也均较平缓,pH变化范围为6.43~7.19,水体呈弱酸性至中性.
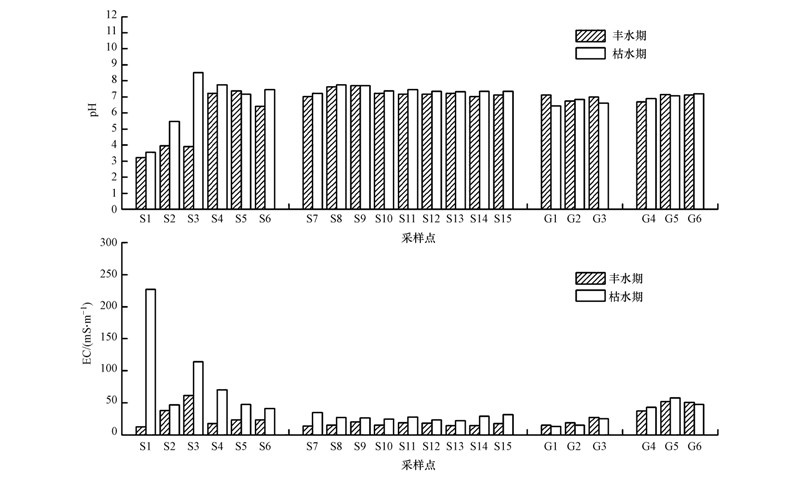 |
| 图 2 丰水期、枯水期水体pH、EC值的变化 Fig. 2 Changes of pH、EC in the water samples |
EC值在一定程度上能反映水体中阴阳离子的浓度(张亚丽等,2014).由图 2可看出,不同时期II区水体的EC值沿程变化不大,而I区水体变化则较为明显.丰水期时,EC值随水体流向逐渐增大,至S3处达到最大值后开始下降,在采样点S4之后又开始缓慢上升.由于S3处的水体为大宝山铁龙尾砂库和槽对坑尾砂库外排废水流经的溪流在凉桥村汇合后的水体,且从汇合口到采样点S3之间又无支流汇入,致使此处EC值高于S1和S2处,而在太平河汇入后的稀释作用下S4处EC值大幅降低,之后随流经路径的增加EC值又缓慢上升;枯水期时,I区地表水体的EC值沿径流路径整体呈下降趋势,且高于II区翁江地表水体,由于I区上游采样点(S1~S3)周边分布多个矿山开采、金属冶炼厂等污染源,其废水的排放是导致I区横石河上游水体EC值较下游高的主要原因.在季节变化方面,枯水期EC值均略高于丰水期,可能与丰水期降雨的稀释作用有关.
3.2 水体中重金属时空分布变化 3.2.1 地表水重金属时空分布变化横石河及翁江(翁源段)不同时期重金属平均含量如表 2所示.除As外,横石河各重金属浓度均显著高于翁江,丰水期、枯水期Ni、Cu、Zn、Cd、Pb重金属平均浓度分别是翁江的16.9、232、180、125、37.5倍和11.5、46.2、80.0、50.5、3.58倍,说明太宝山矿山开采对横石河水体造成了严重的污染.
| 表 2 横石河、翁江不同时期重金属的平均浓度 Table 2 The average concentration of heavy metals in Hengshi River and Wengjiang |
图 3为横石河河水重金属的时空分布变化.由图可知,重金属元素Ni、Cu、Zn、As、Cd、Pb的浓度变化范围分别为3.30~171、12.32~1959、648.10~41060、n.d~5.58、3.16~124、0.150~416 μg · L-1,不同时期各采样点均超过了地表水III类水质标准(国家环境保护总局,2002),水质污染较为严重.丰水期、枯水期重金属Cu、Zn、Cd、Pb的平均浓度分别为1029、11086、36.2、114 μg · L-1和444、8332、31.3、41.2 μg · L-1,分别是地表水III类水质标准值的2.96、41.1、24.8、8.31倍和1.38、33.9、21.2、3.47倍;污染最为严重的元素为Zn,其次为Cd 、Pb、Cu.从季节变化来看,Ni与其它重金属变化趋势略为不同,表现为枯水期>丰水期,而其余重金属元素整体上呈现丰水期>枯水期的变化规律.造成这一现象的原因可能有以下3方面:①横石河上游矿山开采与冶炼厂分布较多,矿渣、尾矿及废污水等遭雨水冲刷后随径流进入下游河道;②丰水期受降雨等条件的影响,农田径流量加大,由施用农药和化肥等活动带来的重金属随径流进入水体中的含量也随之增高;③枯水期时部分采样点周边存在往河流中投放石灰等现象,石灰溶解后可与部分重金属发生沉淀反应而使水体中重金属浓度降低.从空间变化来看,各重金属浓度的最大值都出现在采样点S1处,S1位于大宝山铁龙尾砂库下游,因此,来自大宝山矿山酸性废水的排放是导致此点位重金属浓度显著高于其它采样点的主要原因.无论是丰水期还是枯水期,重金属浓度从上游至下游整体呈下降趋势,原因可能有以下两个方面:一是重金属在随水流向下运动过程中会吸附于固体颗粒物表面而沉淀至河床,使重金属浓度有所降低;二是支流汇入后的稀释作用,如采样点S4,在支流太平河的汇入下,水体pH值显著升高,由酸性转为弱碱性,部分重金属的形态可能发生变化,以沉淀的形式沉于河底.尽管水体的自净作用及支流的稀释作用会对水质重金属污染产生一定的修复能力,但污染严重的Zn、Cd在下游(S5~S6)河段仍处于5.63~19.6、1194~5110 μg · L-1较高浓度水平上,仍超过了地表水III类水质标准,可见污染严重的Zn、Cd等重金属元素仅依靠水体的自净及支流汇入后的稀释作用是难以消除的,应采取一定的措施予以治理.
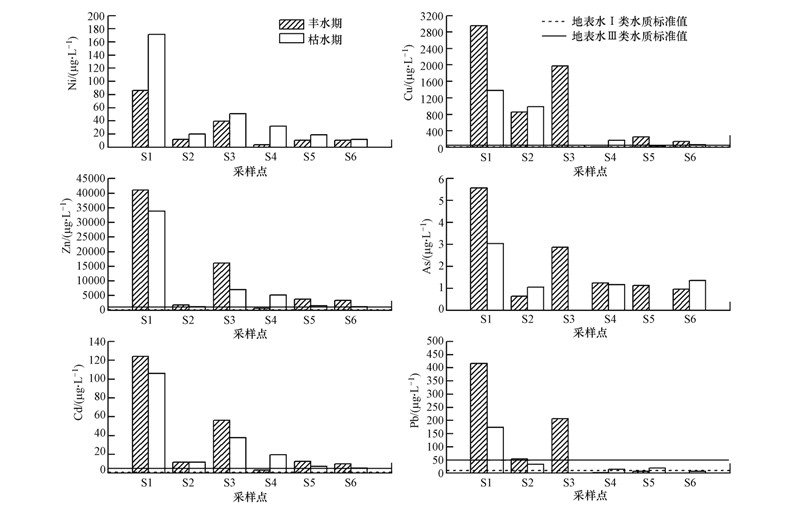 |
| 图 3 I区地表水体重金属浓度时空分布 Fig. 3 Changes of the heavy metals concentration in the surface water of zone I |
图 4为II区翁江(翁源段)河水重金属的时空分布变化.重金属元素Ni、Cu、Zn、As、Cd、Pb的浓度变化范围分别为0.58~7.88、1.66~18.4、13.8~326、1.35~4.13、0.04~1.78、0.45~34.7 μg · L-1.丰水期时,水质污染相对较轻,S11、S12、S14、S15仅个别元素存在超地表水I类水质标准限值(国家环境保护总局,2002)的现象;而枯水期时,除S10外其余各采样点均超过了地表水I类水质标准,主要超标元素为Zn,部分采样点也存在Cu、Pb、Cd超标现象.从季节变化来看,除As外,其余重金属元素均呈现出枯水期>丰水期的变化规律,说明丰水期降雨的稀释作用较大.从空间变化来看,各重金属浓度最小值基本上都出现在S10处,点位S10的正上方有龙仙水(径流量较大)汇入,支流的稀释作用可能是造成S10处重金属浓度最小的原因.不同时期重金属As的浓度沿程变化不大,表明As的浓度与采样点的位置关系不大,而其余各重金属具有以下的规律性:上游(S7~S10)河段重金属浓度整体相对较低,至S11处达到一个“峰值”,之后又逐渐降低,从S14开始又逐渐升高,多数元素在S15处浓度达到最高值.S11位于三华镇,河流周边农田、林地分布面积较大且集中,该镇是农产品的主要产地,农用化学品的使用会造成周边水体及土壤重金属污染(Bai et al., 011),因此,施用农药和化肥可能是导致此处重金属浓度较高的主要原因;而S15由于接受来自支流横石河的污水,污染严重的横石河携带的重金属是造成此处多数重金属浓度最高的原因.
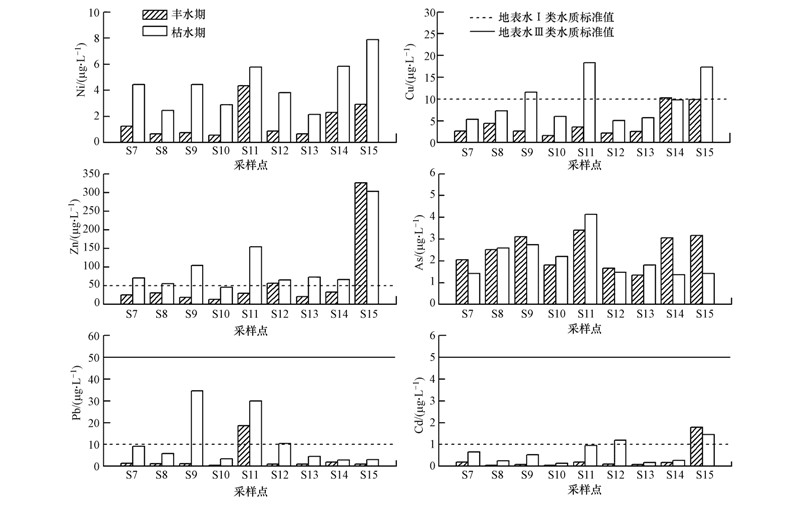 |
| 图 4 II区地表水体重金属浓度时空分布 Fig. 4 Changes of the heavy metals concentration in the surface water of zone II |
就地下水I类水质标准而言,不同时期横石河及翁江沿岸地下水均存在超标的现象.丰水期时,66.67%的采样点Cd元素超标,超标最为严重的为G1,其浓度值是地下水I类标准值(国家环境保护总局,2002)的2.83倍,其余重金属未超标;枯水期时,除元素As外,其它元素均存在超标现象,其中,Cd、Ni、Zn、Pb、Cu的超标比例为分别83.33%、33.33%、66.67%、50%、50%,G1处的Cd同样是超标是为严重的,其浓度是地下水I类标准值的5.42倍.由于各采样点均位于农田附近,施用农药化肥等可能是造成各地下水井Cd元素超标的重要原因之一.在季节变化上,除As外,其余重金属元素均表现为枯水期>丰水期的变化规律.由于地下水样均采自潜水含水层,地下水埋深较浅(最深的为5.92 m,最浅的仅为0.52 m);此外,研究区土壤质地基本上为砂壤土,土壤渗透性较强.因此,降雨入渗对含水层污染物浓度的稀释可能是造成此现象的主要原因.在空间变化上,重金属元素Ni、Zn、Pb、Cu呈现I区<II区的分布趋势,与地表水分布趋势相反.由于I区各采样点距河道均有一定的距离,含水层与河水的水力联系并不强,可说明污染严重的横石河对I区地下水体的影响不大;在II区,G4离河道最近,距离河道不到10 m,但G4的重金属浓度低于离河道较远的G5、G6,在野外采样过程中发现G4的地下水位高于河水水位,存在地下水补给河水的现象,II区地表水也不是造成地下水污染的直接来源,对地下水污染的原因有待进一步研究. 图 5
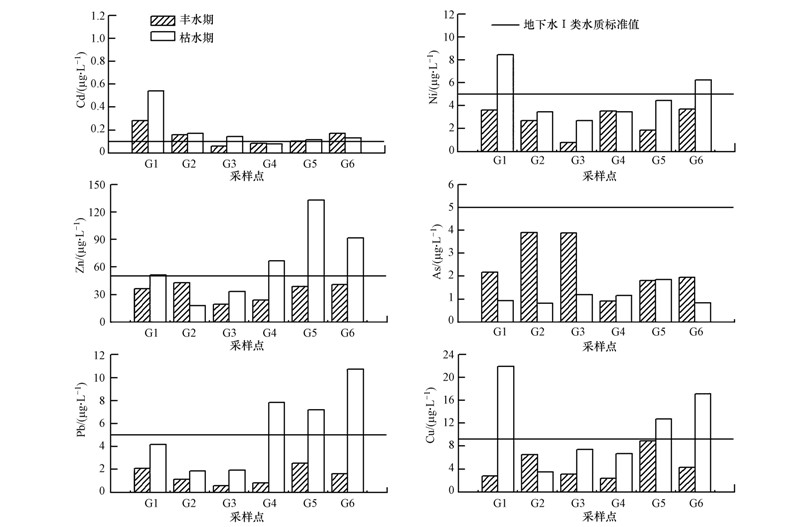 |
| 图 5 翁江上游地下水体重金属浓度时空分布 Fig. 5 Changes of the heavy metals concentration in the groundwater |
丰、枯水期河水水样对发光菌30 min的抑制率如图 6所示.丰水期时,I区横石河河水水样(S1~S6)均表现出一定的毒性,其中,S1、S3的抑制率分别为100%、98.0%,属剧毒;S2的抑制率为66.2%,属重毒;S5的抑制率为39.5%,属中毒;S4、S6为低毒.II区翁江河水水样仅S12、S14表现出一定的毒性,抑制率分别为20.5%、20.2%,属低毒.枯水期时,I区50%的水样表现出毒性,其中,S1的抑制率(97.3%)最高,属剧毒,其次为S2(67.9%),属重毒;而翁江河水水样抑制率均低于10%,为无毒.I区水体生态毒性均高于II区.
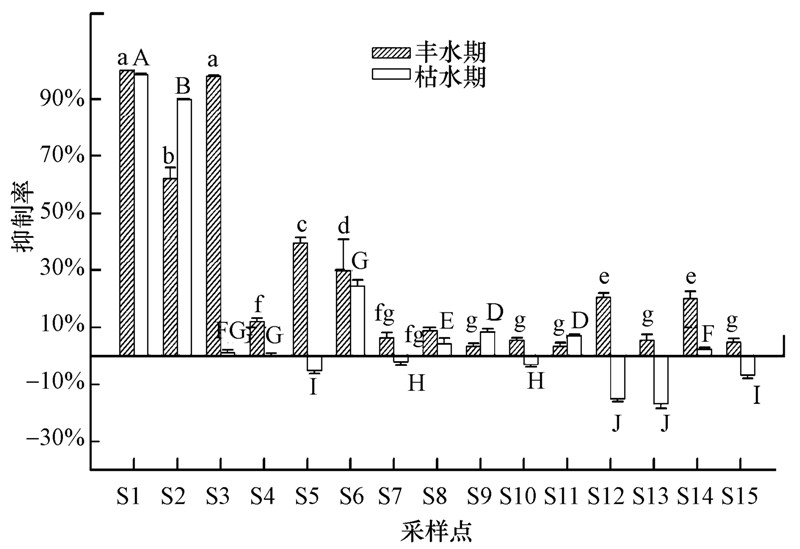 |
| 图 6 地表水体发光抑制率的时空分布(不同大写字母表示枯水期水样的抑制率差异显著,p<0.05;不同小写字母表示丰水期水样的抑制率差异显著,p<0.05) Fig. 6 Changes of luminous inhibition in the surface water |
在空间变化上,发光菌抑制率的最大值均出现在S1处,其次为S3(丰水期)和S2,原因可能有以下两方面:一是重金属的影响,水中低浓度的Cu和Zn能对发光菌产生明显的抑制效应,Cu和Zn对费氏弧菌的半数有效浓度(30 min-EC50)分别为500~2000 μg · L-1和700 μg · L-1(Choi et al., 2001),因此,S1、S2和S3处高浓度的Cu、Zn是产生较大抑制率的原因之一;二是pH值的影响,赵洋甬等(2010)研究发现,当水中pH低于4或高于10时,pH对发光菌有明显的毒性作用,丰水期时S1、S2、S3的pH均低于4,在实验过程中将pH调至6.5重新测定发现其抑制率分别由100%、62.2%、98.0%降至91.7%、22.0%、33.4%,因此,水体pH也是影响发光菌抑制率的重要因素.在季节变化上,除S9、S11外,其余点位的抑制率均呈现丰水期>枯水期的变化趋势,其中,S3的变化最为明显,其丰水期的抑制率为98%,属剧毒;而枯水期时抑制率仅为1.20%,属无毒.枯水期时,由于受投放石灰等活动的影响,该点位水体明显呈碱性(pH=8.52),碱性条件下部分重金属会发生沉淀,经测定重金属Cu、Zn的浓度由丰水期的1969.0、16100 μg · L-1降至枯水期的46.900、7043.0 μg · L-1,因此,投放石灰导致pH值升高及重金属浓度大幅下降是造成S3处抑制率变化明显的主要原因.此外,枯水期时,S5、S7、S10、S12、S13和S15的发光抑制率为负值,一方面可能是由于水样中含有可被微生物利用的营养物质,这些物质促进了发光菌的发光活性;另一方面可能是由于毒性物质在低浓度条件下对发光菌的刺激发光作用(赵洋甬等,2010).
通过计算毒性单位TU可以从毒性总量上来比较水体毒性的大小.发光菌测试结果显示,丰水期时仅S1、S2、S3三个水样抑制率超过了60%,通过对其进行稀释梯度测试,得出水样半数有效抑制浓度(EC50);由于pH低于4或高于10时,pH对发光菌有明显的毒性作用,为避免pH的影响,用0.1 mol · L-1的NaOH将S1和S3的pH调至该范围内再重新测试,结果见表 3.水样毒性单位(TU)的排序为:S1(16.8)>S3(6.07)>S2(1.39),水样S1、S3经调pH后,TU值均大幅下降,原因可能有以下两方 面:一是S1、S3的pH均小于4,发光菌在强酸性条件下的新陈代谢受到抑制;二是调节pH过程中加入的NaOH会与部分重金属发生沉淀反应,使重金属的存在形态或价态等发生变化,从而降低了毒性.
| 表 3 丰水期水样30 min的EC50和毒性单位 Table 3 EC50 and Toxicity Units of water samples in wet season |
图 7为横石河及翁江沿岸地区地下水体对发光菌抑制率的时空分布图.丰水期时,I区G2、G3呈现一定的毒性,其对发光菌的抑制率分别为14.31%,11.93%,属低毒;G1虽未表现出毒性,但其抑制率(9.16%)也将接近10%;因此,居民若长期饮用横石河周边地区的地下水体可能会对人体健康造成影响.从季节变化来看,丰水期各水样对发光菌抑制率均高于枯水期,与重金属的分布趋势相反.杨赛等(2013)的研究中指出,PPCPs等有机污染物尽管在水中浓度较低,但其毒性危害大,且易在生物体内积累,有的还具有“三致”效应.而通过实验测定的丰水期各水样的PPCPs的浓度均显著高于枯水期(图 8),因此,PPCPs等有机污染物的变化可能是导致此现象的主要原因之一.
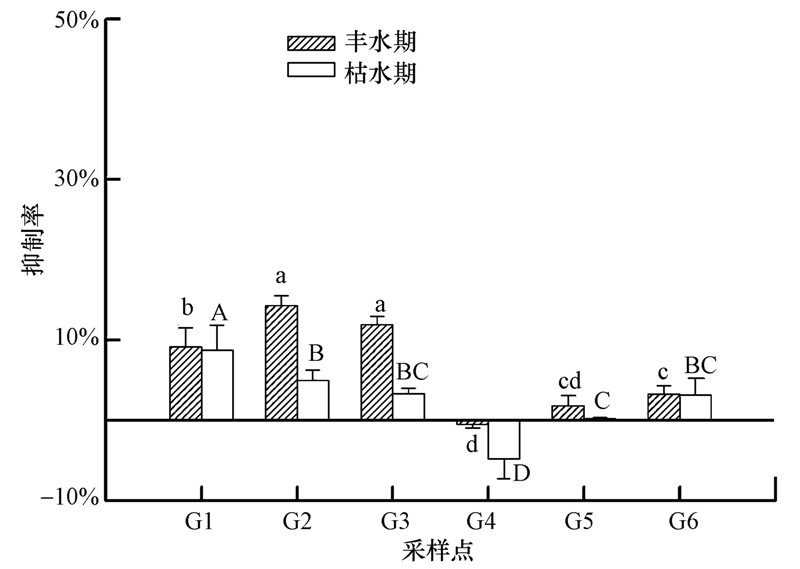 |
| 图 7 地下水体发光抑制率的时空分布(不同大写字母表示枯水期水样的抑制率差异显著,p<0.05;不同小写字母表示丰水期水样的抑制率差异显著,p<0.05) Fig. 7 Changes of luminous inhibition in the groundwater |
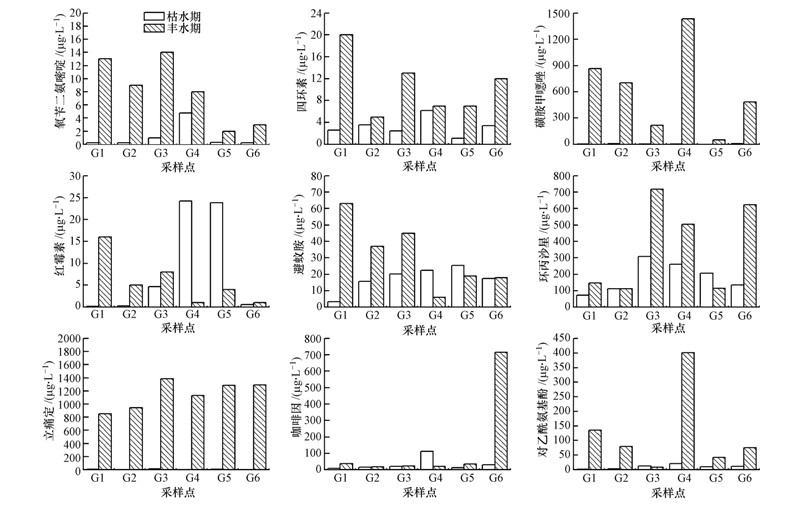 |
| 图 8 地下水体PPCPs浓度的时空分布 Fig. 8 Changes of the concentration of PPCPs in the groundwater |
1)横石河河水受重金属污染较严重,丰、枯水期重金属Cu、Zn、Cd、Pb的平均浓度分别为1029.0、11086、36.200、114.00 μg · L-1和444.20、8332.2、31.300、41.200 μg · L-1,分别是地表水III类水质标准值的2.96、41.1、24.8、8.31倍和1.38、33.9、21.2、3.47倍;翁江河水污染相对较轻,丰、枯水期均未超过地表水III类水质标准.地下水方面,不同时期I、II区均存在超地下水I类水质标准的情况.
2)在季节变化上,翁江河水中重金属元素Cu、Zn、Cd、Pb的浓度表现为枯水期>丰水期,横石河则呈现相反的趋势;地下水方面,除As外,其余各重金属元素的浓度均表现为枯水期>丰水期的变化规律.在空间变化上,各重金属浓度的最大值都出现在大宝山矿山铁龙尾砂库下游的S1处,且I区横石河河水各重金属(As除外)浓度均显著高于翁江,说明大宝山矿区活动对横石河水质造成了严重影响;地下水体方面,重金属元素Ni、Zn、Pb、Cu呈现I区<II区的分布趋势,说明I区地下水体受污染严重的横石河的影响不大.
3)发光菌生态毒性测试结果表明,不同时期I区各水体的生态毒性均显著高于II区.在地表水方面,丰、枯水期I区河水水样对发光菌均产生了显著的毒性效应,其中,S1处水样的抑制率分别高达100%和97.3%,为剧毒;II区仅丰水期时S12、S14处水样表现出一定的低毒性.在地下水方面,丰水期时I区2/3水样表现出一定的毒性,虽均为低毒,但居民若长期饮用可能会对人体健康造成影响.
| [1] | Bai J H,Xiao R,Cui B S,et al. 2011.Assessment of heavy metal pollution in wetland soils from the young and old reclaimed regions in the Pearl River Estuary,South China[J].Environmental Pollution,159(3): 817-824 |
| [2] | Chen A,Lin C,Lu W,et al.2007.Well water contaminated by acidic mine water from the Dabaoshan Mine,South China: Chemistry and toxicity[J].Chemosphere,70(2): 248-255 |
| [3] | Choi K,Merier P G.2001.Toxicity evaluation of metal plating wastewater employing the Microtox assay: A comparison with cladocerans and fish [J].Environmental Toxicology,16(2): 136-141 |
| [4] | 方战强,陈中豪,胡勇有.2003.CEH 3段漂白废水的毒性研究[J].上海环境科学,22(2): 112-114 |
| [5] | 付善明,周永章,赵宇,等.2007.广东大宝山铁多金属矿废水对河流沿岸土壤的重金属污染[J].环境科学,28(4): 805-812 |
| [6] | 高磊,陈建耀,柯志庭,等.2013.东莞石马河流域重金属污染及生态毒性的时空差异[J].环境科学,34(8): 3079-3087 |
| [7] | 国家环境保护总局.2002.GB 3838-2002 中华人民共和国地表水环境质量标准[S].北京: 中国环境科学出版社 |
| [8] | 皇甫鑫,廖翀,杨坪,等.2010.金属化合物对发光菌的毒性效应及不同发光菌的敏感度差异研究[J].环境科学学报,30(9): 1787-1792 |
| [9] | International Organization for Standardization.1999.ISO 11348-1999 Water Quality-Determination of the Inhibitory Effect of Water Samples on the Light Emission of Vibrio fischeri (Luminescent bacteria test) [S].UK: British Standards Institution |
| [10] | Karlsson K,Viklander M,Scholes L,et al.2010.Heavy metal concentrations and toxicity in water and sediment from stormwater ponds and sedimentation tanks[J].Journal of Hazardous Materials,178(1/3): 612-618 |
| [11] | Kwon Y T,Lee C W.2001.Ecological risk assessment of sediment in wastewater discharging area by means of metal speciation[J].Microchemical Journal,70(3): 255-264 |
| [12] | 李永涛,Becquer T,Quantin C,等.2004.酸性矿山废水污染的水稻田土壤中重金属的微生物学效应[J].生态学报,24(11): 2430-2436 |
| [13] | Lin C,Tong X,Lu W,et al.2005.Environmental impacts of surface mining on mined lands,affected streams and agricultural lands in the Dabaoshan Mine region,southern China[J].Land Degradation & Development,16(5): 463-474 |
| [14] | 魏焕鹏,党志,易筱筠,等.2011.大宝山矿区水体和沉积物中重金属的污染评价[J].环境工程学报,5(9): 1943-1949 |
| [15] | 杨赛,华涛.2013.污水处理工艺的生态安全性研究进展[J].应用生态学报,24(5): 1468-1478 |
| [16] | 杨学福,关建玲,王蕾,等.2013.渭河陕西段水体中重金属的时空动态变化特征研究[J].安全与环境学报,13(6): 115-119 |
| [17] | 张汪寿,李晓秀,王晓燕,等.2012.北运河武清段水污染时空变异特征[J].环境科学学报,32(4): 836-846 |
| [18] | 张亚丽,张依章,张远,等.2014.浑河流域地表水和地下水氮污染特征研究[J].中国环境科学,34(1): 170-177 |
| [19] | 赵洋甬,胡建林,邵立军.2010.发光菌毒性测试的影响因子研究[J].现代科学仪器,(3): 75-78 |
| [20] | 邹晓锦,仇荣亮,周小勇,等.2008.大宝山矿区重金属污染对人体健康风险的研究[J].环境科学学报,28(7): 1406-1412 |
 2015, Vol. 35
2015, Vol. 35


