2. 中国科学院水利部水土保持研究所, 黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100
2. State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Institute of Soil and Water Conservation, CAS & MWR, Yangling 712100
底栖动物通过掘穴、沉积物再造、生物淋洗、生物搬运、再悬浮、摄食、排泄和分泌等扰动方式,改变沉积物的理化性质(Widdows et al.,1998),进而促使沉积物-水界面的颗粒态和溶解态物质元素的分布变化与转化(Ciutat et al.,2007).生物扰动作用不仅能改变重金属在沉积物中的形态和分布(Lu and Yan,2010),而且促进了氮磷等元素在沉积物-水界面的迁移和转化(Mermillod-Blondin et al.,2008;Bai et al.,2012),对沉积物中污染物的内源释放有着至关重要的作用.由于各类底栖动物生活习性和扰动方式之间的差异,其活动对沉积物-水界面的生物地球化学过程起不同的作用(Cardinale et al.,2002;Jonsson et al.,2003a).
摇蚊(Chironomid)属于节肢动物门(Arthropoda)、昆虫纲(Insecta)、双翅目(Diptera)、摇蚊科(Chironomidae)、摇蚊属(Chironomus);霍甫水丝蚓(Limnodrilus hoffmeiteri)属于环节动物门(Annelida)、寡毛纲(Oligochaeta)、颤蚓目(Tubificida)颤蚓科(Tubificidae)、水丝蚓属(Limnodrilus).二者均是河流和湖泊中常见的底栖无脊椎动物,也是大多数淡水水体中的优势物种.在对巢湖流域(高峰等,2010)、太湖流域(高欣等,2011)、滇池(王丽珍等,2007)的底栖动物群落调查发现,其主要底栖动物包含摇蚊幼虫和霍普水丝蚓等.国内的生物扰动研究主要涉及水丝蚓生物扰动对沉积物氮释放的影响(吴方同等,2011);摇蚊幼虫对沉积物溶解氧特征及反硝化的影响(商景阁等,2010);颤蚓生物扰动对沉积物氮释放的影响(聂小保等,2011)等,主要是针对单一物种的扰动过程和作用对沉积物理化特性的影响;国外学者Mermillod-Blondin在对海洋中的底栖生物研究发现,不同种属底栖生物对沉积物的扰动方式有着鲜明的特点,生物种属不同,生物扰动的作用方式和对沉积物的作用效果也不尽相同(Mermillod-Blondin et al.,2005);Raffaelli的研究也表明不同物种对生态系统的影响不同(Raffaelli et al.,2003).对渭河的生物扰动研究主要涉及了生物扰动对河流沉积物渗透性的影响(Song et al.,2010).
渭河是黄河的最大支流,也是陕西关中地区生活生产用水主要来源,由于生活和生产中对水资源的不合理利用,对其生态环境造成严重破坏(Chen et al.,2014;Wu et al.,2012;杨小刚等,2014).氮、磷是造成河流富营养化的主要元素,对渭河流域污染调查发现,总氮、总磷、氨氮皆是主要污染因子(武玮等,2013).水环境中的污染因子主要来源于外源输入和内源释放,外源污染物排放随着管理的加强可得到控制,而控制和监测内源污染物释放有着一定的难度,研究内源污染物释放就显得尤为迫切.底栖生物扰动是促进内源污染物氨氮、总氮和总磷等释放的重要因子,殷旭旺等(2013)对渭河流域大型底栖动物调查中发现摇蚊幼虫和霍普水丝蚓都属于该流域的优势类群,其平均丰度分别为(142.6±108.3)ind · m-2和(383.8±539.0)ind · m-2.因此本文以摇蚊幼虫和霍普水丝蚓为研究对象,通过对两种生物在同一生境中的生活习性进行研究,以揭示物种之间的生物扰动作用对沉积物中营养盐氮、磷的释放过程与机理,旨在为水体沉积物中内源污染物释放及水体污染和富营养化的控制提供参考依据.
2 材料与方法(Materials and methods) 2.1 底栖生物取样摇蚊幼虫和霍普水丝蚓均采自于渭河陕西段眉县境内.彼得逊采泥器(20 cm×30 cm)取河床沉积物,通过D型网、60目筛,去除大颗粒沉积物,收集沉积物中的底栖生物,将所需的底栖生物转入实验室生化培养箱中培养待用.用PVC管,采集上层20 cm沉积物,自然风干后过60目筛,将小于60目的沉积物混合均匀用于实验.实验用水均为超纯水.
2.2 实验方法将土样放入12个1 L烧杯(底部直径9.42 cm,高18 cm)中,沉积物厚度为4 cm,轻摇使沉积物均匀平铺于烧杯底部,将超纯水沿烧杯内壁缓慢注入,控制水深12 cm.挑选活力强,体长为0.75 cm的摇蚊幼虫(平均湿重为5.7μg)和2.0~3.5 cm的成熟水丝蚓(平均湿重为4.5μg)待用.
实验处理分为6组:①CK组,无底栖生物;②G1组,摇蚊70条;③G2组,47条摇蚊和23条水丝蚓,密度比为2∶1;④G3组,摇蚊和水丝蚓各35条,密度比为1∶1;⑤G4组,23条摇蚊和47条水丝蚓,密度比为1∶2;⑥G5组,水丝蚓70条.除空白组外,每一组生物总密度为1 ind · cm-2.实验在生化培养箱中暗光、温度恒定为15℃条件下进行.取样时,距沉积物表面2 cm左右处缓慢吸取上覆水,每次取100 mL,用于测量上覆水中的氨氮、总氮、总磷,取完样后补充同体积超纯水.在实验第8天,由于较多摇蚊幼虫变为成虫,实验终止.
2.2.1 计算方法为消除取样、补水对上覆水氮磷浓度影响,准确计算底泥氮磷释放通量,上覆水氮磷浓度利用式(1)修正(吴方同等,2011):
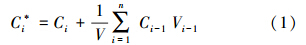
式中,C*i为第i天上覆水氮磷浓度(mg · L-1);Ci、Ci-1分别为第i天取样、第i-1天取样实测氮磷浓度(mg · L-1);V为上覆水体积(L),Vi-1为第i-1天取样体积.
沉积物中氮磷释放速率采用下式计算:

式中,Ji为沉积物氮磷在i天内释放速率(mg · m-2 · d-1);V为上覆水体积(L);C*i为第i天上覆水氮磷浓度(mg · L-1);T为实验天数(d);Si为PVC管的截面积(m2).
净增量(mg · L-1)为每天各生物组上覆水中氮磷浓度减去当天空白组的浓度计算得到.
2.2.2 测定方法水质参数氨氮采用纳氏试剂分光光度法测定;总氮利用碱性过硫酸钾消解紫外分光光度法测定;总磷利用钼酸铵分光光度法测定;上覆水中溶解氧浓度用哈希HQ40D溶氧仪测定(黄毅,2013).试验结果采用Excel和SPSS19.0软件统计和分析.
3 结果与讨论(Results and discussion) 3.1 生物扰动对沉积物中氨氮、总氮释放的过程与机理生物组的氨氮和总氮释放速率普遍高于空白组,其中G1组释放速率最高.相同密度的生物组中,G1到G4组随着摇蚊所占比例的减少,氨氮、总氮的释放速率逐渐降低,G5组的氨氮、总氮释放速率普遍高于G4组(图 1).与CK组对比,G1组氨氮平均净增量最高,达到2.32 mg · L-1,而G5组的氨氮平均净增量只有1.39 mg · L-1.在不同混合比例的G2、G3、G4组中,氨氮平均净增量分别为1.72、1.52、0.72 mg · L-1.对于总氮平均净增量,G1、G2、G3、G4、G5组分别为0.787、0.572、0.522、0.303、0.462 mg · L-1(图 2).在实验期间,各实验组沉积物向上覆水中释放氨氮、总氮的速率随时间增加而逐渐减小.对于上覆水中氨氮、总氮浓度的变化,各个实验组之间呈显著正相关(表 1、2).通过比较氨氮、总氮的释放速率和平均净增量可知,摇蚊幼虫与霍普水丝蚓的扰动对沉积物中氨氮、总氮的释放起促进作用.
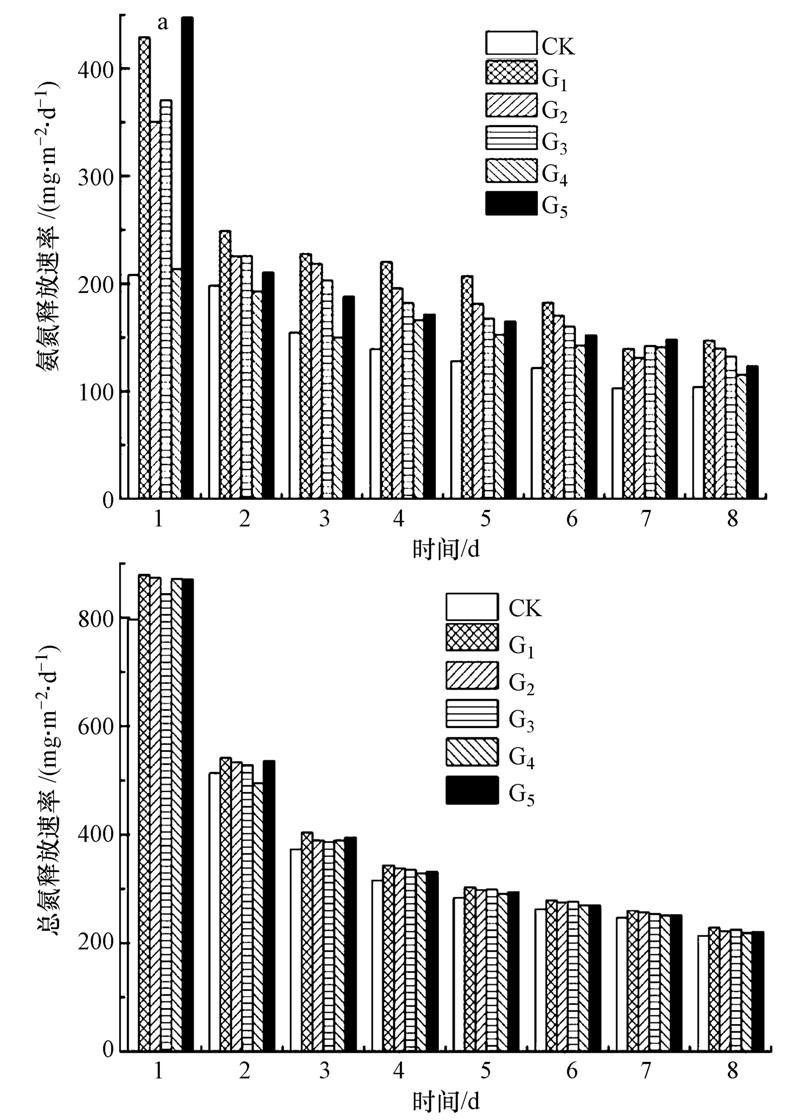 |
| 图 1 实验各组沉积物中氨氮、总氮释放速率随时间的变化 Fig. 1 The releasing rate of ammonia and nitrogen with time(days) |
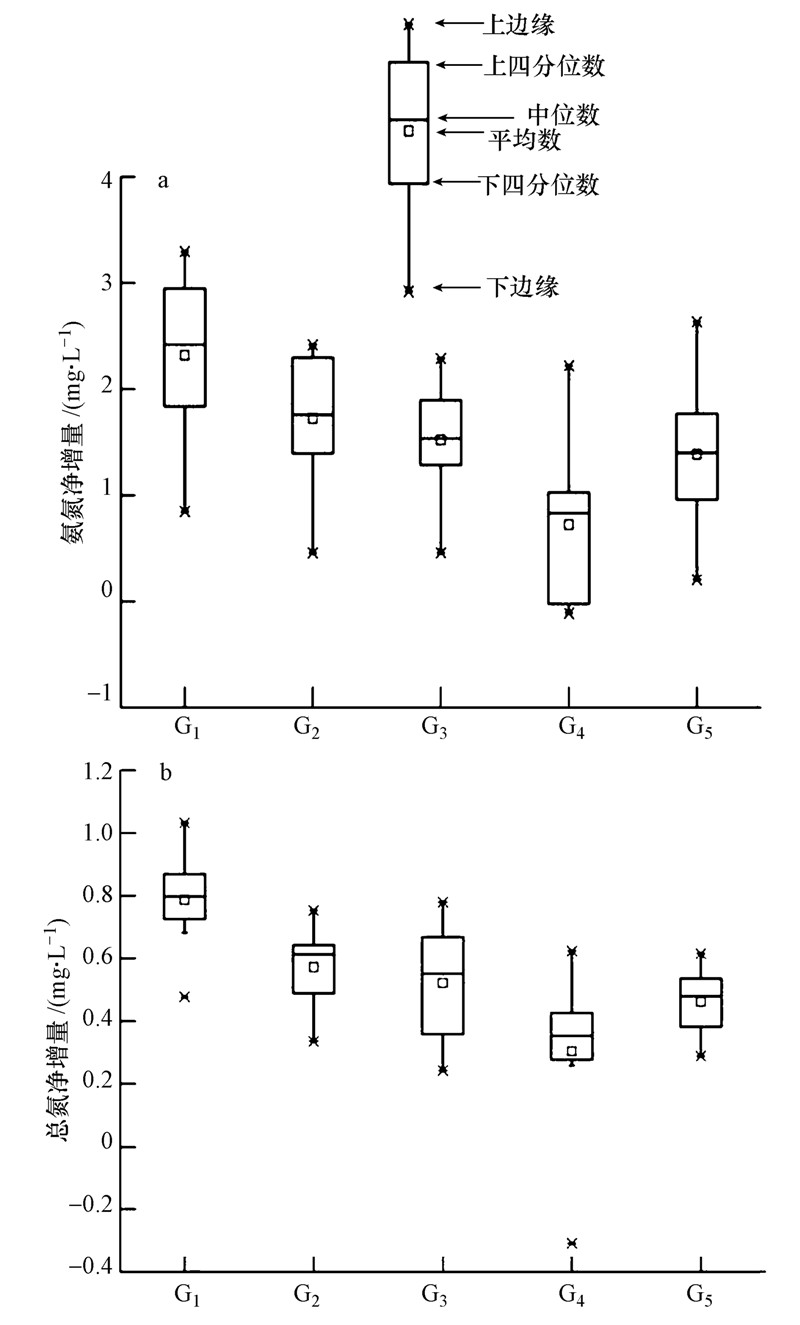 |
| 图 2 各实验组氨氮、总氮净增量变化 Fig. 2 Net increase of ammonia and nitrogen |
| 表 1 各实验组氨氮浓度相关矩阵 Table 1 Correlation matrix for ammonia |
G1组中氨氮、总氮的平均净增量均高于G5组(图 2).实验8 d内,G1组氨氮、总氮释放速率分别为147.13、228.63 mg · m-2 · d-1,G5组分别为123.39、221.03 mg · m-2 · d-1.实验期间,摇蚊幼虫摄取沉积物 表面的有机物、腐殖质等,在沉积物表面筑成管状 巢穴,通过测量烧杯外侧摇蚊幼虫扰动深度,最深为10 mm.霍普水丝蚓会钻入沉积物中摄食并合成垂向通道,在沉积物表面留下孔洞,并将约占体长1/3的尾部在水中呈‘S’型摆动.水丝蚓产生的垂向通道有助于上覆水和间隙水相互交换,促进深层的氨氮、总氮向水中释放(Hedman et al.,2011).商景阁等研究发现,与摇蚊幼虫相比,水丝蚓只有约2/3体长在沉积物中,并不能明显增加氧气的垂向渗透深度(商景阁等,2011).在沉积物表面,可观察到G1组的沉积物再造效果比G5组更明显(图 3).在滇池生物学特征研究中,1 kg摇蚊幼虫每天可消耗鲜藻0.094 kg,1 kg水蚯蚓每天可消耗鲜藻0.089 kg(王丽珍等,2004).底栖生物通过对沉积物的再造作用,及其摄食和排泄将有机物转化为无机物,均促进氨氮和总氮向上覆水中释放.因此,与霍普水丝蚓相比,摇蚊幼虫的扰动作用更有助于促进沉积物中氨氮、总氮向上覆水中释放.
| 表 2 各实验组总氮浓度相关矩阵 Table 2 Correlation matrix for total nitrogen |
有研究表明,在生物地球化学过程中,一类优势种属的作用特点比多种生物共同作用对沉积物的物理、化学性质影响更显著(Hooper and Vitousek,1997;Loreau et al.,2001; Fridley,2002;Emmerson et al.,2001;Jonsson et al.,2003b).也就是说,在不同生物对沉积物的共同作用中,一类优势种属的扰动作用对沉积物化学性质起主要影响.本实验中也得到了类似结论,在G2、G3、G4组中,摇蚊所占比例越高,氨氮和总氮平均净增量就越高.因此,不同比例混合组中,摇蚊幼虫的生物扰动对氨氮、总氮释放起主要促进作用.
在3组摇蚊幼虫与霍普水丝蚓不同混合比例中,随着水丝蚓所占比例升高,氨氮和总氮平均净增量逐渐降低,但G5组氨氮、总氮平均净量高于G4组(图 2),实验8 d内,G5组的氨氮、总氮释放速率也高于G4组(图 1).实验观察发现,在沉积物表层,水丝蚓在沉积物-水交界面留下孔洞,摇蚊幼虫的爬行和筑巢会将水丝蚓的孔洞覆盖和破坏,由于水丝蚓与摇蚊在同一沉积物中,两者的摄食习性具有相似性,并在沉积物空间上会产生重叠扰动,留下相同的孔隙.因此,在G4组中,摇蚊与水丝蚓摄食和空间上的竞争,导致对沉积物中氨氮、总氮释放的促进效果降低.
 |
| 图 3 实验各组生物扰动对沉积物表层结构的影响 Fig. 3 The influence of bioturbation on sediment surface structure |
各实验组中,生物组的总磷释放速率普遍高于空白组,其中G1组释放速率最高.在相同密度的生物组中,G1到G4组随着摇蚊所占比例的减少,总磷的释放速率逐渐降低,G5组的总磷释放速率普遍高于G4组(图 4).G1、G2、G3、G4、G5组的总磷平均净增量分别为0.105、0.065、0.054、0.041、0.063 mg · L-1(图 5).在实验期间,各实验组的沉积物向上覆水中释放总磷的速率随时间增加逐渐减小,且对于总磷浓度的变化,各实验组之间呈显著正相关(表 3).
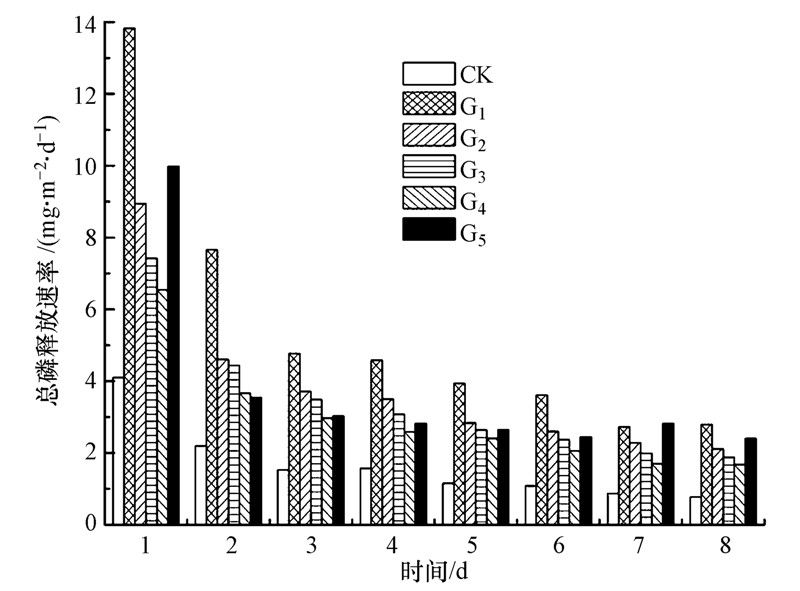 |
| 图 4 实验各组沉积物中总磷释放速率随时间的变化 Fig. 4 The release rate of total phosphorus with time(days) |
 |
| 图 5 各实验组总磷净增量变化 Fig. 5 Net increment of total phosphorus |
各生物组总磷的释放速率均高于空白组,表明摇蚊幼虫和霍普水丝蚓扰动作用对沉积物总磷的释放起促进作用.底栖生物通过沉积物再造、生物扩散、生物平流、再悬浮等作用,能创造适宜溶磷菌和异养菌生存的环境,促进微生物对有机物的矿化分解速率,加速沉积物与上覆水中的磷交换(Bai et al.,2012),提高上覆水中总磷浓度.G1组总磷平均净增量高于G5组,在G2、G3、G4组中,随着摇蚊所占的比例减少,总磷的平均释放速率逐渐降低.摇蚊和水丝蚓通过生物扩散作用,会减少沉积物间隙水中的溶解态磷,将间隙水中的磷释放到上覆水中.有研究表明,摇蚊幼虫比水丝蚓能更显著地减少间隙水中的溶解态磷(Zhang et al.,2010),且摇蚊对沉积物的再造作用比水丝蚓更明显(图 3).因此,相对于水丝蚓的扰动作用,摇蚊幼虫对沉积物中总磷向上覆水中释放的促进效果更明显.
G5组总磷平均释放量高于G3、G4组,低于G2组(图 4),在第8 d,G5组上覆水中总磷释放速率高于G3、G4组.摇蚊与水丝蚓在同一环境中,由于食物、空间等因素相互竞争,摇蚊幼虫对沉积物表面改造较大,影响霍普水丝蚓在沉积物表面的活动,因此,在G3、G4组中,摇蚊与水丝蚓的共同作用使得生物扰动对沉积物中总磷释放的促进效果减弱.
| 表 3 各实验组总磷浓度相关矩阵 Table 3 Correlation matrix for total phosphorus |
相同的实验条件下,所有生物组的溶解氧都比空白组低,在实验第7 d,各实验组上覆水中溶解氧明显降低(表 4).所有生物组日均溶解氧浓度由高到低的顺序为G5、G4、G3、G2、G1组(图 6),表明水丝蚓的扰动作用对上覆水中的溶解氧消耗比摇蚊幼虫少.
| 表 4 各实验组上覆水中溶解氧浓度随时间的变化 Table 4 The changes of dissolved oxygen in overlying water with time(days)mg · L-1 |
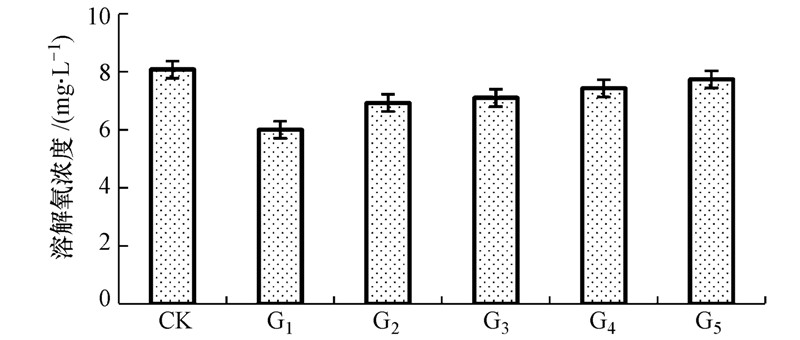 |
| 图 6 各实验组日均溶解氧浓度 Fig. 6 The dissolved oxygen of daily average |
由于生物本身的呼吸以及微生物的硝化等化学作用,都需要消耗一定量的氧.Lagauzère等对无脊椎底栖动物研究发现,底栖生物扰动会改变沉积物构造,增加氧气的消耗(Lagauzère et al.,2009).因此,所有生物组中溶解氧均低于CK组.此外,G2、G3、G4组中,摇蚊数量越少,溶解氧浓度越高.商景阁通过对中国长足摇蚊幼虫和霍普水丝蚓对垂直沉积物中氧气渗透深度研究发现,中国长足摇蚊幼虫扰动后溶解氧平均侵蚀深度超过6 mm,水丝蚓侵蚀深度为5~6 mm,摇蚊幼虫扰动作用能显著增加氧气渗透深度,霍普水丝蚓的扰动作用产生的结果并不明显(商景阁等,2011).氧气渗透深度的增加,能为深层沉积物提供充足的氧,从而增加沉积物中好氧微生物的化学作用,增加水中总氮、总磷的浓度,所以G1组中氨氮、总氮和总磷释放速率较高.深层沉积物溶解氧浓度增加,同时也增加了微生物的耗氧量,上覆水中的溶解氧不断向沉积物迁移.因此,实验组中,摇蚊幼虫所占比例越高,上覆水溶解氧浓度越低.
实验第7 d时,各组中的溶解氧浓度大幅度降低,且G5组沉积物中氨氮、总磷向上覆水中释放的速率高于G1组(表 4).溶解氧的降低会促进微生物的反硝化作用,由于摇蚊扰动后对氧气的消耗量比水丝蚓多,在溶解氧降低时,摇蚊的活性降低,对沉积物的扰动能力减小,微生物的反硝化作用增加,沉积物中的氨氮、总磷释放减少.有研究表明,溶解氧浓度变化对颤蚓显著影响(Famme and Knudsen,1985;Merle et al.,1997),Svensson等发现,在环境条件和生物量一致下,单一水丝蚓沉积物中的反硝化作用程度大约是单一摇蚊幼虫沉积物中的一半(Svensson et al.,2001).通过实验发现,溶解氧浓度降低时,会加速水丝蚓停留在水中部分的尾部摆动,提高对沉积物的扰动作用,促进氨氮、总磷向上覆水中释放.因此,G1组和摇蚊幼虫所占比例高的G2组氨氮、总磷释放速率降低,G3组变化不大,而G5组和G4组氨氮、总磷释放速率显著提高(图 1、4).
4 结论(Conclusions)1)实验模拟表明,摇蚊幼虫、霍普水丝蚓对沉积物中氨氮、总氮释放具有明显的促进作用.单一物种组中摇蚊的氨氮、总氮平均净增量为2.32、0.787 mg · L-1,摇蚊幼虫对沉积物中氨氮、总氮释放效果比霍普水丝蚓更显著.在摇蚊幼虫与霍普水丝蚓不同混合比例的3组中,随着摇蚊所占比例降低,上覆水中的氨氮、总氮释放速率随之降低,因此摇蚊幼虫扰动作用对沉积物的氮释放起主要作用,并且,在混合实验组(摇蚊23条,霍普水丝蚓47条)中,摇蚊幼虫与霍普水丝蚓之间的相互竞争,使其扰动对沉积物中氨氮、总氮释放的促进效果减弱.
2)生物扰动对沉积物中总磷释放起促进作用,且单一物种组中摇蚊释放速率最高.摇蚊幼虫与霍普水丝蚓之间的相互竞争,会降低生物扰动对沉积物中总磷释放的促进效果.
3)空白组上覆水中溶解氧浓度高于其他组,上覆水中日均溶解氧浓度随着水丝蚓所占比例增大而增加.水丝蚓对上覆水中的溶解氧浓度变化更敏感,溶解氧浓度的变化会加剧水丝蚓扰动作用,从而增大对沉积物中氨氮、总磷的释放效果.
| [1] | Bai X L, Zhou Y K, Zhang L. 2012. The influence of tubificid worms bioturbation on organic phosphorus components and their vertical distribution in sediment of Lake Taihu[J]. Acta Ecologica Sinica, 32(17): 5581-5588 |
| [2] | Cardinale B J, Palmer M A, Collins S L. 2002. Species diversity enhances ecosystem functioning through interspecific facilitation[J]. Nature, 415(6870): 426-429 |
| [3] | Chen X H, Mi H C, He H M, et al. 2014. Hydraulic conductivity variation within and between layers of a high floodplain profile[J]. Journal of Hydrology, 515: 147-155 |
| [4] | Ciutat A, Gerino M, Boudou A. 2007. Remobilization and bioavailability of cadmium from historically contaminated sediments: Influence of bioturbation by tubificids[J]. Ecotoxicology and Environmental Safety, 68(1): 108-117 |
| [5] | Emmerson M C, Solan M, Emes C, et al. 2001. Consistent patterns and the idiosyncratic effects of biodiversity in marine ecosystems[J]. Nature, 411(6833): 73-77 |
| [6] | Famme P, Knudsen J. 1985. Aerotaxis by the freshwater oligochaete Tubifex sp.[J]. Oecologia, 65(4): 599-601 |
| [7] | Fridley J D. 2002. Resource availability dominates and alters the relationship between species diversity and ecosystem productivity in experimental plant communities[J]. Oecologia, 132(2): 271-277 |
| [8] | 高峰, 尹洪斌, 胡维平, 等. 2010. 巢湖流域春季大型底栖动物群落生态特征及与环境因子关系[J]. 应用生态学报, 21(8): 2132-2139 |
| [9] | 高欣, 牛翠娟, 胡忠军. 2011. 太湖流域大型底栖动物群落结构及其与环境因子的关系[J]. 应用生态学报, 22(12): 3329-3336 |
| [10] | Hedman J E, Gunnarsson J S, Samuelsson G, et al. 2011. Particle reworking and solute transport by the sediment-living polychaetes Marenzelleria neglecta and Hediste diversicolor[J]. Journal of Experimental Marine Biology and Ecology, 407(2): 294-301 |
| [11] | Hooper D U, Vitousek P M. 1997. The effects of plant composition and diversity on ecosystem processes[J]. Science, 277(5330): 1302-1305 |
| [12] | 黄毅. 2013. 硝化细菌对淡水水族箱水质和异养细菌类群变化的影响. 上海: 上海海洋大学 |
| [13] | Jonsson M, Malmqvist B. 2003a. Mechanisms behind positive diversity effects on ecosystem functioning: testing the facilitation and interference hypotheses[J]. Oecologia, 134(4): 554-559 |
| [14] | Jonsson M, Malmqvist B. 2003b. Importance of species identity and number for process rates within different stream invertebrate functional feeding groups[J]. Journal of Animal Ecology, 72(3): 453-459 |
| [15] | Lagauzère S, Boyer P, Stora G, et al. 2009. Effects of uranium-contaminated sediments on the bioturbation activity of Chironomus riparius larvae (Insecta, Diptera) and Tubifex tubifex worms (Annelida, Tubificidae)[J]. Chemosphere, 76(3): 324-334 |
| [16] | Loreau M, Naeem S, Inchausti P, et al. 2001. Biodiversity and ecosystem functioning: current knowledge and future challenges[J]. Science, 294(5543): 804-808 |
| [17] | Lu Y Z, Yan B X. 2010. Effect of bioturbation by worms on the transport of Pb and Cd between sediments and waters[J]. China Environmental Science, 30(2): 251-255 |
| [18] | Merle C, Danielopol D L, Watanamahart P. 1997. Impact of environmentalconditions on the habitat selection of interstitial-dwelling Tubificids (Oligochaeta). An experimental study[J]. Geobios, 30(Suppl.2): 91-99 |
| [19] | Mermillod-Blondin F, Franois-Carcaillet F, Rosenberg R. 2005. Biodiversity of benthic invertebrates and organic matter processing in shallow marine sediments: an experimental study[J]. Journal of Experimental Marine Biology and Ecology, 315(2): 187-209 |
| [20] | Mermillod-Blondin F, Nogaro G, Vallier F, et al. 2008. Laboratory study highlights the key influences of stormwater sediment thickness and bioturbation by tubificid worms on dynamics of nutrients and pollutants in stormwater retention systems[J]. Chemosphere, 72(2): 213-223 |
| [21] | 聂小保, 吴淑娟, 吴方同, 等. 2011. 颤蚓生物扰动对沉积物氮释放的影响[J]. 环境科学学报, 31(1): 107-113 |
| [22] | Raffaelli D, Emmerson M, Solan M, et al. 2003. Biodiversity and ecosystem processes in shallow coastal waters: an experimental approach[J]. Journal of Sea Research, 49(2): 133-141 |
| [23] | 商景阁, 张路, 张波, 等. 2010. 中国长足摇蚊(Tanypus chinensis)幼虫底栖扰动对沉积物溶解氧特征及反硝化的影响[J]. 湖泊科学, 22(5): 708-713 |
| [24] | 商景阁, 张路, 王建军, 等. 2011. 中国长足摇蚊幼虫和霍普水丝蚓扰动下沉积物氧气特征分析[J]. 水生生物学报, 35(4): 610-615 |
| [25] | Song J X, Chen X H, Cheng C. 2010. Observation of bioturbation and hyporheic flux in streambeds[J]. Frontiers of Environmental Science & Engineering in China, 4(3): 340-348 |
| [26] | Svensson J M, Enrich-Prast A, Leonardson L. 2001. Nitrification and denitrification in a eutrophic lake sediment bioturbated by oligochaetes[J]. Aquatic Microbial Ecology, 23(2): 177-186 |
| [27] | 王丽珍, 李砥, 刘永定, 等. 2004. 滇池摇蚊科幼虫和水丝蚓属的生物学特性分析[J]. 水利渔业, 24(2): 48-50 |
| [28] | 王丽珍, 刘永定, 陈亮, 等. 2007. 滇池底栖无脊椎动物群落结构及水质评价[J]. 水生生物学报, 31(4): 590-593 |
| [29] | Widdows J, Brinsley M D, Bowley N, et al. 1998. A benthic annular flume for in situ measurement of suspension feeding/Biodeposition rates and erosion potential of intertidal cohesive sediments[J]. Estuarine, Coastal and Shelf Science, 46(1): 27-38 |
| [30] | 吴方同, 陈锦秀, 闫艳红, 等. 2011. 水丝蚓生物扰动对东洞庭湖沉积物氮释放的影响[J]. 湖泊科学, 23(5): 731-737 |
| [31] | Wu W, Xu Z X, Liu X C. 2012. Impact of Baojixia water diversion works on the hydrologic regime in the Wei River basin[J]. Procedia Environmental Sciences, 13: 1653-1662 |
| [32] | 武玮, 徐宗学, 于松延. 2013. 渭河流域水环境质量评价与分析[J]. 北京师范大学学报(自然科学版), 49(2/3): 275-281 |
| [33] | 殷旭旺, 徐宗学, 高欣, 等. 2013. 渭河流域大型底栖动物群落结构及其与环境因子的关系[J]. 应用生态学报, 24(1): 218-226 |
| [34] | 杨小刚, 宋进喜, 陈佳, 等. 2014. 渭河陕西段潜流带沉积物重金属变化初步分析[J]. 环境科学学报, 34(8): 2051-2061 |
| [35] | Zhang L, Gu X Z, Fan C X, et al. 2010. Impact of different benthic animals on phosphorus dynamics across the sediment-water interface[J]. Journal of Environmental Sciences, 22(11): 1674-1682 |
 2015, Vol. 35
2015, Vol. 35


