2. 农业部都市农业(南方)重点开放实验室, 上海 200240
2. Open Key Laboratory of Urban Agriculture (South), the Ministry Agriculture of China, Shanghai 200240
磷是促进作物生长和提高农业产量不可缺少的元素之一(Vassilev et al., 2006),在土壤中主要以无机磷化合物和有机磷化合物两种形态存在,其中95%以上为无效磷,植物很难利用(Wang et al., 2003).为了提高农业产量,通常在土壤中施加速效磷肥,其中能被作物吸收的很少,绝大多数磷转化为难溶性磷酸盐并迅速被土壤矿物吸附固定,大量使用会导致土壤养分比例失调、土壤板结及环境污染等一系列问题(Shigaki et al., 2006).而利用生物学方法,提高土壤中磷的有效性是解决这一问题的重要途径.
土壤中存在许多微生物能够将难溶性的磷酸盐转化为可利用形态,这些微生物称为解磷微生物(PSM),包括解磷细菌、解磷真菌和解磷放线菌.近年来,国内外科研人员对土壤中溶磷菌的种类、分布、溶磷机制、应用效果等方面进行了大量的研究.研究表明,微生物溶磷机制具有多样性(Chen et al., 2006),产生低分子量有机酸被认为是溶磷菌溶解难溶无机磷的主要原因(Behbahani,2010),这些有机酸既能降低pH值,又可与铁、铝、钙等离子结合,从而使难溶性的磷酸盐溶解;而对有机磷的溶解主要是通过“酶解作用”,有机磷分子不能透过细胞膜,必须经过胞外磷酸酶的水解,将有机磷转化为生物可吸收利用的可溶性磷(Mudryk,2004).磷酸酶通常分为酸性磷酸酶和碱性磷酸酶,其中,碱性磷酸酶(Alkaline Phosphatase,ALPase)在含磷有机物质的矿化过程中具有重要作用,磷酸酶活性与微生物的类型、磷源的种类等因素有关(钟传青等,2005;姜经梅等,2011;徐爽等,2013).
不同土壤由于其特殊的理化性质可能会导致非土著溶磷菌无法定植,生存竞争较差,对菌株的溶磷能力影响较大(乔志伟等,2013).因此,筛选出既能适应土壤性质、又能解磷的微生物对特殊农业环境来说具有重要意义.目前,关于特殊土壤中分离到的溶磷菌也有报道,如从红壤中分离出的洋葱伯克霍尔德氏菌(Burkholderia cepacia)C5-A(刘文干等,2012),从石灰性土壤分离筛选出的黑曲霉(Aspergillus niger)Z60等(乔志伟等,2013).设施栽培条件下的次生盐渍化土壤,由于其特殊的形成原因,土壤中硝酸盐含量高,土壤理化性质差,会危害作物正常生长和农产品的品质(时唯伟等,2009).已有研究表明,盐胁迫会抑制植物对磷元素的吸收(Martinez et al., 1994),加速植物衰老.通过有益微生物缓解盐胁迫,提高土壤中磷素含量,促进作物生长发育已成为研究的新方向(Egamberdiyeva et al., 2004;Mayak et al., 2004;Yue et al., 2007).但目前针对次生盐渍化土壤中筛选出的解磷菌株报道较少.
课题组前期从设施栽培的次生盐渍化土壤中筛选得到一株巨大芽孢杆菌(Bacillus megatherium)NCT-2,研究发现,该菌株能够耐受硝酸盐,转化硝态氮,缓解盐胁迫,同时能够改善土壤理化性质,增加土壤中微生物的多样性,提高作物产量(张春华等,2011;黄红艳,2012).在此基础上,本文通过摇瓶实验研究该菌株对不同难溶性含磷物的溶解能力及其影响因素,并通过研究溶磷量与pH、磷酸酶活性之间的关系及对代谢产物中磷酸酶和有机酸的分析探讨其溶磷机制,以期为开发具有耐盐促生功效的微生物菌肥提供种质资源和理论依据.
2 材料与方法(Materials and methods) 2.1 菌株实验室自主筛选得到的一株巨大芽孢杆菌(Bacillus megatherium),命名为NCT-2.
2.2 培养基LB培养基:NaCl 10 g,蛋白胨10 g,酵母膏5 g,蒸馏水1000 mL,pH 7.0~7.5.无机磷基础培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4 · 7H2O 0.03 g,MnSO4 · 4H2O 0.03 g,MgSO4 · 7H2O 0.3 g,Ca3(PO4)2 5 g,蒸馏水1000 mL,pH 7.0~7.5.无机盐培养基:KNO3 2.15 g,KCl 1 g,KH2PO4 0.5 g,MgSO4 · 7H2O 0.5 g,FeSO4 · 7H2O 10 mg,CaCl2 1 mg,葡萄糖15 g,蒸馏水1000 mL,pH 7.2.以上培养基均经1×105 Pa灭菌20 min.
2.3 溶磷特性分析 2.3.1 菌株对磷酸钙的溶解特性1)菌株对磷酸钙的溶磷动态:将菌株接种于无机磷培养基,连续培养5 d,每隔1 d测定一次菌液中溶磷量和OD660,研究菌株对磷酸钙的溶磷动态.
2)不同碳、氮源对菌株溶磷量的影响:以(NH4)2SO4为氮源,分别以葡萄糖、麦芽糖、蔗糖、淀粉为碳源,加入量为1%,研究不同碳源对菌株溶磷量的影响;以葡萄糖为碳源,将(NH4)2SO4等量替换为KNO3、尿素、NH4Cl、NaNO2,研究不同氮源对菌株溶磷量的影响.
3)不同浓度磷酸钙对菌株溶磷量的影响:磷酸钙的加入量分别为1、3、5、7 g · L-1.
2.3.2 菌株对不同含磷物的溶解能力将无机磷基础培养基的Ca3(PO4)2改为等量的Al PO4、FePO4、植酸钙,当磷源采用卵磷脂时,加入量为2 g · L-1,另加入CaCO3 5 g · L-1,研究菌株对不同含磷物的溶解能力.
2.4 菌株培养过程将在LB培养基中培养24 h的细菌刮入无菌水中,制备成菌体悬浮液,菌数约为108 cfu · mL-1.向500 mL三角瓶中加入100 mL含磷培养基,按2%接种量接入制备好的菌悬液,30 ℃、180 r · min-1条件下摇床培养.同时设不接菌处理,每个处理重复3次.
2.5 分析方法 2.5.1 OD660和发酵液pH值测定利用酶标仪在660 nm波长处测定培养基的光密度(OD660),光密度值与菌体的细胞浓度成正比,光密度值越大,培养基中的菌体细胞浓度就越高;用DELTA320型pH计测定发酵液的pH值.
2.5.2 发酵液中有效磷和磷酸酶活性测定将发酵液在4 ℃、10000 r · min-1下离心5 min,取上清液稀释适当倍数,通过钼锑抗比色法(史瑞和等,1996)测定有效磷含量;磷酸酶活性测定采用对硝基苯磷酸盐法,采用pH为6.15和11.0的缓冲液将磷酸单脂酶分为酸性磷酸酶和碱性磷酸酶,按照文献(佩奇等,1991)方法检测磷酸酶活性,使用改良型Bradford蛋白质定量测定试剂盒(SK3041,上海生工)测定蛋白含量.在37 ℃条件下,每μg蛋白每小时催化产生1 μmol的对硝基酚称为1个酶活力单位,记为μmol · μg-1 · h-1,以U表示.
2.5.3 GC-MS测定菌株接入无机盐培养基,30 ℃、180 r · min-1条件下摇床培养2 d,取发酵液在5000 r · min-1、4 ℃下离心5 min,取上清过0.22 μm微孔滤膜,滤液经冷冻干燥先后溶于80 μL 15 mg · mL-1甲氧胺盐溶液和80 μL衍生试剂BSTFA+TMCS,待反应后进行测定.
GC-MS条件:初始温度40 ℃,维持2 min,以3 ℃ · min-1升到250 ℃,再以10 ℃ · min-1升到290 ℃.质谱参数:扫描范围(m/z)29~400;样口温度 250 ℃;接口温度 280 ℃;离子源(EI)温度 230 ℃;电离方式EI,电子能量70 eV,四级杆温度150 V.色谱条件:HP-5MS(30 m×0.25 mm×0.25 μm),载气为高纯氦气,载气流速 1.0 mL · min-1;进样方式为不分流;进样量 1 μL.
2.6 数据处理数据采用Origin 8.0和SPSS 18.0统计软件进行处理分析.
3 结果和讨论(Results and discussion) 3.1 菌株NCT-2对磷酸钙的溶磷特性 3.1.1 菌株NCT-2对磷酸钙的溶磷动态菌株NCT-2对磷酸钙的溶磷动态菌株NCT-2在无机磷培养基中连续培养5d,测定培养基中有效磷含量和菌体生物量,结果表明,培养液中的有效磷含量与菌体生长状况密切相关(图 1).在菌株培养前期,随着菌体生物量的增加,培养基中有效磷含量逐渐增大,在第2d,菌株对磷的释放达到最大值93.34 mg · L-1,第2d之后,菌体的生长情况基本呈稳定状态,而培养基中有效磷含量随时间逐渐下降,在第4~5 d,培养基中有效磷含量下降至60 mg · L-1并逐渐保持平衡.解磷微生物溶解难溶性磷酸盐是一个随微生物生长状况而变化的动态过程,微生物不断地生长、繁殖,并分泌出相关的代谢产物与难溶磷发生作用,使难溶磷不断地释放出来,除供菌体利用外还要剩余供测定.巨大芽孢杆菌NCT-2的解磷动态变化趋势表明,在2 d左右,当NCT-2菌株的生物量达到最大时,溶磷效果最好;随着培养时间的延长,微生物数量趋于稳定,但溶磷量缓慢下降,可能是由于培养液中营养成分逐渐减少,难以满足微生物的生长需要,微生物的生理活性受到抑制,从而导致代谢能力下降,与溶磷相关的代谢产物减少,溶磷量因此减少.
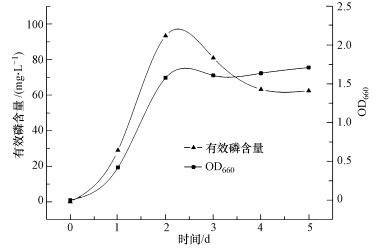 |
| 图 1 菌株NCT-2的生物量和溶磷量随时间的变化 Fig.1 OD660 and available phosphate content of NCT-2 culture during solubilizing |
菌株NCT-2在含有不同碳源的磷酸钙培养液中培养2 d后,测定发酵液中有效磷含量.结果表明,不同碳源对溶磷菌溶解Ca3(PO4)2能力影响很大(图 2),当以葡萄糖为碳源时发酵液中有效磷含量在90 mg · L-1以上;以淀粉为碳源时发酵液中有效磷含量最低,约是葡萄糖处理组的1/3,说明菌株优先利用单糖如葡萄糖,其次为双糖类麦芽糖和蔗糖,而对大分子多糖类物质如淀粉的利用能力较差.这可能是由于菌株对双糖和多糖的利用较为复杂,需要酶的参与将这些双糖或者多糖水解为单糖.当以葡萄糖为碳源时,培养液的pH值大幅度下降,说明菌株因生长活跃,产生了较多的有机酸,溶磷量也明显增加;以淀粉为碳源时,介质的pH值最高,说明菌株产酸能力较以葡萄糖为碳源时减弱;而以麦芽糖和蔗糖为碳源时,pH值变化介于以葡萄糖和淀粉为碳源之间.培养基中pH的变化与菌株对碳源的利用次序的一致性也说明了菌株的产酸能力与碳源的利用顺序是一致的.
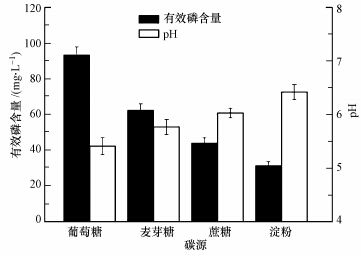 |
| 图 2 不同碳源条件下菌株NCT-2培养液中pH和有效磷含量 Fig.2 The pH and available phosphate content of NCT-2 culture under different carbon sources |
由图 3可知,菌株NCT-2以硫酸铵为氮源时溶磷量为93.34 mg · L-1,以硝酸钾为氮源时溶磷量约为30 mg · L-1,以氯化铵和尿素为氮源时,溶磷量在60 mg · L-1左右;菌株NCT-2对氮源的利用顺序依次为(NH4)2SO4>NH4Cl>尿素>NaNO2>KNO3.图 3结果表明,不同氮源显著影响菌株的溶磷能力,菌株对氮源的利用跟氮的形态(NH4+、NO3-、NO-)密切相关.菌株NCT-2在以铵态氮为氮源时较以硝态氮为氮源时对磷有更好的溶解能力,这可能与氮在菌株体内的代谢途径有关.该菌株对硝酸盐的代谢途径研究结果表明,细胞吸收环境周围的硝酸盐并在硝酸盐还原酶的作用下转化为亚硝酸盐,此后在亚硝酸盐还原酶和谷氨酰胺合成酶的作用下转变为谷氨酰胺,进而满足菌株生长代谢需要(Shi et al., 2014),因此,该菌株对铵态氮的代谢更为迅速直接.由于铵态氮较硝态氮更容易吸收利用,导致以铵态氮为氮源时,菌株的溶磷能力增强,使培养液中溶磷量显著增加.不同形态的氮素对不同溶磷菌的影响各异,有的溶磷菌在以KNO3为氮源时溶磷量最大(乔志伟等,2013);也有研究表明,某些菌株在供给NH4+时解磷活性最高,供给NO3-则降低了解磷活性(赵小蓉等,2002).以(NH4)2SO4、NH4Cl为氮源时,溶磷量的差异可能与SO2-4、Cl-对菌株的不同生理作用相关.5种氮源的溶磷体系pH变化与对氮源的利用顺序一致,pH由低到高依次为(NH4)2SO4、NH4Cl、尿素、NaNO2、KNO3,说明在以铵态氮为氮源时,菌株代谢活跃,产生了较多的有机酸,使pH明显降低,从而有利于磷的溶解.
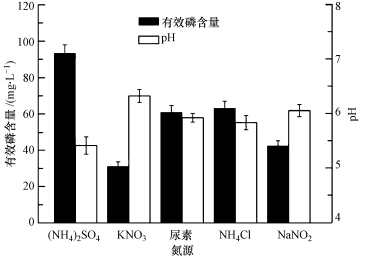 |
| 图 3 不同氮源条件下菌株NCT-2培养液中pH和有效磷含量 Fig.3 The pH and available phosphate content of NCT-2 culture under different nitrogen sources |
将巨大芽孢杆菌NCT-2接种至不同浓度的磷酸钙培养液中培养2 d,发现菌株的生长情况受磷酸钙浓度影响,在7 g · L-1磷酸钙培养基中菌株的生物量最低;而不同浓度的磷酸钙培养基中有效磷含量不同,3、5 g · L-1磷酸钙体系的溶磷量均在90 mg · L-1以上,显著大于1 g · L-1和7 g · L-1磷酸钙的体系,而7 g · L-1磷酸钙体系的溶磷量最低,仅为1.30 mg · L-1(图 4).显然菌株的溶磷能力受到培养基中磷源浓度的影响,过低和过高的磷酸钙浓度都会导致溶磷量的减少.低浓度磷酸钙培养基中由于自身所含磷元素较少,使得有效磷含量也相应较小;而过高浓度的Ca2+可能影响了菌株的生长状态,使菌株产酸能力减弱,从而抑制了菌株对磷酸钙的溶解.
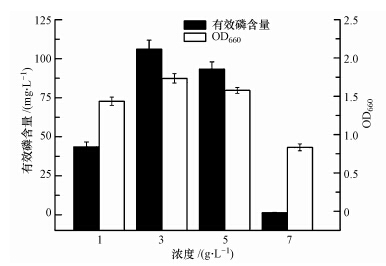 |
| 图 4 不同浓度Ca3(PO4)2对培养液中溶磷量的影响 Fig.4 Effect of Ca3(PO4)2 concentration on phosphate dissolution rate |
菌株NCT-2对不同含磷化合物的溶磷特性有较大差异,如表 1所示,菌株对磷酸钙和植酸钙的溶解能力很强,溶磷量均在90 mg · L-1以上,而对FePO4、AlPO4的溶解能力稍弱,溶磷量为30~40 mg · L-1,溶磷量最小的是卵磷脂,仅为6.15 mg · L-1.显然,菌株NCT-2对无机磷的溶解能力大于有机磷,这与前人的研究结果一致(向文良等,2009).菌株对磷酸钙和植酸钙两种无机磷具有很强的溶解能力,可能是由于菌株分泌的有机酸对Ca2+具有更强的螯合能力,而有机酸对Al3+、Fe3+的螯合能力没有Ca2+强,导致以AlPO4、FePO4为磷源的培养基中有效磷含量明显低于以Ca2+为磷源的培养基.实验结果表明,含有Al3+、Fe3+磷源的培养基的pH值明显低于其他磷源,一方面是由于菌株本身产生的有机酸降低了体系的pH,另一方面,由于酸解游离出来的Al3+、Fe3+会发生酸性水解,导致培养基酸性降低.此外,无机磷培养基的pH值都发生了明显降低,充分证明了菌株在生长过程中自身代谢产生了一定量的有机酸;而卵磷脂培养基解磷液的pH值高于对照组,其原因可能是细菌产生的酶作用于卵磷脂产生胆碱(向文良等,2009),这也表明了菌株对有机磷的溶解方式不是基于有机酸的参与.菌株对卵磷脂的溶磷能力最弱,这是由于卵磷脂为有机磷,本身磷元素含量就相对较低,可能导致菌株的溶磷量相对于几种无机磷源要小的多,另外,由于无机磷和有机磷的溶解机理有所不同,对有机磷的溶解主要靠磷酸酶的参与而不是菌株自身代谢的有机酸,这在机理上的不同也可能导致有机磷的溶解能力要比无机磷弱一些.
| 表 1 不同磷源条件下菌株NCT-2培养液有效磷含量 Table 1 The available phosphate content of NCT-2 culture under different phosphate sources |
产酶或产酸在解磷微生物溶解各种难溶性磷酸盐时都起一定作用(Illmer et al., 1995),而何种溶磷方式起主导作用,主要取决于环境中磷的的存在形式,因而有必要对菌株在不同磷源培养条件下磷酸酶的活性进行测定,同时也有必要确定菌株在代谢过程中是否产生了有机酸.
3.3.1 磷酸酶活性与溶磷量的关系菌株NCT-2在不同磷源的培养基中,产生的酸性磷酸酶和碱性磷酸酶活性差异很大(图 5),以磷酸钙、植酸钙为磷源时,酸性磷酸酶和碱性磷酸酶活性都很低;以FePO4和AlPO4为磷源时,酸性磷酸酶的活性较高,碱性磷酸酶较低;而以卵磷脂为磷源时,酸性磷酸酶活性最低,碱性磷酸酶最高.这应该是由于微生物对不同磷源的不同溶磷机理导致的.磷酸钙、植酸钙体系中较低的磷酸酶活性,说明这两个体系中磷的溶解并不依赖于磷酸酶,而是另有机制,如微生物产酸等.FePO4、AlPO4体系中较高的酸性磷酸酶可能是导致难溶磷溶解的部分原因.该酶催化葡萄糖与可溶性磷酸盐中的PO3-4结合生成葡萄糖-1-磷酸、葡萄糖-6-磷酸等,从而使发酵液pH下降(钟传青等,2005).
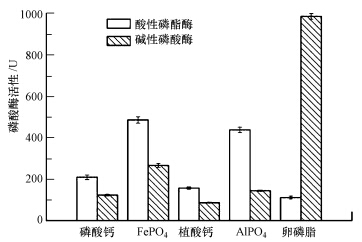 |
| 图 5 不同含磷化合物下菌株NCT-2磷酸酶活性 注解 Fig.5 Phosphate activity of NCT-2 culture under different phosphorus sources |
碱性磷酸酶在以卵磷脂为磷源时活性最高,在其他4种无机磷培养基中活性很低,从而证实了解磷微生物分解有机磷的主要方式是通过分泌碱性磷酸酶,将有机磷转变为可溶性磷.其他4种无机磷培养基中也能检测到微弱的碱性磷酸酶活性,主要原因可能是培养基中存在其他有机磷底物,如微生物菌体的核酸、细胞膜上的磷脂等,这与菌体的生长状态及菌体的生物量等因素也相关(钟传青等,2005).有研究显示,碱性磷酸酶活性与水体中可利用磷的关系一般是“抑制-诱导机制”,即有机磷或可酶解磷含量的增加可诱导碱性磷酸酶活性的提高,高的正磷酸盐(溶解无机磷)含量对碱性磷酸酶活性产生抑制作用(刘存歧等,2007).
3.3.2 GC-MS对NCT-2代谢产物的初步分析有研究表明,培养液溶磷量与培养液pH的变化有一定的相关性(康贻军等,2006;刘文干等,2012),也有研究表明两者之间不存在必然的或者显著的关系(Narsian et al., 2000;郝晶等,2006).本研究中,以磷酸钙为培养基,不同碳氮源条件下溶磷量和pH之间呈显著相关性(p<0.05),但不同磷源培养基中有效磷含量和pH值之间相关性不显著(p>0.05).由此可见,培养液溶磷量与pH的关系比较复杂,与难溶性含磷物的种类和培养基中碳氮源密切相关.在培养过程中,除卵磷脂培养液,其他各培养液中pH值均有明显下降,尤其在FePO4培养液中pH值为3.71,表明菌株NCT-2具有较强的产酸能力.经过GC-MS检测,证实菌株NCT-2在代谢过程中产生了酸类物质,主要有乳酸、乙酸、琥珀酸、丙酸、丁酸、葡萄糖酸等(图 6).目前,葡萄糖酸(草酸)是大多数溶磷菌产生的最主要的有机酸,此外还包含琥珀酸、柠檬酸、乙酸、乳酸、丙酸等多种有机酸(Patel et al., 2008).关于有机酸和溶磷量之间的关系一直没有定论,有学者认为溶磷量与所分泌的有机酸量之间不存在显著相关性(林启美等,2001),有研究显示某种酸含量的可能是决定溶磷量的重要因素(刘文干等,2012),也有学者认为有机酸种类较数量对溶磷的影响更大(Agnihotri,1970).有关菌株NCT-2溶磷过程中有机酸的种类、数量与溶磷量之间的关系还有待于进一步深入研究.
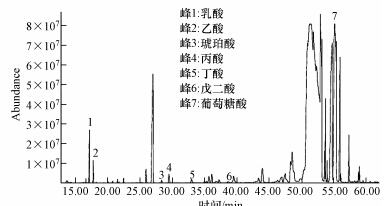 |
| 图 6 GC-MS总离子流图谱 Fig.6 Total ion current chromatogram |
1)耐硝酸盐的巨大芽孢杆菌NCT-2对磷酸钙的溶解效果随菌株的生长而发生变化,在第2 d菌株生物量最大,溶磷效果最好;不同碳氮源会影响菌株的溶磷效果,菌株优先利用葡萄糖,其次为麦芽糖和蔗糖,而对淀粉的利用能力较差;菌株对氮源的利用次序为(NH4)2SO4>NH4Cl>尿素>NaNO2>KNO3;磷底物的浓度会影响菌株溶磷效果,磷源浓度过低或过高都会导致溶磷量过低.当培养基中磷酸钙浓度为3、5 g · L-1时,菌株的溶磷量均在90 mg · L-1以上,而对7 g · L-1磷酸钙的溶磷量仅为1.30 mg · L-1.
2)菌株NCT-2能溶解包括无机磷和有机磷在内的多种难溶性含磷物,对植酸钙溶磷量最高,溶磷量为98.1 mg · L-1,对FePO4、AlPO4的溶解能力稍弱,溶磷量在30~40 mg · L-1之间,对卵磷脂溶磷量较小,最高溶磷量仅为6.15 mg · L-1,这可能与无机磷和有机磷的不同溶磷机制有关.
3)溶磷体系的pH变化受磷源种类影响,无机磷源pH下降较多,pH下降程度与阳离子种类有关,含有Al3+、Fe3+的体系,由于阳离子的水解及酸性磷酸酶的参与,导致体系酸性增强;有机磷源溶磷体系pH变化不大,这是由无机磷和有机磷的不同溶磷机制决定的.
4)无机磷和有机磷的溶磷机制有所不同.卵磷脂溶磷体系中碱性磷酸酶含量明显高于无机磷源体系,说明碱性磷酸酶是有机磷溶解的主要机制;GC-MS分析表明,菌株NCT-2在代谢过程中产生了乳酸、乙酸、琥珀酸、丙酸、丁酸、葡萄糖酸等物质,这些酸类物质促进了难溶性含磷物的溶解,是无机磷的主要溶解机制.
| [1] | Agni hotri V.1970.Solubilization of insoluble phosphates by some soil fungi isolated from nursery seedbeds [J].Canadian Journal of Microbiology, 16(9): 877-880 |
| [2] | Behbahani M.2010.Investigation of biological behavior and colonization ability of Iranian indigenous phosphate solubilizing bacteria [J].Scientia Horticulturae, 124(3): 393-399 |
| [3] | Chen Y P,Rekha P D,Arun A B,et al.2006.Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities [J].Applied Soil Ecology,34(1): 33-41 |
| [4] | Egamberdiyeva D,Höflich G.2004.Effect of plant growth-promoting bacteria on growth and nutrient uptake of cotton and pea in a semi-arid region of Uzbekistan [J].Journal of Arid Environments,56(2): 293-301 |
| [5] | 郝晶,洪坚平,刘冰,等.2006.石灰性土壤中高效解磷细菌菌株的分离、筛选及组合[J].应用与环境生物学报,12(3): 404-408 |
| [6] | 黄红艳.2012.次生盐渍化土壤的微生物多样性及微生物改良效应研究[D].上海:上海交通大学.62-69 |
| [7] | Illmer P,Schinner F.1995.Solubilization of inorganic calcium phosphates-Solubilization mechanisms [J].Soil Biology and Biochemistry,27(3): 257-263 |
| [8] | 姜经梅,赵慧,沈铭能,等.2011.长江口潮滩表层沉积物中碱性磷酸酶活性及其影响因素[J].环境科学学报,31(10): 2233-2239 |
| [9] | 康贻军,胡健,单君,等.2006.两株解磷真菌的解磷能力及其解磷机理的初步研究[J].微生物学通报,33(5): 22-27 |
| [10] | 林启美,王华,赵蓉,等.2001.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,28(2): 26-30 |
| [11] | 刘存歧,陆健健,李贺鹏.2007.长江口潮滩湿地土壤酶活性的陆向变化以及与环境因子的相关性[J].生态学报,27(9): 3663-3669 |
| [12] | 刘文干,何园球,张坤,等.2012.一株红壤溶磷菌的分离、鉴定及溶磷特性[J].微生物学报,52(3): 326-333 |
| [13] | Martinez V,Läuchli A.1994.Salt-induced inhibition of phosphate uptake in plants of cotton (Gossypium hirsutum L.) [J].New Phytologist,126(4): 609-614 |
| [14] | Mayak S,Tirosh T,Glick B R.2004.Plant growth-promoting bacteria confer resistance in tomato plants to salt stress[J].Plant Physiology and Biochemistry,42(6): 565-572 |
| [15] | Mudryk Z J.2004.Decomposition of organic and solubilisation of inorganic phosphorus compounds by bacteria isolated from a marine sandy beach [J].Marine Biology,145(6): 1227-1234 |
| [16] | Narsian V,Patel H H.2000.Aspergillus aculeatus as a rock phosphate solubilizer [J].Soil Biology and Biochemistry,32(4): 559-565 |
| [17] | Patel D K,Archana G,Kumar G N.2008.Variation in the nature of organic acid secretion and mineral phosphate solubilization by Citrobacter sp.DHRSS in the presence of different sugars [J].Current Microbiology,56(2): 168-174 |
| [18] | 佩奇,R 米勒,闵九康,等.1991.土壤分析法(第2部分)[M].北京: 中国农业科技出版社 |
| [19] | 乔志伟,洪坚平,谢英荷,等.2013.一株石灰性土壤强溶磷真菌的分离鉴定及溶磷特性[J].应用与环境生物学报,19(5): 873-877 |
| [20] | 史瑞和,鲍士旦,秦怀英.1996.土壤农化分析(第2版)[M].北京: 北京农业出版社 |
| [21] | Shi W W,Lu W,Liu Q L,et al.2014.The identification of the nitrate assimilation related genes in the novel Bacillus megaterium NCT-2 accounts for its ability to use nitrate as its only source of nitrogen [J].Functional & Integrative Genomics,14(1): 219-227 |
| [22] | 时唯伟,支月娥,王景,等.2009.土壤次生盐渍化与微生物数量及土壤理化性质研究[J].水土保持学报,23(6): 166-170 |
| [23] | Shigaki F,Sharpley A,Prochnow L I.2006.Animal-based agriculture,phosphorus management and water quality in Brazil: options for the future[J].Scientia Agricola,63(2): 194-209 |
| [24] | Vassilev N,Vassileva M,Nikolaeva I.2006.Simultaneous P-solubilizing and biocontrol activity of microorganisms: potentials and future trends[J].Applied Microbiology and Biotechnology,71(2): 137-144 |
| [25] | Wang H,Appan A,Gulliver J S.2003.Modeling of phosphorus dynamics in aquatic sediments: I-model development [J].Water Research,37(16): 3928-3938 |
| [26] | 向文良,冯玮,郭建华,等.2009.一株解磷中度嗜盐菌的分离鉴定及解磷特性分析[J].微生物学通报,36(3): 320-327 |
| [27] | 徐爽,刘存歧,董梦荟,等.2013.白洋淀水体和沉积物中碱性磷酸酶活性的时空分布及其影响因素[J].环境科学学报,33(12): 3317-3323 |
| [28] | Yue H T,Mo W P,Li C,et al.2007.The salt stress relief and growth promotion effect of Rs-5 on cotton[J].Plant and Soil,297(1/2): 139-145 |
| [29] | 张春华,时唯伟,支月娥,等.2011.一株高效转化硝态氮细菌的分离鉴定和特性研究[J].上海交通大学学报(农业科学版),29(2): 1-5 |
| [30] | 赵小蓉,林启美,李保国.2002.C、N源及C/N比对微生物溶磷的影响[J].植物营养与肥料学报,8(2): 197-204 |
| [31] | 钟传青,黄为一.2005.不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报,42(2): 286-294 |
 2015, Vol. 35
2015, Vol. 35

