2. 陇东学院 生命科学与技术学院, 庆阳 745000
2. College of Life Science and Technology, Longdong University, Qingyang 745000
目前,原油开采区污染土壤的生态修复已成为当今环保领域研究热点(Dashti et al.,2009;Al-Mailem et al.,2010;Agamuthu et al.,2010;Zhang et al.,2010),其中植物-微生物联合修复方式以其美化环境、无二次污染及最大限度地降低污染物的浓度等优点已成为最为经济有效的污染治理技术(Tang et al.,2009;姚治华等,2006).但石油烃中强致癌物会随植物进入食物链并传播,修复植物的选用因而尤为慎重.因此寻找耐油污植物作为新的修复介质已成为本领域新的研究热点之一(彭胜巍等,2009;欧阳威等,2006;张松林等,2008;焦海华等,2013;程立娟和周启星,2014).选择修复植物必须坚持“适生”的原则,即乡土物种应用于退化生态系统修复,并辅以当地土著石油降解微生物功能菌群削弱土壤的生态毒性是一个良好的思路(山宝琴等,2014).
陇东黄土高原地区属生态脆弱区,气候干旱少雨,寒暑温差显著,土壤瘠薄,植被分布因而有其独特的地域性.金盏菊(Calendula officina),菊科金盏菊属2年生草本植物,原产欧洲南部,世界各地均有栽培,喜光耐寒,不择土壤,怕炎热天气,根系发达且适应性强,能自播,因而成为陇东黄土高原地区野外分布的优势种群(谷文众等,2009).笔者在开展石油烃污染土壤的生态修复实验过程中发现金盏菊在石油烃浓度达11475 mg · kg-1的污泥中旺盛生长.但近年来有关金盏菊在生态修复方面的研究主要集中在土壤干旱及盐胁迫的生理变化(谷文众等,2009;高慧等,2013),Cd-Pb复合污染土壤和Hg污染土壤的生态修复(黄慧等,2011;刘家女等,2006),污水净化潜力评价(陈永华等,2010)及大气污染物(硫化物和氰化物)的消除和检测(刘家女等,2007),然而有关金盏菊用于石油烃污染土壤的生态修复国内未见报道.
为此,本研究以陇东黄土高原腹地的庆阳市西峰区董志乡长庆油田采二炼油厂的石油污泥为研究对象,通过添加土著石油降解菌剂联合金盏菊开展了为期5个月的原位修复实验.监测了原位修复过程中日气温、降雨量、总石油烃含量、含盐率、pH、碱解氮、速效钾、速效磷、有机质、土壤脲酶、脱氢酶、多酚氧化酶、过氧化氢酶活性以及土壤微生物群落遗传多样性的动态变化情况,并运用多元分析法对15项土壤环境因子进行多元分析,系统研究了金盏菊与土著石油降解菌群对联合修复油污土壤过程的响应及环境因子的动态变化过程,旨在筛选出适合陇东黄土高原土壤类别-适生植物-土著降解菌群的组合,利用乡土物种的适生性降低修复成本,为陇东地区油污土壤生态修复提供新的技术方案和背景资料.
2 材料与方法(Materials and methods) 2.1 自然状况研究区位于陇东黄土高原庆阳市董志乡长庆油田第二炼油厂,土壤类型为沙土,质地为轻壤.地理坐标地处东经106°38′~108°40′,北纬35°41′~35°71′,海拔1380~1400 m.该区属黄土高原沟壑地貌,是典型水土流失区之一,侵蚀面积25050.5 km2,占全区总面积的92.4%,侵蚀模数6383~9000 t · hm-2.属暖温带半干旱季风气候区,光、热等气候资源丰富,作物种植制度为一年两熟.由于季风的强烈影响,冬季寒冷干燥,春季多风且干旱少雨,夏季温暖多雨,水热同期,年降水量400~600 mm,雨量分布不均,且主要集中在7—9月份,多年平均蒸发量1000 mm以上,地面蒸发量为350~560 mm,地下水位深,属雨养农业区,在黄绵土类区农业发展的主要限制因素是干旱,土壤瘠薄,水土流失严重(张希彪等,2004).
2.2 供试样地的选择原位修复样地位于甘肃省庆阳市长庆油田第二炼油厂的油泥(东经107°41′2″,北纬35°59′49″),试验深度0~15 cm,土壤湿容重为(1.768±0.27)g · cm-3,自然含水量(8.94±0.18)%,pH 为(8.71±0.25);经实验测得供试石油污染土壤的初始含油量高达1.93%(即(19252.33±164.48)mg · kg-1),远高于国家农业标准临界值500 mg · kg-1.
2.3 供试菌剂的分离和筛选供试菌剂源自甘肃省高校陇东生物资源保护与利用省级重点实验室通过选择性培养基和富集培养基自主筛选的石油降解菌(押辉远等,2011).初步鉴定为假单胞菌属(Pseudomonas)、微球菌属(Micrococcus)、线菌属(Actinomayces)、真菌类的青霉属(Penicillum)、地霉属(Geotrichum)、毛霉属(Mucor)和曲霉属(Aspergillus).
2.4 实验场地设置及原位修复实验分2个实验区和1个空白区,每区成正方形(3 m×3 m),1号实验区为金盏菊植物修复区;2号实验区为金盏菊和微生物菌剂联合修复区,根据张胜等(2008)的方法,通过计算将扩大培养的菌液按3%(3%的计算方法:300 cm×300 cm×15 cm×1.768 g · cm-3=2386800 g=2386.80 kg,2386.80 kg×3%=71.604 kg)约72 L菌液喷撒并翻耕均匀接入2号试验区供试土壤;3号为空白区,未做任何处理,每组设3个平行实验.自然降雨提供水分(图 1数据资料由甘肃省庆阳市气象局提供).实验开始于 2013年4月4日,结束于2013年8月28日,实验周期为5个月,于2013年4月4日投加菌剂,一周后种植金盏菊幼苗,在39、83、119和147 d用四分法取样,除利用鲜土提取土壤微生物细菌基因组总DNA外,其余土样在室温背阴处风干,过2 mm筛备用.
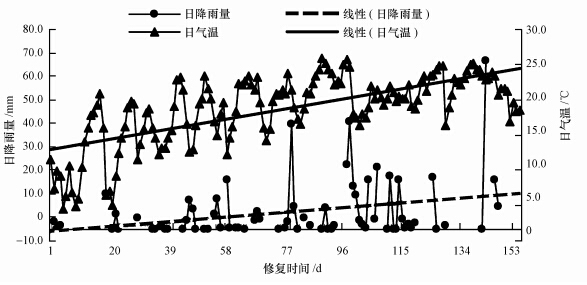 |
| 图 1 原位修复过程中日平均气温与日降水量变化 Fig. 1 Daily mean temperature and precipitation during the process of in-situ remediation |
土壤酶活性测定:过氧化氢酶采用高锰酸钾滴定法;脲酶和多酚氧化酶采用7230G分光光度计比色法(严昶升,1988);脱氢酶采用唐景春的分析方法(唐景春等,2010).
土壤理化性质测定:土壤有机质和碱解氮分别采用重铬酸钾容量法—外加热法和碱解扩散法;土壤速效磷、速效钾分别采用0.5 mol · L-1NaHCO3浸提-钼锑抗比色法和火焰光度计法(鲍士旦,1999);电位法(pHS-3酸度计)测定土样pH值;含盐率采用唐景春的分析方法(唐景春等,2013);采用超声-索氏萃取-重量法测定土壤中总石油烃含量(王如刚等,2010).
2.6 土壤样品总DNA提取、PCR扩增和变性凝胶梯度电泳(DGGE)分析采用土壤细菌基因组试剂盒(E.Z.N.A.TM Soil DNA kit,OMEGA Company),提取土样细菌基因组总DNA,于-20 ℃保存.将提取的土样基因组总DNA作为PCR的模板,PCR扩增过程中所用的引物见表 1.
采用巢式PCR扩增目的片段.第一轮扩增反应条件:94 ℃预变性4 min,94 ℃变性45 s,61 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min.反应体系为20 μL:2 μL 10×PCR Buffer;1 μL MgCl2(25 mmol · L-1);0.8 μL dNTP(2.5 mmol · L-1);0.4 μL PrimerⅠ(BS-for,10 μmol · L-1);0.4 μL PrimerⅡ(BS-rev,10 μmol · L-1); 1 μL Taq酶(5 U · μL-1);1 μL 模板;补足灭菌双蒸水至20 μL.第二轮扩增以第一轮PCR扩增产物16S rDNA为模板,采用Touchdown PCR策略扩增16S rDNA V3区,反应条件为:94 ℃预变性4 min,94 ℃变性45 s,62 ℃退火45 s,72 ℃延伸1 min,之后每一循环降0.5 ℃,20个循环;94 ℃,45 s,56 ℃,45 s,72 ℃,1 min,10个循环;72 ℃终延伸10 min.反应体系与第一轮PCR相同.
| 表 1 用细菌16S rDNA及其V3区扩增的引物 Table 1 Primers for 16S rDNA and its V3 region amplification |
采用DcodeTM 突变检测系统(Bio-Rad)对16S rDNA V3区扩增产物进行DGGE 分析.电泳所用聚丙烯酰胺凝胶浓度为10%,变性梯度为40%~60%.电泳条件为60 ℃恒温下,70 V 电泳15 h,银染后凝胶成像分析结果.
3 结果与讨论(Results and discussion) 3.1 原位修复过程中油污土壤酶活性的变化土壤中各种生物化学过程都离不开土壤中各种酶的参与,同时土壤酶活性易受环境因素的影响,因此土壤酶活性在一定程度上可以反映环境状况,被认为是评价土壤质量和土壤污染程度及土壤中微生物对污染物进行降解的重要指示之一(刘世亮等,2007).表 2为原位修复过程中土壤酶活性变化情况.原位修复过程中不同修复时期土壤脲酶、多酚氧化酶、脱氢酶、过氧化氢酶差异极显著(F脲酶=150.02>F0.01,F多酚氧化酶=52.25>F0.01,F脱氢酶=54.12>F0.01,F过氧化氢酶=51.677>F0.01,p<0.01).多重比较(Duncan,α=0.05)结果进一步显示,土壤脲酶、多酚氧化酶、过氧化氢酶及脱氢酶活性均不同程度呈增加的趋势(p<0.05).
土壤脲酶是唯一一种作用于尿素肥料的水解酶类(和文祥等,2002).它能分解有机物质,促其水解成NH3和CO2.脲酶是一种中性酶,可以加速土壤中潜在养分的有效化,因而土壤中脲酶活性可以作为衡量土壤肥力的指标之一,并能部分反映土壤生产力(李慧等,2005).表 2中脲酶活性逐步增加,说明土壤肥力逐渐提升.与对照相比,两组处理均显著提高了土壤脲酶的活性(p<0.05),且金盏菊与菌剂的联合修复组进一步提高了土壤脲酶活性(p<0.05),到修复后期达(35.81±0.95)μg · g-1 · 24h-1,较修复之前增加了74.14%.究其原因可能是由于石油组分中的多环芳烃(PAHs)可以刺激或诱导土壤脱氢酶和脲酶等生物酶的活性(Stanislaw et al.,2004).本研究中外源菌剂和金盏菊的联合使用有效改善了土壤根际的环境,提高了区域微环境中的土壤微生物数量和有机质含量(王洪等,2011),从而增加了脲酶的活性.其次,植物根系分泌物可为根际生物提供氨基酸、糖类和维生素等养料,改善了根际微生态环境,间接提高了土壤酶活性(肖敏等,2009).但不同植物引起的土壤酶活性的变化不尽相同,金盏菊的种植有效增加了陇东黄土高原地区土壤有机质及速效氮含量(见表 3),油污土壤的氮素转化能力得到了提高,进而刺激了土壤脲酶活性.在土壤物质和能量转化中,氧化还原酶系占有很重要的地位,它参与土壤腐殖质组分及土壤形成过程.目前对于土壤氧化还原酶的研究集中在土壤脱氢酶、过氧化氢酶和多酚氧化酶(李慧等,2005).表 2中可见随着原位修复的进行,与对照相比,两组处理的土壤脱氢酶、过氧化氢酶和多酚氧化酶活性逐步增加(p<0.05),金盏菊与菌剂联用后3种酶活性均达到最高(p<0.05).李慧等(2005)通过对沈抚灌区含油污水灌溉对土壤酶活性的影响中发现,含石油烃污水灌溉能够增加土壤中脱氢酶、过氧化氢酶、多酚氧化酶的活性,且酶活随着污染程度的增加而增加.朱凡等(2014)在利用植物修复PAHs 污染土壤过程发现,土壤过氧化氢酶、多酚氧化酶活性随着时间推移呈先升后降的趋势.上述结果与本研究结果不尽相同,原因可能是由于这3 种酶均参与石油烃及其代谢中间产物在土壤中的降解过程,特别是多酚氧化酶能把土壤中芳香族化合物和酚类氧化成醌,醌与土壤中蛋白质、氨基酸、糖类、矿物等物质反应,生成大小分子量不等的有机质和色素,完成土壤芳香族化合物的循环(Toscano et al.,2003).在石油污染土壤的生物修复过程中,会产生多种酚类物质,而金盏菊的种植在某种程度上在其根际区富集了石油烃,从而刺激石油降解菌产生多酚氧化酶,提高了土壤中多酚氧化酶的活性.因而石油烃可在一定浓度范围内作为底物刺激酶活性的增强(张秀霞等,2014).土壤脱氢酶亦为石油烃降解过程中重要的参与酶,它能使被氧化有机物的氢原子活化并传递其特定的受氢体,使石油污染物彻底氧化.前人研究表明微生物总数与土壤脱氢酶活性成正相关关系(王靖等,2008),土壤脱氢酶的活性可以反映处理体系内活性微生物量及其对有机物的降解效果(朱凡等,2014).本研究中,由于降解菌剂的投加使得微生物总数有所增加,可能引起了土壤脱氢酶活性增加.过氧化氢酶活性可以反映土壤除去呼吸过程中产生的过氧化氢的能力,若过氧化氢一直积累却始终得不到分解,将会对土壤中的微生物产生毒害作用.本研究外源投加了降解菌剂,土壤微生物大量繁殖,这一结果亦可在本文微生物群落遗传多样性分析中体现(见图 3),石油降解菌可能在金盏菊根际大量富集,集中参与了石油烃的降解过程,大量过氧化氢产生使得微生物及土壤生境扩大,解除了呼吸过程所产生的过氧化氢,从而使得过氧化氢酶活性得到提升(吴伟林等,2010).
| 表 2 原位修复过程中油污土壤酶活性 Table 2 Soil enzyme activity of oil-contaminated soil during the process of in-situ remediation |
土壤理化特性,包括含油量、含水量、盐度、酸碱度及营养水平等环境因子变化与分布所构成的非生物学特性,是制约石油生物降解速率和石油污染土壤生物修复效果的关键因素(贾建丽等,2009; Barbara et al.,2001).表 3为原位修复过程中油污土壤理化性质的变化情况.原位修复过程中土壤TPHs含量、含盐率、pH、碱解氮、速效钾、速效磷、有机质均差异极显著(FTPHs=309.93>F0.01,F含盐率=105.76>F0.01,FpH=24.79>F0.01,F碱解氮=13.37>F0.01,F速效钾=47.58>F0.01,F速效磷=32.71>F0.01,F有机质=54.02>F0.01,p<0.01);多重比较(Duncan,α = 0.05)结果显示,随着修复的进行,TPHs、pH、有机质含量、含盐率的变化情况不尽相同,但总体呈下降的趋势(p<0.05);土壤碱解氮、速效磷及速效钾含量总体呈上升趋势(p<0.05).
| 表 3 原位修复过程中油污土壤理化性质 Table 3 Physicochemical properties of oil-contaminated soil during the process of in-situ remediation |
土壤有机质是土壤中各种含碳有机化合物的总称,是污染土壤生物修复的基础.研究表明,石油污泥中的石油烃对土壤的有机质含量有很大的贡献值,石油烃含量与土壤有机质呈显著正相关关系(吴伟林等,2010).表 3可见土壤有机质含量随着土壤TPHs的消减而逐步下降.与对照相比,两组处理的土壤有机质含量明显降低(p<0.05),虽然有机质含量降低,但土壤微生物数量的增加,说明外源菌剂和金盏菊的联合使用有效改善了土壤根际的环境,提高了区域微环境中的土壤微生物数量,从而消耗了部分土壤有机质.然而,金盏菊与菌剂的联合修复组到修复后期较修复之前降低了48.07%,但仍然高达(112.28±5.38)mg · kg-1.可能的原因是与金盏菊的种植有关,地表枯落物也是表层土壤有机质的重要来源(靳治国等,2009).植物根系的分布直接影响土壤有机质的垂直分布,由于金盏菊为2年生草植物,其根际为土壤表层,因而大量死根的腐解归还,为土壤提供了丰富的碳源(王兴明等,2005),因而相比之下金盏菊单独修复组的土壤有机质含量相对较高.由表 3可以看出,与对照组相比,经过147d的原位修复,两组处理的含盐率呈明显降低趋势(p<0.05).金盏菊处理组和金盏菊与菌剂联用处理组的含盐率仅为对照组的47.87%和38.29%.说明外源菌剂和金盏菊的联合使用有效改善了土壤根际的环境,提高了区域微环境中的土壤微生物数量进而大量消耗所致.前人研究表明,石油污泥的pH值均大于7,呈碱性,超过了微生物生长的最佳值7.5~7.8(俞毓馨等,1990),将不利于微生物的生长,甚至会有很强的抑制作用.土壤pH可能会通过影响降解过程中关键酶的酶活性来影响降解率,所以本实验中两组处理方式可能还未能最大限度发挥其降解效能,此类问题有待进一步的分析研究.此外,Leahy和Colwell(1990)研究认为土壤微生物在降解石油烃时会产生羧酸类中间产物,可能会使pH在一段时间内降低.本研究中,经147 d修复后,pH显著降低(p<0.05),这可能是因为在原位修复的过程中厌氧菌对石油烃的降解得到了强化,厌氧降解的过程容易产生酸性物质,特别是土壤中的硫酸盐还原菌(Dell′Anno et al.,2009). 此外,植物根系分泌物可为根际生物提供氨基酸、糖类和维生素等养料,可能改善了根际土壤酸碱度(肖敏等,2009).刘五星等(2007)研究认为土壤氮含量与石油烃含量无明显关系.上述结果与本研究结果不同,随着原位修复的进行,两组处理的土壤碱解氮含量均成明显的增加趋势(p<0.05).究其原因,首先,组成石油的化学元素主要为碳(83%~87%)、氢(11%~14%)、硫(0. 06%~0. 8%)、氧(0. 08%~1. 82%)等,且我国现有油田中以低硫和高氮原油居多,例如大庆原油氮含量为0. 16%,胜利油田为0. 5%,长庆油田为0.04%(王传远等,2010).由于外源投加了石油降解菌及种植金盏菊后分泌的胞外酶有效加速的氮源的有效化,因而促使碱解氮含量上升.第二,土壤微生物及金盏菊本身也需要消耗土壤中的氮、磷和钾等营养元素,会造成修复初期营养元素水平相对较低,使得土壤碱解氮、速效钾及速效磷含量低下,然而金盏菊为2年生草植物,其根际为土壤表层,提高了区域微环境中的土壤微生物数量,也为微生物固持提供选择优势,进而导致在石油污染地区土壤中有效营养元素的浓度增加(王国保等,2013).第三,研究区域周边均已用作农田,因而外源施加的复合肥等营养物质在一定程度上增加了土壤营养物质的含量,同时也说明在修复过程中微生物的呼吸速率和活性得到了很大程度的提升.
3.3 原位修复过程中土壤微生物群落遗传多样性的PCR-DGGE分析本研究采用PCR-DGGE技术对原位修复过程中第0 d、39 d、83 d、119 d和147 d所得土壤样品进行微生物群落遗传多样性分析,图 2为DGGE指纹图谱及其示意图.图谱上条带信息反映了土壤微生物群落多样性及其构成,其中电泳条带的多少反映出土壤中细菌群落多样性;条带的粗细则反映了种群密度的差异.由图 2 可见随着原位修复的进行,两组处理与CK相比,DGGE 图谱在条带数目与亮度上均存在差异.图中所示条带1~7为所有样品中均具有的共同条带,说明陇东地区油污土壤中固有的微生物类型,而这些类型可能就是一些土著石油烃降解菌.随着原位修复的进行,土壤样品出现了一些起初没有的条带,如条带a~w,可能为金盏菊根际富集效应所致.其中,修复后期出现了条带A、B和C,为之前所有时期均未出现的微生物类型.如图 2所示,随着微生物修复时间的增长,DGGE条带数相应增加,条带亮度有不同程度的提高,说明修复使土壤微生物的群落结构和组成发生了变化,土壤中微生物多样性变得更加丰富.
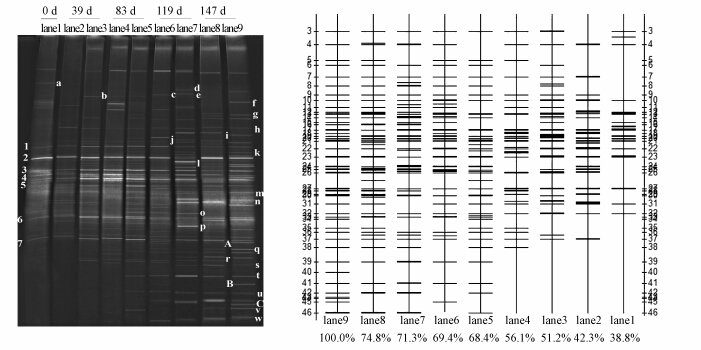 |
| 图 2 原位修复过程中两组处理不同修复期油污土壤样品的PCR-DGGE分离谱图及其示意图(Lane1:为0d时初始石油污染土壤;Lane2~3:39d金盏菊修复和金盏菊菌剂联合修复;lane4~5:83d金盏菊修复和金盏菊菌剂联合修复;lane6~7:119d金盏菊修复和金盏菊菌剂联合修复;lane8~9:147d金盏菊修复和金盏菊菌剂联合修复) Fig. 2 DGGE b and patterns and models of oil-contaminated sludge samples based on two experimental approaches at different in situ remediation times |
本研究采用2种常用的多样性指标进行土壤微生物群落多样性分析,即: Shannon-Wiener多样性指数(H):H = - Σ Pi lnPi,Pi 代表土壤样品中第 i 个条带的吸光度占所有条带吸光度总和的比例;Pielou 均匀度指数(J):J = H / Hmax,Hmax 代表最大多样性值(Hmax = ln S).图 3可以看出,与对照相比,随着原位修复的进行,土壤微生物群落Shannon-Wiener多样性指数(H)和Pielou 均匀度指数(J)整体呈逐步增加的趋势.Li等(2005)研究发现,水稻土中石油污染浓度与细菌度和多样性正相关.聂明(2010)研究表明,芦苇的根际效应可以显著提高土壤细菌丰富度,且受石油污染的正面影响.这与本研究结果相似,由于不同植物的凋落物和根系分泌物中的含氮化合物存在显著差异,从而对土壤细菌的生长产生选择性刺激作用,最终影响后者的群落结构(张杰等,2013).单一植被物种对于土壤微生物的影响主要与植物根系的分泌模式及其养分摄取效率有关(毕江涛和贺达汉,2009).土壤微生物群落多样性指数和丰富度指数可以揭示土壤微生物种类和功能的差异(李鑫等,2012).由于金盏菊为陇东黄土高原地区“适生”植物,有较强的抗逆性,其根系分泌物必然有助于当地土著微生物的生长繁殖,由此说明金盏菊用于陇东地区石油污染土壤的生物修复为可行之举.此外,当金盏菊修复至119 d时Pielou 均匀度指数最高(0.9786),之后有所降低的原因可能是2013年8月连续的高温少雨致使我们所取土壤为0~20 cm的表层土含水量很低因而影响了实验结果.
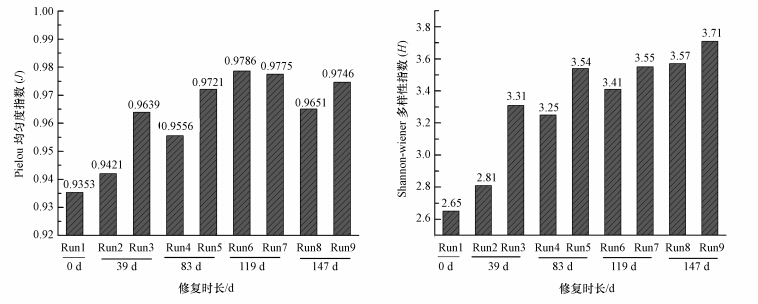 |
| 图 3 原位修复过程中两组处理不同时期油污土壤样品微生物群落遗传多样性指数变化(Run1:为初始石油污染土壤;Run2、4、6、8为金盏菊修复组;Run3、5、7、9为金盏菊和菌剂联合修复组) Fig. 3 Variation of the genetic diversity of the microbial community indexes based on two experimental approaches at different in situ remediation times |
利用主成分分析法对石油污染土样原始变量的信息进行重组,包括石油污染土样的TPHs、含盐率、有机质、速效钾、碱解氮、速效磷、pH、过氧化氢酶、脲酶、多酚氧化酶、脱氢酶、Shannon-Wiener多样性指数、Pielou 均匀度指数和日降雨量与日平均气温15个土壤环境因子,以金盏菊修复和金盏菊菌剂联合修复为实体分别进行了主成分分析,得出各因子的特征根、贡献率及累计贡献率.两组处理前两个公因子累积贡献率分别达96.62%和95.68%,具有广泛的代表性,可用于评价石油污染土壤原位修复过程中土壤环境因子变化情况.
分析表明,两组处理在PC轴上出现明显的分布差异(图 4).就金盏菊修复组而言,依据相对位置,将15种土壤环境因子划分为4个类群(点集): 类群A代表了金盏菊植物过程中土壤理化因子分布情况;类群B为降雨量对金盏菊植物过程的影响;类群C代表了土壤生物因子的影响;而类群D反映了土壤污染状况.从金盏菊和菌剂联合修复组来看,可划分为2个类群(点集): 类群A代表了金盏菊植物过程中土壤理化因子分布情况;类群B则反映了土壤污染状况.从PC1轴上来看,类群D与类群A、B、C明显呈负相关关系;从PC2轴来看,类群A介于类群B、C之间,亦与类群D成呈负相关关系.上述结果很好的诠释了石油污染土壤中环境因子间的相互关系,无论是金盏菊修复还是金盏菊和菌剂联合修复,土壤石油烃含量、含盐率、pH及有机质含量可能是陇东黄土高原地区开展石油污染土壤生物降解的主要制约因子.
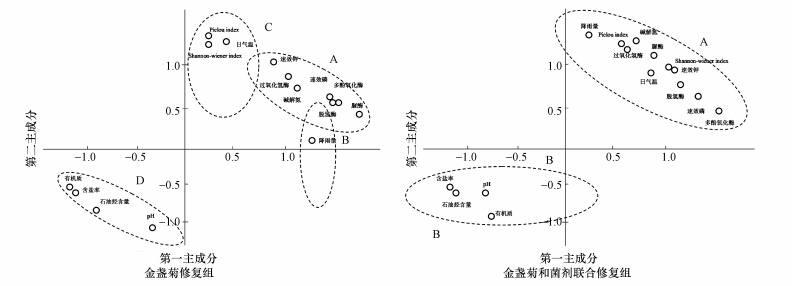 |
| 图 4 两组处理原位修复过程中油污土壤环境因子PCA排序图 Fig. 4 Principal component analysis ordination diagram of oil-contaminated soil environmental factors based on two experimental approaches at different in situ remediation times |
初始载荷因子反映了土壤环境因子的相关性,载荷因子越高表明该环境因子对主成分影响越大(时鹏等,2010).由表 4可知,就金盏菊修复组而言,与PC1相关性较高的环境因子共有11种,其中在金盏菊修复过程中呈正相关关系的依次为:土壤脲酶、脱氢酶、碱解氮、多酚氧化酶、降雨量、速效磷和过氧化氢酶;呈负相关关系的依次为:土壤有机质、含盐率和石油烃含量.与PC2相关性较高的环境因子共有5种,呈正相关关系的依次为:土壤微生物群落Shannon-wiener指数、Pielou 指数、日气温、脱氢酶;呈负相关关系则为土壤pH.从金盏菊和菌剂联合修复组来看(表 4),与PC1相关性较高的环境因子有9种,呈正相关关系的依次为:土壤多酚氧化酶、速效磷、脱氢酶、速效钾和Shannon-wiener指数;呈负相关关系的依次为:土壤含盐率、石油烃含量和pH.与PC2相关性较高的环境因子只有4种,且均呈正相关关系,依次为:降雨量、Pielou 指数、过氧化氢酶和碱解氮.上述结果说明,陇东黄土高原地区金盏菊修复和金盏菊和菌剂联合修复过程中,有机质含量过高是影响其修复效果最大的制约因素,而本研究供试石油污染土壤的初始含油量高达1.93%(即(19252.33 ±164.48)mg · kg-1),高出国家标准38.5倍.如此之高的石油烃含量导致了土壤有机质含量和含盐率的居高不下.前已述及,两组处理均有效改善了土壤根际的环境,提高了区域微环境中的土壤微生物数量进而消耗了部分土壤有机质,较修复之前降低了48.07%,但仍高达(112.28±5.38)mg · kg-1.说明在陇东地区开展石油污染的生态修复,如何降低土壤石油烃、pH、有机质含量和含盐率为决定修复效果的关键土壤因子;其次,如何有效增加土壤脲酶、脱氢酶、碱解氮和多酚氧化酶的活性亦为本地区决定修复效果的关键土壤因子,即筛选当地“适生”植物时需要把握的关键因素;第三,速效磷、碱解氮和速效钾的增加,笔者认为可通过外源施加有机肥和投加固氮能力强的微生物菌剂予以解决.最后,陇东黄土高原地区由于季风的强烈影响,冬春季节寒冷干燥,多风少雨,夏季温暖多雨、水热同期,加之土壤瘠薄,水土流失严重,因而在陇东地区开展植物与微生物联合修复时应在每年的4—9月份进行.
| 表 4 两组处理在原位修复过程中土壤环境因子主成分载荷因子 Table 4 Loading factors of principal component of two experimental approaches at different in situ remediation times |
1)两组处理在原位修复过程中不同修复时期土壤脲酶、多酚氧化酶、过氧化氢酶及脱氢酶活性均不同程度呈增加的趋势(p<0.05).土壤TPHs、pH、有机质含量、含盐率的变化情况不尽相同,但总体程下降的趋势(p<0.05);土壤碱解氮、速效磷及速效钾含量总体呈上升趋势(p<0.05).本研究中外源菌剂和金盏菊的联合使用有效改善了土壤根际的环境,提高了区域微环境中的土壤微生物数量,加之金盏菊根系分泌物可为根际生物提供氨基酸、糖类和维生素等养料,改善了根际微生态环境,有效加速营养元素的有效化,从而提高了土壤酶活性及加速了N、P、K等营养元素的有效化.
2)基于PCR-DGGE技术分析结果显示,两组处理在原位修复过程中,土壤微生物群落Shannon-Wiener多样性指数和Pielou均匀度指数均呈现逐渐增加的趋势,说明土壤微生物群落结构逐渐丰富、分布愈加均匀,多样性显著提升.作为当地“适生”植物的金盏菊以其较强的抗逆性及根系分泌物有助于当地土著微生物的生长繁殖,由此说明金盏菊用于陇东地区石油污染土壤的生物修复为可行之举.
3)修复过程中土壤环境因子PCA分析说明,陇东黄土高原地区金盏菊和金盏菊和菌剂联合修复过程中有机质含量过高是影响其修复效果最大的制约因素.说明在陇东地区开展石油污染的生态修复,如何降低土壤石油烃、pH、有机质和含盐率含量,及有效增加土壤脲酶、脱氢酶、碱解氮和多酚氧化酶的活性为决定陇东地区石油污染修复效果的关键因素.此外,由于陇东地区季风的强烈影响,冬春季节季寒冷干燥,多风少雨,夏季温暖多雨、水热同期,因而在陇东地区开展植物与微生物联合修复时应在每年的4—9月份进行.
| [1] | Agam uthu P, Abioye O P, Aziz A A. 2010. Phytoremediation of soil contaminated with used lubricating oil using Jatropha curcas[J]. Journal of Hazardous Materials, 179(1/3): 891-894 |
| [2] | Al-Mailem D M, Sorkhoh N A, Marafie M, et al. 2010. Oil phytoremediation potential of hypersaline coasts of the Arabian Gulf using rhizosphere technology[J]. Bioresource Technology, 101(15): 5786-5792 |
| [3] | 鲍士旦. 1999. 土壤农化分析 (第3版)[M]. 北京: 中国农业出版社. 245-353 |
| [4] | Barbara M, Annweiler E, Warthmann R J, et al. 2001. The use of a solid adsorber resin for enrichment of bacteria with toxic substrates and to identify metabolites: degradation of naphthalene, o-, and m-xylene by sulfate-reducing bacteria[J]. Journal of Microbiological Methods, 44(2): 183-191 |
| [5] | 毕江涛, 贺达汉. 2009. 植物对土壤微生物多样性的影响研究进展[J]. 中国农学通报, 25(9): 244-250 |
| [6] | 陈永华, 吴晓芙, 陈明利, 等. 2010. 人工湿地污水处理系统冬季植物的筛选与评价[J]. 环境科学, 31(8): 1789-1794 |
| [7] | 程立娟, 周启星. 2014. 野生观赏植物长药八宝对石油烃污染土壤的修复研究[J]. 环境科学学报, 34(4): 980-986 |
| [8] | Dashti N, Khanafer M, El-Nemr I, et al. 2009. The potential of oil-utilizing bacterial consortia associated with legume root nodules for cleaning oily soils[J]. Chemosphere, 74(10): 1354-1359 |
| [9] | Dell'Anno A, Beolchini F, Gabellini M, et al. 2009. Bioremediation of petroleum hydrocarbons in anoxic marine sediments: Consequences on the speciation of heavy metals [J]. Marine Pollution Bulletin, 58(12): 1808-1814 |
| [10] | 高慧, 陈梦玲, 朱小燕. 2013. 不同浓度氯化钠胁迫对金盏菊生长发育的影响[J]. 北方园艺, (24): 67-69 |
| [11] | 谷文众, 刘杨, 谷振军. 2009. 干旱胁迫对金盏菊膜脂过氧化及保护酶活性的影响[J]. 经济林研究, 27(3): 79-81; 97 |
| [12] | 和文祥, 蒋新, 卞永荣, 等. 2002. 杀虫双对土壤酶活性影响的研究[J]. 西北农林科技大学学报(自然科学版), 30(1): 134-17 |
| [13] | 黄慧, 申源源, 陈宏. 2011. Na2S2O3对植物修复Hg污染土壤的影响[J]. 水土保持学报, 25(1): 101-104; 109 |
| [14] | 贾建丽, 刘莹, 李广贺, 等. 2009. 油田区土壤石油污染特性及理化性质关系[J]. 化工学报, 60(3): 726-732 |
| [15] | 焦海华, 刘颖, 金德才, 等. 2013. 牵牛花对石油污染盐碱土壤微生物群落与石油烃降解的影响[J]. 环境科学学报, 33(12): 3350-3358 |
| [16] | 靳治国, 施婉君, 高扬, 等. 2009. 不同土地利用方式下土壤重金属分布规律及其生物活性变化[J]. 水土保持学报, 23(3): 74-77; 96 |
| [17] | Leahy J G, Colwell R R. 1990. Microbial degradation of hydrocarbons in the environment[J]. Microbiological Reviews, 54(3): 305-315 |
| [18] | 李慧, 陈冠雄, 杨涛, 等. 2005. 沈抚灌区含油污水灌溉对稻田土壤微生物种群及土壤酶活性的影响[J]. 应用生态学报, 16(7): 1355-1359 |
| [19] | Li H, Zhang Y, Zhang C G, et al. 2005. Effect of petroleum-containing wastewater irrigation on bacterial diversities and enzymatic activities in a paddy soil irrigation area[J]. Journal of Environment Quality, 34(3): 1073-1080 |
| [20] | 李鑫, 张会慧, 岳冰冰, 等. 2012. 高羊茅草对盐碱地原油污染土壤微生物的影响[J]. 应用生态学报, 23(12): 3414-3420 |
| [21] | 刘家女, 周启星, 孙挺. 2006. Cd-Pb复合污染条件下3种花卉植物的生长反应及超积累特性研究[J]. 环境科学学报, 26(12): 2039-2044 |
| [22] | 刘家女, 周启星, 孙挺, 等. 2007. 花卉植物应用于污染土壤修复的可行性研究[J]. 应用生态学报, 18(7): 1617-1623 |
| [23] | 刘世亮, 骆永明, 丁克强, 等. 2007. 黑麦草对苯并 芘污染土壤的根际修复及其酶学机理研究[J]. 农业环境科学学报, 26(2): 526-532 |
| [24] | 刘五星, 骆永明, 滕应, 等. 2007. 我国部分油田土壤及油泥的石油污染初步研究[J]. 土壤, 39(2): 247-251 |
| [25] | 聂明. 2010. 芦苇及其根围微生物对石油污染响应的生态系统生态学研究. 上海: 复旦大学. 39-41 |
| [26] | 欧阳威, 刘红, 于勇勇, 等. 2006. 高羊茅对微生物强化修复石油污染土壤影响的研究[J]. 环境污染治理技术与设备, 7(1): 94-97 |
| [27] | 彭胜巍, 周启星, 张浩, 等. 2009. 8 种花卉植物种子萌发对石油烃污染土壤的响应[J]. 环境科学学报, 29(4): 786-790 |
| [28] | 山宝琴, 张永涛, 曹巧玲, 等. 2014. 6 种陕北适生豆科植物生长对原油污染土壤的响应[J]. 环境科学, 35(3): 1125-1130 |
| [29] | 时鹏, 高强, 王淑平, 等. 2010. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 30(22): 6173-6182 |
| [30] | 唐景春, 王斐, 褚洪蕊, 等. 2010. 玉米草(Zea Mexicana)与海藻寡糖联合修复石油烃污染土壤的研究[J]. 农业环境科学学报, 29(11): 2107-2113 |
| [31] | 唐景春, 刘文杰, 徐婷婷, 等. 2013. 不同处理条件对石油污染土壤植物修复的影响[J]. 环境工程学报, 7(8): 3231-3236 |
| [32] | Tang T C, Wang R G, Niu X W, et al. 2009. Enhancement of soil petroleum remediation by using a combination of ryegrass (Lolium perenne) and different microorganisms[J]. Soil and Tillage Research, 110(1): 87-93 |
| [33] | Toscano G, Colarieti M L. Greco G. 2003. Oxidative polymerisation of phenols by a phenol oxidase from green olives [J]. Enzyme and Microbial Technology, 33(1): 47-54 |
| [34] | 王传远, 杨翠云, 孙志高, 等. 2010. 黄河三角洲生态区土壤石油污染及其与理化性质的关系[J]. 水土保持学报, 24(2): 214-217 |
| [35] | 王国保, 刘增文, 张晓曦. 2013. 陕北石油区牧草秸秆对油污土壤生物化学性质的修复效应[J]. 草地学报, 21(6): 1101-1108 |
| [36] | 王洪, 李海波, 孙铁珩, 等. 2011. 生物修复PAHs污染土壤对酶活性的影响[J]. 生态环境学报, 20(4): 691-695 |
| [37] | 王靖, 张忠智, 苏幼明, 等. 2008. 石油污染土壤植物修复根际效应研究[J]. 石油化工高等学校学报, 21(2): 36-40 |
| [38] | 王如刚, 王敏, 牛晓伟, 等. 2010. 超声—索氏萃取—重量法测定土壤中总石油烃含量[J]. 分析化学, 38(3): 417-420 |
| [39] | 王兴明, 刘登义, 涂俊芳, 等. 2005. 芜湖钢铁厂周边土壤及油菜籽中镉、铜、锌、铅含量和形态分布研究[J]. 应用生态学报, 16(10): 1924-1931 |
| [40] | 吴伟林, 张秀霞, 单宝来, 等. 2010. 不同处置方式对石油污染土壤理化性质和生物学特性的影响[J]. 石油学报(石油加工), 26(5): 831-834 |
| [41] | 肖敏, 凌婉婷, 高彦征, 等. 2009. 丛枝菌根对菲芘污染土壤中几种酶活性的影响[J]. 农业环境科学学报, 28(5): 919-924 |
| [42] | 押辉远, 易力, 周胜利, 等. 2011. 南阳油污土壤微环境分析及石油降解菌筛选[J]. 湖北农业科学, 50(6): 1132-1136 |
| [43] | 严昶升. 1988. 土壤肥力研究方法[M]. 北京: 农业出版社. 263-280 |
| [44] | 姚治华, 王红旗, 刘敬奇, 等. 2006. 石油污染土壤中苯降解菌的筛选及降解特性研究[J]. 农业环境科学学报, 25(6): 1498-1503 |
| [45] | 俞毓馨, 吴国庆, 孟宪庭. 1990. 环境工程微生物检验手册[M]. 北京: 中国环境科学出版社. 138-142 |
| [46] | 张杰, 余潮, 王自海, 等. 2013. 不同植被群落表层土壤中细菌群落多样性[J]. 环境科学研究, 26(8): 866-872 |
| [47] | 张胜, 陈立, 崔晓梅, 等. 2008. 西北黄土区石油污染土壤原位微生物生态修复试验研究[J]. 微生物学通报, 35(5): 765-771 |
| [48] | 张松林, 董庆士, 周喜滨, 等. 2008. 人为石油污染土壤紫花苜蓿田间修复试验[J]. 兰州大学学报(自然科学版), 44(1): 47-50 |
| [49] | 张希彪, 郭小强, 周天林, 等. 2004. 子午岭种子植物区系分析[J]. 西北植物学报, 24(2): 267-274 |
| [50] | 张秀霞, 武海杰, 白雪晶, 等. 2014. 土壤修复过程中微生物数量、酶活性与石油降解率的关系[J]. 石油学报(石油加工), 30(1): 94-99 |
| [51] | Zhang Z N, Zhou Q X, Peng S W, et al. 2010. Remediation of petroleum contaminated soils by joint action of Pharbitis nil L. and its microbial community[J]. Science of the Total Environment, 408(22): 5600-5605 |
| [52] | 朱凡, 洪湘琦, 闫文德, 等. 2014. PAHs 污染土壤植物修复对酶活性的影响[J]. 生态学报, 34(3): 581-588 |
 2015, Vol. 35
2015, Vol. 35


