2. 河北省药用分子化学重点实验室, 石家庄 050018
2. Hebei Province Key Laboratory of Medicinal Chemistry, Shijiazhuang 050018
我国是抗生素生产大国,自20世纪50年代开始生产抗生素以来,抗生素产量总体规模已达世界第一,2009年全年产量高达14.7万t(周保华等,2011).头孢类抗生素抗菌效果好,因而研发活跃,应用最广泛(白琦锋等,2012).抗生素最初被用来治疗细菌感染的疾病,后来又作为饲料添加剂和促生长剂在养殖业、畜牧业中广泛使用(俞慎等,2011).由于抗生素不易被动物的肠道吸收,大部分会以抗生素原药或其代谢产物形式排出体外(Sarmah et al.,2006).人们滥用抗生素导致细菌耐药性增加、医疗资源浪费及环境污染.近几年的研究表明,土壤、地表水、地下水、污水处理厂废水、底泥中均检测出不同浓度的抗生素(Luo et al.,2011;Li et al.,2012;Kumar et al.,2012;Maki et al.,2006;Silva et al.,2011).而污水处理厂现有处理工艺对其不能有效地去除(王朋华等,2008;2010),有可能造成“假性持久性”污染,进而对生态环境及人类健康造成严重威胁(Ingerslev et al.,2001;Phillips,2003).目前,对环境中四环素类、喹诺酮类、大环内脂类和磺胺类抗生素的研究居多,对头孢类抗生素的研究主要集中在检测方法和废水处理工艺领域,对其生态毒性的研究甚少,对该类抗生素的基因损伤研究更寥寥无几.
超氧化物歧化酶(SOD)对机体的氧化与抗氧化平衡有至关重要的作用,它能清除自由基,SOD活性的高低间接反应机体清除自由基的能力.机体MDA的含量间接反应机体细胞受攻击的严重程度,磷酸化组蛋白H2AX(γ-H2AX)是检验DNA双键断裂的特异性生物标志物.
因此,本研究以头孢噻肟钠为研究对象,测定其在细胞水平、基因水平对斑马鱼肌肉组织SOD活性、MDA含量、γ-H2AX产生的影响,确定头孢噻肟钠对水生生物的生态学效应,为其生态风险评价提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 仪器与试剂岛津UV-2550紫外可见分光光度计;恒温水浴锅(上海精宏实验设备有限公司,型号DK-S26);石英亚沸高纯水蒸馏器(金坛市宏华仪器厂,型号SYZ-A);漩涡混匀器(上海精科实业有限公司,型号XK96-B);台式高速离心机(湖南湘仪实验仪器开发有限公司,型号TG16-WS);实验室pH计(梅特勒-托利多仪器(上海)有限公司,型号FE20);便携式水质硬度仪(上海三信仪表厂,型号YD30);电子天平(梅特勒-托利多仪器(上海)有限公司,型号EL204)等.
头孢噻肟钠为石药集团中诺药业有限公司生产的注射用头孢噻肟钠(规格1.0 g×10瓶/盒),考马斯亮蓝、SOD、MDA生物试剂盒购自南京建成生物工程研究所,斑马鱼磷酸化组蛋白H2AX(γ-H2AX)试剂盒购自上海卡努生物科技有限公司.
2.1.2 受试生物选用斑马鱼(Danio rerio)为受试生物,购自某花鸟鱼虫市场,雌雄各半,体长(34.05±0.43)mm,质量为(0.24±0.03)g,鱼苗经5%食盐水消毒后进入实验室,用48 h曝气的脱氯自来水在实验室驯养7 d用于实验,实验水质符合《渔业水质标准》(GB11607—1989),驯养期间斑马鱼死亡率<5%.
2.2 实验方法根据头孢噻肟钠对斑马鱼急性毒性实验结果(96 h-LC50>200 mg · L-1)进行亚急性毒性浓度组设置,设置的暴露浓度分别为1、5、25、125 mg · L-1,暴露15 d.将在实验室驯养7 d的试验鱼随机放入暴露组和空白对照组,每一浓度设置3个平行,试验液用48 h脱氯自来水进行稀释.在5 L水族箱中分别加入4 L实验溶液,每组投放15条斑马鱼,每2 d测1次SOD活性、MDA含量及γ-H2AX.实验条件:实验温度(23±1)℃,pH为7~9,总硬度为50 mg · L-1(以CaCO3计),溶解氧不低于5 mg · L-1.实验期间不予喂食,每24 h更换一次试验液,用曝气装置连续曝气,每天至少测定1次试验液的水温、pH、硬度、溶解氧含量.
SOD、MDA样本制备:每次测定前从相应的浓度组中取2条试验鱼,解剖,取肌肉组织块(0.2~1.0 g),在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,准确称取待测组织的质量,放入玻璃匀浆器中,用移液器按1 ∶ 9的比例(质量体积比,g/mL)加入9倍体积的生理盐水,冰水浴条件下进行匀浆,上下转动捣杆数十次(约6~8 min),充分研碎,使组织匀浆化;将制好的10%匀浆用普通离心机在3000 r · min-1下离心10 min,取上清液保存于4 ℃冰箱中.γ-H2AX样本制备:用pH=7.4磷酸盐缓冲溶液(PBS)代替生理盐水,其余步骤与SOD、MDA样本制备过程相同,制得10% γ-H2AX样本.
测定方法:SOD、MDA、γ-H2AX按照试剂盒提供的方法进行测定,其中,SOD采用黄嘌呤氧化酶法测定,单位为U · mg-1(以prot计);MDA采用硫代巴比妥酸(TBA)比色法测定,单位为nmol · mg-1(以prot计);γ-H2AX采用双抗体夹心法测定,单位为ng · L-1.
2.3 数据处理数据统计结果用平均值±标准差表示.实验数据采用SPSS17.0统计软件利用单因素方差分析(ANOVA)和最小显著差数法(LSD)对同一天内组间数据进行显著性差异分析,0.01<p<0.05表示差异显著,p<0.01表示差异极显著.
3 结果与讨论(Results and discussion) 3.1 头孢噻肟钠对斑马鱼肌肉组织SOD活性的影响在暴露3、6、9、12、15 d对各浓度组和空白对照组的斑马鱼取样,测定其肌肉组织中SOD活性,测定结果如图 1所示.由图 1可知,暴露3 d时,4个浓度组SOD活性均低于空白对照组,除低浓度组(1 mg · L-1)SOD活性降低不明显,与空白对照组比无显著性差异(p>0.05)外,其余3个浓度组SOD活性均被极显著抑制(p<0.01).这可能是由于暴露初期外源污染物胁迫机体产生的氧自由基使机体自身的酶物质消耗,引起SOD活性降低(吴伟等,2009),也可能是过多的自由基造成了机体抗氧化酶的直接损伤.1、5、25 mg · L-1 3个浓度组SOD活性抑制程度与头孢噻肟钠浓度呈负相关,说明头孢噻肟钠浓度越大,胁迫机体产生的氧自由基越多,消耗的SOD越多,SOD活性越低.高浓度组(125 mg · L-1)并不符合此规律.这是因为机体内抗氧化防御体系中除了SOD可抵御过多的氧自由基外,还有很多其他抗氧化酶,如CAT、GSH等,由于高浓度组(125 mg · L-1)的头孢噻肟钠浓度过高,胁迫机体产生的氧自由基太多,第一道防线SOD无法完成任务时,其他的抗氧化酶已经参与了抗氧化过程.因此,最高浓度组虽然污染物浓度最高,SOD活性却高于25 mg · L-1浓度组.
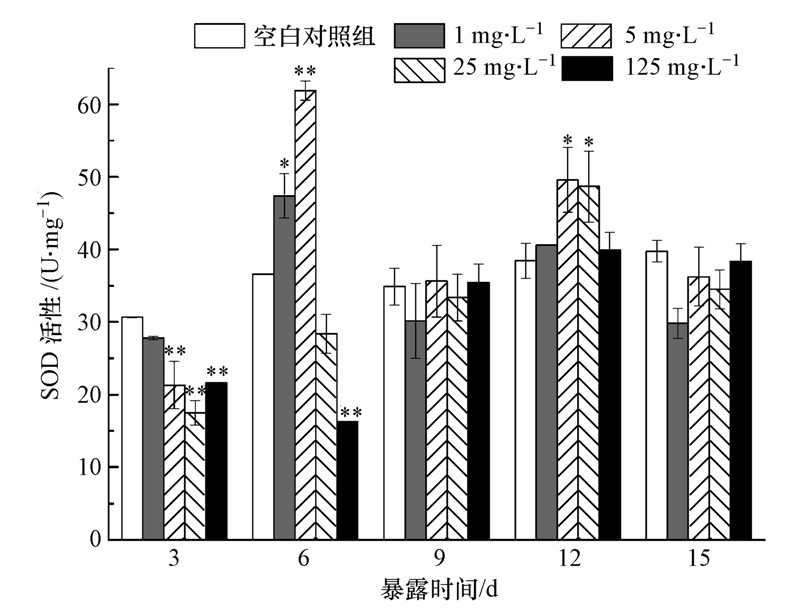 |
| 图 1 头孢噻肟钠对斑马鱼肌肉组织中SOD活性的影响(同一天内各数据均与空白对照组比较,*p<0.05,**p<0.01,下同) Fig. 1 Effects of cefotaxime sodium on SOD activities in muscle tissue of zebrafish(compared with the control group in the same day,*p<0.05, **p<0.01,the same below) |
6 d时,低浓度组(1 mg · L-1)SOD活性明显高于空白对照组(p<0.05),虽然外源污染物浓度很低,但随着暴露时间延长,对机体产生刺激,故机体SOD活性增加以清除氧自由基.1 mg · L-1浓度组第6 d被显著诱导,与此类似,1/16 96 h-LC50青土霉素废水仅在第8 d时对锦鲤鱼肝脏SOD活性产生诱导(吴志刚等,2013);5 mg · L-1浓度组SOD活性由原来的极显著抑制状态转变为极显著诱导状态(p<0.01),诱导率高达116.89%,这可能是由于暴露一段时间后机体累积了过量的氧自由基,故机体需要更多的SOD消除这些过剩的自由基,相关研究中1/16 96 h-LC50、1/4 96 h-LC50青土霉素废水中暴露4 d斑马鱼SOD活性也出现了诱导、抑制状态突然转变(沈洪艳等,2013);25 mg · L-1浓度组SOD活性抑制程度较3 d时有所缓解,此时与空白对照组比较无显著性差异(p>0.05);而高浓度组(125 mg · L-1)显著性抑制(p<0.01)较3 d时进一步加剧,达到整个实验SOD活性最小值16.28 U · mg-1,与此不同,高浓度的氧氟沙星对斜生栅藻SOD活性产生显著性诱导(秦洪伟等,2011).总而言之,6 d时1、5、25 mg · L-1 3个浓度组SOD活性较3 d时有所升高,这是由于前3组浓度不太高,机体正在逐渐适应,利用自身SOD酶消除头孢噻肟钠胁迫产生的过多自由基;而高浓度组由于浓度太高,机体短时间内还无法适应该环境,高浓度的头孢噻肟钠暴露产生的过量自由基对机体的氧化损伤进一步加剧,SOD消耗增加,SOD活性降低.
9 d时,各浓度组与空白对照组间SOD活性均无明显差异(p>0.05),说明机体中抗氧化酶与氧自由基之间酶促反应处于动态平衡.12 d时,低浓度组(1 mg · L-1)和高浓度组(125 mg · L-1)与空白对照组比较相差不大,氧自由基消除反应仍然处于动态平衡,中浓度组(5 mg · L-1和25 mg · L-1)的SOD活性被显著诱导(p<0.05).这可能是因为到了暴露后期,进入中浓度组鱼体内的外源污染物达到了一定水平,氧自由基量超过了正常水平,打破了原有的动态平衡,机体需要更多的SOD消耗底物氧自由基.可见,此时机体的抗氧化能力仍然在可以自由调节的限度内,外源污染物并未对机体造成严重的氧化损伤.15 d时,各暴露组SOD活性稍低于空白对照组,但并无显著性差异(p>0.05),机体又恢复到了动态平衡.但观察9~15 d的SOD活性数据可发现,虽然机体基本处于动态平衡,但第4个浓度组(125 mg · L-1)SOD活性始终更接近空白对照组,波动小,前3个浓度组与空白对照组的的差异均大于第4浓度组,波动范围大,动态平衡是不稳定的.由此可知,中低浓度头孢噻肟钠长期暴露可能对机体存在潜在威胁.
3.2 头孢噻肟钠对斑马鱼肌肉组织MDA含量的影响在暴露3、6、9、12、15 d对各浓度组和空白对照组的斑马鱼取样,测定其肌肉组织中MDA含量,测定结果如图 2所示.由图 2可知,暴露3 d时,低浓度组(1 mg · L-1)MDA含量比空白对照组稍高,但并无显著性差异(p>0.05);高浓度组(125 mg · L-1)的MDA含量极显著增加(p<0.01),说明短时间内高浓度的外源污染物导致机体产生过剩氧自由基,机体的抗氧化系统消除自由基能力有限,过剩的氧自由基与生物膜中的多不饱和脂肪酸发生脂质过氧化作用,形成脂质过氧化物,MDA是产物中的一种,因此,MDA含量增高.6 d时,1 mg · L-1和5 mg · L-1浓度组MDA含量比空白对照组稍低,但并无显著性差异,此时机体SOD活性被诱导,消除机体多余的氧自由基,机体脂质过氧化作用有所缓解,故MDA含量有所下降;而125 mg · L-1浓度组的MDA含量与空白对照组相比极显著增加(p<0.01),比3 d时MDA含量更高,达到整个实验的最大值3.56 nmol · mg-1,说明高浓度的外源污染物对机体的氧化损伤进一步加重.在后期的暴露过程中(9~15 d),只有1 mg · L-1浓度组9 d和15 d的MDA含量出现极显著诱导,且同期该浓度组SOD活性被抑制,其它各浓度组的MDA含量均处于空白对照组水平(p>0.05).可见,机体在抵抗外源污染物的氧化压力时在不断的调节其抗氧化防御系统,使氧自由基的消耗和产生处于动态平衡,机体免受氧化损伤.
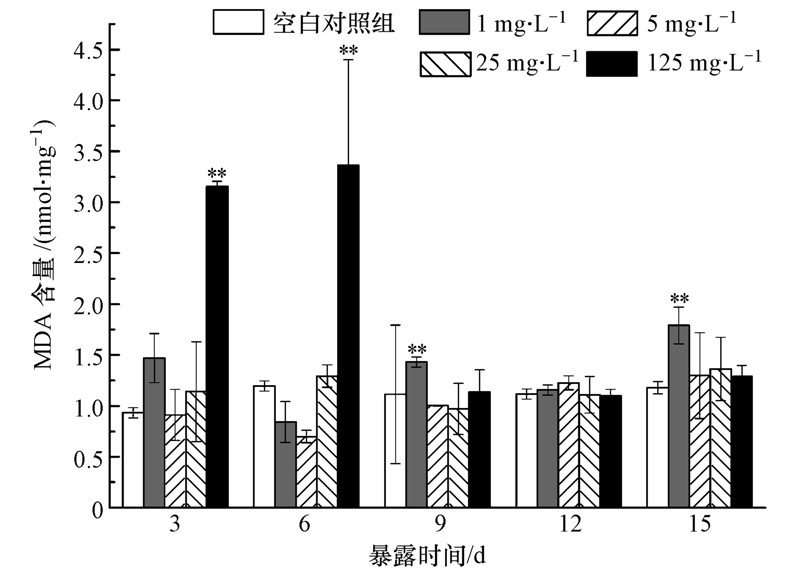 |
| 图 2 头孢噻肟钠对斑马鱼肌肉组织中MDA含量的影响 Fig. 2 Effects of cefotaxime sodium on MDA content in muscle tissue of zebrafish |
丙二醛(MDA)是自由基攻击膜不饱和脂肪酸形成的产物,同时也可以与蛋白质的游离氨基作用,引起蛋白质分子内和分子间交联,导致细胞损伤(Papadimitriou et al.,2002).正常生理状态下,生物体内的 MDA 含量很低,其含量的高低可以反映机体细胞受到自由基攻击的程度.整个实验中,低浓度组(1 mg · L-1)MDA含量一直处于“上升-下降”周期性往复状态,30%和50%的链霉素废水暴露15 d过程中斑马鱼肌肉组织中MDA含量变化也呈现这一规律(沈洪艳等,2014);中浓度组(5 mg · L-1和25 mg · L-1)的MDA含量在整个实验周期内一直与空白对照组无明显差异(p>0.05);高浓度组(125 mg · L-1)MDA含量先上升,6 d时达到最大值,之后恢复至空白对照组水平,外源污染物对机体的氧化损伤随暴露时间的延长而加重,后通过机体抗氧化酶系的调节,恢复至正常水平,这一结果与王琦等(2010)发现的结果一致,磺胺嘧啶短时间内先诱导罗非鱼肝脏中MDA含量显著上升至最大值,暴露末期又恢复到空白对照组水平.本次实验中,只有最高浓度组和最低浓度组的MDA含量变化明显.其中,最低浓度组被间歇性诱导,但诱导作用明显小于最高浓度组;最高浓度组在暴露初期(3、6 d)被极显著诱导(p<0.01),9~15 d MDA含量恢复至空白对照组水平.由此可见,头孢噻肟钠暴露能引起斑马鱼肌肉组织发生不同程度的脂质过氧化,125 mg · L-1的头孢噻肟钠在暴露初期引起斑马鱼机体发生严重的脂质过氧化反应,损伤随着时间的延长最终完全恢复.但1 mg · L-1头孢噻肟钠在暴露初期对斑马鱼造成的脂质过氧化水平不是太严重,但期间诱导-抑制交替,影响持续时间较长,因此,低浓度的头孢噻肟钠长期暴露可能对斑马鱼机体存在潜在影响.中间两个浓度组虽然有升高或降低,但与空白对照组并无显著性差异.在3和6 d时,25和125 mg · L-1浓度组表现出一定的剂量-时间-效应关系:浓度越大,暴露时间越长,MDA含量越高,机体脂质过氧化水平越高.其他研究也发现污染物对机体有明显的浓度-时间-效应关系(钟碧瑾等,2009;方展强等,2004).
3.3 SOD活性与MDA含量对比分析1 mg · L-1浓度组9 d时SOD、MDA均接近空白对照水平,其他时间SOD活性被诱导时MDA含量降低,SOD活性被抑制时MDA含量升高,趋势相反;5 mg · L-1浓度组6 d时SOD活性达到最高,而MDA含量最低;25 mg · L-1浓度组3、6 d时SOD活性被显著性抑制或低于空白对照组,同期MDA含量虽未被显著性激活,但都比空白对照组高;125 mg · L-1浓度组暴露初期SOD活性明显低于空白对照组,MDA含量明显高于空白对照组,差异都极显著,6 d时SOD活性达到整个实验最低值,MDA达到整个实验的最高值.由此可知,实验中各浓度组SOD活性与MDA含量呈负相关.这可能是MDA与蛋白质游离氨基发生了作用,导致了细胞损伤(Papadimitriou et al.,2002),抑制了SOD活性.
3.4 头孢噻肟钠对斑马鱼肌肉组织中γ-H2AX含量的影响为了确定头孢噻肟钠暴露是否对斑马鱼造成了基因损伤,在暴露3、6、9、12、15 d对各浓度组和空白对照组的斑马鱼取样,用酶联免疫法测定其肌肉中γ-H2AX含量,测定结果如图 3所示.DNA双键断裂(DSBs)被认为是DNA损伤中最严重的,DSBs发生后,组蛋白H2AX被磷酸化为γ-H2AX,并在随后的损伤修复过程中发挥重要作用(余艳柯等,2005).由于γ-H2AX的出现与DSBs紧密相关,已经成为检测DSBs的特异性指标.
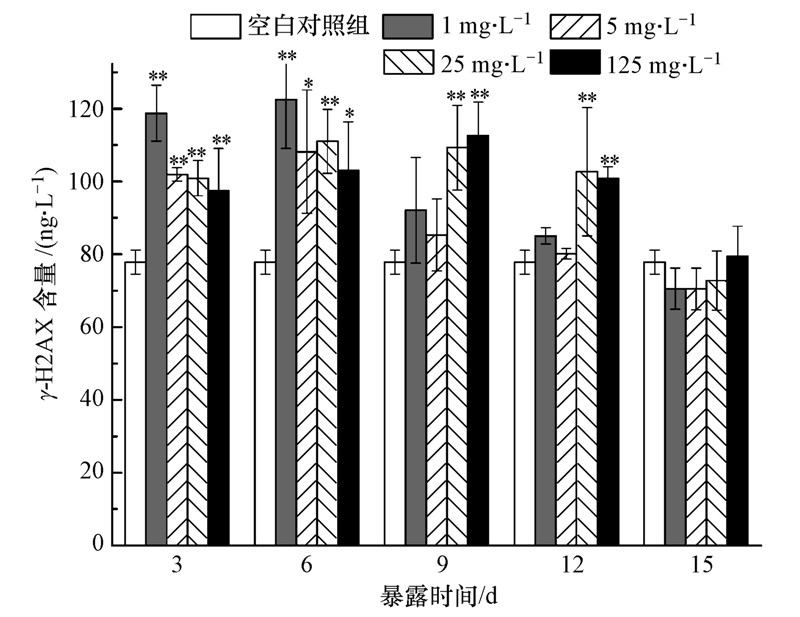 |
| 图 3 头孢噻肟钠对斑马鱼肌肉组织细胞中γ-H2AX含量的影响 Fig. 3 Effects of cefotaxime sodium on γ-H2AX content in muscle tissue of zebrafish |
由图 3可见,头孢噻肟钠暴露造成斑马鱼肌肉中γ-H2AX含量发生显著变化.3 d时头孢噻肟钠暴露已经引起各浓度组斑马鱼肌肉中γ-H2AX含量极显著升高(p<0.01),1 mg · L-1浓度组γ-H2AX含量最高,其余3个浓度组γ-H2AX含量依次降低.可见,暴露初期γ-H2AX含量与头孢噻肟钠的浓度呈负相关,有明显的浓度-效应关系,低浓度头孢噻肟钠的短时间暴露引起的DNA损伤更严重.研究表明,活性氧的量和DNA损伤程度表现出一定的相关性,并认为活性氧是导致DNA损伤的最主要原因(杜仲坤,2012;付立伟等,2014).因此,本实验中γ-H2AX含量升高是因为头孢噻肟钠暴露导致机体活性氧增多造成的,表明斑马鱼肌肉组织DNA已受到损伤.暴露6 d,1、5、25 mg · L-13个浓度组斑马鱼肌肉中γ-H2AX含量达到峰值,分别为122.49、108.17、111.03 ng · L-1,其中,1、5、125 mg · L-1 3个浓度组γ-H2AX含量依然与头孢噻肟钠浓度呈负相关,表现出一定的浓度-效应关系.125 mg · L-1浓度组在9 d时达到峰值112.58 ng · L-1;9~12 d浓度-效应负相关关系转为正相关,前两个浓度组的γ-H2AX含量明显比后两个浓度组的γ-H2AX含量低,说明低浓度的头孢噻肟钠虽然在暴露初期对斑马鱼的DNA损伤更严重,随着暴露时间的延长损伤已经被快速修复;而高浓度的头孢噻肟钠虽然在暴露初期对斑马鱼的DNA损伤比低浓度组低,但随着暴露时间的延长损伤越来越严重,而且修复较慢.4个浓度组γ-H2AX含量在达到峰值后,随暴露时间增加都呈下降趋势,在其他研究中也发现了同样的规律(付立伟等,2014;Wu et al.,2012),前两个浓度组γ-H2AX含量下降高峰期为6~9 d,后两个浓度组γ-H2AX含量下降高峰期为12~15 d,其间为DNA修复的主要时期.这是因为机体的抗氧化防御系统的超氧化物歧化酶(SOD)在暴露初期被显著抑制,导致活性氧积累,机体DNA损伤加剧,因此,γ-H2AX量不断升高;后来机体SOD活性被显著诱导,消除了体内过多的活性氧自由基,阻止活性氧对机体进一步造成基因损伤,同时损伤细胞自身通过γ-H2AX及其他修复因子对已形成的DNA损伤进行修复,使得细胞DNA损伤程度有所减轻,当DNA断裂的双键重新连接并修复完成后,γ-H2AX也会经过去磷酸化过程恢复到原来的H2AX,因此,检测到γ-H2AX量逐渐减少.这个过程可能是经去磷酸化酶催化完成的(Gavrilov et al.,2006),也可能是通过组蛋白交换完成的(Benson et al.,2006).暴露15 d后,各浓度组斑马鱼肌肉中γ-H2AX含量恢复至空白对照组水平(p>0.05),说明机体细胞已经把头孢噻肟钠暴露引起的基因损伤完全修复.据报道,六溴环十二烷(HBCD)的3种非对映体(α、β、γ)能导致玉米细胞发生DNA损伤,γ-H2AX相对含量(实验组γ-H2AX/空白对照组γ-H2AX)≤1.4,暴露末期(96 h)γ-H2AX含量恢复至空白对照水平(Wu et al.,2012),HBCD暴露引起的玉米细胞DNA损伤被全部修复.而卷烟烟气粒相物对仓鼠细胞DNA损伤中γ-H2AX相对含量高达2.8,暴露末期(24 h)γ-H2AX仍明显高于空白对照组,DNA损伤未被全部修复(付立伟等,2014).本研究中头孢噻肟钠暴露对斑马鱼造成了一定程度的DNA损伤,暴露过程中γ-H2AX相对含量<1.6,可见DNA损伤程度并不严重,暴露末期DNA损伤已完全修复.
4 结论(Conclusions)1)不同浓度头孢噻肟钠对斑马鱼肌肉组织中SOD活性、MDA含量影响显著:低浓度头孢噻肟钠对斑马鱼SOD活性主要为诱导作用,高浓度主要为抑制作用;头孢噻肟钠对斑马鱼MDA含量诱导作用显著,破坏了机体的抗氧化平衡系统,给机体带来不同程度的氧化损伤,但损伤处于机体可防御范围内,15 d内机体抗氧化系统可恢复动态平衡.
2)头孢噻肟钠暴露能引起斑马鱼肌肉中γ-H2AX含量显著升高,最高含量为空白对照组的1.5倍,导致斑马鱼肌肉细胞发生一定程度的DNA双键断裂,但15 d内细胞自身可将损伤修复.
3)头孢噻肟钠暴露能够引起斑马鱼的氧化应激,这可能是导致其DNA损伤的重要机制之一.
| [1] | 白琦锋,高礼,袁涛.2012.低浓度头孢类抗生素暴露对嗜热四膜虫超氧化物歧化酶和乳酸脱氢酶活力的影响[J].环境与健康杂志, 29(9):780-782 |
| [2] | Benson L J, Gu Y L, Yakovleva T, et al. 2006. Modifications of H3 and H4 during chromatin replication, nucleosome assembly, and histone exchange[J]. The Journal of Biological Chemistry, 281(14): 9287-9296 |
| [3] | 杜仲坤. 2012. 离子液体 PF6和 Br对斑马鱼氧化胁迫及DNA损伤.济南:山东农业大学.33-35 |
| [4] | 方展强,王春凤. 2004. 硒对汞致剑尾鱼肝氧化损伤的拮抗作用[J].安全与环境学报,4(5): 3-6 |
| [5] | 付立伟,陈欢,杨进,等.2014.基于磷酸化组蛋白H2AX的酶联免疫检测方法评价卷烟烟气基因毒性[J].分析化学研究报告,42(3): 320-325 |
| [6] | Gavrilov B,Vezhenkova I,Firsanov D,et al. 2006. Slow elimination of phosphorylated histone γ-H2AX from DNA of terminally differentiated mouse heart cells in situ[J]. Biochemical and Biophysical Research Communications,347(4): 1048-1052 |
| [7] | Ingerslev F,Halling-Srensen B. 2001. Biodegradability of metronidazole,olaquindox,and tylosin and formation of tylosin degradation products in aerobic soil-manure slurries[J]. Ecotoxicology and Environmental Safety,48(3): 311-320 |
| [8] | Kumar R R,Lee J T,Cho J Y. 2012. Fate,occurrence,and toxicity of veterinary antibiotics in environment[J]. Journal of the Korean Society for Applied Biological Chemistry,55(6): 701-709 |
| [9] | Li W H,Shi Y L,Gao L H,et al. 2012. Occurrence of antibiotics in water,sediments,aquatic plants,and animals from Baiyangdian Lake in North China[J]. Chemosphere,89(11): 1307-1315 |
| [10] | Luo Y,Xu L,Rysz M,et al. 2011. Occurrence and transport of tetracycline,sulfonamide,quinolone,and macrolide antibiotics in the Haihe River Basin,China[J]. Environmental Science & Technology,45(5): 1827-1833 |
| [11] | Maki T,Hasegawa H,Kitami H,et al. 2006. Bacterial degradation of antibiotic residues in marine fish farm sediments of Uranouchi Bay and phylogenetic analysis of antibiotic-degrading bacteria using 16S rDNA sequences[J]. Fisheries Science,72(4): 811-820 |
| [12] | Papadimitriou E,Loumbourdis N S. 2002. Exposure of the frog Rana ridibunda to copper: impact on two biomarkers,lipid peroxidation,and glutathione[J]. Bulletin of Environmental Contamination and Toxicology,69(6): 885-891 |
| [13] | Phillips I. 2003. Does the use of antibiotics in food animals pose a risk to human health? A critical review of published data[J]. Journal of Antimicrobial Chemotherapy,53(1): 28-52 |
| [14] | 秦洪伟,陈柳芳,鲁楠,等. 2011. 氧氟沙星对斜生栅藻的毒性效应[J].环境化学,30(4): 885-886 |
| [15] | Sarmah A K,Meyer M T,Boxall A B A.2006.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics (VAs) in the environment[J].Chemosphere,65(5): 725-759 |
| [16] | 沈洪艳,吴志刚,高吉喜,等.2013.青土霉素废水出水对斑马鱼抗氧化指标的影响[J].河南科技大学学报(自然科学版),34(3): 78-82 |
| [17] | 沈洪艳,王丽新,杨金迪,等.2014.链霉素生产废水对斑马鱼肌肉组织SOD活性和MDA含量的影响[J].河北科技大学学报,35(3): 303-308 |
| [18] | Silva B F D,Jelic A,López-Serna R,et al.2011.Occurrence and distribution of pharmaceuticals in surface water,suspended solids and sediments of the Ebro River basin,Spain[J].Chemosphere,85(8): 1331-1339 |
| [19] | 王朋华,袁涛,谭佑铭,等.2008.水环境中药物污染及迁移转化行为研究进展[J].环境科学与技术,31(9): 57-61 |
| [20] | 王朋华,袁涛.2010.污水厂头孢类抗生素去除规律及潜在风险评估[J].上海交通大学学报,44(11): 1550-1555 |
| [21] | 王奇,范灿鹏,陈锟慈,等.2010.三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响[J].生态环境学报,19(5): 1014-1019 |
| [22] | Wu T,Wang S,Huang H L,et al.2012.Diastereomer-specific uptake,translocation,and toxicity of hexabromocyclododecane diastereoisomers to Maiza[J].Journal of Agricultural and Food Chemistry,60(34): 8528-8534 |
| [23] | 吴伟,聂凤琴,瞿建宏,等.2009.2,2',4,4'-四溴联苯醚对鲫鱼离体肝脏组织的氧化胁迫[J].农业环境科学学报,28(5): 1005-1009 |
| [24] | 吴志刚,沈洪艳,高吉喜,等.2013.青土霉素废水出水对锦鲤肝脏抗氧化酶活性和丙二醛含量的影响[J].江西农业大学学报,35(3): 587-592 |
| [25] | 俞慎,王敏,洪有为.2011.环境介质中的抗生素及其微生物生态效应[J].生态学报,31(15): 4437-4446 |
| [26] | 余艳柯,陆源,余应年,等.2005.γH2AX: DNA双链断裂的标志[J].中国药理学与毒理学杂志,19(3): 237-240 |
| [27] | 钟碧瑾,姚丹,刘娟娟,等.2009.两种有机磷农药对沼水蛙蝌蚪抗氧化系统及MDA浓度的影响[J].福建师范大学学报(自然科学版),25(2): 91-96 |
| [28] | 周保华,高勤,王洪华,等.2011.青霉素、土霉素菌渣研究利用现状及特性分析[J].河北工业科技,28(5): 291-294 |
 2015, Vol. 35
2015, Vol. 35


