随着工业的迅猛发展和城市化进程的加快,我国土壤环境的镉(Cd)污染问题日益突出,调查数据显示,全国遭受Cd污染的农田面积已超过1.3×104 hm2,涉及11个省市的25个地区(崔力拓等,2006).土壤Cd污染的来源包括矿物采、选、冶活动中的烟尘沉降,化肥有机肥的使用、污水灌溉及电镀废水排放等(刘荣乐等,2005;Fischer,2010;冉烈等,2011).Cd元素移动性强且毒性大,其在土壤中的过量累积势必会造成农产品Cd含量的增加甚至超标.有研究表明,大众蔬菜(莴笋、辣椒、茄子、花椰菜、西红柿、大葱、小白菜、苋菜)中的Cd含量均与生长环境中的Cd浓度之间存在着一定的正相关性(刘杨等,2011;丁平等,2012).
细胞壁是植物细胞的外层结构,存在于细胞膜外,细胞壁除了具有界定细胞形状和保护原生质体的作用外,对植物响应外界环境的胁迫也起到了非常重要的作用(Hückelhoven,2007),同时还可对外界污染物尤其是重金属的进入发挥一定的屏障作用.重金属被植物根系吸收后会先透过细胞壁并进入胞内,最终以共质体途径借助木质部导管而向地上部转输(Lux et al.,2011).研究发现,对于非超积累或非耐性植物,为了避免重金属的毒害作用,进入植物地上部(茎、叶)组织细胞的重金属也多累积于细胞壁,如水生植物(水蓼)其根、茎叶细胞中58%~68%的重金属Hg被固定于细胞壁中(钱建平等,2012).
植物细胞壁的构成物质包括木质素、纤维素、半纤维素、蛋白质、果胶质等,并含有多种有机官能团(羟基、醛基、巯基、氨基、羧基等),通过这些自由基团的作用可以改变重金属元素在植物体内的存在形态及迁移行为(段德超等,2014).因此,在植物对重金属产生耐性、甚至是解毒作用的过程中,根细胞壁起到了较为重要的固定作用(Chen et al.,2013; DalCorso et al.,2010).而通过这种固定作用,可避免游离重金属对胞内敏感细胞器的毒害作用.如研究发现,成株期的蒌蒿其根系吸收的Cd有59%被细胞壁所固定,占据了最大份额(董萌等,2013).这种固定作用包括细胞壁上磷酸盐的沉淀作用(Zhao et al.,2015)、多糖基团的结合作用(Zhu et al.,2013),从作用机理上涉及氧化还原、静电交感、离子交换等(蔡佳亮等,2008).
果胶酶改性可借助果胶酶的作用部分去除植物细胞壁上的果胶成分,从而可以判定细胞壁上果胶质在吸附重金属过程中所发挥的作用.氨基甲基化改性的原理在于植物细胞壁经与甲酸(HCOOH)、甲醛(HCHO)作用后,细胞壁组分上的—NH2可转化为—N(CH3)2,从而考察其在吸附重金属过程中所发挥的作用.醋化改性是在强酸作用下利用甲醇(CH3OH)将细胞壁上的—COOH转化为—COOCH3,从而考察其在吸附重金属过程中所发挥的作用.研究发现,通过不同改性处理,植物细胞壁对重金属的吸附量存在一定程度的减少,因而能够有效鉴别细胞壁不同组分、基团在重金属吸附过程中所发挥的作用(王梦等,2015;刘婷婷等,2014;徐劼等,2014;武贝,2009)
傅立叶变换红外光谱(FTIR)是一种基于化合物中官能团和极性键振动的结构分析技术,因而被认为是快速测定细胞组分变化的有效检测手段之一(Baker et al.,2014).近年来,已有应用FTIR技术开展植物重金属耐性机制的研究(顾艳红等,2009; 于明革等,2010; 薛生国等,2011).
芹菜(Apium graveolens L.)属伞形科二年生草本植物,在我国具有较广泛的种植,属于深受喜爱的大众蔬菜.研究表明,芹菜对重金属Cd具有较强的富集能力(段敏等,1999),而且根部对Cd的富集能力显著大于地上部(廖琴等,2011).目前,有关植物根细胞壁对重金属的吸附固定机制研究报道较少.因此,本文通过系统研究芹菜根细胞壁对Cd的吸附特性,同时利用傅立叶红外光谱技术表征芹菜根细胞壁上Cd吸附位点的官能团信息,以期探究芹菜根细胞壁在Cd吸收中的作用机制,也为研究Cd对植物的毒害作用及植物对Cd的适应性、耐性和解毒机制提供重要信息和新的研究方法.
2 材料与方法(Materials and methods) 2.1 芹菜苗培养供试芹菜品种为津南实芹1号,种子购自河北青县神华种子有限责任公司.芹菜种子首先在温室内的无污染土壤中进行育苗,待幼苗长出6片真叶后于人工气候室水培处理.人工气候室昼/夜温度为25 ℃/20 ℃,光照时间为14 h,相对湿度在70%~75%.营养液配方如下(μmol · L-1):Na2MoO4 0.5,ZnSO4 0.5,CuSO4 0.8,Fe-EDTA 5,H3BO3 23,MnSO4 45,MgSO4 500,KH2PO4 500,Ca(NO3)1000.
芹菜苗先置于1/2浓度的营养液中预培养1周后,选取长势较好且一致的芹菜苗移植于塑料小桶(每桶4株)改用全营养液培养,培养1周后,进行Cd胁迫处理,此时芹菜苗株高15~16 cm.营养液中Cd以Cd(NO3)2形式加入,Cd浓度分别为0(CK)、5、10 mg · L-1,每个处理3个重复.芹菜苗培养期间每天均用0.1 mol · L-1 HCl 或0.1 mol · L-1 NaOH 调节营养液体系pH 值在5.5 左右,营养液4 d 更换1次并保持24 h通气,芹菜苗Cd胁迫处理14 d后水培结束.
2.2 芹菜根细胞壁提取分离芹菜植株培养14 d后,根系(CK、Cd处理组)预先置于25 mmol · L-1 EDTA-Na盐溶液中解析15 min,再用去离子水冲洗干净后备用.
根据Zhong等(1993)的方法对空白对照处理组和Cd处理组芹菜的根细胞壁进行提取分离:先将芹菜新鲜根组织样品(离根尖5 cm的根段)置于陶瓷研钵中加入液氮研磨至粉末状;随后再利用75%的冰乙醇溶液对粉末进行3次浸提操作,每次浸提结束后在5000×g的转速下离心分离10 min;最终离心分离所得到的浸提物再依次用1∶ 7(根重/体积)的冰丙酮、冰甲醇-三氯甲烷混合液(1 ∶ 1,V/V)、冰甲醇溶液进行洗涤,最后将经三步洗涤、离心得到的沉淀物进行冷冻干燥.冷冻干燥结束后即作为提取细胞壁样品,于4 ℃密封保存备用.
2.3 芹菜根细胞壁的化学改性 2.3.1 果胶酶改性果胶酶改性处理可验证果胶质在芹菜根细胞壁Cd吸附过程中所起到的作用.改性方法如下(武贝,2009):称取2 g芹菜根细胞壁粉末样品于离心管中,并向离心管中加入0.1%牛血清白蛋白和120 mL 1%果胶酶,随后离心管在30 ℃条件下水浴消化30 min,沉淀经离心分离后用去离子水洗涤(该步骤重复3次).经冷冻干燥后4 ℃保存备用.
2.3.2 酯化改性酯化改性处理可以验证羧基官能团在芹菜根细胞壁Cd吸附过程中所发挥的作用.改性方法如下(武贝,2009):称取2 g芹菜根细胞壁粉末于离心管中,并加入无水甲醇140 mL、浓HCl 1.2 mL,随后将离心管在125 r · min-1的转速条件下振荡反应12 h,反应结束后沉淀经离心分离后用去离子水洗涤(该步骤重复3次),经冷冻干燥后4 ℃保存备用.
2.3.3 氨基甲基化改性氨基甲基化改性处理可以验证氨基官能团在芹菜根细胞壁Cd吸附过程中所发挥的作用.改性方法如下(武贝,2009):称取2 g芹菜根细胞壁粉末于离心管中,并依次加入甲酸80 mL、甲醛40 mL,随后将离心管在125 r · min-1的转速条件下振荡反应6 h,反应结束后沉淀经离心分离后用去离子水洗涤(该步骤重复3次),经冷冻干燥后4 ℃保存备用.
2.4 根细胞壁Cd吸附的动力学实验根据徐劼等(2014)的方法开展根细胞壁Cd吸附的动力学实验:将0.06 g提取的芹菜根细胞壁(未改性或改性的CK组)置于底部垫有滤纸的滤头中,滤头上下接口处均用导管连接,用于泵入吸附液和收集流出液.吸附液为5mg · L-1 Cd(NO3)2+0.01 mol · L-1 NaNO3溶液,吸附液利用蠕动泵以5 mL/10 min的流速泵入滤头,并利用自动收集器收集流出液,每10 min收集1管.吸附实验结束后,用原子吸收法测定每管流出液中Cd2+的浓度.实验重复3次,以平均值作图(标准偏差小于5%,为防止图中曲线不清晰,未在图中标出).
2.5 芹菜根细胞壁的傅立叶红外光谱测定利用傅里叶变换红外光谱仪(Thermo-Nicolet Nexus 470 FTIR)对芹菜根细胞壁进行红外光谱表征.采用KBr压片法制备检测样品:准确称取根细胞壁样品3 mg,按1 ∶ 100的比例加入碎晶型溴化钾 300 mg于玛瑙研钵中充分研磨均匀,压片后放入FTIR样品工作室,在相同条件下测定红外光谱图.扫描范围为4000~400 cm-1,光谱分辨率为4 cm-1.
2.6 数据处理与统计数据采用Origin 8.5和Microsoft Excel2003进行统计分析、作图等.
3 结果与分析(Results and analysis) 3.1 空白对照组芹菜根细胞壁化学改性前后红外光谱分析对改性前后空白对照处理组芹菜根细胞壁的红外光谱图(4000~400 cm-1,图 1)进行解析,得到细胞壁在化学改性前后官能团变化的信息.对未改性的芹菜根细胞壁的红外光谱图进行解析,可以得到空白对照处理组(图 1a)芹菜根细胞壁的特征峰:3410 cm-1处为羟基(O—H)和氨基(N—H)键伸缩振动峰的叠加(No.1),主要源于根细胞壁中脂肪酸、蛋白质及各种碳水化合物(果胶、半纤维素、纤维素、多糖)等对光谱的贡献;2915 cm-1处附近是典型的脂碳链(—CH3、 CH2、 CH—)中C—H的伸缩振动吸收峰(No.2),主要来自于细胞壁组分中亲水脂分子的信息;1743 cm-1处归属为酯化果胶中酯羰基(—C O)的伸缩振动吸收峰(No.3);蛋白质是细胞壁的重要成分之一,谱图中1651 cm-1处和1512 cm-1处的两个强吸收峰对应于蛋白质酰胺I带(No.4)和酰胺Ⅱ带(No.5),其中前者来自C—N的伸缩振动,后者来自于N—H弯曲振动伸缩振动,是蛋白质的特征红外光谱;1419 cm-1处的峰归属为果胶质糖醛酸中羧酸根离子(COO—)(No.6)的特征吸收峰,说明根细胞中存在一定含量的果胶质;1327 cm-1处的峰(No.7)为醇羟基的—C—O弱吸收峰;1250 cm-1处的吸收峰(No.8)有可能是羧基的—C—O、硫酸酯的—C—O—S或磷酸盐的特征吸收峰;1157 cm-1处为多糖环结构的—C—C 或C—O伸缩振动峰(No.9),1111 cm-1处的强吸收峰可能是果胶中的C—C和C—O伸缩振动峰(No.10);1034 cm-1处的吸收峰为碳水化合物(可溶性糖、纤维素糖链、半纤维素等)中的—CH弯曲或—C—C、—C—O伸缩振动峰(No.11).
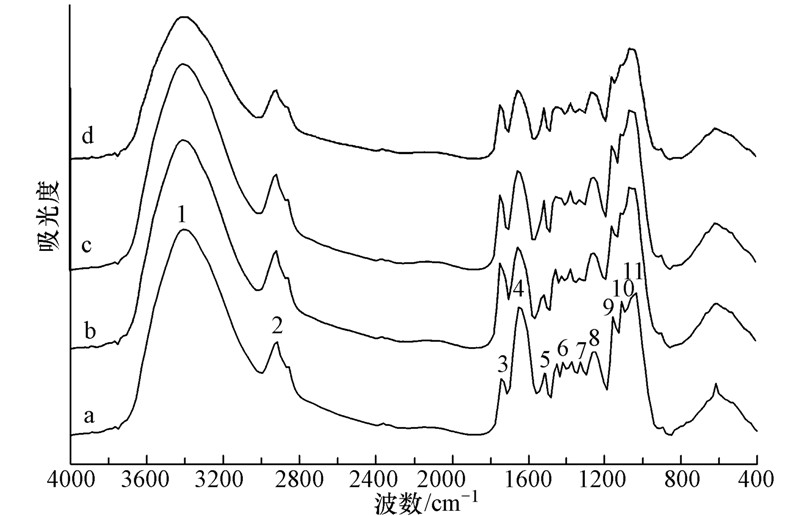 |
| 图 1 化学改性前后空白对照组芹菜根细胞壁红外光谱表征(a未改性处理;b:氨基甲基化改性;c:酯化改性;d:果胶酶改性) Fig. 1 FTIR spectra of the celery root cell wall(CK)before and after chemical modification(a: Unmodified; b: Methylized;c: Esterified; d: Treated with pectinase) |
在甲基化改性后的芹菜根细胞壁红外光谱图(图 1b)中,在1651 cm-1处的酰胺I带吸收峰(No.4)和1512 cm-1处的酰胺Ⅱ带吸收峰(No.5)的峰高与未改性的细胞壁图谱(图 1a)对比有所降低,这表明经甲基化改性处理后细胞壁上的的N—H基团减少;此外,1450 cm-1和1373 cm-1处的甲基峰振动有所增强,也反映出甲基化改性的作用.
在酯化改性后的芹菜根细胞壁中(图 1c),1743 cm-1处为酯羰基(—C O)的伸缩振动吸收峰(No.3),与未改性的细胞壁(图 1a)相比,其吸收振动峰则相对位于较高频的区域,而且峰强也明显高于未改性处理的细胞壁,1157 cm-1处的C—O伸缩振动吸收峰(No.9)峰值也有所增强,以上特征峰值的变化均表明实现了羧基酯化反应.
果胶作为一种多糖类物质含有大量的羟基,在果胶酶改性后的芹菜根细胞壁中(图 1d),3410 cm-1处为羟基(O—H)的伸缩振动吸收峰(No.1),与未改性的细胞壁(图 1a)相比其吸收峰强明显降低,表明果胶酶改性成功.
3.2 改性对空白对照组芹菜根细胞壁Cd吸附能力的影响为了探明Cd在芹菜根细胞壁上的吸附位点,对根细胞壁(空白对照处理组)进行了化学改性处理,根细胞壁改性前后对Cd的吸附动力学曲线如图 2所示.由图 2可见,芹菜根细胞壁改性前后对Cd的吸附均随着时间的延长,吸附量逐渐增加.当吸附时间达到420 min时,经计算与未改性处理相比,芹菜根细胞壁经酯化改性处理后其对Cd的累积吸附量相对降低了42.6%,经氨基甲基化改性处理后其对Cd的累积吸附量相对降低了21.0%,经果胶酶改性处理后其对Cd的累积吸附量相对降低了40.5%.
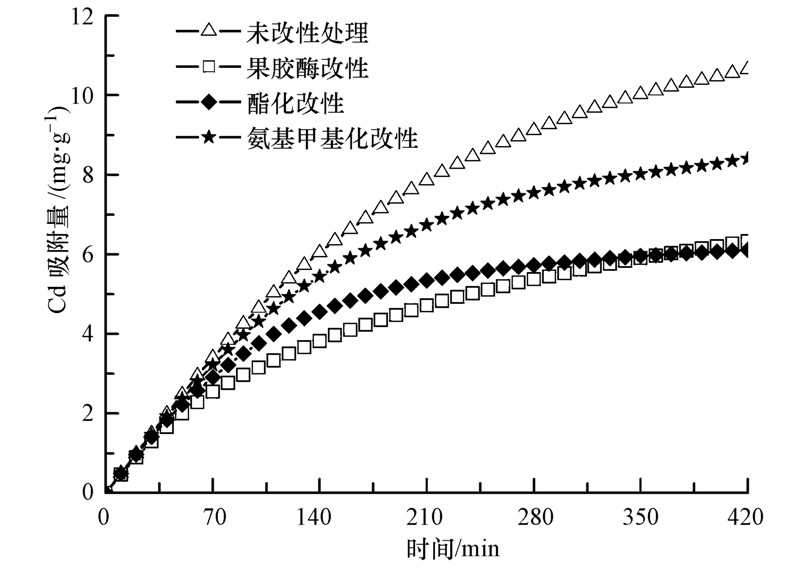 |
| 图 2 化学改性对空白对照组芹菜根细胞壁吸附镉的影响 Fig. 2 Amount of Cd adsorbed by the celery root cell wall(CK)with chemical modification |
空白对照处理组芹菜根细胞壁吸附Cd前后的红外光谱图见图 3.按照张晓斌等(2008)的研究方法,对每个谱图分别以—CH3中C—H的特征吸收峰(2915 cm-1)处的吸光度A2915为标准值,计算其它处特征峰的吸光度A与A2915的比值,利用该比值的大小变化来间接半定量分析芹菜根细胞壁吸附Cd前后官能团特征峰的变化,分析结果见表 1.
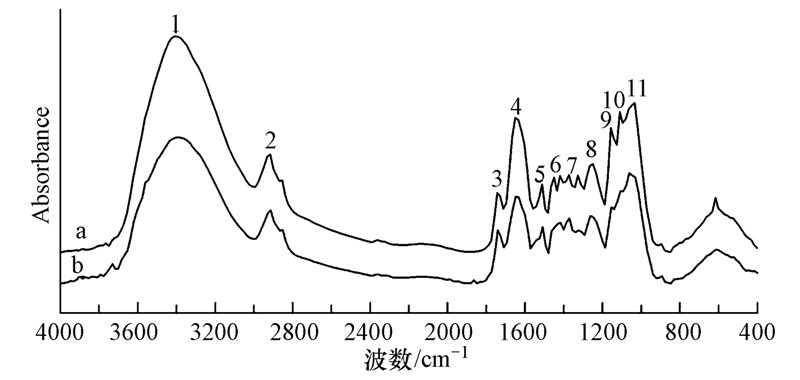 |
| 图 3 空白对照处理组芹菜根细胞壁镉吸附前后红外光谱图(a:Cd吸附前;b:Cd吸附后) Fig. 3 FTIR spectra of the crude and the Cd2+-adsorbed root cell wall of celery(a: Before the adsorption of Cd; b: After the adsorption of Cd) |
| 表 1 空白对照处理组芹菜根细胞壁Cd吸附前后红外光谱的半定量分析结果 Table 1 Semi-quantitative analysis of FTIR spectra of the celery root cell wall(Control)before and after Cd adsorption |
只有参与了Cd的吸附,根细胞壁上官能团的特征吸收峰才会发生不同程度的位移,而没有参与Cd吸附的官能团,其特征吸收峰的位移变化则较小.由Cd吸附前后芹菜根细胞壁傅里叶红外光谱图 3结合半定量分析计算结果表 1可以看出,—OH(No.1)、C—O(No.7)、果胶C—C或C—O(No.10)的特征吸收峰均明显向低频移动,分别向低频移动了26 cm-1、10 cm-1和6 cm-1.半定量计算结果也显示出根细胞壁吸附Cd后,3处位置的A/A2915比值均降低.
3.4 Cd胁迫下芹菜根细胞壁的红外光谱半定量分析芹菜苗分别用含0(CK)、5和10 mg · L-1Cd的营养液水培,胁迫处理14 d后,分离提取Cd胁迫与空白对照组芹菜根细胞壁,利用FTIR进行表征(图 4).由空白对照组芹菜根细胞壁的FTIR谱图(图 4a)可以看出在3410 cm-1处为—OH的特征吸收峰,由于—OH为强极性基团其缔合现象非常明显,故此处的峰形较宽.而Cd胁迫处理后的芹菜,其根细胞壁的FTIR谱图(图 4b、图 4c)在3410 cm-1处附近的吸收峰变得较尖锐,这主要是由于Cd的吸附而使得芹菜根细胞壁上存在大量Cd离子,根细胞壁上的—OH基官能团与Cd发生了明显的交互作用,其与—OH的作用使得细胞壁上—OH浓度下降,造成其缔合效应的减弱,伸缩振动峰峰形也因此而变尖.
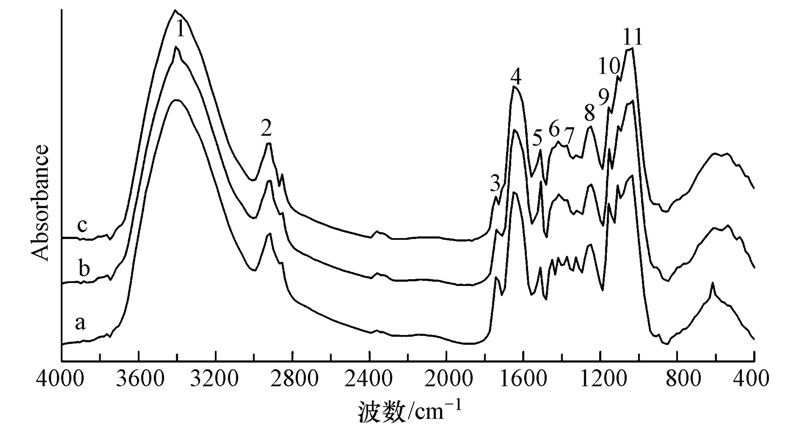 |
| 图 4 对照与不同Cd水平处理时芹菜根细胞壁的红外光谱表征(a:对照; b: 5 mg · L-1 Cd; c: 10 mg · L-1 Cd) Fig. 4 FTIR spectra of the root cell wall of Cd treated celery and control(a: control; b: 5 mg · L-1 Cd; c: 10 mg · L-1 Cd) |
对不同Cd处理的根细胞壁傅里叶红外光谱图以—CH3中C—H的特征吸收峰(2915 cm-1)处的吸光度A2915为标准值,计算其它处特征吸收峰的吸光度A与A2915的比值,利用该比值的大小变化来间接半定量分析Cd胁迫下芹菜根细胞壁化学成分的变化,分析结果见表 2.
由表 2可以看出,Cd处理组(5、10 mg · L-1)根细胞壁的—OH/—NH振动峰(No.1)、—C—N(酰胺I带)(No.4)、—N—H(酰胺Ⅱ带)(No.5)、果胶质糖醛酸中羧酸根离子(COO—)(No.6)、多糖环结构的—C—C 或C—O伸缩振动峰(No.9)、—CH弯曲或—C—C、—C—O伸缩振动峰(No.11)的A/A2915值均大于对照组,且胁迫处理Cd浓度越高A/A2915值越大.1743 cm-1处酯羰基(—C O)的伸缩振动吸收峰(No.3)的A/A2915值随着Cd 处理浓度的增加而降低.
| 表 2 不同Cd处理时芹菜根细胞壁红外光谱特征峰的半定量分析结果 Table 2 Semi-quantitative analysis of the FTIR spectra of root cell wall of Cd theated celery and control |
利用果胶酶对芹菜根细胞壁进行改性处理后,可部分去除根细胞壁中的果胶质,导致其在细胞壁中的含量降低,从而评判果胶质在根细胞壁吸附Cd过程中所发挥的作用.实验研究结果表明,经果胶酶改性后的芹菜根细胞壁,其吸附能力降低了40.5%,说明半乳糖醛酸多聚物果胶质在芹菜根细胞壁Cd吸附过程中起到了一定的作用(图 2b).果胶质作为植物组织细胞壁上的生物相组分包括鼠李半乳糖醛酸聚糖I和鼠李半乳糖醛酸聚糖Ⅱ及同型半乳糖醛酸聚糖,这些多糖类物质因含有许多带负电荷基团,极易结合金属阳离子,因而在重金属的吸附过程中发挥一定的作用.有研究表明,植物组织细胞壁上的果胶质对Al的吸附发挥了重要作用(Schmohl et al.,2000; Zheng et al.,2004);Konno等(2010)的研究也发现,剑叶舌叶藓原丝体细胞壁上的果胶结合了43%的Cu,说明植物细胞壁果胶在对重金属的耐受性方面起到了一定的作用.
氨基甲基化改性的目的主要是让根细胞壁上的氨基与外加引入的甲基发作用,借以考察氨基在Cd吸附过程中所发挥的作用.研究发现,对于Cr(Ⅲ)的吸附而言,紫花苜蓿组织细胞壁上的—NH2并不是主要的结合官能团,但在Au(Ⅲ)的吸附过程中却又发挥了重要作用(Gardea-Torresdey et al.,2002).本实验研究结果表明,根细胞壁酯化后对Cd的吸附量降低了21.0%,说明芹菜根细胞壁中的—NH2活性基团在Cd离子吸附中也存在一定的作用.
酯化改性的目的主要是让根细胞壁上的羧基与外加物质引入的羟基发生酯化反应,从而减少根细胞壁上存在的羧基结合位点,以考察羧基在Cd吸附过程中所发挥的作用.Gardea-Torresdey等(1990)的研究发现,经酯化改性处理后,细胞壁对重金属离子的吸附能力明显降低.本实验结果也表明根细胞壁酯化后对Cd的吸附量降低了42.6%,说明根细胞壁中的羧基在Cd吸附中的贡献作用较大.
4.2 芹菜根细胞壁的红外光谱分析一般情况下,离子化基团(氨基、羟基、羧基等)在重金属吸附过程中的作用都可以用FTIR光谱图进行表征.因此,FTIR检测可以为研究植物细胞壁上聚合物性质及基团特征提供丰富的组分结构信息.其原理主要是当金属离子与有机分子发生结合作用后会导致其化合键吸收红外光子的特征频率发生差异变化,因此,可通过结合作用前后某些官能团的特征吸收峰的变化来判断其是否参与金属离子的结合作用.表 1和表 2的半定量分析结果表明,当Cd离子与根细胞壁上分布的官能团发生相互作用后,由于原有官能团的结构发生了变化,从而使得该官能团上功能原子的化学键力对应发生改变,从而导致振动吸收峰会出现波数的变化和位置的移动.因此,可用于判断参与Cd结合的官能团.
在细胞壁对Cd的吸附过程中,由于羟基上的O配体参与了对Cd的络合,使O—H的键长增加,因而其吸收峰移向低频移动(表 1中No.1),同时也说明细胞壁与Cd结合过程中化学吸附起了一定作用.C—O(表 1中No.7)属于纤维素中的特征吸收峰,果胶C—C或C—O(表 1中No.10)属于果胶质中的特征峰,根细胞壁吸附Cd后这两个特征吸收峰均明显向低频移动,说明果胶质和纤维素中的—OH、—COOH基团在一定程度上参与了Cd的化学吸附,从而削弱了细胞壁表面氢键的作用.
表 2中与空白对照处理组相比,Cd胁迫处理组各特征峰的A/A2915值均有所变化,说明芹菜根细胞壁对Cd 胁迫产生了一定的应激性反应.其中,Cd处理组根细胞壁的—OH/—NH振动峰(表 2中No.1)的A3410/A2915值均大于对照组,说明Cd处理导致芹菜根细胞壁上—OH基官能团数量的增加,表明—OH是结合Cd的重要官能团之一.酯羰基(—C O)伸缩振动吸收峰(表 2中No.3)的A1743/A2915值随着Cd处理浓度的增加而降低,说明Cd处理导致了芹菜根细胞壁上果胶质甲基酯化程度的下降,说明根细胞壁中的酯类物质对Cd胁迫极敏感,推测有可能是这些酯类物质被迅速转化为其他物质,以提高对Cd的耐性.植物细胞壁所含自由羧基的量决定了其与重金属离子的结合能力,而植物细胞壁在重金属的胁迫作用下可通过物质代谢而产生适应性变化.Clemens(2001)研究发现,植物根细胞壁可通过降低果胶的甲基化程度而增加自由羧基含量,从而提高细胞壁的阳离子交换能力,导致吸附更多的Cd2+.张晓斌等(2008)研究也发现,凤眼莲在Cr胁迫下其根细胞壁上的果胶质甲基酯化程度会有所下降,从而使凤眼莲表现出一定的Cr耐受能力.
氨基酸、蛋白质和多肽类物质是芹菜根系分泌物的组成物质(陈波等,2006),因此,在低浓度Cd胁迫的刺激作用下有可能诱导了这类物质的合成和分泌,从而有可能作为Cd离子的运输载体而与Cd离子发生络合作用,以减轻其对植株的毒害作用.因此,造成Cd胁迫下芹菜根细胞壁上—N—H(酰胺Ⅱ带)(表 2中No.5)的A1512/A2915值增大.Didierjean 等(1996)研究认为,这些重金属胁迫诱导蛋白可能具有保护植物细胞免受重金属毒害的作用.A1651 /A2951的比值表示蛋白二级结构中肽键间氢键的结合力的强弱(任立民等,2008),因此,Cd胁迫下芹菜根细胞壁—C—N(酰胺I带)(表 2中No.4)的A1651/A2915增大,说明其细胞壁上蛋白二级结构中肽键间氢键的结合力有所增强.龚宁等(2010)借助傅立叶变换-衰减全反射红外光谱(FTIR-ATR)技术研究也发现,Cd 处理可导致小白菜幼根中蛋白质分子结构中氢键数目增加、结合力增强,并认为这是小白菜对Cd 胁迫应激性的表现.
多糖环结构的—C—C 或C—O伸缩振动峰(表 2中No.9)A1157/A2915的比值、碳水化合物中的—CH弯曲或—C—C、—C—O伸缩振动峰(表 2中No.11)A1034/A2915的比值代表糖类物质,特别是可溶性糖的含量(曾峰等,2013).有研究认为在较高重金属浓度胁迫的环境下,某些植物器官组织细胞的细胞壁能够诱导合成一些多糖类物质,这种诱导合成细胞壁多糖的机制提高了植株对重金属的耐性(裴惠娟等,2011).本研究结果也表明Cd处理组的A1157/A2915和A1034/A2915值均大于对照组,且胁迫处理Cd浓度越高A/A2915值越大.Van等(1994)研究也发现,在Al胁迫条件下,南瓜幼苗茎的细胞壁中半纤维素和纤维素含量各自增加了25%和10%,因而认为南瓜幼苗可通过增加细胞壁中糖类物质的量来提高铝离子的吸附能力,从而缓解Al的毒害.郑绍建(2014)经过深入研究认为,植物组织细胞壁中的半纤维素更可能是Al、Cd的主要结合位点,而且细胞壁上的半纤维素含量与植物的Al、Cd抗性存在关联,通过细胞壁组分的自我修饰(改变半纤维素含量)可缓解Al、Cd的毒害作用.
5 结论(Conclusions)1)芹菜根细胞壁Cd吸附的动力学实验研究表明,根细胞壁经酯化改性处理后其对Cd的累积吸附量相对降低了42.6%,经氨基甲基化改性处理后其对Cd的累积吸附量相对降低了21.0%,经果胶酶改性处理后其对Cd的累积吸附量相对降低了40.5%.
2)利用傅立叶红外光谱技术表征了芹菜根细胞壁上Cd吸附位点的官能团信息,研究结果表明,Cd主要与细胞壁纤维素、半纤维素和木质素中的羧基官能团发生结合作用,同时根细胞壁上的蛋白质和果胶质也参与了Cd的结合.
3)在Cd胁迫条件下,凭借某种生理调节作用,根细胞壁果胶质组分中自由羧基的数量得以增加,根细胞壁上蛋白质二级结构中肽键间氢键的结合力得以增强,同时促进了根细胞壁合成一些多糖类物质,从而使得芹菜在低浓度Cd的胁迫作用下显现出一定的适应性.
| [1] | Baker M J,Trevisan J,Bassan P,et al.2014.Using Fourier transform IR spectroscopy to analyze biological materials[J].Nature Protocols, 9:1771-1791 |
| [2] | 蔡佳亮,黄艺,郑维爽.2008.生物吸附剂对废水重金属污染物的吸附过程和影响因子研究进展[J].农业环境科学学报,27(4):1297-1305 |
| [3] | 陈波,徐冬梅,刘广深,等.2006.异丙甲草胺对芹菜根际与非根际生物活性的影响[J].应用生态学报,17(5):925-928 |
| [4] | Chen G C,Liu Y Q,Wang R M,et al.2013.Cadmium adsorption by willow root:the role of cell walls and their subfractions [J].Environmental Science and Pollution Research,20(8):5665-5672 |
| [5] | Clemens S.2001.Molecular mechanisms of plant metal tolerance and homeostasis [J].Planta,212(4):475-486 |
| [6] | 崔力拓,耿世刚,李志伟.2006.我国农田土壤镉污染现状及防治对策[J].现代农业科技,(11):184-185 |
| [7] | DalCorso G,Farinati S,Furini A.2010.Regulatory networks of cadmium stress in plants [J].Plant Signaling Behavior,5(6):663-667 |
| [8] | Didierjean L,Frendo P,Nasser W,et al.1996.Heavy-metal-responsive genes in maize:identification and comparison of their expression upon various forms of abiotic stress [J].Planta,199(1):1-8 |
| [9] | 丁平,庄萍,李志安,等.2012.镉在土壤—蔬菜—昆虫食物链的传递特征[J].应用生态学报,23(11):3116-3122 |
| [10] | 董萌,赵运林,库文珍,等.2013.蒌蒿对镉的富集特征及亚细胞分布特点[J].植物学报,48(4):381-388 |
| [11] | 段德超,于明革,施积炎.2014.植物对铅的吸收、转运、累积和解毒机制研究进展[J].应用生态学报,25(1):287-296 |
| [12] | 段敏,马往校,李岚.1999.17种蔬菜中铅铬镉元素含量分析研究[J].干旱区资源与环境,13(4):74-80 |
| [13] | Fischer T B.2010.Reviewing the quality of strategic environmental assessment reports for English spatial plan core strategies [J].Environmental Impact Assessment Review,30(1):62-69 |
| [14] | Gardea-Torresdey J L,Becher-Hapak M K,Hosea J M.1990.Effect of chemical modification of algal carboxyl groups on metal ion binding [J].Environmental Science & Technology,24(9):1372-1378 |
| [15] | Gardea-Torresdey J L,Tiemann K J,Parsons J G,et al.2002.XAS investigations into the mechanism(s) of Au(Ⅲ) binding and reduction by alfalfa biomass [J].Microchemical Journal,71(2/3):193-204 |
| [16] | 龚宁,李荣华,孟昭福,等.2010.Cd对小白菜萌发生理影响的FTIR-ATR研究[J].农业环境科学学报,29(1):9-14 |
| [17] | 顾艳红,刘鹏,蔡琪敏,等.2009.FTIR结合生理特性研究镉胁迫对果灰藓的影响[J].光谱学与光谱分析,29(3):620-623 |
| [18] | Hückelhoven R.2007.Cell wall-associated mechanisms of disease resistance and susceptibility[J].Annual Review of Phytopathology,45:101-127 |
| [19] | Konno H,Nakashima S,Katoh K.2010.Metal-tolerant moss Scopelophila cataractae accumulates copper in the cell wall pectin of the protonema[J].Journal of Plant Physiology,167(5):358-364 |
| [20] | 廖琴,王胜利,南忠仁,等.2011.干旱区绿洲土壤中Cd、Pb、Zn、Ni复合污染对芹菜的影响及其富集迁移规律[J].干旱区资源与环境,25(7):173-177 |
| [21] | 刘荣乐,李书田,王秀斌,等.2005.我国商品有机肥料和有机废弃物中重金属的含量状况与分析[J].农业环境科学学报,24(2):392-397 |
| [22] | 刘婷婷,彭程,王梦,等.2014.海州香薷根细胞壁对铜的吸附固定机制研究[J].环境科学学报,34(2):514-523 |
| [23] | 刘杨,张薇,吉普辉,等.2011.沈阳张士灌区六种蔬菜的镉污染[J].生态学杂志,30(6):1229-1233 |
| [24] | Lux A,Martinka M,Vaculík M,et al.2011.Root responses to cadmium in the rhizosphere:a review[J].Journal of Experimental Botany,62(1):21-37 |
| [25] | 裴惠娟,张满效,安黎哲.2011.非生物胁迫下植物细胞壁组分变化[J].生态学杂志,30(6):1279-1286 |
| [26] | 钱建平,江文莹,张力.2012.水蓼对汞积累与分布的水培实验[J].生态学杂志,31(8):2119-2124 |
| [27] | 冉烈,李会合.2011.土壤镉污染现状及危害研究进展[J].重庆文理学院学报(自然科学版),30(4):69-73 |
| [28] | 任立民,成则丰,刘鹏,等.2008.美洲商陆对锰毒生理响应的FTIR研究[J].光谱学与光谱分析,28(3):582-585 |
| [29] | Schmohl N,Horst W J.2000.Cell wall pectin content modulates aluminium sensitivity of Zea mays (L.) cells grown in suspension culture[J].Plant,Cell & Environment,23(7):735-742 |
| [30] | Van H L,Kuraishi S,Sakurai N.1994.Aluminum-induced rapid root inhibition and changes in cell-wall components of squash seeding[J].Plant Physiology,106(3):971-976 |
| [31] | 王梦,段德超,徐辰,等.2015.茶树根细胞壁不同组分对铅的吸附性能及其功能团的傅里叶红外光谱学研究[J].生态学报,35(6):1743-1751 |
| [32] | 武贝.2009.海州香薷Cu耐性与积累机制研究.杭州:浙江大学.35-38 |
| [33] | 徐劼,保积庆,于明革,等.2014.茶树根细胞壁对铅的吸附作用[J].应用生态学报,25(2):427-432 |
| [34] | 薛生国,朱锋,叶晟,等.2011.紫茉莉对铅胁迫生理响应的FTIR研究[J].生态学报,31(20):6143-6148 |
| [35] | 于明革,陈英旭.2010.茶废弃物对溶液中重金属的生物吸附研究进展[J].应用生态学报,21(2):505-513 |
| [36] | 曾峰,唐永金.2013.高浓度U胁迫下植物物质成分的FTIR研究[J].湖南师范大学自然科学学报,36(5):59-64 |
| [37] | 张晓斌,刘鹏,李丹婷,等.2008.铬诱导植物根细胞壁化学成分变化的FTIR表征[J].光谱学与光谱分析,28(5):1067-1070 |
| [38] | Zhao Y F,Wu J F,Shang D R,et al.2015.Subcellular distribution and chemical forms of cadmium in the edible seaweed,Porphyra yezoensis[J].Food Chemistry,168:48-54 |
| [39] | Zheng S J,Lin X Y,Yang J L,et al.2004.The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant wheat (Triticum aestivum L.) cultivar[J].Plant and Soil,261(1/2):85-90 |
| [40] | 郑绍建.2014.细胞壁在植物抗营养逆境中的作用及其分子生理机制[J].中国科学:生命科学,44(4):334-341 |
| [41] | Zhong H L,Lauchli A.1993.Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J].Journal of Experimental Botany,44(4):773-778 |
| [42] | Zhu X F,Wang Z W,Dong F,et al.2013.Exogenous auxin alleviates cadmium toxicity in Arabidopsis thaliana by stimulating synthesis of hemicellulose 1 and increasing the cadmium fixation capacity of root cell walls[J].Journal of Hazardous Materials,263(2):398-403 |
 2015, Vol. 35
2015, Vol. 35


