2. 天津工业大学, 环境与化学工程学院, 天津 300387;
3. 天津城建大学, 环境与市政工程学院, 天津 300384
2. School of Environmental and Chemical Engineering, Tianjin Polytechnic University, Tianjin 300387;
3. School of Environmental and Municipal Engineering, Tianjin Chengjian University, Tianjin 300384
水环境的颗粒物是指尺寸大于1 nm的无机、有机和生物颗粒物质,河流中颗粒物来源于上游广大地区地表沉积层,在天然情况下,同一条河流中粒径<63 μm细颗粒物的时间、空间分布相对均匀,且颗粒物百分含量随粒径的增大而减小(杨艳玲等,2007).水体颗粒物往往与污染物相互作用并成为其载体,吸附结合水中的重金属和离子、抗生素等微污染物,在很大程度上决定着污染物在环境中的迁移转化和循环归宿(汤鸿霄等,2000).
抗生素在世界范围内拥有巨大的年产量和使用量.滥用的抗生素以代谢物的形式随粪便和尿液排出,以持久性有机污染物的形式存在于环境中,对人类的健康造成不利影响(周启星等,2007).据报道,目前全球抗生素类药物的消耗量已经超过20万t(姚宏等,2013);我国既是抗生素的生产大国,也是使用大国,年产抗生素原料大约21万t(Westerhoff et al., 2005).
近年来世界多处饮用水和地表水中检测到了抗生素残留.对英国南威尔士地区两条河流进行的56种PPCPs(Pharmaceutical and Personal Care Products,药物及个人护理品)监测结果显示,抗癫痫药物以及抗菌药物频繁存在,其中部分药物在水环境中呈持久性状态(Kasprzyk-Hordern et al., 2008).Stackelberg等(2007)分析了106种有机污染物经过混凝沉淀饮用水处理厂的情况,有40种化合物能在上游或原水中检出,17种在出厂水中检出.我国在香港维多利亚港与珠江中检测多种抗生素,含量分别在70~489 ng · L-1与13~69 ng · L-1之间(叶计朋等,2007;徐维海等,2007).在法国、德国、美国、意大利等地均有抗生素在水体中被检出的报道(Heberer, 2002a,b;Derksen et al.,2004;Reemtsma et al.,2006;Yu et al., 2006).
当前,关于颗粒物对抗生素的吸附研究主要集中在土壤和底泥等对抗生素的吸附机理上.1992年,Weber等(Weber and Huang, 1996; LeBoeuf and Weber, 1997)修正了线性分配理论,提出多端元反应模型.Pignatello和Xing(1995)把研究重点放在土壤有机质上面,认为土壤有机质可分为溶解相和孔隙填充相两部分,提出了双模式吸附模型(dual modesorption model).土壤吸附离子型有机化合物的研究表明,离子型有机化合物与土壤之间相互作用主要有:阳离子交换( MacKay and Seremet,2008)、表面络合( Gu and Karthikeyan,2005a)和阳离子架桥(Nowara et al., 1997)等.同时,抗生素本身的结构和性质也对吸附产生一定影响.Gu和Karthikeyan(2005b)用红外光谱研究水合铁铝氧化物(HFO和HAO)与环丙沙星吸附机理时发现,环丙沙星通过羧基上的羟基氧与HAO表面配位,而酮基(—C O)与HAO表面羟基间可能存在弱氢键作用,通过羧基上的羟基氧和酮基上的氧与HFO表面发生双齿配位而被吸附.Zhang和Huang(2007)研究表明,羧基对喹诺酮类抗生素吸附在无机矿物上的贡献较大.同时Figueroa等(2003)研究认为四环素中带正电的—NH(CH3)2部分可以通过正电作用吸附到矿物的负电位点上,或通过阳离子交换而被吸附.这些研究往往将颗粒物作为一个整体,并未对颗粒物进行粒径分级.
抗生素在天然水体中的浓度和天然水体中颗粒物的浓度很低,故以往鲜有对颗粒物粒径分级进行抗生素的吸附研究.但是,水体中小颗粒物(粒径<1 μm)的百分含量较高,加之其广大的比表面积,会不可避免地对水体中残留的抗生素进行大量吸附.而传统饮用水处理标准中没有针对小颗粒物去除效果的相关标准;与此同时,粒径越小,颗粒物越难以去除,其表面吸附的抗生素也会随之残留在水体,进而对饮用水安全产生潜在影响.研究抗生素从进入自然水体到处于平衡状态的过程中各种抗生素的固、液相分配,对水体中抗生素去除方法的研究具有指导意义.在此之前,小颗粒强大的吸附能力并未引起社会广泛关注;但其存在本身就意味着现有方式处理过的饮用水存在极大风险.因此,本文进行了天然水体颗粒物对四大类抗生素的吸附平衡实验,并分粒径测定了不同大小颗粒物上抗生素含量;同时研究了水体pH对吸附抗生素的影响.
2 材料与方法(Materials and methods) 2.1 仪器与材料超高效液相色谱-三重串联四级杆质谱联用仪(美国Agilent公司),VAC ELUT SPS 24固相萃取仪(美国Agilent公司),单模微波合成仪(屹尧科技,NOVA-2S),恒温振荡器(美国 CRYSTAL),SB 25-12DTDN超声波清洗仪(宁波新芝生物科技股份有限公司),N-EVAP氮吹仪(美国Organomation),OASIS HLB固相萃取柱(6 mL/500 mg,美国Waters),SAX阴离子交换小柱(3 mL/200 mg,美国Agilent),ZORBAX Eclipse C18 柱(3.5 μm,2.1 mm×100 mm,美国Agilent),滤膜(聚碳酸酯,1 μm,美国Whatman),切向流过滤仪(KrosFlo,含0.05 μm膜组件),pH测定仪(美国Hach).
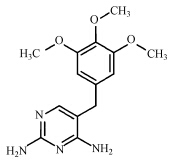
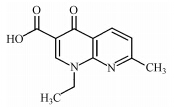
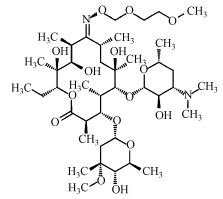
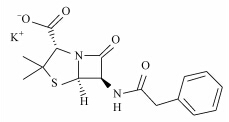
本文从七大类抗生素中挑选了四大类进行研究,包括青霉素类:青霉素G(Penicilline G potassium salt,PG),喹诺酮类:萘啶酸(Nalidixic acid,NAL),磺胺类:甲氧苄啶(Trimethoprim,TMP),大环内酯类:罗红霉素(Roxithromycin,ROX).其标准品均购自德国Dr.Ehrenstorfer、西玛通(100 μg · mL-1 in Methanol,美国 Accust and ard),Caffeine-13C3(100 μg · mL-1 in Methanol,剑桥同位素实验室),甲醇与乙腈(色谱纯,美国Fisher),乙二胺四乙酸二钠(优级纯,美国Sigma),醋酸与醋酸铵(CNW,上海安谱科学仪器有限公司).抗生素类药物在环境中的迁移转化等过程都与抗生素物质的物理化学性质相关,故将实验中4种抗生素的物理化学性质列表如下(胡伟,2011;Renner,2002;Schüürmann et al., 2006;Gramatica et al., 2007)
| 表 1 抗生素的理化性质 Table 1 Physical and chemical properties of antibiotics |
实验所用原水取自天津某饮用水厂饮用水源水,取回实验室后,用切向流过滤仪0.05 μm膜组件对原水中颗粒进行浓缩,之后加入到浓度为4 mol · L-1的NaOH溶液中60 ℃水浴4 h,取出后120 ℃条件下烘干3 h,以去除颗粒上吸附的其他有机污染物.用能谱仪和纳米粒度仪对处理前后的样品进行分析可知,其组成元素相似,各元素相对含量相差不大,故将处理后的颗粒样品稀释到原浓度进行实验.
2.3 反应时间对吸附效果的影响吸附试验参照OECD guideline 106批平衡方法进行.在恒温水浴槽中加入目标抗生素,浓度为1000 ng · L-1.25 ℃下避光恒温振荡(300 r · min-1),前1.5 h每隔10 min取样检测,1.5~7 h每隔30 min取样检测.每次取样500 mL,含抗生素500 ng.所取样品先经1 μm膜过滤,截留颗粒进行微波萃取以确定粒径>1 μm颗粒的吸附效果;滤过液随即用0.05 μm膜组件进行浓缩,0.05~1 μm颗粒样品加入甲醇溶解后用微波萃取仪处理,总投加量减去两次测得的颗粒物吸附量就是水相中的抗生素含量;滤过液用固相萃取进行前处理,所有样品最后由HPLC-MS/MS进行检测;实验均做3个重复.其中固相萃取条件如下:取500 mL样品,用稀硫酸调节其pH至3~4,之后加入0.2 g Na2EDTA 以螯合水样中的诸如Ca2+、Mg2+等二价离子,并用滤膜过滤,之后过SAX-HLB萃取系统.依次用5 mL甲醇、5 mL纯水活化固相萃取柱;洗脱液为8 mL甲醇与乙腈比例为1 ∶ 4的混合液;氮吹后用初始流动相定容至1 mL.后用高效液相色谱-质谱联用仪器(HPLC-MS/MS)对样品进行测定,固相萃取的加标回收率为93.51%~106.51%.
2.4 pH值对吸附效果的影响设置抗生素初始浓度为1000 ng · L-1,以5%盐酸溶液或1 mol · L-1NaOH溶液调整pH值为2、4、7、10、13.在上述方法基础上进行实验并测定平衡时溶液pH值.
2.5 色谱与质谱的测定条件ZORBAX Eclipse C18柱(3.5 μm,2.1 mm×100 mm,美国 Agilent);流动相中水相为0.3%甲酸,有机相为甲醇与乙腈比例为1 ∶ 1的混合溶液,梯度洗脱过程如下:0~1 min,10% 有机相;1~5.5 min,10%~80% 有机相;5.5~10 min,80%~100% 有机相;10~11.5 min,100% 有机相;11.5~15.5 min,100%~10% 有机相;15.5~18 min,10% 有机相.测定过程中Gas Flow 保持在9 L · min-1,柱温箱温度为30 ℃,进样量为10 μL,进样带洗针,流速为0.3 mL · min-1.
2.6 微波萃取条件微波萃取常用于土壤、沉积物中多环芳烃、农药残留的测定及重金属形态分析等方面样品的前处理(龚丽雯等,2006;谭晓燕等,2009).故颗粒物上吸附的抗生素也被尝试用微波萃取进行富集和浓缩,实验选用罗红霉素进行微波萃取条件的优化.选用了甲醇、甲醇 ∶ 乙腈=7 ∶ 3、甲醇 ∶ 乙腈=3 ∶ 7、乙腈4种洗脱液对样品进行洗脱.
实验结果显示,随着甲醇所占比例的降低,回收率也随之降低.在洗脱液为纯乙腈的条件下,抗生素浓度为0,此时回收率为0.在纯甲醇状态下,样品回收率为104%,但当甲醇 ∶ 乙腈=7 ∶ 3时回收率下降至78%,故选定纯甲醇作为最终洗脱液.之后,又对比了10 mL和20 mL洗脱液对实验结果的影响,发现20 mL时回收率更高,故选定20 mL作为洗脱液用量.在此基础上,进一步对萃取温度和时间进行优化.考虑到抗生素受热可能发生降解影响实验效果,故萃取温度最高选在100 ℃;在40、60、80、100 ℃ 4种温度条件下进行了优化.由于连续平衡吸附实验的取样间隔为10 min或30 min,故萃取时间选择了5、10、15、20、30 min 5个萃取时间;交叉实验结果见表 2.已有的实验表明,吸附平衡时,水相罗红霉素含量为60%左右(朱齐齐等,2014).表 2中,不同温度、不同萃取时间实验结果波动很大,但60 ℃条件,15、20、25 min的数值相近,且符合真实数值(400 ng左右).故最终温度选在60 ℃,萃取时间选在20 min.
| 表 2 萃取温度及时间优化实验 Table 2 The extraction antibiotics under different temperatures and time |
之后又对4种抗生素在此条件下进行了加标回收率实验,内标为C13,4种抗生素的微波萃取加标回收率为95%~102%,在可接受范围.最终,微波萃取的条件为:萃取剂为20 mL甲醇,萃取温度60 ℃,萃取时间20 min.萃取后将样品在10000 r · min-1条件下离心10 min,重复3次;后经氮吹仪浓缩,1 mL流动相(40%水相,60%有机相)溶解,0.22 μm有机膜过滤后装入进样瓶.
2.7 质量控制为控制实验过程中人为干扰,保证操作过程准确,以超纯水和超纯水中加入相同浓度抗生素作为空白对照.超纯水中未检测出抗生素,即实验过程中无人为污染.另外一个空白对照中抗生素回收率在93%~110%,说明实验过程中抗生素未降解.标准曲线的浓度梯度为0、5、10、50、100、500、1000 μg · L-1;其线性方程及检测限如表 3所示.
| 表 3 抗生素的标准曲线 Table 3 The calibration curve for the determination of antibiotics |
实验前先对原水、出水的粒径分布进行了测定,结果表明,两种水样中均含大量的小颗粒,特别是粒径<1 μm的颗粒,传统饮用水工艺对这些小颗粒的去除效果不明显;原水中小颗粒集中于1 μm以下,故实验选择1 μm作为小颗粒与大颗粒的分界.经多次测量,颗粒绝大多数分布在100 nm以上,有研究表明100 nm以下的颗粒不能稳定存在(梁伟杰等,2006),结合实验室条件,最终选择用0.05 μm膜组件来截留小颗粒.
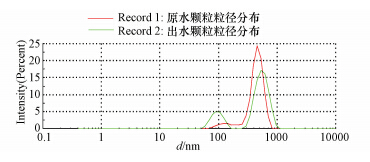 |
| 图 1 原水、出水颗粒粒径分布 Fig.1 particle size distribution of the raw water and the finished water |
由于在对原水的检测实验中发现多种抗生素被检出(朱齐齐等,2014),故在正式实验前先对原水颗粒进行了浓缩,以排除水中已溶解抗生素的干扰;并用NaOH溶液对浓缩后颗粒物进行了处理.为了印证处理前后颗粒物的元素组成未发生变化,对处理前后颗粒进行了能谱分析(表 4).对比发现,处理前后各元素组成的相对百分比只是出现了微小的浮动,并未导致颗粒元素组成及性质发生变化,可以用来代表原水水体颗粒物.
| 表 4 处理前后原水颗粒的元素组成 Table 4 Content of various elements in particulate matter before and after treatment |
粘土矿物是河流中颗粒物的主要矿物组成,据文献中的数据(汤鸿霄等,2000),滦河中伊利石、蒙脱石、高岭石的相对百分比分别为29%、59%、12%;这一数据易受流域气候条件的影响.实验中对粒径>0.05 μm、0.05~1 μm粒径区间的原水颗粒进行了扫描电镜和能谱分析,并设置了空白对照.结果发现,C、O元素的相对比例0.05~1 μm粒径区间要大于粒径d>0.05 μm,说明0.05~1 μm区间较粒径d>0.05 μm有机物含量增多,非有机物含量减少.同时,0.05~1 μm粒径区间内,Mg、P、Ca、K、Cl、Ni元素消失,只有Al、Si等常见元素.即粒径>1 μm主要是蒙脱石和伊利石为代表的粘土矿物;0.05~1 μm这一范围主要是一些有机物和以高岭石为代表的少量粘土矿物.
 |
| 图 2 不同粒径区间颗粒元素分布 Fig.2 the elemental composition of particle with different size |
诸多关于污染物与沉积物之间的相互作用表明,吸附和解吸附通常由两个阶段组成.实验证实,天然水体颗粒也不例外.但由于抗生素本身性质的不同,其具体吸附过程又有所不同.
甲氧苄啶所属的磺胺类抗生素与萘啶酸所属的喹诺酮类抗生素因相对分子质量较低,官能团较少,性质相似,故甲氧苄啶与萘啶酸具有相似的吸附曲线.在反应的前100 min里,吸附与解吸附同时发生,且速度较快.粒径0.05~1 μm颗粒在100 min完成了快速吸附,在100~300 min达到了吸附解析平衡,随着反应时间的增长,在300~360 min之间慢吸附过程发生主导作用,使吸附量二度增加.360~420 min内达到了动态平衡.粒径>1 μm颗粒与粒径0.05~1 μm颗粒吸附过程并不相同,其在反应开始时就迅速完成了快速吸附过程.20~120 min时间段内,吸附与解吸附交替领先,实现了短期的动态平衡;120 min过后,0.05~1 μm颗粒完成了快速吸附并达到平衡,而大颗粒吸附量快速增加,至240 min第二阶段吸附结束,240~420 min达到饱和.之后小颗粒的吸附量明显高于大颗粒的吸附量.
罗红霉素分子量较大,表面官能团较多,在天然水体中,呈现正离子状态,而此时由于体系中pH大于其等电位点,硅铝酸盐带负电.二者电性相反,阳离子交换作用增强,使得实验过程中罗红霉素的吸附量一直增加.前150 min解吸附过程明显,150~300 min快速吸附至300 min达到平衡.而大颗粒吸附量则一直在增加,至360 min平衡,且与小颗粒吸附量相当.
青霉素G与其他几大类抗生素不同,小颗粒吸附量小于大颗粒.且小颗粒吸附过程速度缓慢,大颗粒吸附亦分两个阶段进行,第一阶段吸附及解吸附过程都很明显,210 min开始吸附速度陡升,至360 min达到平衡,平衡时吸附量远高于小颗粒.
四种抗生素经过不停的吸附解吸过程,均能在360 min达到动态平衡,平衡时固相百分比均在32%~44%之间,实验证实,在天然水体中,虽然颗粒物百分含量较小,但却拥有极强的吸附能力.在自然条件下,残留在水体的抗生素有相当一部分被吸附在颗粒物上.而对于颗粒物而言,粒径越小,其重量百分比越小,但其吸附抗生素的能力却越强,有超过一半的被粒径<1 μm的小颗粒吸附,这些颗粒在饮用水处理中,很难得到有效去除,这也使饮用水安全存在着一定的安全隐患.
| 表 5 吸附平衡时固相水相配比 Table 5 he distribution of antibiotics in solid and liquid phases under adsorption equilibrium |
| 表 6 不同粒径吸附百分比 Table 6 Adsorption percentage of antibiotics by different size particles |
实验发现,pH是影响水体颗粒吸附抗生素的重要原因.甲氧苄啶的pKa为17.33和7.16,0.05~1 μm颗粒吸附能力最大值出现在7左右,粒径d>1 μm颗粒的吸附最大值出现在5左右,在7.16<pH<17.33时,甲氧苄啶以阳离子、阴离子与分子形式存在,整体呈现中性状态,故颗粒总吸附量最大值出现在pH=7处;最小值出现在pH=2处.在7<pH<13区间,随着pH增大吸附量虽有下降趋势,但整体上还是大于pH=2时的吸附量.且除了pH=4外,0.05~1 μm粒径颗粒吸附量明显大于粒径d>1 μm颗粒的吸附量,这也再次印证了小颗粒强大的吸附能力.
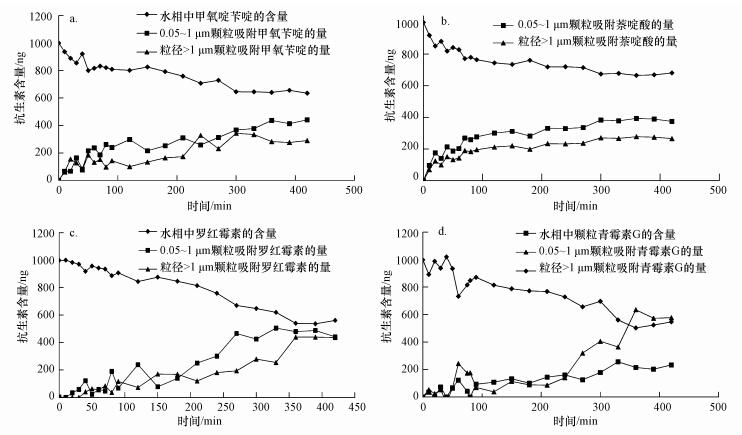 |
| 图 3 四种抗生素吸附曲线(a.甲氧苄啶,b. 萘啶酸,c. 罗红霉素,d. 青霉素G,注:各个数据点为多次平行实验的平均值,相对标准偏差(RSD)在1.21%~3.74%之间) Fig.3 Adsorption curve of four kinds of antibiotics(a. Trimethoprim,b. Nalidixic acid,c. Roxithromycin,d. Penicilline G potassium salt) |
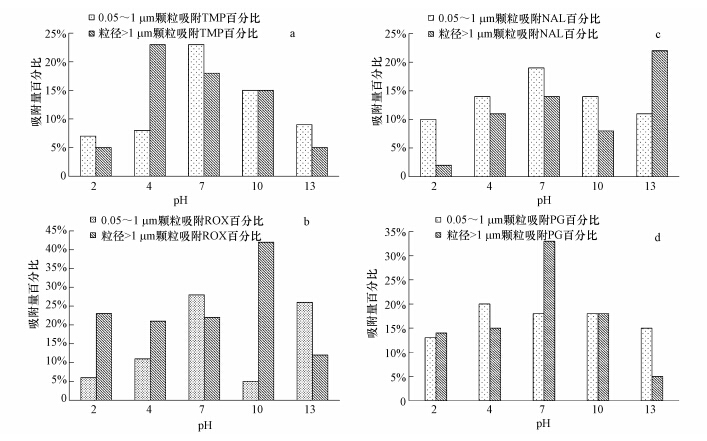 |
| 图 4 pH对不同抗生素吸附量影响(a. 甲氧苄啶吸,b. 萘啶酸,c.罗红霉素,d. 青霉素G,注:各个数据点为多次平行实验的平均值,相对标准偏差(RSD)在1.03%~4.62%之间) Fig.4 Effect of pH on the adsorption capacity of different antibiotics (a. Trimethoprim, b. Nalidixic acid, c. Roxithromycin, d. Penicilline G potassium salt) |
萘啶酸和罗红霉素的吸附结果与甲氧苄啶相似,pH=7时,总吸附量和0.05~1 μm粒径颗粒吸附量达到最大;粒径d>1 μm颗粒吸附量最大值,萘啶酸出现在pH为13处,罗红霉素出现在pH=10处.萘啶酸除了pH为13外,0.05~1 μm粒径颗粒吸附量明显大于粒径d>1 μm颗粒的吸附量;而罗红霉素只有pH=7和pH=13时才出现.0.05~1 μm粒径颗粒和粒径d>1 μm颗粒对青霉素G的吸附结果一致,最大吸附量亦出现在pH=7处,且0.05~1 μm粒径颗粒的吸附量较稳定,pH对其影响不大.
不难发现,虽然pH对4种抗生素吸附量影响不尽相同,粒径d>1 μm颗粒吸附量随pH变化波动很大,峰值出现在酸性或碱性条件下;0.05~1 μm粒径颗粒的吸附量随pH有规律的变化,峰值出现在中性条件下.但是固相吸附量最大值均出现在pH=7处,绝大多数情况下0.05~1 μm粒径颗粒的吸附量大于粒径d>1 μm颗粒.在饮用水处理工艺中,pH不会有太大的浮动,均维持在中性条件,此条件,虽不尽是不同粒径颗粒物吸附能力的峰值,但小颗粒物的吸附量却很高,若不能有效将其去除,其表面携带的抗生素及其他污染物将长期残留,进而对人畜健康带来巨大危害.
4 结论(Conclusions)1)连续平衡实验在360 min达到平衡,平衡时抗生素在水相与固相分布百分比相当,固相中0.05~1 μm小颗粒与粒径d>1 μm的大颗粒吸附百分比亦相当,有超过一半的抗生素吸附在小颗粒物上.
2)pH是影响水体颗粒吸附抗生素的重要原因,固相和0.05~1 μm小颗粒吸附能力最大值均出现在中性条件下,这对饮用水安全构成了潜在威胁.
| [1] | Derk sen J G M, Rijs G B J, Jongbloed R H. 2004. Diffuse pollution of surface water by pharmaceutical products [J]. Water Science & Technology, 49(3): 213-221 |
| [2] | Figueroa R A, Leonard A, MacKay A A. 2003. Modeling tetracycline antibiotic sorption to clays[J]. Environmental Science & Technology, 38(2): 476-483 |
| [3] | 龚丽雯, 王成云, 李京会. 2006. 微波萃取/HPLC法测定污泥中的烷基酚类物质[J]. 中国给水排水, 22(24): 84-87 |
| [4] | Gramatica P, Giani E, Papa E. 2007. Statistical external validation and consensus modeling: A QSPR case study for Koc prediction [J]. Journal of Molecular Graphics Modelling, 25(6): 755-766 |
| [5] | Gu C, Karthikeyan K G. 2005a. Interaction of tetracycline with aluminum and iron hydrous oxides [J]. Environmental Science & Technology, 39(8): 2660-2667 |
| [6] | Gu C, Karthikeyan K G. 2005b. Sorption of the antimicrobial ciprofloxacin to aluminum and iron hydrous oxides[J]. Environmental Science & Technology, 39(23): 9166-9173 |
| [7] | Heberer T. 2002a. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data[J]. Toxicology Letters, 131(1/2): 5-17 |
| [8] | Heberer T. 2002b. Tracking persistent pharmaceutical residues from municipal sewage to drinking water [J]. Journal of Hydrology, 266(3/4): 175-189 |
| [9] | 胡伟. 2011. 天津城市水、土环境中典型药物与个人护理品(PPCPs)分布及其复合雌激素效应研究[D]. 天津: 南开大学 |
| [10] | Kasprzyk-Hordern B, Dinsdale R M, Guwy A J. 2008. The occurrence of pharmaceuticals, personal care products, endocrine disruptors and illicit drugs in surface water in South Wales, UK [J]. Water Research, 42(13): 3498-3518 |
| [11] | LeBoeuf E J, Weber W J Jr. 1997. A distributed reactivity model for sorption by soils and sediments. 8. Sorbent organic domains: Discovery of a humic acid glass transition and an argument for a polymer-based model[J]. Environmental Science & Technology, 31(6): 1697-1702 |
| [12] | 梁伟杰, 周勤, 孙伟, 等. 2006. 给水原水中纳米级颗粒物的存在研究[J]. 环境化学, 25(1): 106-107 |
| [13] | MacKay A A, Seremet D E. 2008. Probe compounds to quantify cation exchange and complexation interactions of ciprofloxacin with soils [J]. Environmental Science & Technology, 42(22): 8270-8276 |
| [14] | Nowara A, Burhenne J, Spiteller M. 1997. Binding of fluoroquinolone carboxylic acid derivatives to clay minerals [J]. Journal of Agricultural and Food Chemistry, 45(4): 1459-1463 |
| [15] | Pignatello J J, Xing B S. 1995. Mechanisms of slow sorption of organic chemicals to natural particles[J]. Environmental Science & Technology, 30(1): 1-11 |
| [16] | Reemtsma T, Weiss S, Mueller J, et al. 2006. Polar pollutants entry into the water cycle by municipal wastewater: a European perspective [J]. Environmental Science & Technology, 40(17): 5451-5458 |
| [17] | Renner R. 2002. The Kow controversy [J]. Environmental Science & Technology, 36(21): 410A-413A |
| [18] | Schüürmann G, Bert R -U, Kühne R. 2006. Prediction of the sorption of organic compounds into soil organic matter from molecular structure [J]. Environmental Science & Technology, 40(22): 7005-7011 |
| [19] | Stackelberg P E, Gibs J, Furlong E T, et al. 2007. Efficiency of conventional drinking-water-treatment processes in removal of pharmaceuticals and other organic compounds [J]. Science of the Total Environment, 377(2/3): 255-272 |
| [20] | 谭晓燕, 黎国兰, 李松, 等. 2009. 水中痕量苯酚的微波萃取气相色谱分析[J]. 化学研究与应用, 21(7): 1067-1069 |
| [21] | 汤鸿霄, 钱易, 文湘华. 2000. 水体颗粒物和难降解有机物的特性与控制技术原理上卷 水体颗粒物[M]. 北京: 中国环境科学出版社. 23-30 |
| [22] | Weber W J, Huang W L. 1996. A distributed reactivity model for sorption by soils and sediments. 4. Intraparticle heterogeneity and phase-distribution relationships under non equilibrium conditions[J]. Environmental Science & Technology, 30(3): 881-888 |
| [23] | Westerhoff P, Yoon Y, Snyder S, et al. 2005. Fate of endocrine-disruptor, pharmaceutical, and personal care product chemicals during simulated drinking water treatment processes[J]. Environmental Science & Technology, 39(17): 6649-6663 |
| [24] | 徐维海, 张干, 邹世春, 等. 2007. 典型抗生素类药物在城市污水处理厂中的含量水平及其行为特征[J]. 环境科学, 28(8): 1779-1783 |
| [25] | 杨艳玲, 李星, 李圭白. 2007. 水中颗粒物的检测及应用[M]. 北京: 化学工业出版社. 1-5 |
| [26] | 姚宏, 王辉, 苏佳亮, 等. 2013. 某饮用水处理厂中5种抗生素的去除[J]. 环境工程学报, 7(3): 801-809 |
| [27] | 叶计朋, 邹世春, 张干, 等. 2007. 典型抗生素类药物在珠江三角洲水体中的污染特征[J]. 生态环境, 16(2): 384-388 |
| [28] | Yu J T, Bouwer EJ, Coelhan M. 2006. Occurrence and biodegradability studies of selected pharmaceuticals and personal care products in sewage effuent[J]. Agricultural Water Manage, 86:72-80 |
| [29] | Zhang H C, Huang C H. 2007. Adsorption and oxidation of fluoroquinolone antibacterial agents and structurally related amines with goethite[J]. Chemosphere, 66(8): 1502-1512 |
| [30] | 周启星, 罗义, 王美娥. 2007. 抗生素的环境残留、生态毒性及抗性基因污染[J]. 生态毒理学报, 2(3): 243-251 |
| [31] | 朱齐齐, 赵鹏, 张宏伟, 等. 2014. 天然水体中颗粒物吸附抗生素特征分析[J]. 环境科学学报, 34(5): 1150-1156 |
 2015, Vol. 35
2015, Vol. 35