水稻是我国主要的粮食作物,稻米是我国65%以上人口的主食,我国现有水稻种植面积3140万hm2,生产的稻谷约占全国粮食总产量40%,水稻安全对我国粮食安全具有举足轻重的作用(蔡洪法,2000).近年来,由于灌溉中砷污染水的大量使用,导致砷污染水稻田大面积出现(Zhu et al.,2008).根据近期国土资源部和环保部联合颁布的《全国土壤污染状况调查报告》,全国耕地土壤总超标率为19.4%,其中大部分为重金属污染,砷是耕地污染最严重3种重金属之一,超标率为2.7%.稻田砷污染使得以稻米为主食的居民健康受到严重威胁(Islam et al.,2004; Stroud et al.,2011).研究结果表明,中国人日常砷摄取量约为42 μg · d-1,而来自大米的砷,占总砷日摄入量的60%(Li et al.,2011).
水稻作为典型的淹水植物,具有发达的通气组织,可将大气中的氧高效率的运输到根部,从而使根表处于相对氧化状态(Liu et al.,2001).土壤中存在的还原性金属离子(如Fe2+和Mn2+等)被根系分泌O2等氧化,并沉积在水稻根表形成铁膜(Jiang et al.,2009).水稻根表铁膜的扩展X-射线吸收光谱(EXAFS)和精细结构X射线能谱(XANES)表明,铁膜主要成分为水铁矿(Ferrihydrite),并含有少量针铁矿和赤铁矿等晶体(陈学萍等,2008).砷在其中以As(Ⅲ)和As(Ⅴ)为主,含量相当(Liu et al.,2006).水稻根表铁膜对砷的吸附固定能力,可减少植物根系对砷的吸收,是水稻抵抗环境中重金属毒害的重要抗性机制(何春娥等,2004).
水稻根表铁膜对养分的富集、吸收和重金属污染的控制问题,已经有了较多的研究.但是,在水稻收获之后,吸附有大量砷的水稻根系留在土壤中.这些被铁膜固定的砷的环境行为尚缺乏清楚认识.铁还原微生物是重要的控制淹水环境中铁氧化物还原的功能环境微生物.异化铁还原菌能够将有机物的氧化与铁的化合物相偶联并能够从反应中获得能量,例如属于变形菌门的希瓦氏菌(Shewanella)可以通过细胞色素在细胞膜上将Fe(Ⅲ)氧化物和电子传递系统联系起来从而还原不可溶的Fe(Ⅲ)氧化物(Myers and Myers,1997).以前报道主要集中在来自水稻土的具有铁还原能力的富集菌群对水稻根表铁膜的还原作用,但是缺乏纯菌对根表铁膜中砷释放的研究
本实验以水稻根表铁膜和含砷或磷的水铁矿为实验材料,研究Shewanella oneidensis MR-1对铁膜中铁的还原过程,进一步采用铁膜的主要成分水铁矿为材料,研究铁还原菌对铁氧化物的还原及砷的释放,以阐明微生物对水稻根表铁膜中砷的释放和再固定的影响.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 水稻根表铁膜本实验采用的水稻根采自湖南祁阳砷污染稻田.将水稻根用去离子水洗净后放入60 ℃烘箱烘干至恒重.水稻根系上的铁膜用dithionite-citrate-bicarbonate(DCB)的方法浸提,此方法是在Taylor and Crowder(1983)和Otte et al.,(1991)基础上改进的,具体操作如下:取0.3 g根,浸泡在0.03 mol · L-1柠檬酸三钠(Na3C6H5O7 · 2H2O)和0.125 mol · L-1碳酸氢钠(NaHCO3)的30 mL混合溶液中5 min,再加入0.5 g 保险粉(Na2S2O4)继续浸泡1 h,使根表铁膜全部溶解,最后用超纯水清洗水稻根数次,放入60 ℃烘箱烘干,得到无铁膜的水稻根(浸提根).将浸提根和有铁膜的原根分别剪成约1 cm长的小段,分别混合均匀并灭菌后待用.
2.1.2 含砷磷水铁矿制备水铁矿根据Schwertmann和Cornell(2000)报道的方法制备.具体方法如下:将1 mol · L-1氢氧化钠(NaOH)逐滴加入到1 L 0.4 mol · L-1三氯化铁(FeCl3)溶液中,直至pH到7.0,离心(8000 g,10 min)得到沉淀,然后用10倍体积去离子水洗涤至少5次,去除盐离子.取最后一次洗涤液,用0.1 mol · L-1硝酸银(AgNO3)溶液检测无白色沉淀,说明洗涤充分,得到水铁矿Fcr.将制得的水铁矿放入60 ℃烘箱中烘干,研磨后过200目筛备用.
称取3份14.1 g水铁矿粉末分别加入600 mL 5 mmol · L-1砷酸钠(Na3AsO4)溶液、5 mmol · L-1 磷酸二氢钠(NaH2PO4)溶液和5 mmol · L-1砷酸钠、磷酸二氢钠混合溶液中,使用稀盐酸或氢氧化钠调节pH到7.0.充分摇匀后,置于30 ℃,100 r · min-1摇床中1 d.将吸附有砷、磷的水铁矿离心(8000 g,10 min)弃去上清液,得到含砷水铁矿FAs,含磷水铁矿FP,同时含砷磷水铁矿FAs+P.将3种水铁矿放入60 ℃烘箱中烘干,过200目筛待用.水铁矿中砷、磷与铁比例如表 1所示.
| 表 1 水铁矿Fcr、含砷水铁矿FAs、含磷水铁矿FP和含砷磷水铁矿FAs+P中砷与磷的含量 Table 1 Percentages of As and P in four kinds of ferrihydrite |
向含有100 mL培养基(20 mmol · L-1乙酸钠,30 mmol · L-1 NaHCO3,28 mmol · L-1 NH4Cl,1.34 mmol · L-1 KCl,30 mmol · L-1 NaCl,4.29 mmol · L-1 NaH2PO4,10 μmol · L-1 NaNTA,1 μmol · L-1 Na2SeO4,Kieft的矿质元素培养基和维生素培养基,使用稀盐酸或氢氧化钠调节pH到7.0)的160 mL血清瓶中分别加入2 g水稻原根和浸提根.血清瓶121 ℃,30 min灭菌,充N2,30 min,以除去氧气.取冻存于-80 ℃的Shewanella oneidensis MR-1菌种接种10%到新鲜培养基中于30 ℃活化12 h左右,然后向血清瓶中接种处于生长对数期的Shewanella oneidensis MR-1,细胞密度达到3×109 cells · mL-1,放入30 ℃生化培养箱中.各处理设置3个重复,并设置不接菌的对照实验.测定培养360 h过程中溶液中的Fe(Ⅱ)含量,120 h内溶液中的总砷含量以及水稻原根处理体系中砷的形态.
2.3 水铁矿还原实验分别向160 mL血清瓶中加入100 mL除去NaH2PO4的碳酸氢钠缓冲液培养基,和10 mmol · L-1水铁矿Fcr、水铁矿FAs、水铁矿FP和水铁矿FAs+P.血清瓶121 ℃,30 min灭菌,充N2,30 min,以除去氧气.然后接种处于生长对数期的Shewanella oneidensis MR-1,细胞密度达到3×109 cells · mL-1,放入30 ℃生化培养箱中.各处理设置3个重复.测定360 h之内溶液中Fe(Ⅱ)含量和120 h内溶液中的总砷含量.反应结束后,从溶液中收集矿物,并在厌氧条件下干燥,将干燥的固体涂抹到玻璃载物片上,采用X射线衍射(D/max2500 Diffractometer with CuKa radiation,日本)进行XRD分析.
2.4 菌吸附As实验在160 mL血清瓶中分别加入100 mL含有150 μmol · L-1和1500 μmol · L-1砷酸钠(Na3AsO4)的碳酸氢钠缓冲液培养基,121 ℃,30 min灭菌,充N2 30 min,以除去氧气.向血清瓶中接种处于生长对数期的Shewanella oneidensis MR-1,细胞密度达到3×109 cells · mL-1,放入30 ℃生化培养箱中.各处理设置3个重复,并设置不接菌的空白对照.对实验72 h内溶液中的砷含量进行测定.
2.5 元素含量及形态分析二价铁的测定采用1,10-邻菲罗啉显色,于530 nm下比色法测定(Weber et al.,2001).在测定之前,每次用无菌注射器抽取混合溶液0.5 mL,立即加入0.5 mL 0.75 mol · L-1 HCl酸化5 min,过0.45 μm 滤膜.
采用电感耦合等离子体发射光谱仪(ICP-OES)测定反应体系中砷的浓度.采用高效液相色谱-电感耦合等离子体质谱联用(HPLC-ICP-MS)(Agilent 7500a,美国安捷伦公司)测定砷形态(Williams et al.,2006).在测定前,每次用无菌注射器抽取混合液1 mL,离心(8000 g,10 min)取上清液,过0.45 μm 滤膜后测定.其中分析色谱柱购于美国Hamilton公司,包括保护柱(11.2 mm,12~20 mm)和PRP-X100阴离子交换柱(250 mm×4.1 mm,10 μm).流动相为10 mmol · L-1磷酸氢二铵((NH4)2HPO4)和10 mmol · L-1的硝酸铵(NH4NO3),用硝酸或氨水调节pH到6.2,过0.45 μm 滤膜,流动相速度为1.0 mL · min-1.
3 结果(Results) 3.1 Shewanella oneidensis MR-1对水稻根表铁膜还原在浸提根和原根不接菌的空白处理中,溶液内检测到少量Fe(Ⅱ),含量小于0.5 mmol · L-1.接种S. oneidensis MR-1后,水稻浸提根和原根在溶液中的Fe(Ⅱ)含量随时间增加,且在接种360 h时,含有铁膜的原根被还原后溶液中产生的Fe(Ⅱ)含量大约是还原浸提根的6倍(图 1).水稻根系细胞的破裂或者接种铁还原菌对水稻根表铁膜的还原,能够造成溶液中Fe(Ⅱ)浓度的升高,并且铁还原菌的添加有效促进了铁膜中铁的溶出.
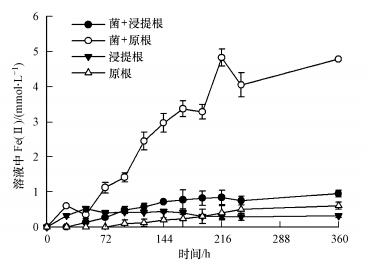 |
| 图 1 Shewanella oneidensis MR-1还原水稻原根和浸提根过程溶液中的Fe(Ⅱ)随时间变化 Fig.1 Production of Fe(Ⅱ)in a solution of paddy roots digested by leach liquor and paddy roots with iron plaques during reduction by Shewanella oneidensis MR-1 |
未接种菌的浸提根和原根溶液中检测到微量砷,且含量在整个实验期间(120 h)内无明显变化(图 2).对于接种S. oneidensis MR-1的体系,12 h内,浸提根和原根溶液中砷含量都有缓慢上升趋势,12 h后,只有含铁膜体系中砷含量继续大幅度上升,到48 h溶液中的砷含量达到最大值18 μmol · L-1,之后砷含量逐渐下降,在120 h下降了最大值的约60%.
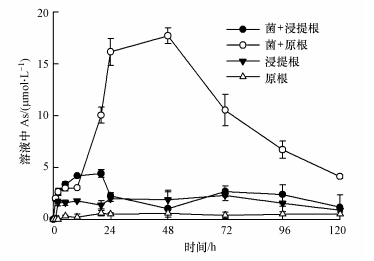 |
| 图 2 Shewanella oneidensis MR-1还原水稻原根和浸提根溶液中的总砷含量随时间变化曲线 Fig.2 Concentrations of total As in a solution of paddy roots with and without iron plaques inoculated with Shewanella oneidensis MR-1 |
水稻原根铁膜被S. oneidensis MR-1菌还原过程中,在溶液中同时检测到As(Ⅲ)和As(Ⅴ)的存在,且含量总体趋势均是先增加后减少(图 3).接种120 h之后,检测到As(Ⅲ)含量与最大值相比下降了约50%,而As(Ⅴ)含量则同比下降了约90%,溶液中As(Ⅴ)下降比例显著大于As(Ⅲ).
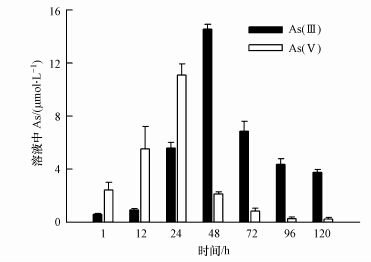 |
| 图 3 Shewanella oneidensis MR-1还原水稻原根过程中溶液中的三价砷和五价砷含量随时间变化曲线 Fig.3 Concentrations of As(Ⅲ) and As(Ⅴ)in solution of paddy roots with iron plaques during reduction by Shewanella oneidensis MR-1 |
由图 4可知,水铁矿中的Fe(Ⅲ)被S. oneidensis MR-1还原成Fe(Ⅱ)并快速释放到溶液中,且水铁矿Fcr被还原生成Fe(Ⅱ)含量明显高于含有砷和磷的水铁矿FAs、水铁矿FP和水铁矿FAs+P.4 d之后,水铁矿Fcr处理溶液中的Fe(Ⅱ)含量达到最大值1.4 mmol · L-1,之后趋于平衡.含有砷和磷的水铁矿溶液中,由于Fe(Ⅱ)与可能析出的砷和磷结合生成沉淀或二次吸附到水铁矿上进而造成溶液中Fe(Ⅱ)含量轻微下降.
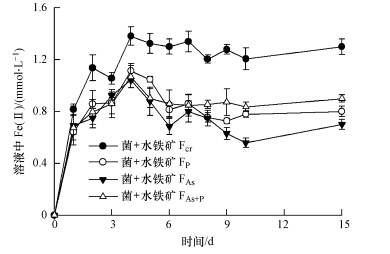 |
| 图 4 Shewanella oneidensis MR-1还原水铁矿Fcr、水铁矿FAs、水铁矿FP和水铁矿FAs+P溶液中的二价铁含量随时间变化曲线 Fig.4 Production of Fe(Ⅱ)in ferrihydrite suspensions during reduction by Shewanella oneidensis MR-1 |
对比水铁矿FAs+P和水铁矿FAs两个处理在砷释放的差异,可知溶液中的砷含量水铁矿FAs+P >水铁矿FAs(图 5).接种3 d后,水铁矿FAs+P处理中的砷含量大约是水铁矿FAs处理的4倍.3 d后,水铁矿FAs+P处理的砷含量明显下降.结果表明,在铁还原菌还原含砷水铁矿过程中,磷的添加对砷的释放起到促进作用.
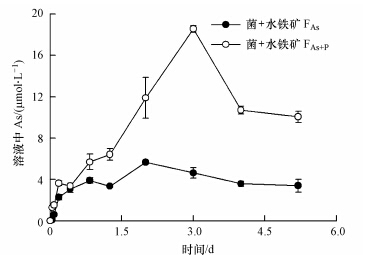 |
| 图 5 Shewanella oneidensis MR-1还原水铁矿FAs和水铁矿FAs+P溶液中的砷含量随时间变化曲线 Fig.5 Concentrations of total As in ferrihydrite suspensions during reduction by Shewanella oneidensis MR-1 |
S. oneidensis MR-1没有对水铁矿FAs+P的晶形造成影响.接种15 d之后水铁矿FAs+P(图 6b)和未接菌的空白对照水铁矿FAs+P(图 6a)的XRD图并无明显差异,均无明显波峰.说明并无新晶形矿物产生.
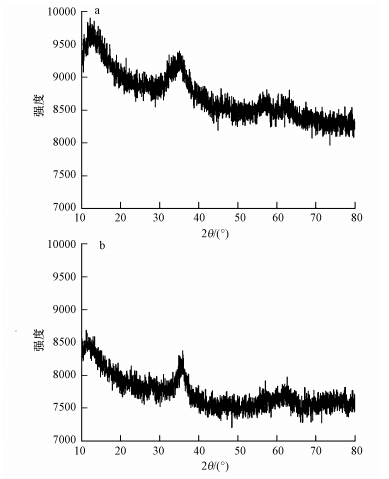 |
| 图 6 水铁矿FAs+P还原反应前(a)和还原反应15 d后(b)的XRD图 Fig.6 XRD of ferrihydrite F4 before(a) and after 15 days reduction(b) |
在不同浓度As(Ⅴ)处理下,溶液中的砷都有较明显的下降,显示了S. oneidensis MR-1对溶液中的砷有较明显的吸附能力.在150 μmol · L-1 As溶液中接种菌72 h后,砷含量减少了约4 μmol(图 7a).在1500 μmol · L-1 As溶液中接种菌24 h时,砷含量减少了大约20 μmol,但是24 h之后,溶液中砷含量又再次增加(图 7b).
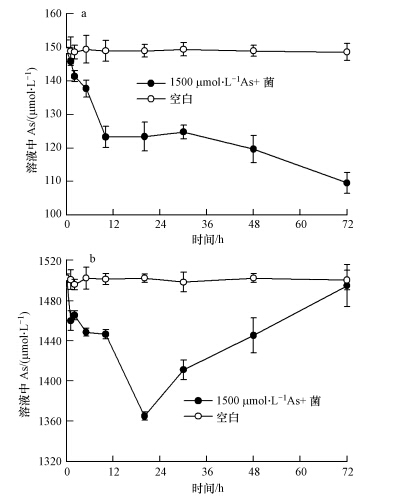 |
| 图 7 分别在含150 μmol · L-1 As(a) and 1500 μmol · L-1 As(b)培养基中接种Shewanella oneidensis MR-1后溶液中的砷含量随时间变化曲线 Fig.7 Concentrations of total As in bacterial cultures of Shewanella oneidensis MR-1 with 150 μmol · L-1 As(a) and 1500 μmol · L-1 As(b) |
近年来,有关水稻田砷污染的报道逐渐引起人们的广泛关注,而砷污染土壤的治理首先要基于土壤中砷的生物有效性的研究.本文以铁膜和铁膜的主要组成部分水铁矿为试验材料,对生物还原以及其对砷生物有效性的影响进行探究.
在含有铁膜的水铁矿原根还原实验0~48 h中,我们发现溶液中的Fe(Ⅱ)和总砷之间存在正相关关系(图 1和图 2).结果证实了砷的释放与铁的还原相关,即砷的移动是由铁的还原和溶解造成的(Berg et al.,2001; Horneman et al.,2004; Wang et al.,2009).而且实验过程中,不接菌的对照处理中也发现了铁膜的还原,这可能是因为根的腐解可以释放有机酸,而这些有机酸可以将铁溶解并且还原(Ratering and Schnell,2000).在铁膜还原实验48 h后,发现溶液中的Fe(Ⅱ)和总砷之间存在负相关关系(图 1和图 2),而且As(Ⅴ)含量的减少量大于As(Ⅲ)的减少量(图 3).由于铁膜中的Fe(Ⅲ)氧化物成分复杂,且S. oneidensis MR-1不具有还原As(Ⅴ)的能力,所以为了弄清楚砷减少的原因,设计实验S. oneidensis MR-1还原人工合成的水铁矿(水稻根表铁膜中的主要成分),模拟简化S. oneidensis MR-1 还原水稻根表铁膜过程.因为磷也是铁膜中含有的一种重要元素,有些研究报道认为铁膜中的磷是植物吸收的重要磷源,同时磷可能还参与了铁膜的形成(Geng et al.,2005; Liu et al.,2006; Guo et al.,2007).所以实验前水铁矿做不同的砷、磷吸附处理,借此研究水铁矿被还原过程中磷对砷释放的影响.
水铁矿还原实验的结果中,砷的运移变化与铁膜还原实验保持一致(图 4和图 5).但是添加磷元素后,促进了水铁矿中砷的释放.这是因为磷元素为细菌生长提供了必需营养,同时有研究表明磷能够促进S. putrefaciens stain CN32还原纤铁矿的能力,总Fe(Ⅱ)的生成量大于不加磷处理(O′Loughlin et al.,2013).因此可以认为磷元素促进了S. oneidensis MR-1 还原水铁矿,进而促进了水铁矿中砷的释放.
不论是在铁膜还原实验还是水铁矿还原实验中,溶液中的总砷含量都是先升高后下降(图 2和图 5).之前研究认为长时间的还原可以导致铁矿物晶形的转变,进而促使砷固定在铁矿中(Appelo et al.,2002; Tufano and Fendorf,2008; Wang et al.,2009).同时在添加磷处理的纤铁矿被S. putrefaciens stain CN32还原30 d后产生了绿铁矿(O′Loughlin et al.,2013).但在本研究中,接菌15 d后的水铁矿的XRD图与接种前的无明显差异,未得到晶形矿物的产生的证据(图 6).此结果表明虽然加入砷磷处理的水铁矿被还原后溶液中产生的Fe(Ⅱ)含量在4 d后有轻微降低(图 4),但是Fe(Ⅱ)含量过低且还原时间较短导致大部分铁矿物依然保持无定形态.也有同样的研究结果认为S. oneidensis MR-1还原含砷水铁矿会导致水铁矿二次吸附溶液中的砷,但不会产生新的晶形矿物(Jiang et al.,2013).于是猜测微生物自身的固定作用可能会对溶液中砷的含量造成影响.
细菌对环境中的重金属具有一定的固定作用,主要分为胞外吸附作用和胞内吸收作用.细菌因为代谢活动旺盛和表面活性强,自身可以通过细胞壁对重金属比如砷进行胞外吸附再转移到细胞内吸收积累(孙嘉龙等,2007).但是,由于很难将水稻根表铁膜还原体系和水铁矿还原体系中的细菌分离出来单独测定菌固定的砷含量,为了更进一步解释溶液中释放的砷降低这一结果,本文设计了在150 μmol · L-1和1500 μmol · L-1的As(Ⅴ)溶液中接入相同量的S. oneidensis MR-1实验.结果表明在150 μmol · L-1的砷溶液中,72 h后,细菌吸收了大约4 μmol的砷(图 7a).而在铁膜还原实验中,72 h后砷含量减少了约1.5 μmol(图 2);在水铁矿还原实验中,4 d后砷含量减少了约0.8 μmol(图 5),结果表明在还原铁膜和水铁矿过程中,菌对砷的吸附和吸收作用对溶液中砷的减少起到了重要作用.而在1500 μmol · L-1的砷溶液中,菌先吸收了大约20 μmol砷,之后溶液中的砷含量又恢复到最初水平.结果说明细菌胞内积累砷的能力有限,当菌吸收的砷达到一定浓度时,为保证自身正常生长,细菌的解毒机制启动将吸收的砷又再次外排到溶液中(王利红等,2009).在过去的研究中认为 S. oneidensis MR-1在厌氧条件下无法将溶液中As(Ⅴ)还原成As(Ⅲ)(Jiang et al.,2013),因此S. oneidensis MR-1对砷的解毒机制有待实验进一步研究.
5 结论(Conclusions)1)铁还原菌还原铁膜可以有效促进铁膜中砷的释放.由于微生物的固定作用,溶液中的砷含量会逐渐降低.
2)铁还原菌还原不同浓度砷磷吸附处理的水铁矿,发现添加磷处理会显著增加砷的释放.由于微生物的固定作用,溶液中的砷含量会逐渐降低,达到砷二次固定的作用.
| [1] | Appe lo C A J, Van Der Weiden M J J, Tournassat C, et al. 2002. Surface complexation of ferrous iron and carbonate on ferrihydrite and the mobilization of arsenic [J]. Environmental Science & Technology, 36(14): 3096-3103 |
| [2] | Berg M, Tran H C, Nguyen T C, et al. 2001. Arsenic contamination of groundwater and drinking water in Vietnam: a human health threat [J]. Environmental Science & Technology, 35(13): 2621-2626 |
| [3] | 蔡洪法. 2000. 我国水稻生产现状与发展展望 [J]. 中国稻米, (6): 5-8 |
| [4] | 陈学萍, 朱永官, 洪米娜, 等. 2008. 不同施肥处理对水稻根表铁和砷形态的影响 [J]. 环境化学, 27(2): 231-234 |
| [5] | Geng C N, Zhu Y G, Liu W J, et al. 2005. Arsenate uptake and translocation in seedlings of two genotypes of rice is affected by external phosphate concentrations [J]. Aquatic Botany, 83(4): 321-331 |
| [6] | Guo W, Zhu Y G, Liu W J, et al. 2007. Is the effect of silicon on rice uptake of arsenate (AsV) related to internal silicon concentrations, iron plaque and phosphate nutrition? [J]. Environmental Pollution, 148(1): 251-257 |
| [7] | 何春娥, 刘学军, 张福锁. 2004. 植物根表铁膜的形成及其营养与生态环境效应 [J]. 应用生态学报, 15(6): 1069-1073 |
| [8] | Horneman A, Van Geen A, Kent D V, et al. 2004. Decoupling of As and Fe release to Bangladesh groundwater under reducing conditions. Part I: Evidence from sediment profiles [J]. Geochimica et Cosmochimica Acta, 68(17): 3459-3473 |
| [9] | Islam F S, Gault A G, Boothman C, et al. 2004. Role of metal-reducing bacteria in arsenic release from Bengal delta sediments [J]. Nature, 430: 68-71 |
| [10] | Jiang F Y, Chen X, Luo A C. 2009. Iron plaque formation on wetland plants and its influence on phosphorus, calcium and metal uptake [J]. Aquatic Ecology, 43(4): 879-890 |
| [11] | Jiang S H, Lee J H, Kim D, et al. 2013. Differential arsenic mobilization from As-bearing ferrihydrite by iron-respiring Shewanella strains with different arsenic-reducing activities [J]. Environmental Science & Technology, 47(15): 8616-8623 |
| [12] | Li G, Sun G X, Williams P N, et al. 2011. Inorganic arsenic in Chinese food and its cancer risk [J]. Environmental International, 37(7): 1219-1225 |
| [13] | Liu M C, Li H F, Xia L J, et al. 2001. Effect of Fe, Mn coating formed on roots on Cd uptake by rice varieties [J]. Acta Ecologica Sinica, 21(4): 598-602 |
| [14] | Liu W J, Zhu Y G, Hu Y, et al. 2006. Arsenic sequestration in iron plaque, its accumulation and speciation in mature rice plants (Oryza sativa L.) [J]. Environmental Science & Technology, 40(18): 5730-5736 |
| [15] | Myers C R, Myers J M. 1997. Cloning and sequence of cymA, a gene encoding a tetraheme cytochrome c required for reduction of iron (Ⅲ), fumarate, and nitrate by Shewanella putrefaciens MR-1 [J]. Journal of Bacteriology, 179(4): 1143-1152 |
| [16] | O'Loughlin E J, Boyanov M I, Flynn T M, et al. 2013. Effects of bound phosphate on the bioreduction of lepidocrocite (γ-FeOOH) and maghemite (γ-Fe2O3) and formation of secondary minerals [J]. Environmental Science & Technology, 47(16): 9157-9166 |
| [17] | Otte M L, Dekkers M J, Rozema J, et al. 1991. Uptake of arsenic by Aster tripolium in relation to rhizosphere oxidation [J]. Canadian Journal of Botany, 69(12): 2670-2677 |
| [18] | Ratering S, Schnell S. 2000. Localization of iron-reducing activity in paddy soilby profile studies [J]. Biogeochemistry, 48(3): 341-365 |
| [19] | Schwertmann U, Cornell R M. 2000. Iron Oxides in the Laboratory [M]. Weinheim: Wiley VCH Verlag GmbH |
| [20] | Stroud J L, Norton G J, Islam M R, et al. 2011. The dynamics of arsenic in four paddy fields in the Bengal delta [J]. Environmental Pollution, 159(4): 947-953 |
| [21] | 孙嘉龙, 李梅, 曾德华. 2007. 微生物对重金属的吸附、转化作用 [J]. 贵州农业科学, 35(5): 147-150 |
| [22] | Taylor G J, Crowder A A. 1983. Use of DCB technique for extraction of hydrous iron oxides from roots of wetland plants [J]. American Journal of Botany, 70(8): 1254-1257 |
| [23] | Tufano K J, Fendorf S. 2008. Confounding impacts of iron reduction on arsenic retention [J]. Environmental Science & Technology, 42(13): 4777-4783 |
| [24] | 王利红, 尹西翔, 段桂兰, 等. 2009. 生物体砷代谢解毒机制的研究进展 [J]. 安徽农业科学, 37(17): 8144-8147 |
| [25] | Wang X J, Chen X P, Yang J, et al. 2009. Effect of microbial mediated iron plaque reduction on arsenic mobility in paddy soil [J]. Journal of Environmental Sciences, 21(11): 1562-1568 |
| [26] | Weber K A, Picardal F W, Roden E E. 2001. Microbially catalyzed nitrate-dependent oxidation of biogenic solid-phase Fe(Ⅱ) compounds [J]. Environmental Science & Technology, 35(8): 1644-1650 |
| [27] | Williams P N, Islam M R, Adomako E E, et al. 2006. Increase in rice grain arsenic for regions of Bangladesh irrigating paddies with elevated arsenic in groundwaters [J]. Environmental Science & Technology, 40(16): 4903-4908 |
| [28] | Zhu Y G, Williams P N, Meharg A A. 2008. Exposure to inorganic arsenic from rice: a global health issue? [J]. Environmental Pollution, 154(2): 169-171 |
 2015, Vol. 35
2015, Vol. 35


