2. 中国科学院生态环境研究中心环境水质学实验室, 北京 100085;
3. 深圳大学化学与化工学院, 深圳 518060
2. Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
3. College of Chemistry and Chemical Engineering, Shenzhen University, Shenzhen 518060
近年来,重金属污染对自然生态和人类生存与健康造成了严重威胁.采矿、冶炼、皮革及其制品等行业排放的重金属废水中通常含有化学络合剂、表面活性剂等有机物,由于重金属离子易与共存的有机物形成络合物,采用常规的化学沉淀法、铁屑还原法或化学混凝等处理方法难以满足行业排放新标准(Charerntanyarak,1999;谢丽萍等,2012),如《电镀污染物排放标准》(GB21900—2008)中新建企业总镍排放浓度限值仅为0.5 mg · L-1;而吸附法和离子交换方法对络合态重金属去除能力有限(Cavaco et al., 2007).光催化法(Madden et al., 1997)、H2O2/UV法(Jiraroj et al., 2006)、臭氧氧化(Stemmler et al., 2001)等方法在处理重金属废水时处理效率低,鲜有实际应用案例;化学芬顿方法存在H2O2利用率低,产泥量大等问题.因此,发展高效经济的重金属废水处理方法对排污企业可持续发展,防治重金属污染,保护和改善环境具有重要意义.
电芬顿是一种有效的去除水中污染物的方法(Nidheesh and Gandhimathi, 2012).电芬顿主要分为利用气体扩散阴极电化学原位产生H2O2与外加的Fe2+的阴极电芬顿以及利用电化学阳极溶解方法产生Fe2+,与外加的H2O2反应的阳极电芬顿过程(Brillas et al., 2009).在电芬顿过程中,部分Fe3+离子也可在阴极还原为Fe2+离子.与传统芬顿法相比,电芬顿法具有H2O2与Fe2+利用率高,处理过程清洁,产泥量少,设备占地面积小等优点.
目前,国内外电芬顿技术研究主要集中在染料、农药等难降解有机污染物的降解(Sirés and Brillas, 2012;胡晶晶等,2012;王爱民等,2006;Özcan et al., 2013).Ghosh等曾用电芬顿方法对含锌有机工业废水进行研究(Ghosh et al., 2011);Voglar和Lestan采用电化学方法研究了经过EDTA淋洗处理的被重金属污染的土壤淋洗液,通过分析电极类型和电氧化与电芬顿处理络合态重金属的效率,发现电芬顿是一种有效的处理EDTA淋洗液的方法(Voglar and Lestan, 2012).2013年,王海东等采用阳极电芬顿方法处理电镀综合废水(王海东等,2013),得到了较好的处理效果并进行了工程化应用,重金属离子与有机污染物均得到有效去除,但在不同的水质特点条件下,发现采用的电化学条件以及絮凝沉淀时间均存在差异,对不同类型的重金属离子的去除率也明显不同,电芬顿系统的处理效率有待进一步提高.
本文针对络合态重金属污染物Ni-EDTA,开展了电芬顿氧化破络Ni-EDTA,并通过产生的铁絮体以及铁氧化物的絮凝、吸附以及共沉淀等作用协同去除Ni离子及EDTA的实验研究.
2 材料与方法(Materials and methods) 2.1 实验试剂乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O,AR,国药);浓硫酸(H2SO4,AR,国药);氢氧化钠(NaOH,AR,国药);高氯酸钠(NaClO4,AR,国药);高氯酸镍(Ⅱ)六水合物(Ni(ClO4)2 · 6H2O,GR,阿尔埃莎);30%过氧化氢(H2O2,GR,国药)实验用水为超纯水(Milli-Q).
2.2 实验装置及步骤电芬顿实验装置如图 1所示.阳极采用铁板(8 cm×6.5 cm×0.1 cm),阴极为不锈钢板(8 cm×6.5 cm×0.1 cm),极板间距1 cm.反应在500 mL烧杯中进行.配制不同浓度的Ni-EDTA络合物反应液,取400 mL于烧杯中,加入80 mL 1 g · L-1的NaClO4作为电解质,反应前用0.1 mol · L-1 NaOH和0.1 mol · L-1 H2SO4调节pH值,通电后每隔10 min加入30% H2O2,反应时间60 min,每10 min取样,样品用0.45 μm水系滤膜过滤后检测Ni-EDTA的去除率.由DH1718E-4型双路跟踪稳压稳流电源提供恒稳电流,实验装置如图 1所示.
 |
| 图 1 电芬顿实验装置图(①电源;② 阴极-不锈钢板;③ 阳极-铁板;④ 磁力搅拌转子;⑤ 磁力搅拌器) Fig. 1 Test system for electro-fenton experiment(①power supply; ②Cathode-stainlesssteelplate; ③Anode- iron plate; ④Magnetic stirring rotor; ⑤Magnetic stirrer) |
pH检测使用标准型pH计(UB-7,DENVER).H2O2浓度的检测采用紫外-可见光分光光度计(3010型,HITACHI),取1.5 mL样品,依次加入0.75 mL 0.1 mol · L-1邻苯二甲酸氢钾(0.1 mol · L-1)和0.75 mL(KI 0.4 mol · L-1 + NaOH 0.06 mol · L-1 + 钼酸铵~10-4 mol · L-1)溶液,混合均匀,静置2 min,在λ=352 nm处检测吸光度(ε=26400 L · mol-1 · cm-1),方法检出限~10-6 mol · L-1.Ni含量检测使用电感耦合等离子体发射光谱仪(ICP-OES,P700,Agilent).EDTA采用高效液相色谱(HPLC-1260Agilent,USA)检测,分析方法:使用C-18分析柱,流动相为20 mmol · L-1磷酸铵溶液 : 乙腈 = 75 : 25,设定分析柱温度25 ℃,流动相流速1 mL · min-1,进样量10 μL,保留时间10 min. TOC采用总有机碳分析仪(TOC-VCPH,SHIMADZU)检测.
3 结果与讨论(Results and discussion) 3.1 电絮凝与电芬顿对比在Ni-EDTA初始浓度为0.1 mmol · L-1,pH =3.5,电流密度为3.85 mA · cm-2条件下进行电絮凝反应.在相同初始浓度、pH、电流密度时,投加450 μmol · L-1 H2O2,进行电芬顿反应.结果如图 2所示.电絮凝对Ni和EDTA的去除率都仅有20%左右,对总有机物TOC几乎没有去除效果.电絮凝对Ni-EDTA络合物的去除效果很差.而电芬顿反应对EDTA去除达到90%,对Ni去除率达到70%,总有机物TOC的去除率也有45%左右.对比显示,电芬顿的去除效果更好.原因是电芬顿过程产生强氧化性羟基自由基(· OH),可降解大部分有机物.
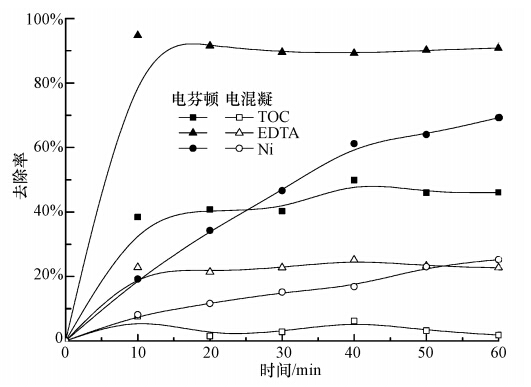 |
| 图 2 电絮凝与电芬顿反应效果对比图 Fig. 2 Removal of Ni-EDTA by electro-flocculation and electro-fenton process |
在Ni-EDTA初始浓度为0.1 mmol · L-1,H2O2浓度为450 μmol · L-1,电流密度为3.85 mA · cm-2条件下,分别进行溶液初始pH值为3.5、4.5、5.5、6.5电芬顿去除Ni-EDTA实验,实验结果如图 3所示.随着反应时间的增加,溶液中的Ni的去除率逐渐提高,4种pH值条件下,Ni的去除率以pH =3.5时处理效果最佳,其他3种条件下去除率结果相似,但越接近pH =3.5时其处理效果越好.EDTA的去除率同样随着反应时间延长而逐渐提高,pH =3.5时其去除率最高且最先达到稳定,随着pH值的升高,最终的去除率越小.分析原因可能为,pH = 3~4时电芬顿反应最活跃(程丽华等,2001),随着pH升高,· OH产量减少,H2O2的利用率降低,因为在pH > 5时,H2O2会分解为O2和H2O(Deng and Englehardt, 2006),另外pH值也会影响· OH的氧化能力,· OH的氧化电位随着pH值的升高而降低(任艳等,2011);当pH >3.5时,Fe2+部分转化为Fe3+,与OH-反应产生Fe(OH)3沉淀(Gallard et al., 1999),减少了与H2O2反应产生· OH的机会,抑制了芬顿反应的进行,对EDTA的氧化分解作用降低.实验结果表明溶液初始pH值的变化对Ni-EDTA的去除有显著影响,溶液的最佳初始pH值为3.5.
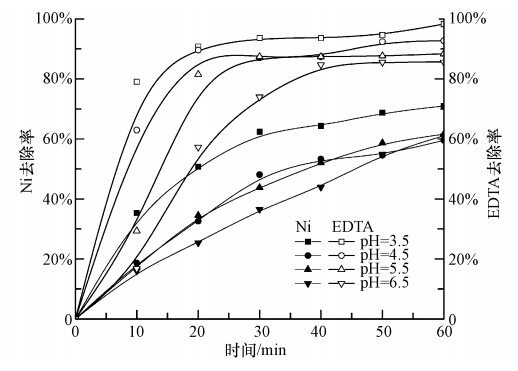 |
| 图 3 不同pH值对Ni-EDTA去除率的影响 Fig. 3 Influence of different pH values on the Ni-EDTA removal |
在初始pH =3.5,电流密度3.85 mA · cm-2,H2O2投加浓度为450 μmol · L-1条件下进行去除不同初始浓度Ni-EDTA实验.结果显示,Ni与EDTA的去除率均随着反应时间的增加逐渐升高;3种具有不同初始浓度的反应液中EDTA的去除率在10 min时均已达到80%以上,反应时间继续增加,EDTA的去除率随初始浓度的不同显现出不同的趋势.初始浓度越低,EDTA的去除率越高.溶液中Ni的去除率随反应时间变化与EDTA的去除率显现相同趋势,但在相同的反应条件下,3种不同初始浓度反应液中EDTA的去除率都高于Ni的去除率.表明电芬顿方法对EDTA的处理效率优于对重金属的处理效率.
3.4 H2O2投加量的影响在Ni-EDTA初始浓度为0.1 mmol · L-1,pH =3.5,电流密度为3.85 mA · cm-2条件下,投加不同浓度H2O2分别进行反应,实验结果如图 4所示.当投加量< 200 μmol · L-1时,溶液中的Ni和EDTA的去除率都会随着H2O2投加量的增大而增大;而投加量> 200 μmol · L-1时,溶液中的Ni和EDTA的去除率增加趋势明显变缓.原因可能为在H2O2浓度较低时,增加H2O2的浓度,促进· OH的产生,利于反应进行(吴彦瑜等,2010).而当浓度过高时,H2O2对· OH有猝灭作用,两者反应生成· OH2(Dutta et al., 2001),降低了H2O2的利用率.在H2O2的浓度极低时,几乎没有去除率,说明对于Ni-EDTA络合物的去除过程,是先由· OH对其强氧化破络合,再分别对EDTA和Ni进行氧化和絮凝作用.实验结果表明,H2O2的最佳投加量为450 μmol · L-1.
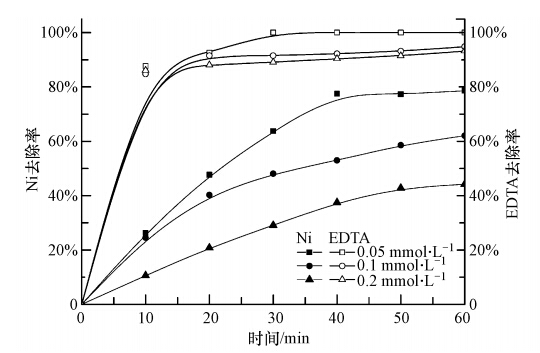 |
| 图 4 不同初始浓度对去除率的影响 Fig. 4 Influence of different initial concentrations on the Ni-EDTA removal |
在Ni-EDTA初始浓度为0.1 mmol · L-1,H2O2投加浓度450 μmol · L-1,pH =3.5条件下,进行不同电流密度的反应.实验结果如图 5,EDTA的去除率在反应10 min时已经达到最高,去除率随电流密度升高而升高.原因是EDTA的去除主要为羟基自由基的强氧化分解作用,电流密度决定Fe2+产量,Fe2+催化· OH生成(徐之寅等,2014),电流密度越大,芬顿作用越强,对EDTA处理效果越好.溶液中Ni的去除率随反应时间的延长,逐渐变大,且随着电流密度的增大而增大.分析原因,可能是增加电流强度,铁阳极溶出的铁离子增多,有利于增强铁离子的絮凝沉淀;另外电子迁移量变大,增强了阴阳极板对游离态Ni的吸附作用(Heidmann and Calmano, 2008).因此,电流密度越大,电芬顿处理Ni-EDTA效率越高.
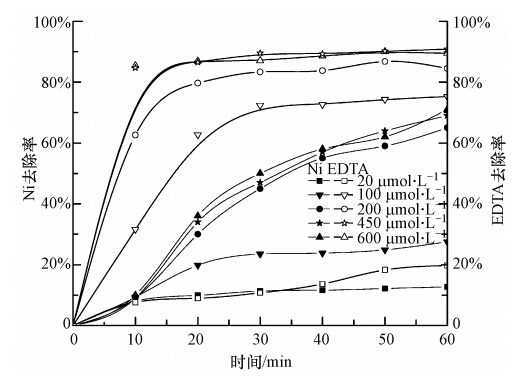 |
| 图 5 不同H2O2投加量对去除率的影响 Fig. 5 Influence of different H2O2 dose quantities on the removal rate |
研究结果显示· OH无选择性的强氧化作用对Ni-EDTA的破络合有显著效果,由电芬顿基本反应式和电絮凝原理推测,电芬顿反应过程可能为Ni-EDTA络合物在溶液中被· OH氧化破络合,EDTA直接被· OH分解为小分子有机物,一部分小分子有机物随着电子流迁移到阳极附近被氧化,生成CO2和H2O;一部分小分子有机物在铁的络合物凝聚吸附、共沉淀作用下形成沉淀物质被去除.如图 7所示,反应结束后镍的去向为,阳极极板5.5%、阴极极板5.8%、沉淀50.3%、溶液38.4%,由此推断Ni去除原因:一是随着电流迁移到极板上被极板吸附;二是镍离子与铁离子和OH-共同形成稳定络合物,直接絮凝沉淀;三是被各种铁络合物凝聚吸附后与铁络合物共沉淀而得到去除.
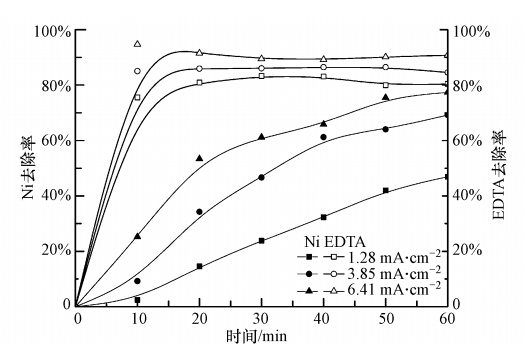 |
| 图 6 不同电流密度对去除率的影响 Fig. 6 Influence of different current densities on the removal rate |
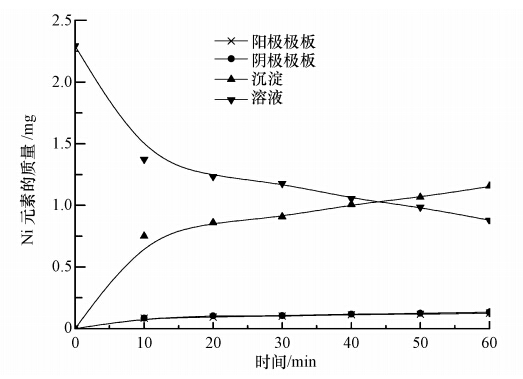 |
| 图 7 Ni元素平衡 Fig. 7 Nickel balance |
电絮凝对络合物Ni-EDTA处理效率较低,而电芬顿对EDTA去除率90%,Ni去除率70%,总有机物TOC的去除率为45%左右.Ni-EDTA重金属络合物初始浓度越低,电芬顿方法处理效果越好.pH值、H2O2投加量、电流密度对电芬顿反应均有影响.最佳溶液初始pH为3.5;在相同初始浓度、相同H2O2投加量时,电流密度越高去除率越高;H2O2的最佳投加量为450 μmol · L-1.电芬顿过程中,Ni-EDTA络合物被羟基自由基氧化破络合,EDTA被氧化分解为小分子有机物.部分镍离子被极板吸附,部分镍离子通过吸附、絮凝沉淀等多过程得以去除.
| [1] | Brillas E, Sirés I, Oturan M A. 2009. Electro-Fenton process and related electrochemical technologies based on Fenton's reaction chemistry[J]. Chemical Reviews, 109(12): 6570-6631 |
| [2] | Cavaco S A, Fernandes S, Quina M M, et al. 2007. Removal of chromium from electroplating industry effluents by ion exchange resins[J]. Journal of Hazardous Materials, 144(3): 634-638 |
| [3] | Charerntanyarak L. 1999. Heavy metals removal by chemical coagulation and precipitation[J]. Water Science and Technology, 39(10/11): 135-138 |
| [4] | 程丽华, 黄君礼, 王丽, 等. 2001. Fenton试剂的特性及其在废水处理中的应用[J]. 化学工程师, (3): 24-25 |
| [5] | Deng Y, Englehardt J D. 2006. Treatment of landfill leachate by the Fenton process[J]. Water Research, 40(20): 3683-3694 |
| [6] | Dutta K, Mukhopadhyay S, Bhattacharjee S, et al. 2001. Chemical oxidation of methylene blue using a Fenton-like reaction[J]. Journal of Hazardous Materials, 84(1): 57-71 |
| [7] | Gallard H, De Laat J, Legube B. 1999. Spectrophotometric study of the formation of iron(Ⅲ)-hydroperoxy complexes in homogeneous aqueous solutions[J]. Water Research, 33(13): 2929-2936 |
| [8] | Ghosh P, Samanta A N, Ray S. 2011. Reduction of COD and removal of Zn2+ from rayon industry wastewater by combined electro-Fenton treatment and chemical precipitation[J]. Desalination, 266(1/3): 213-217 |
| [9] | 胡晶晶, 莫文艳, 孙杰. 2012. 电芬顿降解活性艳红X3B的阳极影响因素[J]. 化工学报, 63(11): 3694-3699 |
| [10] | Heidmann I, Calmano W. 2008. Removal of Zn(Ⅱ), Cu(Ⅱ), Ni(Ⅱ), Ag(Ⅰ) and Cr(Ⅵ) present in aqueous solutions by aluminium electrocoagulation[J]. Journal of Hazardous Materials, 152(3): 934-941 |
| [11] | Jiraroj D, Unob F, Hagège A. 2006. Degradation of Pb-EDTA complex by a H2O2/UV process[J]. Water Research, 40(1): 107-112 |
| [12] | Madden T H, Matye A K, Fulton M, et al. 1997. Oxidation of metal-EDTA complexes by TiO2 photocatalysis[J]. Environmental Science & Technology, 31(12): 3475-3481 |
| [13] | Nidheesh P V, Gandhimathi R. 2012. Trends in electro-Fenton process for water and wastewater treatment: An overview[J]. Desalination, 299: 1-15 |
| [14] | Özcan A, Šahin Y, Oturan M A. 2013. Complete removal of the insecticide azinphosmethyl from water by the electro-Fenton method-a kinetic and mechanistic study[J]. Water Research, 47(3): 1470-1479 |
| [15] | 任艳, 蒋进元, 周岳溪, 等. 2011. 电-Fenton法预处理腈纶聚合废水的影响[J]. 环境科学研究, 24(3): 301-307 |
| [16] | Sirés I, Brillas E. 2012. Remediation of water pollution caused by pharmaceutical residues based on electrochemical separation and degradation technologies: A review[J]. Environment International, 40(4): 212-229 |
| [17] | Stemmler K, Glod G, von Gunten U. 2001. Oxidation of metal-diethylenetriamine-pentaacetate (DTPA)-complexes during drinking water ozonation[J]. Water Research, 35(8): 1877-1886 |
| [18] | Voglar D, Lestan D. 2012. Electrochemical treatment of spent solution after EDTA-based soil washing[J]. Water Research, 46(6): 1999-2008 |
| [19] | 王爱民, 曲久辉, 宋玲玲, 等. 2006. 活性炭纤维电极生成羟基自由基降解酸性红B[J]. 化学学报, 64(8): 767-771 |
| [20] | 王海东, 陈发源, 杨春风, 等. 2013. 电混凝处理电镀综合废水[J]. 环境工程学报, 7(10): 3833-3838 |
| [21] | 吴彦瑜, 周少奇, 覃芳慧, 等. 2010. Fenton法氧化/混凝作用去除腐殖酸的研究[J]. 环境科学, 31(4): 996-1001 |
| [22] | 谢丽萍, 付丰连, 汤兵. 2012. 络合重金属废水处理的研究进展[J]. 工业水处理, 32(8): 1-5 |
| [23] | 徐之寅, 刘志英, 陆雪梅, 等. 2014. 含吡啶有机废水物化预处理工艺[J]. 环境工程学报, 8(5): 1863-1868 |
 2015, Vol. 35
2015, Vol. 35


