2. 东南大学能源热转换及其过程测控教育部重点实验室, 南京 210096
2. Key Laboratory of Energy Thermal Conversion and Control of Ministry of Education, Nanjing 210096
化学链燃烧是一种很有前景的温室气体控制方法(金红光等,2008).化学链燃烧基本原理:氧载体在燃料反应器中与碳氢燃料进行反应,氧载体释放氧,将燃料氧化成CO2和H2O(汽),冷凝除去H2O得到纯净的CO2.随后,还原态氧载体进入空气反应器中,与空气接触进行氧化再生.目前,金属氧化物是主流的氧载体.金属氧载体具有高反应活性的优点,但存在一些固有缺陷:一是价格高,且存在重金属二次污染等问题;二是煤中硫分和灰渣与金属氧载体反应,生成低熔点固相硫化物,导致金属氧载体永久失活(Zhao et al.,2008;Shen et al.,2010).近来,由于价格便宜,铁矿石氧载体引起了广泛的关注(蒋林林等,2010;李新爱等,2012;肖睿等,2011;张思文等,2013;Cuadrat et al.,2012;Schwebel et al.,2012;Li et al.,2010),但是铁基氧化物载氧率较低.CaSO4非金属氧载体,是通过CaSO4-CaS之间循环交替反应来实现燃料的燃烧,CaSO4氧载体具有价格低廉、自然界中储量丰富、氧载率高等优点.
CaSO4氧载体与Fe2O3氧载体,各自具有很强的特点:CaSO4具有很高的载氧能力,但在高温还原、再生过程中存在气体硫化物释放问题和硫释放引起的氧载体失活问题;Fe2O3具有较高的反应活性,并且H2S气体对Fe2O3氧载体载氧能力的影响不大(Tian et al.,2009),但载氧能力相对较弱,且在过度还原的情况下会发生爆裂、甚至表面烧结等一系列不可逆的化学相变过程.在CaSO4氧载体中添加少量的Fe2O3氧载体,制备钙铁双氧载体,能取二者之长,补两者之弊端.现有实验研究表明(丁宁等,2011),通过浸渍法制备的钙铁双氧载体(CaSO4-Fe2O3)具有较好的反应活性,能显著地提高碳氢气体燃料向CO2和H2O的转化效率,并减少气体硫化物的释放,有利于CO2捕集.然而,现阶段尚无CaSO4-Fe2O3双氧载体反应的热力学研究,也未能揭示钙铁双氧载体的反应机理.
我国以煤炭为主要能源,亟需实现煤燃料与化学链燃烧的结合.以煤为燃料的化学链燃烧反应中,通常氧载体所能传递氧与煤中碳的摩尔比约为7~9.由于煤相对氧载体不足,双氧载体CaSO4和Fe2O3之间,存在竞争还原的关系.此外,双氧载体中的铁氧化物可能起到固硫的作用.因此,本文对水蒸汽气化介质条件下CaSO4-Fe2O3双氧载体与煤的反应展开热力学研究,重点对双氧载体竞争还原反应及双氧载体中铁氧化物的固硫反应可能性展开理论分析,旨在揭示钙铁双氧载体与煤的反应机理,为实验研究提供理论依据.所研究的双氧载体CaSO4-Fe2O3,CaSO4为主要的氧载体组份.
2 双氧载体竞争还原反应分析(Analysis of the competitive reductions of the dual oxygen carrier)Fe2O3在参与煤气化-氧载体还原反应过程中,Fe2O3可能被还原成各种形态的铁化合物或单质:
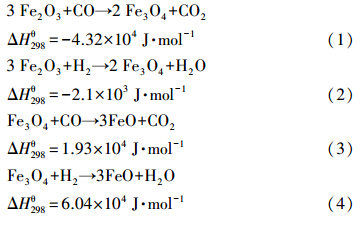
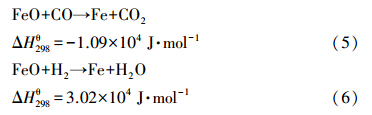
由于本研究的双氧载体是以CaSO4为主体,而Fe2O3量少,所以对以上反应进行评估还需引入CaSO4的影响.(式(7))和(式(8))描述了CaSO4与煤气化主要产物CO和H2进行反应的主要途径,也是燃料反应器中的主反应:
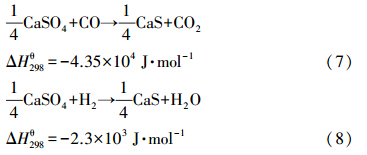
煤中C也可能直接和氧载体颗粒发生以(式(9))和(式(10))为代表的固-固反应,且氧载体和C的固-固反应平衡常数也很大.然而,在实际的反应过程中,煤通过此途径转化为CO2的份额很少.
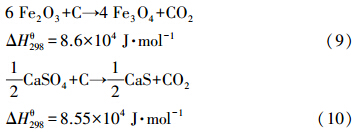
Aspen Plus 软件是一种通用的过程模拟优化和设计软件,物性模型和数据精确可靠,对化工、石化、炼油等工业过程均有较好的模拟.Aspen Plus数据库包括近6000种纯组分物性数据,本文采用Aspen Plus 软件中的热力学数据——各温度下的纯物质的吉布斯自由能ΔGθT,并依据平衡常数的计算公式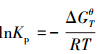 ,计算获得了相关化学反应平衡常数随反应温度的变化曲线.其中,ΔGθT的单位为J · mol-1,R为普通常数,单位为J · mol-1 · k-1;T为反应温度,单位为K,Kp无量纲.
,计算获得了相关化学反应平衡常数随反应温度的变化曲线.其中,ΔGθT的单位为J · mol-1,R为普通常数,单位为J · mol-1 · k-1;T为反应温度,单位为K,Kp无量纲.
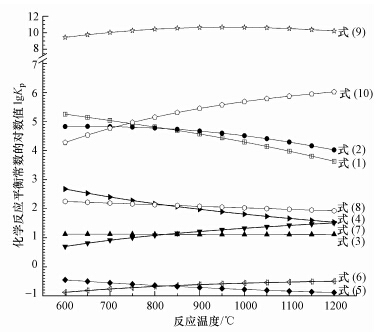
对于平衡常数表达式形式相类似的反应,平衡常数的大小反映了反应所能进行的程度.反应(式(1)~(8))平衡常数表达形式一致,化学平衡常数相互间具有可比性,相关反应的化学平衡常数随温度变化呈现图 1中.由图 1可看出,900 ℃时,无论是通过H2还是CO,Fe2O3被还原成Fe3O4的反应平衡常数对数值都达到了4.5以上;CaSO4被H2或CO还原为CaS的平衡常数对数值为2左右;而Fe3O4生成FeO的反应平衡常数对数值只有1左右,FeO生成Fe的反应平衡常数对数值更是低至-0.5.
由于Fe2O3氧载体与CO和H2的反应平衡常数较CaSO4氧载体大,煤气化产物CO和H2很容易地通过反应(式(1)、(2))而被消耗,Fe2O3转换成Fe3O4;此外,气化产物还会通过(式(7)和(8))与CaSO4进行反应.因此,从化学反应平衡的角度来看,相比CaSO4氧载体,采用Fe2O3氧载体,有利于提高燃料(C、CO、H2)燃烬度.
 |
| 图 1 主要化学反应的平衡常数曲线 Figure.1 Equilibrium constant curves of the main chemical reactions |
双氧载体中Fe2O3的份额比较少,在反应中可能被过度还原成FeO或Fe.然而,根据图 1所示的化学反应平衡常数曲线可见,与前述的反应(式(1)、(2)、(7)和(8)相比,对于生成FeO的反应(式(3)和(4)),因为平衡常数差异达到了一个数量级,Fe3O4即使能通过反应(式(3)和(4))转换为FeO,其数量是很少的;而对于生成Fe的反应(式(5)和(6)),因为化学平衡常数差异达到两个数量级,反应平衡时所生成的Fe的量也是极微少的.最主要的是,化学反应(式(1)、(2)、(7)和(8))与FeO、Fe生成反应(式(3)~(6)))的气体反应物和气体产物组分都相同,由于(式(1)、(2)、(7)和(8))反应平衡常数大,气体产物H2O和CO2的生成浓度高,这些气体产物的存在完全能抑制铁基氧载体过度还原成FeO和Fe.因此,由于过量CaSO4氧载体的存在,且反应过程中通入大量的水蒸汽,复合氧载体被还原后的含铁组份主要是Fe3O4,Fe2O3被过度还原成FeO或Fe的可能性极小.
3 铁氧化物对H2S和SO2释放的影响 (Effects of iron oxide on H2S and SO2 emissions)根据文献(郑敏等,2010)气体硫化物释放机理,除了上述所需要的主反应外,复合氧载体中的CaSO4还可能发生如下的副反应,生成CaO和气体硫化物SO2或H2S,包括:① CaSO4与还原性气体CO和H2的竞争副反应;② CaS与CaSO4之间的固-固反应;③ CaS与CO2和CaS与H2O之间的气-固反应.
双氧载体中铁氧化物还可能与气体硫化物发生反应.由前面的分析可知,在整个反应过程中,铁基氧载体主要以两种形态存在:Fe2O3、Fe3O4.所以,铁氧化物与气体硫化物的可能反应如下:
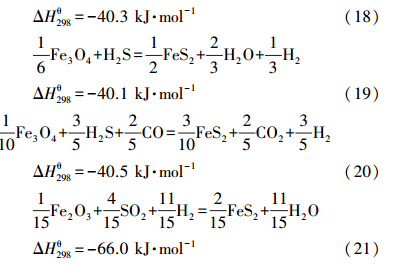
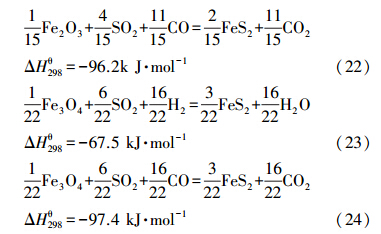
铁氧化物与气体硫化物反应平衡常数见图 2.铁氧化物可能直接与气体硫化物反应,也可能在CO或H2气氛下与气体硫化物发生反应.由图可见,一方面,对于铁氧化物直接与气体硫化物的反应,极容易发生H2S氧化成SO2和H2O的反应(式(11)),与FeS和FeS2的生成反应(式(13)~(20))形成竞争H2S的关系.另一方面,铁氧化物固硫生成FeS和FeS2的反应需要CO或H2的参与,因此,FeS和FeS2的生成反应(式(13)~(16)、(20)~(24))与复合氧载体的还原反应(式(1)、(2)、(7)和(8))存在竞争CO和H2的关系.然而,相关反应的平衡常数不同,并不能直接进行比较.可在平衡常数计算的基础上,通过对该复杂体系展开平衡计算,获得平衡产物的分布情况.
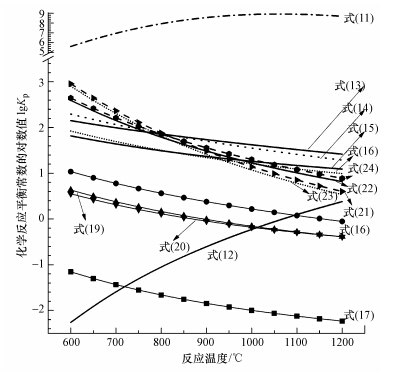 |
| 图 2 铁氧化物与气体硫化物反应平衡常数 Figure.2 Reaction equilibrium constants for the reactions of iron oxides and gas sulfides |
Aspen Plus 中的RGibbs反应器,是以化学平衡为基础的反应器,通过吉布斯自由能最小化原理来确定产品组成.本文采用RGibbs反应器,考查在燃料反应器中,铁钙双氧载体与煤在水蒸汽气氛下的平衡产物分布,并借以分析铁基氧化物的还原机理、固硫反应机理和复合载氧体与煤灰反应机理.考虑水蒸汽气氛下煤化学链燃烧反应过程和煤灰与钙铁双氧载体反应的复杂性,并且鉴于煤中主要的可燃元素是碳元素,而煤经燃烧后生成的残留物是灰分,因此本文简化分析,忽略煤中的水分和挥发分,将煤简化成碳和灰分的混合物.并设定:煤由碳(76%)和灰分(24%)组成,其中灰为普通低钙灰,灰成分考虑SiO2(13%)、Al2O3(5%)、Fe2O3(4%)和CaO(2%),煤加入量为1.5 g · min-1;水蒸汽加入量:2 g · min-1;双氧载体中CaSO4加入量:49.500 g · min-1,Fe2O3加入量:7.051 g · min-1.1 mol CaSO4转换成CaS时所能提供的氧原子为4 mol,而1 mol Fe2O3转换成Fe3O4时所能提供氧原子为1/3 mol.因此,本模拟中,双氧载体的载氧原子数为1.47 mol · min-1,其中Fe2O3组分所能提供的氧原子数仅占总量的1%.
对该复杂反应系统而言,考虑其中存在的元素为Ca、S、O、Fe、C、H2,包含的组分有:CaSO4、CaS、CaO、CaCO3、Fe2O3、Fe3O4、FeO、Fe、CO2、CO、CH4、C、H2O、H、H2S、SO2、FeS和FeS2.此外,煤灰与CaSO4或Fe2O3可能发生反应,生成以下产物(刘豪等,2007;李宁等,2003):CaSiO3、Ca2SiO4、CaAl2O4、CaFe4O6和3CaO·3Al2O3·CaSO4以及FeSiO3.受Aspen plus数据库的限制,平衡计算时不考虑CaFe4O6和3CaO·3Al2O3·CaSO4组分.当反应器内达到化学平衡和质量平衡时,体系的吉布斯自由能达到极小值.
图 3给出了固相平衡产物组份随反应温度的变化趋势.产物中无C残留,也没有FeO、Fe、FeS以及FeSiO3的生成,故没有在图中列出这些物质.在400~550 ℃反应温度范围,Fe2O3组分全部转化成了Fe3O4(摩尔分数达到了99.5%以上)和少量的FeS2,但是随着反应温度的提高,FeS2不能稳定存在,会发生热分解,当反应温度超过600 ℃以后,铁基固体产物只有Fe3O4.同时,在400~500 ℃反应温度范围,CaSO4氧载体反应后的主要固态产物是CaCO3;煤灰中SiO2容易与CaO反应,全部被转化成CaSiO3.在550 ℃时,CaO因碳酸化程度降低而与SiO2反应生成CaSiO3.当反应温度超过650 ℃后,固相产物出现CaS,其生成量随反应温度升高略有增加直至950 ℃出现CaO后再下降,在此过程中Ca2SiO3生成量保持不变;进一步增加反应温度至850 ℃以上,煤灰中Al2O3组分与CaO发生反应,全部被转化成了CaAl2O4.因此,在化学链燃烧燃料反应器实施的适宜温度范围(850~1050 ℃)(沈来宏,2007),铁基氧化物主要是起到载氧的作用,向燃料提供氧.由于复合氧载体中CaSO4相对于碳是过量的,并且反应过程中还通入大量的水蒸汽气化介质,铁基氧化物被还原成Fe3O4,不会被过度还原成FeO或Fe;且铁基氧化物不会与H2S和SO2发生反应,固体产物中无FeS或FeS2.同时,CaSO4氧载体在还原过程中生成的CaO副产物容易与煤灰中SiO2和Al2O3反应,生成热稳定性相对较好的Ca2SiO3和CaAl2O4.
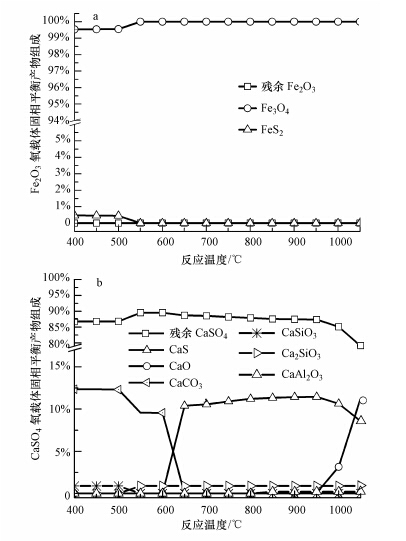 |
| 图 3 反应温度对Fe2O3基氧载体和CaSO4基氧载体固相平衡产物组份的影响(铁钙复合载氧体中Fe2O3载氧比率1%) Figure.3 Effects of reaction temperature on the solid products of the Fe2O3-based oxygen carrier and the CaSO4-based oxygen carrier(the Fe2O3 fraction in the dual oxygen carrier is 1%) |
现有的实验研究(Tian et al.,2009;王保文等,2011)发现,气态H2S会导致氧载体反应活性下降.美国能源部国家能源技术实验室Tian等(2009)发现900 ℃时,含H2S气体的煤气燃料与Fe2O3会发生反应,生成了FeS,导致铁基氧载体反应活性下降.而本文的计算却未发现有固相硫化物FeS生成.这可能是因为,反应气氛中存在大量的水蒸汽阻碍了Fe2O3与H2S反应生成固相硫化物和H2O.依据文献资料(李彦旭等,2000),反应气氛中存在的水蒸汽不利于Fe2O3与H2S反应生成FeS2或FeS,且水蒸汽浓度越大影响越显著.另外,文献(王保文等,2011;Zhao et al.,2008)发现煤中灰分分别与Fe基、Cu基和Ni基氧载体反应形成了一些低熔点惰性组分,这会导致氧载体失活.本文的计算结果表明煤灰与钙铁双氧载体中Fe2O3组分未发生反应,但是与CaSO4组分发生了反应,生成了钙的低熔点惰性组分.因此,在煤化学链燃烧反应系统中,有必要将氧载体颗粒与灰分进行分离,以降低灰分对氧载体反应活性的不利影响.
图 4给出了干基气相平衡产物组份随反应温度的变化趋势.在400~900 ℃,气体产物中CO2浓度基本上呈线性下降,从98.89%减少到91.60%;而当反应温度超过950 ℃,降幅明显,从91.14%降到64.90%,主要是因为高温下CaSO4还原分解成CaO并释放出大量的SO2而降低了CO2浓度.H2S浓度随反应温度增加;而在750~950 ℃,H2S浓度随反应温度减少,进一步增加反应温度,H2S释放略有增加.此外,受化学反应平衡的限制,产物气中还残留浓度低于1%的CO和H2.
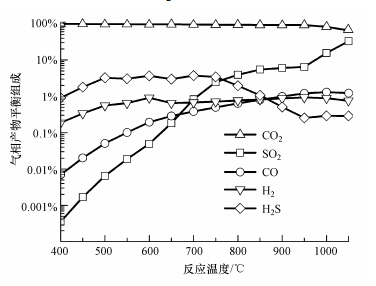 |
| 图 4 反应温度对干基气相平衡产物组份的影响(铁钙复合载氧体中Fe2O3载氧比率1%) Figure.4 Effects of reaction temperature on the dry gas products(the Fe2O3 fraction in the dual oxygen carrier is 1%) |
此外,本文还在维持复合载氧体(CaSO4-CaS、Fe2O3-Fe3O4)总有效载氧量相同的条件下,探讨当Fe2O3组分为0,CaSO4加入量为50 g · min-1时,煤气化-氧载体还原反应平衡产物的分布情况如图 5所示.当Fe2O3载氧比率从0%提高1%,CO2浓度提高,而H2S、SO2、CO和H2浓度下降,这说明添加Fe2O3组分有利于提高燃料燃烬度.此外,低温下(≤550 ℃)H2S释放量显著降低,而SO2释放量基本保持不变,这说明H2S不是被铁氧化物氧化成SO2,而是被转化成FeS2.并且,CaS出现的反应温度从450 ℃升高到600 ℃,这说明,Fe2O3具有较高反应活性,减少了CaSO4载氧体被煤气化产物还原的几率.当反应温度超过700 ℃,由于Fe2O3组分相对煤不足,且Fe2O3载氧比率0%和1%条件下的反应机理相同,相应温度下气相平衡产物的分布保持不变.因此,在化学链燃烧燃料反应器实施的适宜温度范围(850~1050 ℃),采用CaSO4和少量Fe2O3的混合物做为氧载体时,随着反应温度的升高,CO浓度上升,表明温度升高一方面导致燃料燃烬度下降;而SO2增幅显著则说明CaSO4以及CaS在高温下容易转变成CaO而失去载氧能力,这与单独采用CaSO4作为载氧体的变化趋势一致.
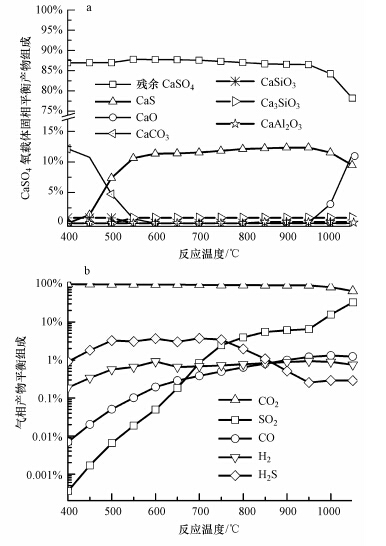 |
| 图 5 反应温度对固相平衡产物组分和干基气相平衡产物组分的影响(铁钙复合载体中Fe2O3载氧比率0) Figure.5 Effects of reaction temperature on the solid products and the try gas products(the Fe2O3 fraction in the dual oxygen carrier is 0) |
1)相比CaSO4氧载体,Fe2O3氧载体与C、CO、H2的反应的亲和性更好.在CaSO4氧载体中加入少量Fe2O3,有利于提高燃料燃烬度;另外,Fe2O3被还原成Fe3O4,不会被过度还原成FeO或Fe.
2)在化学链燃烧燃料反应器实施的适宜温度范围(850~1050 ℃),Fe2O3主要是起到载氧的作用,铁氧化物不会与H2S和SO2反应而转化成FeS或FeS2.CaSO4氧载体在还原过程中生成CaS和CaO,并释放出气体硫化物;同时,CaO容易与煤灰中SiO2和Al2O3反应,生成钙的硅酸盐Ca2SiO3和铝酸盐CaAl2O4.
| [1] | Cuadrat A, Abad A, Adánez J, et al. 2012. Behavior of ilmenite as oxygen carrier in chemical-looping combustion[J]. Fuel Processing Technology, 94(1): 101-112 |
| [2] | 丁宁, 郑瑛, 罗聪, 等. 2011. 钙基复合载氧体的化学链燃烧循环实验研究[J]. 工程热物理学报, 32(9): 1613-1616 |
| [3] | 金红光, 张希良, 高林, 等. 2008. 控制CO2排放的能源科技战略综合研究[J]. 中国科学(E辑: 技术科学), 38(9): 1495-1506 |
| [4] | 蒋林林, 赵海波, 张少华, 等. 2010. 煤基化学链燃烧技术的Fe2O3/Al2O3氧载体研究[J]. 工程热物理学报, 31(6): 1053-1056 |
| [5] | Li K Z, Wang H, Wei Y G, et al. 2010. Direct conversion of methane to synthesis gas using lattice oxygen of CeO2-Fe2O3 complex oxides[J]. Chemical Engineering Journal, 156(3): 512-518 |
| [6] | 李宁, 周俊虎, 岑可法. 2003. 高温固硫物相的研究[J]. 浙江大学学报(工学版), 37(5): 612-616 |
| [7] | 李新爱, 何方, 赵坤, 等. 2012. 钙钛矿型氧化物LaFeO3的制备及甲烷化学链燃烧性能[J]. 天然气化工(C1化学与化工), 37(6): 1-2 |
| [8] | 李彦旭, 李春虎, 郭汉贤, 等. 2000. 铁钙氧化物高温脱硫过程中H2和H2O(g)效应[J]. 燃料化学学报, 28(2): 120-123 |
| [9] | 刘豪, 邱建荣, 徐朝芬, 等. 2007. 煤灰氧化物与钙基固硫产物的高温多相反应机理[J]. 中国电机工程学报, 27(32): 29-33 |
| [10] | Schwebel G L, Leion H, Krumm W. 2012. Comparison of natural ilmenites as oxygen carriers in chemical-looping combustion and influence of water gas shift reaction on gas composition[J]. Chemical Engineering Research and Design, 90(9): 1351-1360 |
| [11] | 沈来宏, 肖军, 肖睿, 等. 2007. 基于CaSO4载氧体的煤化学链燃烧分离CO2研究[J]. 中国电机工程学报, 27(2): 69-74 |
| [12] | Shen L H, Wu J H, Gao Z P, et al. 2010. Characterization of chemical looping combustion of coal in a 1kWth reactor with a nickel-based oxygen carrier[J]. Combustion and Flame, 157(5): 934-942 |
| [13] | Tian H J, Simonyi T, Poston J, et al. 2009. Effect of hydrogen sulfide on chemical looping combustion of coal-derived synthesis gas over bentonite-supported metal-oxide oxygen carriers[J]. Industrial & Engineering Chemistry Research, 48(18): 8418-8430 |
| [14] | 肖睿, 张帅, 郑文广, 等. 2011. 基于铁矿石载氧体的化学链燃烧[J]. 燃烧科学与技术, 17(2): 97-102 |
| [15] | 王保文, 赵海波, 郑瑛. 2011. 惰性载体Al2O3对Fe2O3及CuO氧载体煤化学链燃烧的影响[J]. 中国电机工程学报, 31(32): 53-61 |
| [16] | 张思文, 沈来宏, 肖军, 等. 2013. 碱土金属Ca对铁矿石载氧体煤化学链燃烧的影响[J]. 中国电机工程学报, 33(2): 39-45 |
| [17] | Zhao H B, Liu L M, Wang B W, et al. 2008. Sol-Gel-derived NiO/NiAl2O4 oxygen carriers for chemical-looping combustion by coal char[J]. Energy & Fuels, 22(2): 898-905 |
| [18] | 郑敏, 沈来宏, 肖军, 等. 2010. 煤化学链燃烧还原阶段的污染物抑制[J]. 工程热物理学报, 31(10): 1780-1784 |
 2015, Vol. 35
2015, Vol. 35


