2. 中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012;
3. 中国环境科学研究院, 城市水环境科技创新基地, 北京 100012
2. State Key Laboratory of Environmental Criteria and Risk Assessment (SKLECRA), Chinese Research Academy of Environmental Sciences, Beijing 100012;
3. Department of Urban Water Environmental Research, Chinese Research Academy of Environmental Science, Beijing 100012
全氟化合物(PFCs)是一类新型的持久性有机污染物(POPs)(王亚韡等,2010),由于PFCs具有良好的疏油、疏水特性,它被广泛应用于纺织、造纸、农药、地毯、包装、皮革、地板打磨和灭火泡沫等工业和民用领域(Bao et al.,2009;Corsolini et al.,2012).PFCs产品的广泛使用使得其以多种途经进入全球范围内的各种环境介质如大气(Ren et al.,2014)、水体(Zhang et al.,2012;Boone et al.,2014;,Rahman et al.,2014)、土壤(Zhao et al.,2012)中,经由食物链的传递、放大,目前已经在许多动物组织乃至人体中发现了PFCs的存在(Lien et al.,2011;Lee et al.,2012;Tang et al.,2014).PFCs具有化学键能很高的C—F共价键,因此此类化合物普遍具有很高的稳定性,能够抵抗水解、光照、代谢和生物降解(Naile et al.,2010).近年来,全氟化合物在全球环境中的含量、迁移、风险评估等研究已经成为各国的研究热点(Zhao et al.,2011;Wu et al.,2012).
目前,环境水样中全氟化合物的测定方法已经日渐成熟,大多数研究采用高效液相色谱-串联质谱(HPLC-MS/MS)对水中PFCs进行测定(Young and Van Tran,2007;Dufková et al.,2012;Anumol et al.,2013)对于沉积物样品,由于复杂的基质干扰,使得沉积物中全氟化合物的定量检测具有一定困难(王懿等,2012),潘媛媛等(2010)利用高效液相色谱三重四级杆串联质谱实现了对土壤、底泥和活性污泥中12种全氟化合物的准确定量分析,样品检出限低至0.01~0.1 ng · g-1(土壤和底泥,干重).
生态风险评价(ecological risk assessment,ERA)是一个预测环境污染物对生态系统或其中一部分可能产生损害的程度、范围的过程,旨在保证水生态系统中的生物能正常栖息、活动和繁殖的环境,保证地区物理化学循环的正常运行,是继早期人类健康风险评价之后发展起来的新的研究热点(雷炳莉等,2009;姚薇和王一喆,2011).美国环境保护署EPA(U.S Environmental Protection Agency)于1992年提出了生态风险评价的“框架”,旨在找出关键问题,建立一种生态风险评价方法(Norton et al.,1992). 目前,国内外对水环境中PFCs 的污染状况、环境影响及生态风险进行了一定的研究(Ahrens et al.,2011;Yang et al.,2011),吕刚等(2008)利用熵值法对全氟辛烷磺酸基化合物的水生生态风险和人体健康风险进行评价; Wang等(2012)利用危险商数对地表水中PFOA和PFOS的生态风险进行评价.
浑河-大辽河水系是辽河流域的重点污染河流,该水系范围内集中了以沈阳为中心,包括本溪、辽阳、鞍山、营口等的石油、化工、制药、印染、冶金等行业,工业的快速发展对浑河-大辽河水系造成了严重的污染.目前,该流域中PFCs的污染状况和浓度水平还不清楚,尤其是对浑河-大辽河水系水体和沉积物中PFCs 的生态风险评价鲜见报道.
本文基于建立的固相萃取-超高效液相色谱-电喷雾串联三重四级杆质谱(SPE-UPLC-ESI-MS/MS)方法,调查了浑河-大辽河水系水体和沉积物中典型全氟化合物的污染水平;在此基础上,采用商值法对水体和沉积物中PFOA和PFOS的生态风险进行评价.以期为该类化合物的进一步研究以及该区域水环境综合管理提供科学依据.
2 材料与方法(Materials and methods) 2.1 仪器与试剂实验所用仪器和设备包括:UPLC-ESI-MS/MS(UPLC-Xevo TQD,美国Waters公司);分析柱(ACQUITY UPLCBEH C18,2.1 mm×50 mm,1.7 μm);数控超声仪(Scientz-DQ600,宁波新芝生物科技股份有限公司);离心机(Sorvall RC-6 Plus,美国ThermoFisher公司);固相萃取仪(美国Suplco公司);固相萃取柱:Oasis HLB(美国Waters公司,500 mg,6 mL);氮吹仪(WD-12,杭州奥盛仪器有限公司).数据收集与处理使用MassLynx V4.1和Origin 8.0软件.
全氟丁酸(perfluorobutanoic acid,PFBA,99%)、全氟丁基磺酸钾(potassium nonafluoro-1-butanesulfonate,PFBuS,98%)、全氟戊酸(perfluoropentanoic acid,PFPA,97%)、全氟己酸(perfluorodecanoic acid,PFHxA,98%)、全氟庚酸(perfluoroheptanoic acid,PFHpA,98%)、全氟癸酸(perfluorodecanoic acid,PFDA,98%)、全氟十一烷酸(perfluoroundecanoic acid,PFUnA,96%)和全氟十二烷酸(perfluorododecanoic acid,PFDoA,96%)均购自J&K Scientific GmbH(德国);全氟辛酸(perfluorooctanoic acid,PFOA,)和全氟辛烷磺酸(perfluorooctane sulfonic acid,PFOS)购自于AccuSt and ard Inc(美国);内标物13C4-PFOA(perfluoro-n-[1,2,3,4-13C4] octanoicacid,M-PFOA)、13C4-PFOS(sodium perfluoro-1-[1,2,3,4-13C4] octanesulfonate,M-PFOS)购自加拿大Wellington实验室.甲醇(色谱纯)购自美国Fisher公司,冰醋酸(分析纯)购自国药化学试剂公司.
2.2 样品的采集水样和沉积物样品于2014年5月采自辽河流域的浑河与大辽河干流以及浑河的支流沈阳细河,采样点布置见图 1,其中,浑河干流7个(编号从上 游到下游依次为H1~H7),大辽河干流2个(编号为DL1和DL2),沈阳细河7个(编号从上游到下游依次为X1~X7).各采样点水质特性见表 1.
| 表 1 各采样点水质特性 Table 1 Chemical parameters of the freshwaters from each sampling site |
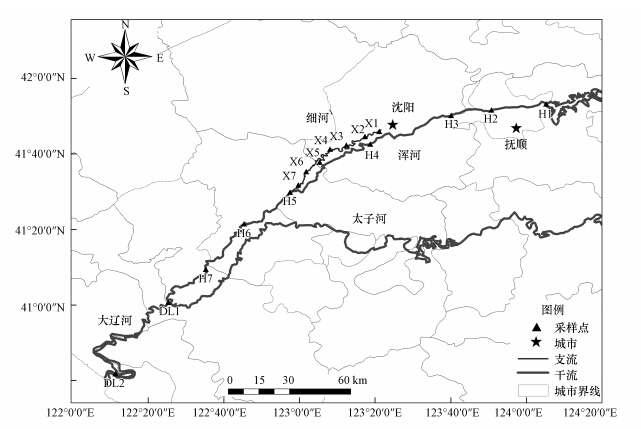 |
| 图 1 采样点分布图 Fig.1 Sampling locations in HR,DLR and XR |
采集的表层水样于1 L的PP聚丙烯(PP)瓶中,样品在低温下保存并当天运回实验室,用0.7 μm的GF/F Whatman 玻璃纤维滤膜(马弗炉中于500 ℃烘4 h)进行过滤,4 ℃下保存,备用.采集的沉积物样品保存于洁净的聚乙烯材质的密封袋中,在低温条件下运送到实验室,于-20 ℃冰箱中保存至分析.
2.3 样品的前处理采用Oasis HLB对2 L水样进行固相萃取(SPE)富集.将HLB柱分别用5 mL甲醇和5 mL超纯水进行活化,水样通过SPE小柱的流速控制为2~5 mL · min-1.48 h完成预富集实验.
称取湿的沉积物样品(干重约5.0 g)置于50 mL聚丙烯离心管A中,加入10 mL 1%的乙酸溶液,混匀,40 ℃水浴超声15min,6000r · min-1离心15 min,取上层清液置于另一聚丙烯离心管B中,沉淀中加入2.5 mL 90∶10(V∶ V)甲醇∶ 1%乙酸溶液,40 ℃水浴超声15min,6000r · min-1离心15 min,取上清液置于B管中,重复上述步骤一次,最后用10 mL 1%的乙酸溶液清洗残渣,合并上清液于B管中,过活化后的固相萃取柱(HLB小柱),进行纯化处理.
富集样品的HLB小柱,抽干0.5 h除去柱中残留的水分.目标分析物用15 mL甲醇分3次洗脱,洗脱液氮吹至干,加入1 mL 1 ∶ 3(V∶ V)甲醇:水,最后加入两种内标物各10 μL,混匀,过0.22 μm的PP微孔滤膜,待测.
2.4 仪器条件色谱条件:流动相A:2 mmol · L-1乙酸铵水溶液;流动相B:2 mmol · L-1乙酸铵乙醇溶液;流速:0.25 mL · min-1;柱温:50 ℃;进样体积10 μL.色谱梯度洗脱方法见表 2.
| 表 2 超高效液相色谱梯度洗脱方法 Table 2 Elution gradient of ultra performance liquid chromatography |
质谱条件:采用电喷雾离子源(ESI),负离子模式;毛细管电压:2.7 kV;锥孔电压:20 V;截取电压:3 V;源温度:150 ℃;去溶剂温度:400 ℃;锥孔气流及去溶剂气流速度分别为30 L · h-1和900 L · h-1.
3 结果与分析(Results and analysis) 3.1 质量控制与保证在选定的最佳色谱和质谱条件下,采用内标法,对全氟目标化合物进行测定.以6个不同浓度的PFCs标准溶液(0.025~60.0 μg · L-1)作标准曲线,具有很好的线性关系,其相关系数均大于0.990.在1 L 高纯水中,加入0.5 ng、1 ng和10 ng的10种目标PFCs,平行3个样品,PFBuS、 PFPA、 PFHxA、 PFHpA、 PFOA、 PFOS和PFDA的平均回收率为70.0%~111%,相对标准偏差小于17.0%.同时,在样品基质1 g沉积物和1 L河水中,分别添加0.5 ng、1 ng和10 ng的10种目标PFCs的混合标准液,每个添加水平分别平行配制3个样,经过前处理和分析,PFBuS、 PFPA、 PFHxA、 PFHpA、 PFOA、 PFOS和PFDA的平均回收率在61.4%~104%之间,相对标准偏差在1.6%~14.0%之间,表明该方法具有较好的准确度和精密度,可以满足定量分析的需要,并可用于实际样品的测定.所有的样品分析测试均实行质量保证和质量控制,每10个样品,加入溶剂空白和过程空白分析,在进入仪器分析之前加入色谱定量内标消除仪器响应的波动.该研究中方法检出限分别为0.220~0.560 ng · L-1(河水)和0.070~0.530 ng · g-1干重(沉积物).
3.2 河水中PFCs的污染水平浑河、大辽河、细河水体中主要PFCs的浓度范围及各组分的检出率见表 3.
| 表 3 浑河、大辽河、细河水中主要PFCs的浓度范围及各组分的检出率 Table 3 Concentrations and detectable ratio of PFCs in Hun River,Daliao River and Xi River |
由分析可知,在浑河干流水中,PFCs总浓度范围为1.80 ~9.50 ng · L-1,PFHxA、PFHpA、PFOA、PFOS和PFDA是主要污染物,其在总浓度中所占的比例分别为6.24%~9.00%、8.90%~15.0%、59.8%~86.4%、6.44%~21.3%、3.80%~7.50%,其中PFOA所占比例超过50%,各污染物在河流中的检出率分别为57.1%、85.7%、100%、85.7%和57.1%.由PFCs总浓度分布图可以看出(图 2),在浑河干流中,上游的PFCs浓度明显低于下游的PFCs浓度,但是H4和H5点的PFCs浓度高于H6和H7点位的浓度,这主要是由于H4点位于沈阳市区的下游,接受了大量来自沈阳市的工业和城市污水,H5是浑河与细河汇流之后的采样点,细河是沈阳的城市与工业废水的重点排污河,是导致H5点PFCs浓度大幅增长的原因.由于河水的稀释作用,使得H6和H7采样点的PFCs浓度略有降低.
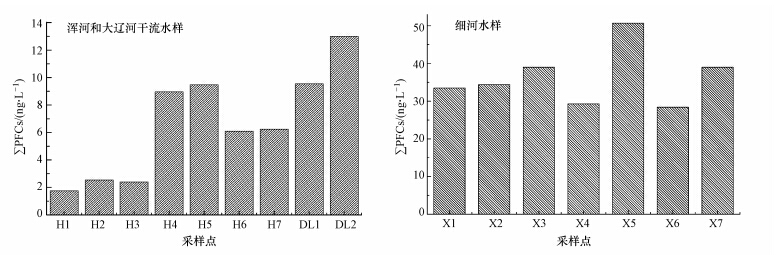 |
| 图 2 河水中PFCs的浓度分布 Fig.2 Concentration of PFCs in river water |
在大辽河干流中,PFCs总浓度范围为9.50~13.0 ng · L-1,PFBuS、PFHxA、PFHpA、PFOA和PFOS是主要污染物,各污染物在河流中的检出率均为100%.DL1是浑河接受了太子河河水后的采样点,由于典型行业污水的排放导致河水中PFCs的浓度增加,使得大辽河河水中PFCs浓度升高.
沈阳细河河水中,PFPA、PFOA、PFOS和PFDA是主要污染物,其在总浓度中所占的比例分别为34.2%~75.3%、19.5%~35.7%、2.35%~30.2%、0.99%~3.44%,各污染物检出率均为100%.细河中目标污染物的总浓度(27.0~50.0 ng · L-1)远高于浑河、大辽河中的浓度.
比较3条河流PFCs的污染状况可以得出,以PFCs平均浓度计,浑河干流(5.40 ng · L-1)< 大辽河干流(11.3 ng · L-1)<沈阳细河(36.3 ng · L-1).众所周知,浑河是大辽河的上游,接纳了太子河河水后形成了大辽河,太子河是辽河流域重点污染河段,共接纳本溪、辽阳、鞍山3城市工业废水和生活污水,典型污染行业有化工、石化、钢铁冶金、造纸、纺织印染等,污水的排放导致河水中PFCs的浓度增加,使得大辽河中PFCs浓度升高.细河是沈阳市的主要排污河渠,由于没有天然河水的稀释作用,加之周围有很多企业(如化工、医药、电镀等行业),工厂废水和生活污水会直接或间接地排入细河,导致细河中PFCs浓度最高.
3.3 沉积物中PFCs的污染水平沉积物中主要PFCs的含量范围及各组分的检出率见表 4.由沉积物中PFCs总含量分布图(图 3)可以看出,沉积物与水体中PFCs的污染及分布特征有明显的差异.浑河、大辽河沉积物中,PFHxA是主要检出污染物,其含量最高为0.490 ng · g-1,PFHxA的检出率分别为71.4%和100%.PFOA仅在采样点H3被检出,含量为0.120 ng · g-1.在细河沉积物中,PFHxA和PFOS是主要污染物,其浓度水平最高为0.220 ng · g-1和0.830 ng · g-1干重,检出率分别为85.7%和57.1%.水体与沉积物中PFCs的污染与分布特征差异可能源自于污染物自身性质以及与沉积物界面反应过程的差异,有关这方面的研究还需要进一步探讨.
| 表 4 沉积物中主要PFCs的含量范围(ng · g-1)及各组分的检出率 Table 4 Concentration and detectable ratio of PFCs in sediments |
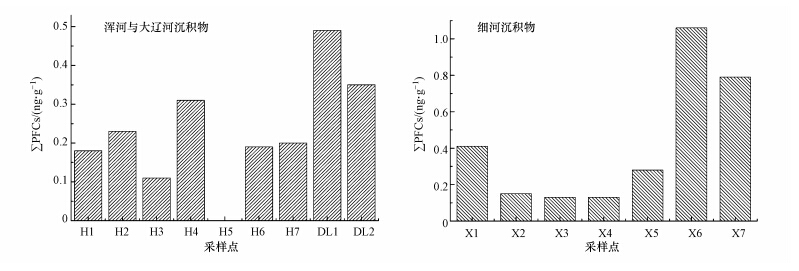 |
| 图 3 沉积物中PFCs的浓度分布 Fig.3 Concentration of PFCs in sediment |
通过该方法得到的结果与以前的研究结果进行对比分析(见表 5),结果表明,Sun et al.使用WAX固相萃取柱,利用高效液相色谱串联质谱法测得浑河和细河水体中PFOA、PFOS和PFDA的浓度与本文所得的结果相似,细河中PFHpA的浓度稍高于本文中测得的结果(Sun et al., 2011).印度恒河和Sundarban红树林湿地沉积物中PFOA的含量低于0.500~14.1 ng · g-1,但高于本文测得的浑河和细河中PFOA的含量,而PFOS的含量和本文结果相似(Corsolini et al.,2012).
| 表 5 不同流域PFCs的浓度比较 Table 5 Comparison of PFCs level between different regions |
近年来定量的生态风险表征方法越来越受到普遍关注,生态风险表征的方法主要有确定性风险评价和概率生态风险评价(章海波等,2007; 雷炳莉等,2009).确定性风险评价主要有商值法,商值法又称比率法,是使用最普遍、最广泛的风险表征方法. 商值法的基本做法是通过把实测或模型计算出的环境暴露浓度(EEC或PEC)与表征该物质危害的指标值相比较(通常是依据污染物的单一毒性数据预测的水中无效应浓度PNEC相比),商值在某一数值范围内为有风险,小于该数值则为无风险.本研究采用商值法对PFOA和PFOS的生态风险进行评估,通过公式(1),计算得到风险商值(RQ).该方法只是对风险进行比较粗略的估计,计算中存在很多不确定性,因此只能用于单个污染的较低水平的评价.若比值大于1,说明有风险,比值越大,风险越高;若比值小于1,说明此化合物对生态环境是安全的.

公式(1)中,PNEC的计算通常采用评估因子法(AF)或物种敏感度分布(SSD)法外推来计算(曹莹等,2013).首先筛选用于外推模型的毒性数据,对于相同物种经过相同暴露时间后,取相同毒性终点的数据,采用这些数据的几何平均值来计算PNEC;当有同一物种不同毒性终点的多个毒性数据值时,选取最小值进行外推计算PNEC.魏明翠等(魏明翠,2013)运用这两种方法推算得到水中PFOA的PNEC值为4798 μg · L-1.由于缺少沉积物的毒性数据,采用平衡分配法计算沉积物中预测无效应浓度(PNEC沉积物).按照欧盟化学物质风险评价技术指导文件(TGD)中标准环境特征参数,忽略PFOA和PFOS在水体悬浮物与气体的分配,根据公式(2)得到PNEC沉积物(mg · kg-1)(曹莹等,2013).

式中,PNEC水是水中的预测无效应浓度(mg · L-1);RHO沉积物是沉积物的湿体积密度(kg · m-3);K沉积物-水为沉积物-水分配系数(m3 · m-3).
Brooke等(Brook et al.,2004)采用上述方法得到PFOS在水中的PNEC值为25 μg · L-1,沉积物的PNEC值为67 μg · kg-1,曹莹等(2013)利用欧盟化学物质风险评价技术指导文件(TGD),结合我国本土生物物种的毒性数据,计算得到了PFOA在水、沉积物中的PNEC值分别为570 μg · L-1和2060 μg · kg-1.本研究采用Brooke和曹莹等的结果,计算PFOA和PFOS的风险商RQ,各采样点的RQ值如表 6所示.
| 表 6 各采样点水体和沉积物中PFOA和PFOS的风险商RQ Table 6 RQ of PFOA and PFOS in water and sediment at each sampling point |
由表 6可以看出,浑河、大辽河及细河水体和沉积物中PFOA、PFOS的RQ值均远远小于1,表明所研究水域河水和沉积物中的PFOA和PFOS浓度尚未达到对生态环境具有风险的水平.但是,细河水中PFOA和PFOS的RQ值普遍高于浑河和大辽河水中,表明细河中PFOA和PFOS对生态环境的潜在风险高于浑河和大辽河干流,并且风险商值从上游到下游呈递增趋势.
4 结论(Conclusions)本研究基于SPE-UPLC-ESI-MS/MS联用技术对浑河-大辽河水系的水体和沉积物中典型PFCs的暴露浓度进行了分析,实现了对水和沉积物中常见PFCs的准确定量测定.结果表明,浑河、大辽河的干流水中,PFCs总浓度范围为1.80~13.0 ng · L-1,其中,PFHxA、PFHpA、PFOA、PFOS和PFDA是主要污染物;沈阳细河中PFCs的总浓度为27.0~50.0 ng · L-1,其主要污染物为PFPA、PFOA、PFOS和PFDA.在浑河、大辽河沉积物中,唯一的检出物是PFHxA,其含量为0.130~0.490 ng · g-1(干重);除了PFHxA,PFOS也是细河中的主要污染物,其浓度水平分别为0.070~0.220 ng · g-1和0.180~0.830 ng · g-1(干重).采用商值法对水体和沉积物中PFOA和PFOS的生态风险进行评价,其暴露浓度均未达到对生态环境具有风险的水平.
| [1] | Ahre ns L, Yeung L W Y, Taniyasu S, et al. 2011. Partitioning of perfluorooctanoate (PFOA), perfluorooctane sulfonate (PFOS) and perfluorooctane sulfonamide (PFOSA) between water and sediment[J]. Chemosphere, 85(5): 731-737 |
| [2] | Anumol T, Merel S, Clarke B O, et al. 2013. Ultra high performance liquid chromatography tandem mass spectrometry for rapid analysis of trace organic contaminants in water[J]. Chemistry Central Journal, 7: 104 |
| [3] | Bao J, Jin Y H, Liu W, et al. 2009. Perfluorinated compounds in sediments from the Daliao River system of northeast China[J]. Chemosphere, 77(5): 652-657 |
| [4] | Brooke D, Footitt A, Nwaogu T A, et al. 2004. Environmental risk evaluation report: Perfluorooctanesulphonate (PFOS)[R]. United Kingdom: Environment Agency |
| [5] | Boone J S, Guan B, Vigo C, et al. 2014. A method for the analysis of perfluorinated compounds in environmental and drinking waters and the determination of their lowest concentration minimal reporting levels[J]. Journal of Chromatography A, 1345: 68-77 |
| [6] | 曹莹, 周腾耀, 刘秀华, 等. 2013. 我国环境中全氟辛酸(PFOA)的预测无效应浓度推导[J]. 环境化学, 32(7): 1180-1187 |
| [7] | Corsolini S, Sarkar S K, Guerranti C, et al. 2012. Perfluorinated compounds in surficial sediments of the Ganges River and adjacent Sundarban mangrove wetland, India[J]. Marine Pollution Bulletin, 64(12): 2829-2833 |
| [8] | Dufková V, C ˇ abala R, evčík V. 2012. Determination of C5-C12 perfluoroalkyl carboxylic acids in river water samples in the Czech Republic by GC-MS after SPE preconcentration[J]. Chemosphere, 87(5): 463-469 |
| [9] | Lee W W, Lee S Y, Yu S M, et al. 2012. High speed separation of PFCs in human serum by c18-monolithic column liquid chromatography-tandem mass spectrometry[J]. Bulletin of the Korean Chemical Society, 33(11): 3727-3734 |
| [10] | 雷炳莉, 黄胜彪, 王子健. 2009. 生态风险评价理论和方法[J]. 化学进展, 21(2/3): 350-358 |
| [11] | Lien G W, Wen T W, Hsieh W S, et al. 2011. Analysis of perfluorinated chemicals in umbilical cord blood by ultra-high performance liquid chromatography/tandem mass spectrometry[J]. Journal of Chromatography B, 879(9/10): 641-646 |
| [12] | 吕刚, 王利兵, 刘军, 等. 2008. 全氟辛烷磺酰基化合物水生生态风险和人体健康风险评价[J]. 长江流域资源与环境, 17(6): 904-908 |
| [13] | Naile J E, Khim J S, Wang T Y, et al. 2010. Perfluorinated compounds in water, sediment, soil and biota from estuarine and coastal areas of Korea[J]. Environmental Pollution, 158(5): 1237-1244 |
| [14] | Norton S B, Rodier D J, Van Der Schalie W H, et al. 1992. A framework for ecological risk assessment at the EPA[J]. Environmental Toxicology and Chemistry, 11(12): 1663-1672 |
| [15] | 潘媛媛, 史亚利, 蔡亚岐. 2010. 土壤、底泥和活性污泥中全氟化合物的高效液相色谱-串联质谱分析方法[J]. 环境化学, 29(3): 519-523 |
| [16] | Rahman M F, Peldszus S, Anderson W B. 2014. Behaviour and fate of perfluoroalkyl and polyfluoroalkyl substances (PFASs) in drinking water treatment: a review[J]. Water Research, 50: 318-340 |
| [17] | Ren Y, Schlager H, Martin D. 2014. The application of TD/GC/NICI-MS with an Al2O3-PLOT-S Column for the determination of perfluoroalkylcycloalkanes in the atmosphere[J]. Chromatographia, 77(3/4): 309-316 |
| [18] | Sun H W, Li F S, Zhang T, et al. 2011. Perfluorinated compounds in surface waters and WWTPs in Shenyang, China: mass flows and source analysis[J]. Water Research, 45(15): 4483-4490 |
| [19] | Tang C M, Tan J H, Wang C M, et al. 2014. Determination of perfluorooctanoic acid and perfluorooctane sulfonate in cooking oil and pig adipose tissue using reversed-phase liquid-liquid extraction followed by high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 1341: 50-56 |
| [20] | Wang T Y, Khim J S, Chen C L, et al. 2012. Perfluorinated compounds in surface waters from Northern China: comparison to level of industrialization[J]. Environment International, 42: 37-46 |
| [21] | 王亚韡, 蔡亚岐, 江桂斌. 2010. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展[J]. 中国科学: 化学, 40(2): 99-123 |
| [22] | 王懿, 孔德洋, 单正军, 等. 2012. 加速溶剂萃取-固相萃取净化-超高效液相色谱串联质谱法测定土壤中11种全氟化合物[J]. 环境化学, 31(1): 113-119 |
| [23] | 魏明翠. 2013. 氟化学工业园周边区全氟化合物的生态风险评估研究. 天津: 南开大学. 40-42 |
| [24] | Wu Y N, Wang Y X, Li J G, et al. 2012. Perfluorinated compounds in seafood from coastal areas in China[J]. Environment International, 42: 67-71 |
| [25] | Yang L P, Zhu L Y, Liu Z T. 2011. Occurrence and partition of perfluorinated compounds in water and sediment from Liao River and Taihu Lake, China[J]. Chemosphere, 83(6): 806-814 |
| [26] | 姚薇, 王一喆. 2011. 化学品风险评估制度建设进展和建议[J]. 环境工程技术学报, 1(5): 431-437 |
| [27] | Young M S, Van Tran K. 2007. OASIS WAX 固相提取吸附剂用于水及组织中PFOS和相关化合物的UPLC/MS定量分析[J]. 环境化学, 26(1): 119-121 |
| [28] | Zareitalabad P, Siemens J, Hamer M, et al. 2013. Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater-A review on concentrations and distribution coefficients[J]. Chemosphere, 91(6): 725-732 |
| [29] | 章海波, 骆永明, 李志博, 等. 2007. 土壤环境质量指导值与标准研究 Ⅲ.污染土壤的生态风险评估[J]. 土壤学报, 44(2): 338-349 |
| [30] | Zhang Y, Meng W, Guo C S, et al. 2012. Determination and partitioning behavior of perfluoroalkyl carboxylic acids and perfluorooctanesulfonate in water and sediment from Dianchi Lake, China[J]. Chemosphere, 88(11): 1292-1299 |
| [31] | Zhao L X, Zhu L Y, Yang L P, et al. 2012. Distribution and desorption of perfluorinated compounds in fractionated sediments[J]. Chemosphere, 88(11): 1390-1397 |
| [32] | Zhao Y G, Wan H T, Law A Y S, et al. 2011. Risk assessment for human consumption of perfluorinated compound-contaminated freshwater and marine fish from Hong Kong and Xiamen[J]. Chemosphere, 85(2): 277-283 |
 2015, Vol. 35
2015, Vol. 35


